QuEChERS/液相色谱-串联质谱法测定5种蔬菜中17种氨基甲酸酯类农药的基质效应研究
2017-02-15许文娟王振刚丁葵英郭礼强
许文娟,王振刚,丁葵英,孙 军,郭礼强
(1.潍坊出入境检验检疫局,山东 潍坊 261041;2.潍坊医学院附属医院,山东 潍坊 261041)
QuEChERS/液相色谱-串联质谱法测定5种蔬菜中17种氨基甲酸酯类农药的基质效应研究
许文娟1*,王振刚2,丁葵英1,孙 军1,郭礼强1
(1.潍坊出入境检验检疫局,山东 潍坊 261041;2.潍坊医学院附属医院,山东 潍坊 261041)
建立了QuEChERS/液相色谱-串联质谱法测定5种蔬菜中17种氨基甲酸酯农药残留的方法,研究了该方法下姜、大葱、黄瓜、胡萝卜和白菜对17种农药的基质效应,并探讨了基质种类、基质浓度、农药浓度对基质效应的影响。结果表明:不同基质中的17种氨基甲酸酯农药在5~100 μg/L浓度范围内线性关系良好,平均回收率为76.5%~111.8%,相对标准偏差(n=6) 为2.5%~8.2%。5种常见蔬菜对17种氨基甲酸酯农药均存在不同程度的基质效应,且多数呈基质抑制效应,其中,基质种类、基质浓度和农药浓度均会影响基质效应强度。胡萝卜对硫双威和乙霉威、黄瓜对硫双威的基质效应均在0.8~1.1之间,日常检测中,可根据实际需求忽略其基质效应影响。但对于其他蔬菜中氨基甲酸酯类农药的检测,必须考虑基质效应的影响。
QuEChERS;基质效应;液相色谱-串联质谱;蔬菜;氨基甲酸酯;农药残留
氨基甲酸酯类农药是一种广泛使用的杀虫剂,高效且选择性强[1-2]。近年来,氨基甲酸酯类农药的用量及范围不断扩大,其在果蔬、作物中的残留以及对人类健康和环境造成的危害也越来越受关注。各国制定了严格的氨基甲酸酯类农药的最大残留限量[3-4],对蔬菜中该类农药残留量的准确检测提出了更高的要求(小于10 μg/kg)。
目前,液相色谱-串联质谱法(LC-MS/MS) 是应用最广且最有效的氨基甲酸酯类农药检测方法[5-9]。LC-MS/MS分析中,样品基质在很大程度上影响着检测信号的强度。基质是指样品中除了分析物以外的组分,由基质组分的存在对分析方式、分析结果的影响称为基质效应。基质效应严重影响定量分析的准确度和精密度[10-11],目前国际上已达成共识,LC-MS/MS方法的验证应包括基质效应[12]。前处理方法、样品基质种类、仪器分析方法等多种因素均会影响检测方法的基质效应,进而影响检测结果的可靠性。通过对特定检测过程的基质效应进行评估,进而针对性地指导方法改进并采取有效的基质效应补偿措施,对获得准确的结果至关重要。QuEChERS前处理与液相色谱-串联质谱法相结合,是目前应用最广的氨基甲酸酯类农药残留分析方法[13-15]。针对性地研究该过程的基质效应,对农药残留检测工作具有实际指导意义。
本文选用姜、大葱、黄瓜、胡萝卜和白菜5种常见蔬菜为代表基质,建立了QuEChERS前处理结合LC-MS/MS同时检测蔬菜中17种常见氨基甲酸酯类农药残留的方法,并考察了该方法下5种蔬菜中17种农药的基质效应。相关研究对消除日常检测中常见氨基甲酸酯类农药在蔬菜中的基质干扰,进而进行快速、准确的定量分析提供了依据。
1 实验部分
1.1 仪器与试剂
Agilent 6430液相色谱-串联质谱仪(美国Agilent公司),配电喷雾离子源(ESI);GM 200碾磨仪(德国Retsch公司);AE 163电子天平(瑞士Mettler公司);T25均质器(德国IKA公司);Eppendof 5810R离心机(德国Eppendof公司);N-EVAP 111氮吹仪(美国Organomation公司);WD 9000微波炉(格兰仕);MS3 basic涡流混匀器(德国IKA公司)。
甲醇、乙腈(色谱纯,美国Fisher公司);乙酸乙酯(色谱纯,德国Merck公司);甲酸(色谱纯,美国Tedia公司);无水硫酸镁(分析纯,天津市光复精细化工研究所),用前在500 ℃马弗炉内烘5 h;石墨炭黑粉、C18、PSA粉、氨丙基粉(Agela technologies inc公司);涕灭威亚砜、涕灭威砜、涕灭威、异丙威、速灭威、甲萘威、克百威、残杀威、抗芽威、硫双威、二氧威、乙硫苯威、仲丁威、猛杀威、乙霉威15种标准品(美国 Sigma公司,纯度均≥95%);灭多威、杀线威液体标准品(浓度为100 mg/L,Accustandard公司)。
1.2 实验方法
1.2.1 标准溶液的配制称取10 mg(精确至0.1 mg) 15种农药的标准品,分别置于100 mL棕色容量瓶中,用甲醇溶解,准确定容至100 mL,得100 μg/mL标准储备液单标,杀线威和灭多威购入时即为100 μg/mL液体标准品。将上述17种浓度为100 μg/mL的储备液用甲醇稀释至1 μg/mL的混合标准溶液。
1.2.2 基质匹配标准溶液的配制每种基质各取6份空白样品提取液,每份样品提取液为1 mL,氮气吹干后用1 μg/mL的混合标准溶液稀释,配成6种不同浓度的基质匹配标准溶液,现配现用。
1.2.3 实验方法大葱切成约2 cm的小段,姜、大黄瓜、胡萝卜和白菜样品打碎,然后取出部分有代表性的样品,采用四分法缩分至不少于500 g试样,装入清洁容器内,加封后标明标记后备用;准确称取30.00 g上述样品(大葱于720 W微波消解1.5 min) 至100 mL离心管中,依次加入6 g无水硫酸镁、15 mL乙腈于高速均质器上充分均质,离心10 min(10 000 r/min),取3 mL上清液于预先装有50 mg石墨炭黑粉、200 mg C18和150 mg氨丙基粉的10 mL玻璃试管中,涡旋2 min,静止分层后取2 mL上清液于另一干净玻璃试管中,氮气吹干,用1 mL乙腈-水(体积比1∶9)溶解,过0.2 μm滤膜,上机检测。
取500 μL定容液用氮气吹干后配制0.025,0.05,0.08,0.1 μg/mL的不同浓度标准溶液,分别用液相色谱-串联高分辨质谱仪进行测定,其中每个蔬菜基质每个浓度均为1个处理,每个处理6次重复。计算每种蔬菜样品基质的基质效应。
1.3 LC-MS/MS条件
1.3.1 LC条件色谱柱Agilent ZORBAX SB-C18柱(3.0 mm×100 mm,1.8 μm):柱温35 ℃,进样体积:20 μL;流动相:0.1%甲酸水(A相) 和甲醇(B相);梯度洗脱程序:0~5.0 min,10%~90%B,保持3 min;然后在0.1 min内由90%B线性下降至10%B,保持4.0 min,以平衡色谱柱。流速0.3 mL/min,运行时间12 min。
1.3.2 MS/MS条件离子源:电喷雾离子源(ESI);扫描方式:正离子(ESI+) 模式扫描;检测方式:多反应监测(MRM)方式;毛细管电压:4 000 V;干燥气流速:10 L/min;温度300 ℃。其他参数见表1。

表1 17种农药的质谱分析参数
*quantitative ion
2 结果与讨论
2.1 方法的线性关系
对质量浓度为 5,10,25,50,80,100 μg/L 的17 种农药纯溶剂标准溶液按“1.2.3”方法进行样品前处理,并按“1.2.2”配制的5种蔬菜基质匹配标准溶液进行分析,以峰面积(y)对质量浓度(x,μg/L)作回归曲线。结果显示,在5~100 μg/L浓度范围内,17种农药的纯溶剂标准溶液回归方程的相关系数(r2)为0.997 2~0.999 7,5种基质匹配标准溶液的r2为0.996 3~0.999 8,说明17种目标组分在5~100 μg/L浓度范围内线性关系良好。
2.2 方法的定量下限、检出限、回收率及精密度

图1 黄瓜样品加标水平10 μg/kg的色谱图Fig.1 Chromatogram of cucumber sample spiked 10 μg/kg standard
分别以目标组分母离子的3倍信噪比(S/N=3) 和10倍信噪比(S/N=10) 确定17种目标物的方法检出限(LOD) 和定量下限(LOQ)。结果显示,17种农药的LOD为0.9~3.1 μg/kg,LOQ为2.7~5.5 μg/kg。所有农药的LOQ均小于10 μg/kg,方法的灵敏度符合国内外法规的残留限量要求。
采用基质匹配标准溶液-外标法定量,在姜、大葱、黄瓜、胡萝卜和白菜5种空白基质中添加17种氨基甲酸酯农药进行加标回收率试验,添加水平为10,20,40 μg/kg,每个添加水平重复测定6次,17种目标物的平均回收率为76.5%~111.8%,相对标准偏差(RSD)均小于10%。黄瓜样品加标10 μg/kg的色谱图见图1。17种农药的LOQ以及在姜基质中的回收率和RSD见表2。研究结果表明该方法能够满足国内外对蔬菜中氨基甲酸酯类农药残留量检测的要求。

表2 17种农药的定量下限以及在姜基质中的加标回收率及相对标准偏差(n=6)
2.3 基质效应分析
本文采用提取后加标法定量测定空白基质提取液与纯溶剂中同浓度分析物的离子响应强度,通过二者比值来评价基质效应(ME),即公式:ME=B/A,其中A和B分别表示纯溶剂与基质溶液中分析物的峰面积。若ME<1,说明基质对分析物的响应产生抑制作用;ME>1,则说明基质会增强分析物的响应;ME=1表示不存在基质效应[16-17]。在本实验条件下,不同基质浓度(5,10,20 g/mL) 和农药浓度(25,50,80,100 μg/L) 下,5种蔬菜中17种氨基甲酸酯农药的基质效应变化范围见表3。
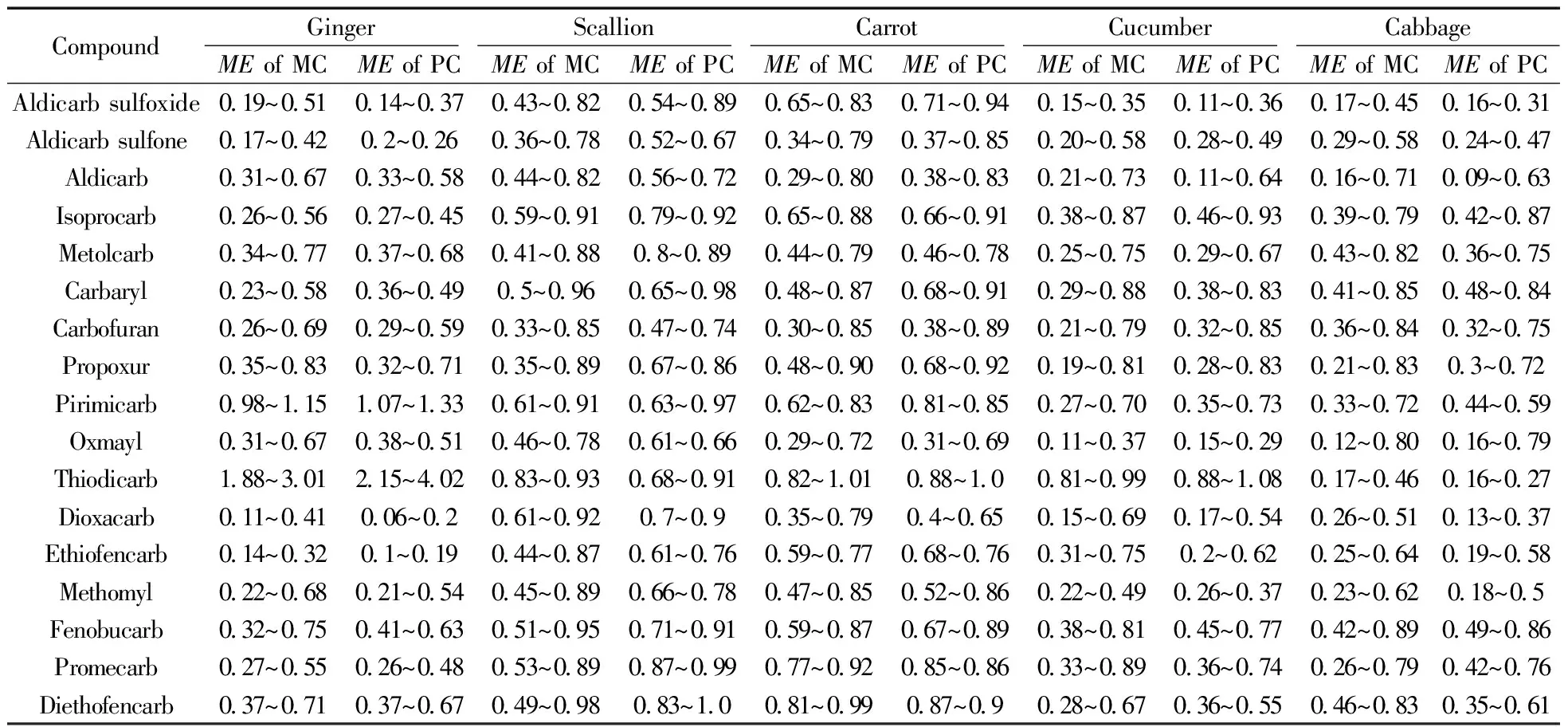
表3 基质浓度和农药浓度对17种氨基甲酸酯农药基质效应的影响*
*MC:matrix concentration;PC:pesticide concentration
2.3.1 基质种类对基质效应的影响通过比较同一农药添加浓度(100 μg/L) 下17种农药在5种不同基质中的基质效应,得出基质种类对基质效应的影响。如图2所示,除了姜对抗芽威和硫双威具有明显的基质增强效应,黄瓜对硫双威具有微弱的基质增强效应外,其余化合物在其它基质中均表现为基质抑制效应。

图2 不同蔬菜基质中17种农药(100 μg/L) 的基质效应Fig.2 Matrix effects of 17 pesticides(100 μg/L) in different vegetable extracts
不同基质对同一农药呈现不同的基质效应。以涕灭威为例,白菜对涕灭威在LC-MS/MS上的响应有明显的抑制作用(ME为0.09),而姜、大葱、胡萝卜、黄瓜对涕灭威的ME分别为0.58,0.72,0.83,0.64。对于硫双威,大葱、胡萝卜和黄瓜对其基质效应不明显,ME值为0.91~1.02,在实际检测中可适当忽略基质效应因素,但姜对硫双威具有明显的基质增强作用(ME为4.02),而白菜会显著抑制硫双威在LC-MS/MS上的响应,其ME为0.18。对大姜和白菜中的硫双威进行检测时,必须考虑基质效应对定量结果的影响。
白菜对所有农药均有显著的抑制作用,ME为0.09~0.58(仅仲丁威为0.71);大葱对多数农药的抑制作用无明显差异,对11种农药的ME为0.86~0.99;胡萝卜对多数农药的基质效应与大葱相似,各农药的基质效应差异不大,其中有9种农药的ME大于0.8(0.83~0.96);黄瓜基质对17种农药的信号强度影响各异,ME在0.29~1.02之间;大姜对不同农药的影响差异明显,ME为0.18~4.02。
2.3.2 农药浓度对基质效应的影响比较了同一种蔬菜基质(分别以姜和大葱为例),不同农药浓度(25,50,80,100 μg/L) 对基质效应的影响(图3),不同农药浓度下,同种蔬菜基质对同一农药的基质效应不同,但基质对各农药的基质效应随农药浓度的递增而增大。即:对于基质抑制效应,农药浓度越高,基质对其抑制作用越不明显;对于基质增强效应,农药浓度越高,基质对其响应值的增强作用更加显著。另外,对于绝大多数农药,在较高浓度时,姜的基质效应情况基本不变,50,80,100 μg/L 3个较高浓度的基质效应曲线基本重合。在大葱基质中,农药浓度的影响表现出类似的规律,80 μg/L和100 μg/L两个高农药浓度的基质效应曲线接近重合。即,在同一种基质中,当农药浓度在一定范围内变化时,其对各化合物的基质效应影响作用不明显。
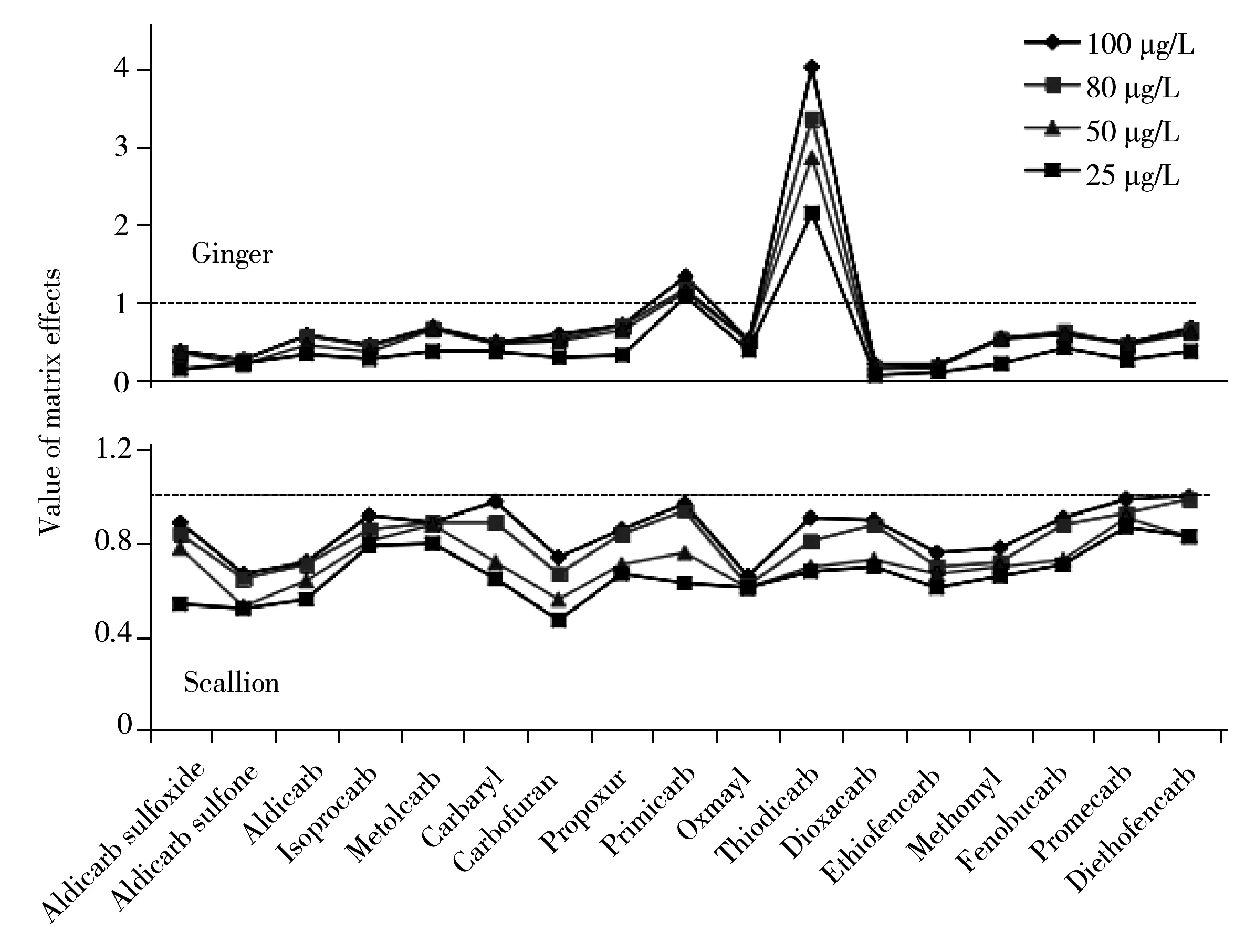
图3 不同农药浓度下姜和大葱对17种农药的基质效应Fig.3 Matrix effects of 17 pesticides in ginger and scallion of different pesticide concentrations
2.3.3 基质浓度对基质效应的影响考察了同一农药浓度下,不同基质浓度对同种基质中各氨基甲酸酯农药的基质效应。按照“1.2.3”前处理方法,分别以5(10 g样品定容2 mL)、10(10 g样品定容1 mL)、20(20 g样品定容1 mL) 浓缩倍数用0.1 mg/L混合标准溶液准确定容,得到基质浓度分别为5,10,20 g/mL,农药浓度为0.1 mg/L的基质提取后添加溶液,用LC-MS/MS进行分析。
17种农药在不同浓度姜和大葱基质中的基质效应如图4所示。由图4可以看出,在姜和大葱基质中,基质浓度对各农药基质效应的影响呈现相同规律,即基质浓度越大,其对各农药的影响作用越强。对于具有基质抑制效应的农药,基质浓度越大,其ME值越小,表明在LC-MS/MS分析过程中,基质对其离子化作用的抑制作用越明显;对于具有基质增强效应的农药(姜中抗芽威和硫双威),基质浓度越高,其ME值越大,表明基质对其LC-MS/MS响应值的增强作用越显著。以大葱中乙霉威为例,基质浓度为5 g/mL时,大葱基质对乙霉威的基质效应(ME值) 为0.98,表明此浓度下大葱基质对乙霉威在LC-MS/MS上的响应无明显的基质效应;而当基质浓度增加到20 g/mL时,ME值为0.49,此浓度的大葱基质对乙霉威具有明显的基质抑制作用。
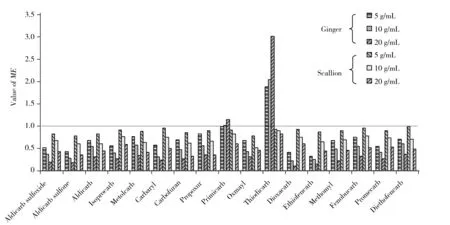
图4 17种农药在不同浓度姜和大葱基质中的基质效应Fig.4 Matrix effects of 17 pesticides in ginger and scallion with different matrix concentrations
3 结 论
在用QuEChERS前处理结合LC-MS/MS法进行蔬菜中氨基甲酸酯类农药的检测时,姜、大葱、黄瓜、胡萝卜和白菜5种常见蔬菜对17种氨基甲酸酯农药均存在不同程度的基质效应,且多数呈现基质抑制效应。由于基质性质和农药性质不同,基质对各农药表现出的基质效应情况不同。基质种类、基质浓度和农药浓度均会影响基质效应强度。另外,在不同基质浓度和农药浓度下,胡萝卜对硫双威和乙霉威、黄瓜对硫双威表现出的基质效应均在0.8~1.1之间,日常检测时,可根据实际需求忽略其基质效应影响。但对于其他蔬菜中氨基甲酸酯类农药的检测,必须考虑基质效应的影响。实际检测中,对于基质效应明显的蔬菜和农药,建议采用基质加标曲线定量。本文研究结果为氨基甲酸酯农药日常检测的定性、定量分析提供了依据。
[1] He H L,Xu X M,Lü M L,Mo W M,Ren Y P.J.Instrum.Anal.(何华丽,徐小民,吕美玲,莫卫民,任一平.分析测试学报),2014,33(2):197-202.
[2] Ding K Y,Lü W G,Sun J,Dong J,Hao Y,Gong X M.J.Instrum.Anal.(丁葵英,吕文刚,孙军,董静,郝莹,宫小明.分析测试学报),2011,30(3):312-315.
[3] Lu M P,Huang K J,Zhou Z,Lin C W,Yang N,Liu X F,Gao F Q.J.Instrum.Anal.(卢敏萍,黄克建,周哲,林翠梧,杨宁,刘晓锋,高凡钦.分析测试学报),2016,35(7):777-784.
[4] GB 2763-2014.National Food Safety Standard-Maximum Residue Limits for Pesticedes in Food(食品安全国家标准-食品中农药最大残留限量.中华人民共和国国家标准).
[5] He Z Y,Wang L,Peng Y,Luo M,Wang W W,Liu X W.FoodChem.,2015,169:372-380.
[6] Liu X W,Li L Y,Lü J G,Mai G X,Li H,Wang X,Zhou R Y,Han Y,Wang L,Li W J.Chin.J.Anal.Lab.(刘潇威,李凌云,吕俊岗,买光熙,李红,王娴,周如意,韩玉,王璐,李卫键.分析试验室),2007,26(4):111.
[7] Zhang F,Huang Z Q,Zhang Y,Li Z H,Wang M L.Chin.J.Chromatogr.(张帆,黄志强,张莹,李忠海,王美玲.色谱),2010,28(4):348-355.
[8] Moreno-González1 D,Huertas-Pérezl J F,García-Campaa A M,Gracia L G.Talanta,2014,128:299-304.
[9] Rebelo A M,Heller M,Dolzan M D,Deschamps F C,Abate G,Micke GA,Grassi M T.Anal.Method,2014,6(3):9469-9476.
[10] Xiang P,Shen M,Zhuo X Y.J.Instrum.Anal.(向平,沈敏,卓先义.分析测试学报),2009,28(6):753-754.
[11] Yu J,Li X Y,Li S J,Li M,Dong L P,Gao Q,Gao Y S,Sui T.FoodRes.Dev.(于杰,李晓玉,李淑娟,李淼,董丽萍,高群,高玉生,隋涛.食品研究与开发),2013,34(23):41-44.
[12] Shah V P,Midha K K,Findlay J W A,Hill H M,Hulse J D,Gilveray I J,McKay G,Miller K J,Patnaik R N,Powell M L,Tonelli A,Viswanathan C T,Yacobi A.Pharm.Res.,2000,17(12):1551-1557.
[13] Wang L Z,Zhou Y,Chen Y,Wang R L,Lin Z X,Lin D J,Zheng S H.Chin.J.Chromatogr.(王连珠,周昱,陈泳,王瑞龙,林子旭,林德娟,郑少惠.色谱),2012,30(2):146-153.
[14] Ding K Y,Xu W J,Li K,Guo L Q,Sun J.Chin.J.Chromatogr.(丁葵英,许文娟,李凯,郭礼强,孙军.色谱),2016,34(2):165-169.
[15] Zhou L,Wang X Q,Xu H,Wang X Y,Liu X C,Liu Z W,Liu Q J,Zhang H.Phys.Test.Chem.Anal:Chem.Anal.(周莉,王新全,徐浩,王祥云,刘芯成,刘之炜,刘秋菊,张虎.理化检验:化学分册),2011,47:1398-1401.[16] Stahnke H,Reemtsma T,Alder L.Anal.Chem.,2009,81(6):2185-2192.
[17] Wang L Q,Zeng Z L,Shu J H,Wang X F,He L M,Liu M,Zhang G K.Chin.J.Anal.Chem.(王立琦,曾振灵,束建花,王旭峰,贺利民,刘敏,张高奎.分析化学),2012,40(9):1445-1449.
Detection of Matrix Effects of 17 Carbamate Pesticides in 5 Vegetables by QuEChERS/LC-MS/MS Method
XU Wen-juan1*,WANG Zhen-gang2,DING Kui-ying1,SUN Jun1,GUO Li-qiang1
(1.Weifang Entry-Exit Inspection and Quarantine Bureau,Weifang 261041,China;2.Affiliated Hospital of Weifang Medical University,Weifang 261041,China)
A QuEChERS coupled with liquid chromatography-tandem mass spectrometric(LC-MS/MS) method was developed for the detection of 17 carbamate pesticides in five vegetables.The matrix effects in ginger,scallion,cucumber,carrot and cabbage,together with the influences of matrix type,matrix concentration and pesticide concentration on the matrix effects were discussed.The results showed that,the liner ranges of 17 pesticides in different vegetables ranged from 5 μg/L to 100 μg/L,and the recoveries ranged from 76.5% to 111.8% with relative standard deviations of 2.5%-8.2%.Different vegetables present different matrix effects for the responses of 17 pesticides in LC-MS/MS,mostly the matrix suppression effects,which were impacted by matrix type,matrix concentration and pesticide concentration.In addition,the matrix effects of thiodicarb and diethofencarb in carrot and thiodicarb in cucumber ranged from 0.8-1.1 despite of matrix concentrations and pesticide concentrations,suggesting the matrix effects of these circumstances advisably being ignored in routine testing.However,the matrix effects must be considered carefully during detection procedures of 17 carbamate pesticides in ginger,scallion,cucumber,carrot and cabbage.
QuEChERS;matrix effects;liquid chromatography-tandem mass spectrometry;vegetables;carbamate;pesticides
10.3969/j.issn.1004-4957.2017.01.009
2016-07-29;
2016-08-21
质检总局科技计划项目(2016IK208);山东出入境检验检疫局项目(SK201420);潍坊市科学技术发展项目(2015ZJ1101)
*通讯作者:许文娟,硕士,中级工程师,研究方向:食品中农兽药残留检测,Tel:0536-8582601,E-mail:wenjuanciq@163.com
O657.63;F767.2
A
1004-4957(2017)01-0054-07
