IMRT与γ刀联合TACE术治疗原发性肝癌的疗效比较
2017-02-15陈绍水刘长民李广欣
张 钰,陈绍水,黎 功,刘长民,李广欣
IMRT与γ刀联合TACE术治疗原发性肝癌的疗效比较
张 钰1,陈绍水2,黎 功1,刘长民2,李广欣3
目的 比较调强放疗(IMRT))与伽马刀(γ刀)联合经肝动脉化疗栓塞(TACE)术治疗原发性肝癌(PHC)的疗效。方法 选择自2012-03至2014-06武警总医院收治的PHC患者94例,按照随机数表将患者分为对照组和观察组,每组47例。对照组患者行IMRT联合TACE术治疗,而观察组患者行γ刀联合TACE术治疗。对比分析两组患者的近期及远期疗效、药物不良反应发生情况及血清中甲胎蛋白(AFP)水平。结果 治疗1个月后,观察组有效率为82.98%(39/47),明显高于对照组的57.45%(27/47) ,且差异具有统计学意义(P<0.05);与治疗前相比,两组患者治疗后血清中AFP水平明显下降,而观察组患者血清中AFP水平显著低于对照组,且差异均具有统计学意义(P<0.05或P<0.01);观察组患者药物不良反应发生率为14.89%(7/47)明显低于对照组的25.53%(12/47),且差异具有统计学意义(P<0.05); 两组患者在治疗后6个月及12个月的生存率之间的差异无统计学意义(P>0.05),而治疗后24个月,观察组患者的生存率显著高于对照组(P<0.05)。结论 相对于IMRT联合TACE术,伽马刀联合TACE术治疗原发性肝癌具有较高的近期及远期疗效,不仅可以有效降低药物毒物反应发生率,而且可以显著抑制血清AFP水平,值得推广应用。
伽马刀;调强放疗;经肝动脉化疗栓塞;原发性肝癌
原发性肝癌(primary hepatic carcinoma, PHC)是消化系统常见的恶性肿瘤之一,具有发病隐匿、进展快、转移率高、生存期短及预后差等特点[1]。每年全球PHC新患病例将近一半在中国,而且不经过治疗的患者的生存率极低[2]。该病早期临床特点不明显,确诊时往往是中晚期,错过了根治性手术的最佳时期。根据2006年美国临床肿瘤学会年会提出的“提高生存质量,延长生存时间”的全新标准,经肝动脉化疗栓塞(transcatheter hepaticarterial chemoembolization, TACE)是目前临床上首选治疗方法,适用于不能切除的肝癌,可以有效提高临床疗效[3]。但是单纯的TACE术不能对肿瘤进行根治,反复使用并不能提高远期生存率[2]。临床上有将TACE和IMRT联合使用的研究,但是放疗对于周边组织的影响较大,肝癌的放射耐受性差,使得治疗受到限制[4]。随着放疗技术的发展,通过精确设计靶区,降低对周边组织的损伤,伽马刀(γ刀)利用γ射线进行放疗,不仅可以提高肿瘤组织的照射剂量,而且最大限度控制肿瘤发展,改善患者的生存质量[5]。γ刀和TACE属于临床上成熟的技术,但是两者联用的研究较少,本研究通过对比γ刀与IMRT联合TACE术治疗PHC的临床疗效,阐述其临床应用特点。
1 对象与方法
1.1 对象 选择自2012-03至2014-06武警总医院肿瘤中心收治的PHC患者94例,均为单发肝癌患者,所有患者均符合原发性肝癌的诊断标准[6],且经过多普勒彩超、上腹部CT或MRI及肝动脉造影,同时结合血清甲胎蛋白(alpha fetal protein, AFP)检测值,经肝穿刺取少量病变组织确诊。按照随机数表达将患者分为对照组和观察组,每组47例。对照组中男32例,女15例;年龄30~68岁,平均(48.23±5.39)岁;肿瘤直径1.8~5.8 cm,平均(3.77±0.48)cm;Child-pugh 分级 A级30例,B级17例。观察组中男29例,女18例;年龄28~70岁,平均(50.17±6.22)岁;肿瘤直径1.7~5.6 cm,平均(3.68±0.54)cm;Child-pugh 分级 A级25例,B级22例。试验过程经伦理委员会通过,且所有患者均签署知情同意书。两组患者的性别、年龄及肿瘤直径等临床资料之间的差异无统计学意义,具有可比性。
1.2 纳入及排除标准 纳入标准:(1)患者具有PHC临床症状;(2)患者为首次确诊PHC;(3)接受治疗前一周内未接受其他治疗;(4)患者无精神障碍;(5)卡氏评分>70分;(6)不伴随发生门静脉癌栓。排除标准:(1)癌症出现远处转移;(2)合并患有心、肝、肾等重大脏器病变;(3)肿瘤边界不清晰;(4)严重的肝硬化并出现大量的腹腔积液;(5)孕妇及哺乳期妇女;(6)病情发展迅速而不能完成试验的患者;(7)炎性反应性肝癌患者。
1.3 治疗方法 对照组患者行IMRT联合TACE术治疗,具体操作方法为先进行2个周期的TACE,TACE的方法按照Seldinger法,经皮股动脉穿刺成功后,常规消毒,选择性置入Yashiro, Cobra导管,行腹腔动脉造影后确定肿瘤的位置、大小及供血情况,确定靶血管后,将微导管超选择性送入靶血管,按照每平方米体表面积注入40~60 mg顺铂+6~10 mg丝裂霉素C+1000 mg氟尿嘧啶;灌注完成后,每平方米体表面积注入30 mg吡柔比星+8~20 ml 40%碘化油的混合物,使用明胶海绵栓塞靶动脉后,再次进行造影,如果结果显示大部分肿瘤血管中断即可,拔出导管鞘,对穿刺部位略加压包扎,治疗结束,每4周重复1次。休息2周之后进行IMRT,患者取仰卧位,使用真空体模固定体位,患者平静呼吸,对膈顶上3~5 cm至肝下缘3~5 cm行连续的薄层螺旋CT扫描,层厚及层间距为5 cm,将CT图像传至TPS三维放射治疗工作站中,计算放射治疗的肿瘤靶区,将肿瘤靶区向外扩大0.5~1.2 cm设定为计划靶体积,选择5~8个共面适形野进行照射,通过剂量-体积直方图确定放射治疗的最佳方案及最大剂量。每次放射剂量4~5 Gy,每周5次,1个疗程为20~25次,总放射剂量为40~50 Gy。
观察组患者行γ刀联合TACE术治疗,具体操作方法为:TACE方法同对照组,注意事项同对照组,将薄层CT扫描图像应用到三维计划系统中精密确定肿瘤区、临床靶区和计划靶区,计划靶体积的确定原则:肿瘤直径<3 cm外扩1.5~2 cm;3~5 cm外扩1~1.5 cm;5~10 cm外扩0.5~1 cm。通过剂量-体积直方图优化放射方案,剂量设计原则:肿瘤直径<3 cm,5 Gy/次,3~4次/周,共6次,总剂量18~24 Gy; 3~5 cm,4~6 Gy/次,3~5次/周,共6~8次,总剂量40~48 Gy;5~10 cm,4~5 Gy/次,2~5次/周,共8~12次,总剂量32~60 Gy。保证靶区在射野内,避免胰脏、肾等重大脏器受到照射。治疗期间进行常规的保肝及对症治疗。
1.4 检测方法 分别于治疗前及治疗后1个月对肝脏进行CT或MRI扫描,并详细记录肿瘤的最大直径、血清中AFP水平及观察临床症状及药物不良反应发生情况。跟踪随访为期24个月,了解患者6个月、12个月及24个月的生存率。
1.5 疗效评价标准 疗效判断参考2000年WHO制定的实体肿瘤评价标准[7]。(1)完全缓解:肿瘤病灶完全消失,至少维持>4周,且不产生新病灶;(2)部分缓解:肿瘤病灶缩小>50%,至少维持>4周,且无新病灶产生;(3)无变化:肿瘤病灶缩小20%~50%,且无新病灶产生;(4)进展:肿瘤病灶增大>25%,或出现新的病灶。有效率(%)=(完全缓解例数+部分缓解例数)/总例数×100%。
1.6 统计学处理 应用SPSS19.0软件对所有数据进行统计分析,组间比较采用t检验;计数资料用百分率(%)表示,组间比较采用χ2检验,以P<0.05表示差异具有统计学意义。
2 结 果
2.1 两组患者近期疗效对比 治疗1个月后,通过CT或MRI对患者进行复查,结果发现对照组患者的有效率为57.45%(27/47),而观察组患者的有效率为82.98%(39/47),观察组的有效率明显高于对照组,且差异具有统计学意义(P<0.05,表1)。

表1 两组原发性肝癌患者近期疗效对比 (n=47)
注:对照组=IMRT治疗;观察组=γ刀治疗
2.2 两组患者血清中AFP水平对比 治疗前,两组患者血清中AFP水平之间的差异无统计学意义(P>0.05)。与治疗前相比,两组患者治疗后血清中AFP水平明显下降,而观察组患者血清中AFP水平显著低于对照组,且差异均具有统计学意义(P<0.05或P<0.01,表2)。
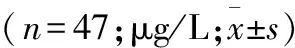

组别治疗前治疗后tP对照组1148.34±103.28673.29±88.5219.3270.008观察组1187.18±148.29502.17±79.1322.1090.002t0.1843.173P0.0930.038①
注:与对照组比较,①P<0.05
2.3 两组患者药物不良反应发生情况 两组患者出现药物不良反应,比如恶心、呕吐、发热、转氨酶升高及骨髓抑制。对照组的发生率为25.53%(12/47),观察组的发生率为14.89%(7/47),观察组患者药物不良反应发生率明显低于对照组,且差异具有统计学意义(P<0.05,表3)。

表3 两组原发性肝癌患者药物不良反应发生情况 (n=47)
注:与对照组比较,①P<0.05
2.4 两组患者远期疗效对比 治疗后6个月及12个月,两组患者的生存率之间的差异无统计学意义(P>0.05)。而治疗后24个月,观察组患者的生存率显著高于对照组,且差异具有统计学意义(P<0.05)。见表4。

表4 两组原发性肝癌患者远期生存率对比 [n=47;n(%)]
注:与对照组比较,①P<0.05
3 讨 论
原发性肝癌主要表现为肝脏进行性增大、黄疸、食欲不振、身体消瘦等症状,对身体健康及生活质量造成重大影响[8]。随着医学技术的发展,治疗PHC的方法越来越多样化,对于不能切除的肝癌患者首选TACE术,是目前临床上较为安全可靠的治疗方式之一。它主要是通过将肿瘤供血动脉栓塞使得肿瘤坏死,加上抗肿瘤药物的局部治疗,有效延缓病情的发展[9]。但是,PHC的肝癌血供丰富,栓塞肝动脉后形成侧支循环,单纯的肝动脉栓塞并不能清除所有病灶,残存一部分的肿瘤细胞及肝内转移细胞,使得TACE的临床应用受到限制[10]。γ刀为肿瘤的治疗提供新思路,可以使高剂量区域肿瘤区保持一致,中心剂量高,周围剂量低,患者的耐受性好,不仅能有效治疗肿瘤,而且保护肿瘤周边组织,可以有效延长患者的生存时间[4]。临床上往往采用综合治疗方案,TACE与γ刀联合应用可以互补,切断肿瘤血供,提高药物浓度,达到较好的临床疗效[4]。
本研究通过对治疗1个月后患者近期疗效进行统计分析,发现观察组患者的有效率明显高于对照组(P<0.05),提示γ刀联合TACE术治疗PHC的近期疗效优于IMRT联合TACE术,主要是由于IMRT的定位精度没有γ刀精确,γ刀可以通过非共面聚焦式多野照射,使得靶区内肿瘤得到有效的控制[4],加上治疗周期短,防止肿瘤的再次增殖,患者的耐受性好,从另一面改善患者的病情恢复情况[11]。PHC患者血清中AFP的含量是病情加重的重要指标之一,AFP含量越高,病情越严重[7],对患者血清中AFP水平进行研究发现与治疗前相比,两组患者治疗后血清中AFP水平明显下降(P<0.01),而观察组患者血清中AFP水平显著低于对照组,且差异均具有统计学意义(P<0.05),表明两种手术方式均能明显降低AFP水平,而γ刀联合TACE术对PHC患者血清AFP的改善具有重要作用,与国外研究结果一致[12]。TACE中的化疗药物可能会带来一系列的药物毒副反应,化疗药物兴奋延脑中枢催吐感受区,同时还可能通过刺激胃肠道粘膜的类嗜铬细胞而提高5-羟色胺的分泌,从而诱发恶心呕吐。另外,TACE术使肿瘤局部缺血坏死,以及肿瘤病灶中的炎性细胞释放致热物质导致体温升高;转氨酶是肝功能的重要指标之一,肝脏受损时转氨酶升高;治疗肿瘤的化疗药物长期应用会产生骨髓抑制作用,不利于患者的预后[13,14]。本研究发现,观察组患者药物毒副反应为14.89%(7/47),明显低于对照组的25.53%(12/47) (P<0.05),说明γ刀联合TACE术可以有效降低药物不良反应的发生率,临床上应根据不同的药物不良反应进行对症治疗,避免其发生。未接受治疗的PHC患者的生存率低,对接受手术的患者进行为期24个月的跟踪随访,结果发现两组患者在治疗后6个月及12个月的生存率之间的差异无统计学意义(P>0.05),而治疗后24个月,观察组患者的生存率显著高于对照组(P<0.05),说明γ刀联合TACE术可以降低肿瘤的复发率,延长生存期[5],对于PHC患者具有较高的生存率,与韩冰等[15]研究结果一致。
综上所述,伽马刀联合TACE术治疗PHC相对于IMRT联合TACE术具有较好的近期疗效,有效降低血清中AFP水平和药物不良反应的发生率,还可以提高患者的远期生存率,表明伽马刀联合TACE是一种有效及有应用前景的非手术治疗方法。
[1] 吕 行,赵 强,宁 鹏,等.奥沙利铂和吉西他滨栓塞化疗联合三维适形放疗治疗晚期原发性肝癌疗效观察[J].海南医学,2014,(22):3307-3309.
[2] 彭 巍.射波刀及其联合灌注栓塞化疗治疗原发性肝癌的临床研究[D].广西医科大学,2013.
[3] Hu B,Wang S S,Du Q.Traditional Chinese medicine for prevention and treatment of hepatocarcinoma: From bench to bedside[J].World J Hepatol,2015,7(9):1209-1232.
[4] 黄 慧,谢从华,龙志雄.伽马刀或三维适形调强放疗联合经皮肝动脉插管化疗栓塞治疗原发性肝癌的疗效观察[J].中国肿瘤临床与康复,2013,20(2):137-139.
[5] 沙晓锋,张 娇,韦淑贞,等.介入联合体部伽玛刀治疗原发性肝癌疗效分析[J].现代肿瘤医学,2013,21(10):2281-2283.
[6] 中国抗癌协会肝癌专业委员会.原发性肝癌的临床诊断与分期标准[J].中华肝脏病杂志,2001,9(6):324.
[7] 刘德华,富 韬,罗娅红,等.动脉化疗栓塞与三维适形放疗联合在原发性肝癌患者中应用及效果[J].现代生物医学进展,2013,13(15):2921-2924.
[8] 田 慧,和振坤,徐庆杰,等.TACE联合放疗治疗原发性肝癌的疗效及对生存质量的影响[J].中国老年学杂志,2013,33(20):4987-4989.
[9] 彭生才,袁志平,王 秋,等.肝动脉栓塞化疗联合三维适形放疗治疗中晚期原发性肝癌临床疗效评价[J].西部医学,2013,25(10):1529-1531.
[10] 刘合代,丁 罡,张 明,等.肝动脉栓塞化疗联合放疗治疗原发性肝癌的疗效分析[J].现代肿瘤医学,2015,(9):1258-1261.
[11] 严 程,朱政鸣,孙晓龙,等.伽玛刀联合肝动脉栓塞化疗治疗原发性肝癌的临床疗效观察[J].现代生物医学进展,2015,15(24):4686-4689.
[12] Chung Y H,Han G,Yoon J H,etal.Intetim analysis of START: Studyin Asia of the combination of TACE (transcatheter arterial chemoem-bolization)with sorafenib in patients with hepatocellular carcinomatrial[J].Int J Cancer,2013,132(10):2448-2458.
[13] 王 民.肝动脉化疗栓塞联合三维适形放射治疗原发性肝癌的临床观察[D].山东大学,2012.
[14] 吴 鹤,应晓珍,吕素珍,等.肝动脉栓塞化疗联合调强放疗治疗原发性肝癌的临床疗效[J].中国现代医生,2015,53(20):51-53.
[15] 韩 冰.伽马刀放疗与肝动脉化疗栓塞联合治疗肝癌伴门静脉癌栓的疗效分析[J].中国继续医学教育,2015,7(23):96-97.
(2016-09-02收稿 2016-09-20修回)
(责任编辑 梁秋野)
Clinical comparative study of intensity-modulated radiotherapy and gamma knife combined with TACE for the treatment of primary hepatic carcinoma
ZHANG Yu1,CHEN Shaoshui2,LI Gong1,LIU Changmin2,and LI Guangxin3.
1.Cancer Second Division,General Hospital of Chinese People’s Armed Police Force,Beijing 100039,China; 2.Cancer Division,Affiliated Hospital of Binzhou Medical Oncology,Binzhou 256600,China 3. Cancer Division, Third Hospital of Beijing Municipal Corps,Chinese People’s Armed Police Force, Beijing 100049,China
Objective To compare the clinical curative effect of the gamma knife (γ knife) and intensity-modulated radiotherapy(IMRT) combined with transcatheter hepaticarterial chemoembolization (TACE) for primary hepatic carcinoma.Methods According to the stochastic indicator, 94 cases of PHC patients betweem March 2012 and June 2014 were equally divided into control group and observation group. Patients in control group were treated with intensity-modulated radiotherapy combined with TACE, while observation group was treated with γ knife combined with TACE. The recent and forward curative effect, occurrence of adverse reactions of drugs and the level of serum alpha fetal protein (AFP) of the two groups were analyzed comparatively.Results After one-month treatment, the effective rate of observation group was 82.98% (39/47), which was obviously higher than that of control group[57.45% (27/47)], and the difference was statistically significant (P<0.05). The level of serum AFP of the two groups declined obviously after treatment, and thatof observation group was significantly lower than in control group. The difference was statistically significant (P<0.05 orP<0.01). The incidence of adverse reactions in observation group was 14.89% (7/47), which was significantly lower than in control group[25.53% (12/47)], and the difference was statistically significant (P<0.05). However, the difference of survival rate after 6 months and 12 months of treatment between the two groups was not of statistical significance (P>0.05). The survival rate of observation group after 24 months of treatment was significantly higher than that of control group (P<0.05).Conclusions Compared with intensity-modulated radiotherapy combined with TACE, γ knife combined with TACE for the treatment of primary hepatic carcinoma has a better recent and forward curative effect in that it can not only reduce the incidence of toxic reactions of drugs effectively, but significantly inhibit the level of serum AFP, which is worthy of clinical popularization and application.
gamma knife;intensity-modulated radiotherapy;transcatheter hepaticarterial chemoembolization;primary hepatic carcinoma
张 钰,本科学历,医师。
1.100039 北京,武警总医院肿瘤二科;2.256600,滨州医学院附属医院肿瘤科;3.100049,武警北京总队第三医院肿瘤科
陈绍水,E-mail:bytychenss@126.com
R735.7
