新型4-吡啶基-2-氨基嘧啶类化合物的合成及其生物活性
2017-02-15张齐丁志彬孙楠徐徐高聪芬王石发
张齐, 丁志彬, 孙楠, 徐徐,2,3, 高聪芬, 王石发,2,3*
(1.南京林业大学化学工程学院,南京210037;2.江苏省生物质绿色燃料与化学品重点实验室,南京210037;3.广西林产化学与工程重点实验室,南宁530008; 4.南京农业大学植物保护学院,南京210095)
新型4-吡啶基-2-氨基嘧啶类化合物的合成及其生物活性
张齐1, 丁志彬1, 孙楠1, 徐徐1,2,3, 高聪芬4, 王石发1,2,3*
(1.南京林业大学化学工程学院,南京210037;2.江苏省生物质绿色燃料与化学品重点实验室,南京210037;3.广西林产化学与工程重点实验室,南宁530008; 4.南京农业大学植物保护学院,南京210095)
以诺蒎酮为原料,合成了新型的4-吡啶基-2-氨基嘧啶类化合物,并探索了该类化合物的抑菌和抗虫活性。诺蒎酮分别与吡啶-3-甲醛和吡啶-4-甲醛在乙醇钠催化作用下缩合制得3-(3′-吡啶)亚甲基诺蒎酮(2a)和3-(4′-吡啶)亚甲基诺蒎酮(2b),2a和2b在叔丁醇钾催化作用下与盐酸胍经环化反应,得到新型吡啶基嘧啶类化合物5,6,7,8-四氢-4-(3′-吡啶基)-7,7-二甲基-6,8-桥亚甲基喹唑啉-2-胺(3a)和5,6,7,8-四氢-4-(4′-吡啶基)-7,7-二甲基-6,8-桥亚甲基喹唑啉-2-胺(3b)。采用1H NMR、13C NMR、IR、MS和HRMS对化合物3a和3b的结构进行了表征,探讨了化合物3a和3b的抑菌活性和对萝卜蚜虫(Lipaphiserysimi)和紫薇长斑蚜虫(Tinocalliskalawaluokalani)的杀虫活性。结果表明,合成的化合物对细菌和真菌具有较好的抑制效果,其中3b对枯草芽孢杆菌(Bacillussubtilis)有较强的抑制作用,最低抑菌浓度为7.80 μg/mL。化合物对蚜虫均表现出较好的杀虫活性,在50 mg/L的浓度下对蚜虫的致死率可达60%以上。通过分析化合物的抗虫活性,为开拓松节油的深加工应用提供理论依据。
诺蒎酮;嘧啶衍生物;抑菌活性;杀虫活性
嘧啶是一类非常重要的杂环化合物,嘧啶类化合物在农林生产中可作为杀虫剂[1]、杀菌剂[2-3]、除草剂[4]等使用,因其高效、广谱、作用方式独特,在农药创制研究中是较为活跃的领域[5-7]。Hunt等[8]通过乙酰丙酮和硫脲制备2-巯基-4,6-二甲基嘧啶后再用Raney镍还原巯基得到4,6-二甲基嘧啶;El-Zahar等[9]以查耳酮和硫酸氨基脲为原料,在1%的氢氧化钠乙醇溶液中,回流10 h后得到2-氨基嘧啶类化合物;花文廷[10]在含有盐酸盐的乙醇溶液中分别加入乙酰丙酮和尿素两种原料,反应最终得到2-羰基-4,6-二甲基嘧啶,合成方法具有反应时间短、易操作、反应温度温和、得率高等优点。Dow公司开发的嘧啶类化合物[11],能够有效地防治甜菜夜蛾、烟芽夜蛾、果蝇和埃及伊蚊。日本住友化学开发的嘧虫胺[12]和先正达报道的嘧啶威[13]均为嘧啶类农药,因生物毒性大、对环境不友好,从而制约了该药的广泛使用。另一方面, 植物源农药[14]以其对害虫的作用机制独特,不容易产生抗药性,对天敌和人、畜低毒, 以及无残留污染等优点,被称为绿色农药。为寻找高效低毒的绿色杀虫剂和杀菌剂,本研究以具有生物活性的天然产物萜烯类[15-17]物质β-蒎烯为原料,采用活性拼接的方法, 将嘧啶环和吡啶环引入蒎烷基中,以诺蒎酮[18]为先导化合物,经与吡啶甲醛缩合后得到3-吡啶亚甲基诺蒎酮,再与盐酸胍在碱性条件下环化合成了新型吡啶基-2-氨基嘧啶化合物,旨在开发具有生物活性的新型杂环有机化合物,为进一步结构改造以及药物设计合成提供重要依据。
1 材料与方法
试剂:诺蒎酮自制,纯度≥95.0% (GC),盐酸胍、吡啶-3-甲醛、吡啶-4-甲醛、乙醇钠、叔丁醇钾、氯化钠、无水硫酸钠、叔丁醇、乙醇、甲醇、乙酸乙酯均为市售分析纯,未处理直接使用。
仪器:所合成的中间体及目标产物的核磁共振光谱采用德国Bruker AV-300 MHz核磁共振仪进行分析(TMS为内标,DMSO-d6为溶剂);红外光谱采用美国Thermo Electron Corporation Nicolet 380 FTIR红外光谱仪进行分析(压片法);质谱采用美国Agilent公司生产的7890A/5975C型GC-MS联用仪进行分析;高分辨质谱采用德国Bruker高分辨质谱仪进行分析;熔点测定采用北京泰克X-6显微熔点测定仪进行检测(温度计未经校正)。
其中,气相色谱(GC-MS仪器)的分析条件为:氢火焰离子化检测器,采用Agilent HP-5毛细管柱(30 mm×0.250 mm×0.25 μm),以氮气作载气,柱头压力为100 kPa,分流比为20∶1,气化室温度280℃,检测器温度250℃,柱温为60℃下,保留2 min,升温速度为10℃/min,终温300℃,保留18 min,采用面积归一化法进行定量分析。质谱部分的分析条件为:采用电子轰击离子化法,电子能量70 eV,加速电压3 kV,离子电流为300 μA,离子源温度230℃, MS四级杆温度150℃。
1.2 新型吡啶基-2-氨基嘧啶类化合物的合成
目标化合物5,6,7,8-四氢-4-(3′-吡啶基)-7,7-二甲基-6,8-桥亚甲基喹唑啉-2-胺(3a)和5,6,7,8-四氢-4-(4′-吡啶基)-7,7-二甲基-6,8-桥亚甲基喹唑啉-2-胺(3b)的合成路线见图1。

图1 目标化合物合成路线Fig. 1 Synthetic route of target compounds
3a的合成路线和方法为:将0.1 mol诺蒎酮、0.15 mol吡啶-3-甲醛、3.0 g乙醇钠和50 mL乙醇依次加入配有搅拌器和温度计的三口烧瓶中,常温下进行反应;反应物用0.1 L乙酸乙酯萃取3次,合并萃取液,用蒸馏水洗涤至中性,然后再用饱和食盐水洗涤1次,有机相采用无水硫酸钠干燥去水分;过滤去除干燥剂后浓缩回收溶剂,得到3-(3′-吡啶)亚甲基诺蒎酮粗产物;3-(3′-吡啶)亚甲基诺蒎酮粗产物在甲醇溶剂中进行重结晶,得到精制3-(3′-吡啶)亚甲基诺蒎酮;将0.01 mol 的3-(3′-吡啶)亚甲基诺蒎酮、0.02 mol盐酸胍、60 mL叔丁醇和3.0 g叔丁醇钾依次加入配有搅拌器和回流冷凝器的单口烧瓶中,加热回流反应2~6 h,用gas chromatography(GC)跟踪检测,直到3-(3′-吡啶)亚甲基诺蒎酮转化率达到95%后停止反应;反应物用0.5 L乙酸乙酯萃取3次,合并萃取液,用蒸馏水洗涤至中性,然后再用饱和食盐水洗涤1次,有机相用无水硫酸钠干燥去水分;过滤去除干燥剂后浓缩回收溶剂,得到粗产物;粗产物在甲醇溶剂中进行重结晶,得到精制产物。
3b的合成路线和方法为:将0.1 mol诺蒎酮、0.15 mol的吡啶-4-甲醛、3.0 g乙醇钠和50 mL乙醇依次加入配有搅拌器和温度计的三口烧瓶中,常温下反应;反应物用0.1 L乙酸乙酯萃取3次,合并萃取液,用蒸馏水洗涤至中性,然后再用饱和食盐水洗涤1次,有机相用无水硫酸钠干燥去水分;过滤去除干燥剂后浓缩回收溶剂,得到3-(4′-吡啶)亚甲基诺蒎酮粗产物;3-(4′-吡啶)亚甲基诺蒎酮粗产物在甲醇溶剂中进行重结晶,得到精制3-(4′-吡啶)亚甲基诺蒎酮;将0.01 mol的3-(4′-吡啶)亚甲基诺蒎酮、0.02 mol盐酸胍、60 mL叔丁醇和3.0 g叔丁醇钾依次加入配有搅拌器和回流冷凝器的单口烧瓶中,加热回流反应2~6 h,用GC跟踪检测,直到3-(4′-吡啶)亚甲基诺蒎酮转化率达到95%后停止反应;反应物用0.5 L乙酸乙酯萃取3次,合并萃取液,用蒸馏水洗涤至中性,然后再用饱和食盐水洗涤1次,有机相用无水硫酸钠干燥去水分;过滤去除干燥剂后浓缩回收溶剂,得到粗产物;粗产物在甲醇溶剂中进行重结晶,得到精制产物。
尽管是白天,但别墅里的光线却格外晦暗。罗恬只感觉陈洋的眼睛灼灼地闪着光芒。陈洋轻轻抚着她的脸颊说:“那么多人死了,你不害怕吗?”
1.3 生物活性试验
1.3.1 化合物对蚜虫的活性试验
1)供试虫源:供试害虫为萝卜蚜(Lipaphiserygimi)和紫薇长斑蚜(Tinocalliskalawaluokalani),萝卜蚜采自南京农业大学温室种植的甘蓝上,紫薇长斑蚜采自南京农业大学校园生长的紫薇树叶上。
2)试验方法:采用喷雾法测定供试杀虫剂对萝卜蚜虫的毒力效果。以0.1% TritonX-100水溶液为对照,试验时母液用0.1% TritonX-100水溶液稀释成所需要的系列浓度梯度。喷雾采用Potter喷雾塔,将未接触过药剂的甘蓝叶片放置在喷雾塔中并用相应浓度进行喷雾,然后将叶片上即刻接入无翅成蚜和个体较大的无翅若蚜,每个处理15头蚜虫,重复3次。等叶片晾干后放入直径5 cm培养皿中并拧紧盖口,置于温度为(25±1)℃,光周期为16 h∶8 h(L∶D)的培养箱内。24 h后检查死亡率。检查时用毛笔轻轻拨动虫体,不能动即视为死亡。
采用喷雾法测定供试杀虫剂对紫薇长斑蚜虫的毒力效果。喷雾采用Potter喷雾塔,将未接触过药剂的紫薇叶片放置在喷雾塔中并用相应浓度进行喷雾,然后将叶片上即刻接入无翅成蚜和个体较大的无翅若蚜,每个处理15头蚜虫,重复3次。其他步骤同萝卜毒杀试验。
1.3.2 化合物的抑菌活性试验
供试菌种为大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)、枯草芽孢杆菌(Bacillussubtilis)、白色念珠菌(Moniliaalbican)、黑曲霉(Aspergillasniger)、热带假丝酵母(Candidatropicalis)均由南京林业大学化学工程学院微生物实验室提供。
制备培养基和菌悬液,并测试化合物3a和3b最低抑菌浓度(MIC),实验方法参照文献[19]。
2 结果与分析
2.1 化合物的结构表征
3-(3-吡啶)亚甲基诺蒎酮(2a):黄色透明晶体,纯度98.0% (GC),收率为84.3%;1H NMR (DMSO,300 MHz)δ:0.86 (s,3H),1.36 (s,3H),1.43 (d,J=6.2 Hz,1H),2.33~2.35 (m,1H),2.59~2.68 (m,2H),2.99 (m,2H),7.48~7.51 (m,1H),7.59 (s,1H),8.10 (d,J=6 Hz,1H);8.58~8.59 (m,1H),8.86 (d,J=1.7 Hz,1H);13C NMR (DMSO,75 MHz)δ:21.35,25.78,26.77,30.27,38.72,39.00,39.17,39.33,39.50,39.67,39.83,40.00,40.38,55.16,123.61,130.95,131.06,134.96,136.87,149.37,151.58,201.32;MS (70 eV)m/z(%):227 (M+,95),226 (88),212 (60)。
3-(4-吡啶)亚甲基诺蒎酮(2b):黄色透明晶体,纯度97.6% (GC),收率为85.0%;1H NMR (DMSO,300 MHz)δ:0.85 (s,3H),1.36 (s,3H),1.43 (d,J=6.2 Hz,1H),2.33~2.35 (m,1H),2.61~2.68 (m,2H),3.00 (m,2H),7.52 (s,1H),7.61 (d,J=2.9 Hz,1H),8.67 (d,J=2.9 Hz,1H);13C NMR (DMSO,75 MHz)δ:21.34,25.74,26.70,30.16,38.61,39.00,39.17,39.34,39.50,39.67,39.84,40.00,40.42,55.22,124.27,131.72,137.22,141.99,149.99,201.26;MS (70 eV)m/z(%):227 (M+,100),212 (44),184 (63)。


2.2 目标化合物的合成
在合成目标化合物过程中,诺蒎酮分别与吡啶-3-甲醛、吡啶-4-甲醛进行反应后得到中间体化合物2a与2b,此反应是经典的羟醛缩合反应,反应时间短且得率较高。随后得到的中间体化合物与盐酸胍进行环化反应,此反应与羟醛缩合反应相比,反应时间长,同时由于中间体易分解,其得率有所降低。
2.3 波谱解析
由于化合物类似,本文只列出3a化合物的结构表征图谱以进行波谱解析。图2和图3分别为化合物3a的红外谱图和高分辨谱图。
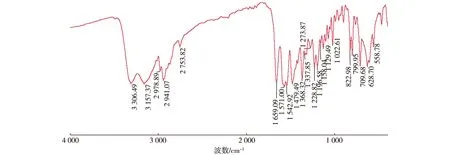
图2 3a的红外谱图Fig. 2 IR spectrum of 3a

图3 3a的高分辨谱图Fig. 3 High resolution mass spectrum (HRMS) of 3a

在EI-MS谱图中,目标化合物的分子离子峰与理论值均吻合。目标产物的HRMS[M+H]+实测值与计算值误差基本在0.5%以内。
2.4 生物活性
采用喷雾法评价的化合物对蚜虫活性试验结果见表1和表2。由表1可知,化合物3a和3b在200 mg/L的质量浓度下对蚜虫的致死率分别为100%和95.6%,表明所合成的化合物对蚜虫的生长有抑制作用。表2列出了不同浓度下化合物3a和3b对紫薇长斑蚜虫的抑制活性。结果显示,目标化合物在50 mg/L的质量浓度下对蚜虫的致死率均在60%以上。

表1 化合物3a和3b对萝卜蚜虫的抑制活性
注:CK为空白对照组,PCa为阳性对照噻虫嗪。下同。

表2 化合物3a和3b对紫薇长斑蚜虫的抑制活性
采用微量二倍稀释法评价的化合物对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、白色念珠菌、黑曲霉、热带假丝酵母等的活性试验结果见表3。由表3可知, 化合物具有较好的抑制活性能力,其中,化合物3b对枯草芽孢杆菌有很强的抑制作用,最低抑菌浓度为7.80 μg/mL。

表3 化合物3a和3b的最低抑菌浓度(MIC)
注:PCa阳性对照(positive control),细菌为阿米卡星,真菌为酮康唑。
3 结 论
以诺蒎酮为原料合成了新型吡啶基嘧啶类化合物3a和3b,采用1H NMR、13C NMR、IR、MS和HRMS对化合物3a和3b的结构进行了表征,并测试了化合物的抗虫活性与抑菌效果。结果表明,合成的化合物3b对枯草芽孢杆菌有很强的抑制作用,最低抑菌浓度为7.80 μg/mL。化合物对蚜虫均表现出较好的杀虫活性,50 mg/L处理下对蚜虫的致死率可达60%以上。该研究旨在开发具有生物活性的新型杂环有机化合物,为进一步结构改造以及药物设计合成提供重要信息,也可作为潜在的紫薇长斑蚜虫杀虫剂进行深入研究。
[1]SUKUMALANAND P, BURANAPANICHPAN S, TAYUTIVUTIKUL J. Field evaluation of pyrimidifen for controlling of the African red mite,Eutetranychusafiicanus(Tucker) on tangerines in Chiang Mai[J]. Journal of Agriculture (Thailand), 1999, 15: 39-46.
[2]SAKAI M, MATSUMURA T,MIDORIKAWA S, et al. 4-(3-butynyl) aminopyrimidine derivatives aspest control agents for agricultural and horticultural use: U.S. patent 8,586,505[P]. 2013-11-19.
[3]BAMBA M, MURAKI M, TAKASHIMA S. Fluorine containing quinazoline-derived pest-control agent for use in agriculture and horticulture[P]. WO: 2012096115, 2012.
[4]SIBONY M, RUBIN B. Molecular basis for multiple resistance to acetolactate synthase-inhibiting herbicides and atrazine inAmaranthusblitoides(prostrate pigweed)[J]. Planta, 2003, 216(6):1022-1027.
[5]ZHU Y J, JIANG F C. Progress in the study of antitumor drug targeting on the Ras signaling pathway[J]. Acta Pharmaceutica Sinica, 2009, 44(1):1-10.
[6]SAITO T, OBITSU T, KONDO T, et al. 6,7-dihydro-5H-cyclopenta[d]pyrazolo[1, 5-a]pyrimidines and their derivatives as novel corticotropin-releasing factor 1 receptor antagonists[J]. Bioorganic & Medicinal Chemistry, 2011, 19(18):5432-5445.
[7]GHORAB M M, NOAMAN E, ISMAIL M M, et al. Novel antitumor and radioprotective sulfonamides containing pyrrolo[2,3-d]pyrimidines[J]. Arzneimittel Forschung-Drug Research, 2006, 56(6):405-413.
[8]HUNT R R, MCOMIE J F W, SAYER E R. 109. Pyrimidines. Part X. Pyrimidine, 4: 6-dimethylpyrimidine, and their 1-oxides[J]. Journal of the Chemical Society, 1959:525-530.
[9]EL-ZAHAR M I, EL-KARIM S A, ANWAR M M, et al. Synthesis, antimicrobial and antioxidant activities of some novel cyclized naphthyl cyclohexanone derivatives[J]. Der Pharma Chemica, 2010, 2(4):118-134.
[10]花文廷. 杂环化学[M]. 北京:北京大学出版社, 1991: 492-494. HUA W T. Heterocyclic chemistry[M]. Beijing: Peking University Press, 1991: 492-494.
[11]BREWSER W, MDEMETER D, ERIKSON W. Pesticides and their use as agrochemicals: WO2011025505[P]. 2011-03-03.
[12]GHANIM M, LEBEDEV G, KONTSEDALOV S, et al. Flufenerim, a novel insecticide acting on diverse insect pests: biological mode of action and biochemical aspects[J]. Journal of Agricultural and Food Chemistry, 2011,59(7, SI):2839-2844.
[13]MULLA M S. Toxicity of new organic insecticides to mosquito fish and some other aquaticorganisms[J]. Mosquito News, 1966, 26(1):87-91.
[14]RAKASH A, RAO J, NANDAGOPAL V. Future of botanical pesticides in rice, wheat, pulses and vegetables pest management[J]. Journal of Biopesticides, 2008, 1(2):154-169.
[16]LI J, TIAN X R, GAO Y Q, et al. A value-added use of volatile turpentine: antifungal activity and QSAR study of beta-pinene derivatives against three agricultural fungi[J]. RSC Advances, 2015, 5(82):66947-66955.
[17]GAO Y Q, LI J, SHANG S B, et al. Synthesis and insecticidal activity of acylthiourea derivatives from beta-pinene[J]. Letters in Drug Design & Discovery, 2015, 12(3):241-249.
[18]刘兵,敖汪伟,杨杨,等. 左旋β-蒎烯选择性氧化合成右旋诺蒎酮的研究[J]. 南京林业大学学报(自然科学版), 2010, 34(2):89-94. LIU B, AO W W, YANG Y, et al. Synthesis of (+)nopinone from (-)pinene by selective oxidation[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2010, 34(2):89-94.
[19]魏柏松, 谷文, 徐徐, 等. 新型蒎烷基含氮杂环化合物的合成及抑菌活性研究[J]. 有机化学, 2013, 33(10):2196-2204. WEI B S, GU W, XU X, et al. Synthesis and antibacterial activity of new chiral nitrogen-containing heterocycles[J]. Chinese Journal of Organic Chemistry, 2013, 33(10):2196-2204.
Synthesis and biological activity of novel4-pyridyl-2-aminopyrimidine derivatives
ZHANG Qi1, XU Xu1,2,3, GAO Congfen4, WANG Shifa1,2,3*
(1.CollegeofChemicalEngineering,NanjingForestryUniversity,Nanjing210037,China;2.JiangsuKeyLaboratoryofBiomass-basedGreenFuelsandChemicals,Nanjing210037,China;3.GuangxiKeyLaboratoryofChemistryandEngineeringofForestProducts,Nanning530008,China;4.CollegeofPlantProtection,NanjingAgriculturalUniversity,Nanjing210095,China)
Novel 4-pyridyl-2-aminopyrimidine derivatives were synthesized by using nopinone as the starting material, and their antibacterial and insecticidal activities were analyzed in this paper. Nopinone were condensed with pyridine-3-carboxaldehyde and pyridine-4-carboxaldehyde to get the intermediates 3-(3′-pyridylmethylene) nopinone (2a) and 3-(4′-pyridylmethylene) nopinone (2b) by using sodium ethoxide as the catalyst. The 4-pyridyl-2-aminopyrimidine derivatives of 5,6,7,8-tetrahydro-4-(3′-pyridyl)-7,7-dimethyl-6,8-methanoquinazolin-2-amine (3a) and 5,6,7,8-tetrahydro-4-(4′-pyridyl)-7,7-dimethyl-6,8-methanoquinazolin-2-amine (3b) were obtained by condensation and cyclization from 2a and 2b under the condition of usingt-BuOK as the catalyst int-butanol. The chemical structures of 3a and 3b were determined by1H NMR,13C NMR, IR, MS and HRMS, and the antibacterial and insecticidal activities of the compounds 3a and 3b were also examined. The results showed that both 3a and 3b had good bacteriostatic effect against turnip aphid(Lipaphiserysimi) and Kirkaldy(Tinocalliskalawaluokalani). The compound 3b had a strong inhibitory effect onBacillussubtilis, minimum inhibitory concentrations (MIC) was 7.80 μg/mL, and both 3a and 3b had good insecticidal activities. The lethal rate of aphids was more than 60% under the concentration of 50 mg/L. The results of this study would provide the theoretical basis for further processing of turpentine.
nopinone; 4-pyridyl-2-aminopyrimidine; bacteriostatic activity; insecticidal activity
2016-04-27
2016-05-28
江苏省高校自然科学研究重大项目(14KJ220001);国家自然科学基金项目(31470529);广西林产化学与工程重点实验室开放基金项目(JSBEM2014010)。
张齐,男,研究方向为天然产物的合成与利用。通信作者:王石发,男,教授。E-mail:wsfyyq@njfu.edu.cn
TQ453.2
A
2096-1359(2017)01-0051-06
