左乙拉西坦对热性惊厥大鼠治疗作用的研究
2017-02-14李学超王建忠卢凌凌
李学超,王 淼,王建忠,卢凌凌
左乙拉西坦对热性惊厥大鼠治疗作用的研究
李学超1,王 淼1,王建忠1,卢凌凌2
目的 观察左乙拉西坦对热性惊厥大鼠的治疗作用。方法 通过热水浴建立热性惊厥大鼠模型,将40只SD幼龄热性惊厥大鼠随机分为模型组及左乙拉西坦低、中、高剂量组[100、200、300 mg/(kg·d)],分别于造模前灌胃,造模后进行47 ℃热水浴试验,每天惊厥1次,共惊厥5 d。观察每组大鼠惊厥潜伏期、惊厥持续时间、惊厥级别。采用TUNLE法检测各组大鼠海马神经元凋亡情况。试剂盒法检测海马组织中含半胱氨酸的天冬氨酸水解酶(Caspase 3)活性及谷氨酸(Glu)含量,Western blot检测γ-氨基丁酸(GABA蛋白)表达量。结果 与模型组比较,左乙拉西坦低、中、高剂量组中大鼠惊厥潜伏期延长,惊厥持续时间缩短,惊厥严重程度降低,海马神经元凋亡率降低,Caspase 3活性及Glu含量降低,GABA表达量提高,差异均有统计学意义(P<0.01)。结论 左乙拉西坦对热性惊厥大鼠具有显著治疗作用,可能与抑制神经元凋亡及调节Glu与GABA表达量有关。
左乙拉西坦;热性惊厥;海马神经元;谷氨酸;γ-氨基丁酸
0 引言
热性惊厥是小儿时期最常见的惊厥性疾病,在小儿惊厥中占50%左右,在6岁以下儿童的发病率将近5%。热性惊厥易于复发,并因为复发次数较多,可造成不同程度的脑损伤,引起脑组织病理学变化,从而导致幼儿智力发育障碍,甚至癫痫的发生[1-2]。研究表明,神经元损伤、兴奋性氨基酸递质与抑制性氨基酸递质失衡是热性惊厥产生的原因之一[3-4]。左乙拉西坦是新型抗癫痫药物,临床及动物实验均已证实其对小儿热性惊厥即幼龄大鼠具有治疗作用,但具体机制未知[5-6]。因此,研究左乙拉西坦与热性惊厥导致的海马神经元损伤及氨基酸递质失衡的关系,对于进一步全面了解左乙拉西坦治疗小儿热性惊厥的具体机制具有重要作用。
1 材料和方法
1.1 动物 28 d幼龄SD雄性大鼠40只,购于上海斯莱克实验动物有限责任公司,合格证号:SCXK(沪)2012-0002,室内温度控制在(23±2)℃,大鼠自由饮食和摄水。
1.2 药物及试剂 BCA法蛋白定量试剂盒,ECL超敏发光液,小鼠抗GAPDH单克隆抗体,Caspase 3活性检测试剂盒(碧云天生物技术研究所);兔抗GABA多克隆抗体(美国Abcam公司);TUNEL试剂盒(武汉博士德生物技术有限公司)。
1.3 仪器 LDZ5-2型台式低速离心机(北京医用离心厂);电泳仪,转印电泳仪(北京六一仪器厂);ChemiDocTM XRS凝胶成像系统(美国Bio-Rad公司);AF6000荧光显微镜(德国徕卡公司);-80 ℃冰箱(美国Thermo公司)。
1.4 热性惊厥大鼠模型建立、分组及观察指标[6-7]参考相关文献,进行热水浴试验,温度为47 ℃,在5 min内大鼠发生惊厥即选为试验大鼠。将选出的40只合适的大鼠随机分为模型组及左乙拉西坦低、中、高剂量组[100、200、300 mg/(kg·d)],分别于热性惊厥试验前灌胃,然后进行47 ℃热水浴试验,每天惊厥1次,共惊厥5 d。观察每组大鼠惊厥潜伏期、惊厥持续时间、惊厥级别。惊厥潜伏期指大鼠放入热水中即刻至发生惊厥的时间,记录单位为秒(s)。惊厥持续时间指大鼠由刚开始发生惊厥至惊厥停止的时间,记录单位为秒(s)。惊厥级别能够反映惊厥发生的严重程度,具体标准为:0级,没有发生惊厥;Ⅰ级,点头,眨眼等面部抽动行为;Ⅱ级,有节律性的点头;Ⅲ级,前肢阵挛,抽搐;Ⅳ级,全身强直;Ⅴ级,全身强直,跌倒。
1.5 标本采集 大鼠用10%水合氯醛注射麻醉后,断头取脑,于冰浴上钝性分离大鼠双侧海马脑组织,在液氮罐中保持。
1.6 Caspase 3活性及Glu含量测定 海马组织匀浆后,取上清液,分别根据试剂盒说明书进行测定。
1.7 TUNEL法检测海马神经元凋亡 取海马组织标本,按照TUNEL试剂盒说明书进行操作。每个标本海马组织切片,在200倍显微镜目镜下随机选取5个视野进行计数,其中阳性细胞呈棕色或棕褐色,分别计数细胞总数及阳性细胞数,取其平均值,细胞凋亡指数(Apoptotic index,AI)=每个视野TUNEL染色后阳性的细胞数/每个视野细胞总数×100%。
1.8 Western blot检测GABA蛋白表达 取海马组织标本,按比例加入RIPA(10 μg/mL)裂解液和蛋白酶抑制剂裂解,每隔10 min置于涡旋仪中震荡30 s,40 min后离心,吸取上清液,获得总蛋白。采用BCA试剂盒测定蛋白浓度。蛋白样品热变性后上样,进行十二烷基苯磺酸钠凝胶电泳1~2 h,接着湿法转膜30~50 min。5%脱脂奶粉进行封闭1 h,一抗溶液(GABA,稀释浓度为1∶100)孵育,4 ℃冰箱过夜;二抗室温摇床中孵育1 h后,在凝胶成像系统中曝光。最后用“Quantity one”软件统计各抗体条带灰度值。

2 结果
2.1 各组大鼠惊厥潜伏期、惊厥持续时间比较 与模型组比较,左乙拉西坦低、中、高剂量组惊厥潜伏期显著延长,惊厥持续时间显著降低,差异均有统计学意义(P<0.01)。见表1。

表1 各组大鼠惊厥潜伏期、惊厥持续时间比较(s)
注:与模型组比较,**P<0.01
2.2 各组大鼠惊厥程度比较 与模型组比较,左乙拉西坦低、中、高剂量组中大鼠惊厥程度显著降低,差异均有统计学意义(P<0.01)。见表2。
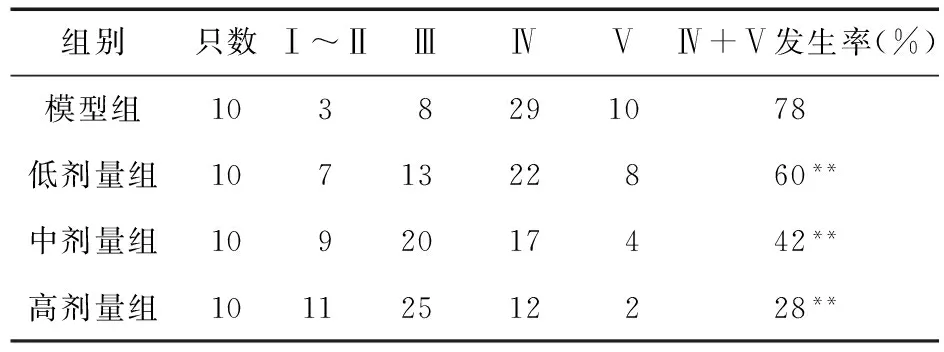
表2 各组大鼠5 d惊厥程度比较(只)
注:与模型组比较,**P<0.01
2.3 各组大鼠海马神经元凋亡程度比较 与模型组比较,左乙拉西坦低、中、高剂量组中神经元凋亡率显著降低,差异均有统计学意义(P<0.01)。见图1。
2.4 各组大鼠海马组织中Caspase 3活性及Glu含量的比较 与模型组比较,左乙拉西坦低、中、高剂量组中Caspase 3活性及Glu含量均显著降低,差异均有统计学意义(P<0.01)。见图2。
2.5 各组大鼠海马组织中GABA蛋白表达的比较 与模型组比较,左乙拉西坦低、中、高剂量组中GABA表达量均显著提高,差异均有统计学意义(P<0.01)。见图3。

图1 各组大鼠海马神经元凋亡程度的比较
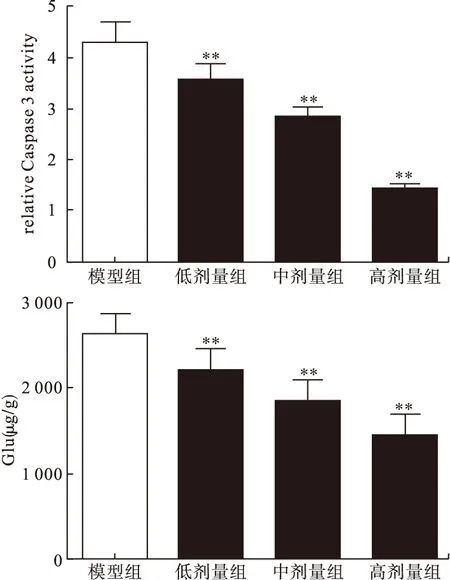
图2 各组大鼠海马组织中Caspase 3活性及Glu含量比较

图3 各组大鼠海马组织中GABA蛋白表达比较
3 讨论
左乙拉西坦是一种新型的抗癫痫药物,能够解除锌离子和β-咔啉对GABA和谷氨酸门控通道的抑制作用,从而起到抗惊厥及癫痫作用[8-9]。大量临床实验结果表明,左乙拉西坦对小儿热性惊厥具有显著疗效[5]。动物实验也证实,左乙拉西坦对热性惊厥大鼠具有显著的治疗作用[6]。我们的研究通过热水浴建立大鼠热性惊厥模型,观察大鼠惊厥潜伏期、惊厥持续时间、惊厥严重程度,结果表明,与模型组比较,左乙拉西坦低、中、高剂量组大鼠惊厥潜伏期延长,惊厥持续时间缩短,惊厥严重程度降低,与程敏等[6]的研究结果一致,充分说明了左乙拉西坦对热性惊厥大鼠具有显著的治疗作用。
热性惊厥使得大脑处于缺氧缺血状态,使细胞ATP能量供应不足,导致维持细胞内外离子平衡的通道失衡受损,特别是ATP依赖性的Ca2+通道受损严重,导致Ca2+内流,引起细胞内Ca2+超载,从而引起自由基及兴奋性氨基酸大量释放,最终导致神经元坏死凋亡[10-12]。Caspase是细胞凋亡的执行者,其中Caspase 3处在Caspase级联反应的中下游,是细胞凋亡过程中主要效应因子和凋亡途径的汇聚点[13]。研究证实,热性惊厥引起大鼠神经元凋亡及Caspase 3活性升高,扭转此变化能在一定程度上减轻热性惊厥引起的大鼠脑损伤[4,14-15]。因此,我们通过TUNLE法检测了各组大鼠海马神经元凋亡情况,结果表明,左乙拉西坦低、中、高剂量组大鼠海马神经元凋亡率显著低于模型组,左乙拉西坦各剂量组中Caspase 3活性显著降低,说明左乙拉西坦能通过抑制海马神经元凋亡,进而减轻热性惊厥大鼠脑损伤,从而达到其治疗效果。
研究表明,兴奋性氨基酸递质与抑制性氨基酸递质失衡是热性惊厥发病的机制之一[3,15-16]。在热性惊厥发生过程中,中枢神经系统中抑制性氨基酸递质水平显著降低,而兴奋性氨基酸递质水平显著提高。其中Glu是最主要的兴奋性神经递质,能使中枢神经系统起到兴奋作用,动物实验研究表明,热性惊厥大鼠海马及皮层组织中Glu水平显著提高,并对海马神经组织具有病理损伤作用[16]。GABA是主要的抑制性神经递质,在多种中枢神经系统疾病中起保护作用,具有镇静及抗焦虑作用,其主要来源于Glu,是通过GABA转运体及转氨酶的作用而相互转化。在各种惊厥类型中,发现GABA水平显著下调,并与惊厥严重程度呈正相关[3,17]。因此,通过调节GABA与Glu的平衡,能在一定程度上减轻热性惊厥所导致的脑损伤。我们通过检测各组大鼠海马神经元组织中GABA及Glu的表达,结果表明,与模型组比较,左乙拉西坦组中GABA表达量显著上升,Glu表达量显著降低,说明左乙拉西坦能通过提高抑制性氨基酸递质GABA水平,降低兴奋性氨基酸递质Glu水平,减轻热性惊厥大鼠脑兴奋作用对海马神经的毒性作用,从而减轻脑损伤。
综上所述,左乙拉西坦通过延长热性惊厥大鼠惊厥潜伏期,缩短惊厥持续时间,减轻惊厥严重程度,抑制海马神经元凋亡,并调节GABA与Glu水平,从而达到治疗热性惊厥的目的。
[1] 袁萍,蒋莉.再谈热性惊厥预后与防治研究进展[J].中国实用儿科杂志,2014,29(2):101-103.
[2] Khair AM,Elmagrabi D.Febrile seizures and febrile seizure syndromes:an updated overview of old and current knowledge[J].Neurol Res Int,2015,2015:849341.
[3] Witsch J,Golkowski D,Hahn TT,et al.Cortical alterations in a model for absence epilepsy and febrile seizures:in vivo findings in mice carrying a human GABA(A)R gamma 2 subunit mutation [J].Neurobiol Dis,2015,77:62-70.
[4] 邵巧燕,戴锦泉,吴斌,等.长托宁对热性惊厥幼鼠海马神经元的保护作用[J].福建医科大学学报,2014,48(4):232-236.
[5] 张前明,黄志,李劲松.左乙拉西坦预防复杂性热性惊厥的疗效及不良反应的临床研究[J].中国药物与临床,2015,15(8):1126-1128.
[6] 程敏,黄志,李思秀.左乙拉西坦预防动物热性惊厥的实验研究[J].儿科药学杂志,2009,15(4):16-18.
[7] 许先科,邵征洋,叶育双,等.防惊汤对热性惊厥大鼠惊厥复发的影响[J].中医杂志,2015,56(4):332-334.
[8] 晏玉奎,王庄.左乙拉西坦基础研究进展[J].中国现代应用药学,2013,30(5):565-570.
[9] Molokwu OA,Ezeala-Adikaibe BA,Onwuekwe IO.Levetiracetam-induced rage and suicidality:two case reports and review of literature [J].Epilepsy Behav Case Rep,2015,4:79-81.
[10]江鹏,罗惠玲,黄惠仪,等.惊厥患儿脑脊液激活素 A 水平变化及临床意义[J].中国小儿急救医学,2015,22(7):505-507.
[11]Syndi SD,Pellock JM.Recent research on febrile seizures:a review [J].J Neurophysiol,2013,4(165).
[12]卢嘉铭,刘光明,聂述山,等.975例儿科急诊惊厥病因分析[J].中国小儿急救医学,2016,23(3):178-185.
[13]Chen H,Yang X,Feng Z,et al.Prognostic value of Caspase-3 expression in cancers of digestive tract:a meta-analysis and systematic review[J].Int J Clin Exp Med,2015,8(7):10225-10234.
[14]吴星,王艳.热性惊厥患儿血清及脑脊液肾上腺髓质素及神经元特异性烯醇化酶水平与脑损伤的关系[J].中华实用诊断与治疗杂志,2015,29(5):476-477.
[15]Chen J,Qin J,Liu X,et al.Nitric oxide-mediated neuronal apoptosis in rats with recurrent febrile seizures through endoplasmic reticulum stress pathway [J].Neurosci Lett,2008,443(3):134-139.
[16]张炼,罗小平.热性惊厥对大鼠海马齿状回谷氨酸受体功能的影响[J].华中科技大学学报(医学版),2011,40(2):156-159.
[17]Koyama R,Tao K,Sasaki T,et al.GABAergic excitation after febrile seizures induces ectopic granule cells and adult epilepsy[J].Nat Med,2012,18(8):1271-1278.
Treatment effect of levetiracetam on febrile convulsion in rats
LI Xue-chao1,WANG Miao1,WANG Jian-zhong1,LU Ling-ling2
(1.Maternity and Child Hospital of Qinhuangdao,Qinhuangdao 066100,China;2.Center for Disease Control and Prevention of Qinhuangdao,Qinhuangdao 066100,China)
Objective To explore the therapeutic effect of levetiracetam on febrile convulsion in rats.Methods The model of febrile convulsion in rats was established by hot water bath.Forty SD young febrile convulsion rats were randomly divided into model group and low,medium and high dose levetiracetam group [100,200 and 300 mg/(kg·d)].Before modeling,the rats were given intragastric administration,then received hot water bath experiment once daily,for a total of five days.The rats′ latency,seizure duration and seizure level were observed.The apoptosis of hippocampal neurons was examined by TUNEL method.The activity of cysteinyl aspartate specific proteinase 3 (Caspase 3) and level of glutamate (Glu) was examined.The expression of gamma aminobutyric acid (GABA) was examined by Western blot.Results Compared with model group,the convulsant latency in levetiracetam groups was prolonged (P<0.01),the duration of convulsion was shortened (P<0.01);the severity of convulsion was alleviated (P<0.01);the rate of apoptosis of hippocampal neurons,the activity of Caspase 3 and the level of Glu were decreased (P<0.01),the expression of GABA was increased (P<0.01).Conclusion Levetiracetam has significant therapeutic effect on febrile convulsion in rats,which is related to inhibiting of neuronal apoptosis and regulating the expression of Glu and GABA.
Levetiracetam;Febrile convulsion;Hippocampal neurons;Glutamate;Gamma aminobutyric acid
2016-06-12
1.秦皇岛市妇幼保健院,河北 秦皇岛 066100;
2.秦皇岛市疾控中心,河北 秦皇岛 066100
10.14053/j.cnki.ppcr.201701007
