谷氨酰胺补充和电刺激对C2C12肌管蛋白合成通路的影响
2017-02-11董合玲徐晓阳赵军
董合玲,徐晓阳,赵军
DONG He-ling1,XU Xiao-yang2,ZHAO Jun1
谷氨酰胺补充和电刺激对C2C12肌管蛋白合成通路的影响
董合玲1,徐晓阳2,赵军1
DONG He-ling1,XU Xiao-yang2,ZHAO Jun1
骨骼肌占整个机体质量的40%~50%,对生命质量的维持具有非常重要的作用。蛋白质更新可以增加骨骼肌质量[29],而运动时蛋白质代谢呈现出复杂的动态过程,与机体运动方式、运动量、运动强度、运动时间、营养的补充剂量及时间等有关。谷氨酰胺(Glutame,Gln)是人体含量最多的条件性必需氨基酸,主要在骨骼肌中合成。在运动机体中,谷氨酰胺可以通过调节蛋白质合成代谢和降低肌肉蛋白质的降解,增长肌肉力量,维持机体的生理功能[1]。因此,运动员在运动训练中,合理补充一定量的谷氨酰胺对运动机能的提高是非常重要的。但是,机体对谷氨酰胺的需要量有一定的限度,过量补充只能造成谷氨酰胺的过代谢,增加肝脏代谢负担。目前,补充谷氨酰胺的研究关键是确定在不同情况下、不同时间段的所需剂量。
细胞内有多条蛋白代谢调控通路,如Ras/MAPK通路、AMPK通路、PI3K/Akt/mTOR通路、Calcineurin/NFAT通路、MEK/ERK/p90RSK等,它们在细胞内部构成一个复杂有序的调控网络系统,其中起核心作用的是mTOR通路[26,29]。mTOR,即哺乳动物雷帕霉素靶蛋白,在细胞的增殖、生长和分化过程中起中心调控作用[23],参与蛋白质合成代谢。mTOR经上游因子作用激活后,主要通过4E-BP1、S6K1两个下游因子的磷酸化,进一步调控机体蛋白的代谢及细胞的生长和增殖。mTOR通路在骨骼肌的生长发育尤其是运动性骨骼肌肥大中发挥重要的作用,而S6K1则是运动导致mTOR激活的直接反映因子和蛋白质合成增加的标志因子[19]。研究证明,对mTOR通路的抑制能阻断95%的肌肉肥大效应[7]。目前,mTOR通路与运动关系的研究主要集中在3种类型的运动练习中,分别为急性的一次性抗阻运动、高频电刺激模拟抗阻运动和低频电刺激模拟耐力运动,而相关长时间系统性运动类型的研究相对较少。此外,大部分研究是关于mTOR通路在运动后恢复早期中作用的研究,而在恢复后期mTOR通路影响的研究相对较少。而且,运动时肌肉收缩激活mTOR信号通路的具体机制还不清楚。比较普遍的看法是,类似耐力训练形式的运动可激活骨骼肌细胞AMPK通路,抑制mTOR信号通路,而类似抗阻训练形式的运动则激活mTOR通路[4,27]。
本研究的实验对象为C2C12(Mouse C3H muscle myoblast)细胞,分化的C2C12肌管可完成与在体骨骼肌细胞同样的收缩[5],同时避免了在体实验中其他器官、组织、细胞和激素的影响,能更实时的研究运动刺激和谷氨酰胺补充对骨骼肌细胞蛋白质合成的影响。适宜的运动可以促进蛋白质合成,谷氨酰胺的适量补充也可以促进蛋白质的合成,但其机制仍不完全清楚。mTOR通路是骨骼肌蛋白质合成代谢的主要调控通路,而关于谷氨酰胺补充与mTOR通路关系的研究较少。本实验通过采用电刺激模拟运动训练方案(15 V,30 ms,3 Hz,90 min)以及补充谷氨酰胺(10 mmol/L,48 h)方案,测定肌管的蛋白质含量,以及mTOR通路中mTOR mRNA和S6K1 mRNA的相对表达率,研究电刺激模拟运动与谷氨酰胺补充对蛋白质含量及mTOR通路的影响,为运动损伤及恢复提供理论依据。
1 研究材料与方法
1.1 研究材料
C2C12细胞(小鼠骨骼肌肌母细胞株,购自南方医科大学解剖教研室);DMSO、DEPC、L-谷氨酰胺(美国sigma公司);4-羟乙基哌嗪乙磺酸(HEPES,MBCHEM公司);胎牛血清(杭州四季青公司);DMEM培养基、马血清(美国GIBCO公司);Primer、引物合成(美国Invitrogen公司);RIPA裂解液、BCA试剂盒(碧云天生物技术研究所);SYBR premix Ex TaqⅡ(TaKaRa公司)。
1.2 谷氨酰胺孵育及电刺激方案
C2C12细胞常规培养,取生长状态好的细胞传代于35 cm的6孔板培养皿中,加入4 mmol/L谷胺酰胺含10%胎牛血清的生长培养基培养,待细胞铺满皿底面积的90%以上时,加入含2%马血清的分化培养基分化5天。谷氨酰胺孵育组在10 mmol/L谷氨酰胺分化培养基中孵育48 h,其他组继续分化,待所有组细胞分化7天时,开始进行电刺激或无刺激实验。采用GRASS S48 Stimulator型电刺激器电刺激共分化7天的C2C12肌管,强度为15 V,30 ms,3 Hz,90 min。电刺激后0 h、6 h、18 h、24 h收样。
1.3 实验分组:
单独对照组(Con);单独谷氨酰胺组(Gln);根据电刺激的收样时间,单独电刺激组分为:单独电刺激后0 h收样组(Es0)、单独电刺激后6 h收样组(Es6)、单独电刺激后18 h收样组(Es18)、单独电刺激后24 h收样组(Es24);谷氨酰胺孵育+电刺激组分为:谷氨酰胺孵育加电刺激后0 h收样组(Gln+Es0)、谷氨酰胺孵育加电刺激后6 h收样组(Gln+ Es6)、谷氨酰胺孵育加电刺激后18 h收样组(Gln+Es18)、谷氨酰胺孵育加电刺激后24 h收样组(Gln+Es24)。共计10组。
1.4 指标测定
1.4.1 C2C12肌管总蛋白浓度测定
采用碧云天研究所提供的二辛可宁酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒。将待测样品上清弃去,用预冷的PBS洗2次。加入RIPA裂解液(200µL/皿),冰上裂解30 min,4℃离心(12 000 g,10 min),吸取上清。依照试剂盒说明书测定蛋白含量,同时制作标准曲线。C2C12细胞蛋白量单位用每平方厘米皿底面积含有的蛋白微克数来表示(g/ cm2)。
1.4.2 测定C2C12肌管中mTOR mRNA和S6K1 mRNA表达
1.提取细胞内总RNA
用Trizol裂解液裂解C2C12肌管,按常规方法提取纯化总RNA,溶于适量DEPC水后分装,取适量测其纯度和总量,其余于-80℃冰箱保存。
2.RNA反转录为cDNA
按试剂说明书配RT反应液,总体积10µL:5×Prime-Script Buffer 2µL;PrimeScript RT Enzyme MixⅠ 0.5µL;Random 6mers(100µmol/L)0.5µL;Oligo dT Primer(50 µmol/L)0.5µL;Total RNA 2µL;DEPC水4.5µL。使用反转录仪将RT反应液中的RNA反转录为cDNA,反应条件如下:37℃,15 min;85℃,5 s;4℃,30 min。将反转录好的cDNA于-80℃冰箱保存。
3.定量PCR
按照说明书配制PCR反应液,总体积25µL:SYBR Premix Ex TaqⅡ(2×)12.5µL;引物混合液/内参引物2µL;RT反应液2µL;DEPC水8.5µL。引物序列:mTOR上游5'-ATGGCGGATGATCTAAAGCGA-3';mTOR下游5'-GGCACTGTCGTTAGCCACT-3',S6K1上游5'-CCATCACACACCACGTCAAG-3',S6K1下游5'-TTGCGTACCAGGAAGACTTTG-3'。PCR反应液混匀后在荧光PCR仪上扩增目的基因:95℃预变性30 s一个循环,然后执行(95℃变性5 s,60℃退火25 s,72℃延伸30s)45个循环,最后72℃再延伸5min,反应结束后,采用55℃~95℃间隔1℃2s进行融解曲线分析。
1.5 数据统计处理
研究数据用SPSS 16.0统计软件进行统计学处理,各数据以均值±标准差(±SD)表示,并用单因素方差分析进行各组间的差异显著性检验。P<0.05为有显著性差异,P<0.01为有极显著性差异。
2 结果
2.1 C2C12分化过程中总蛋白含量的变化
由表1数据可知,C2C12细胞分化前6天总蛋白含量变化呈上升趋势,且每天的总蛋白含量与前一天比较均有极显著差异(P<0.01),六天后总蛋白含量变化趋于稳定,无显著差异(P>0.05)。
表1 本研究不同分化天数后C2C12肌管总蛋白含量的变化结果(g/cm2,±SD)Table 1 Protein Content of Different Differentiation Time in C2C12
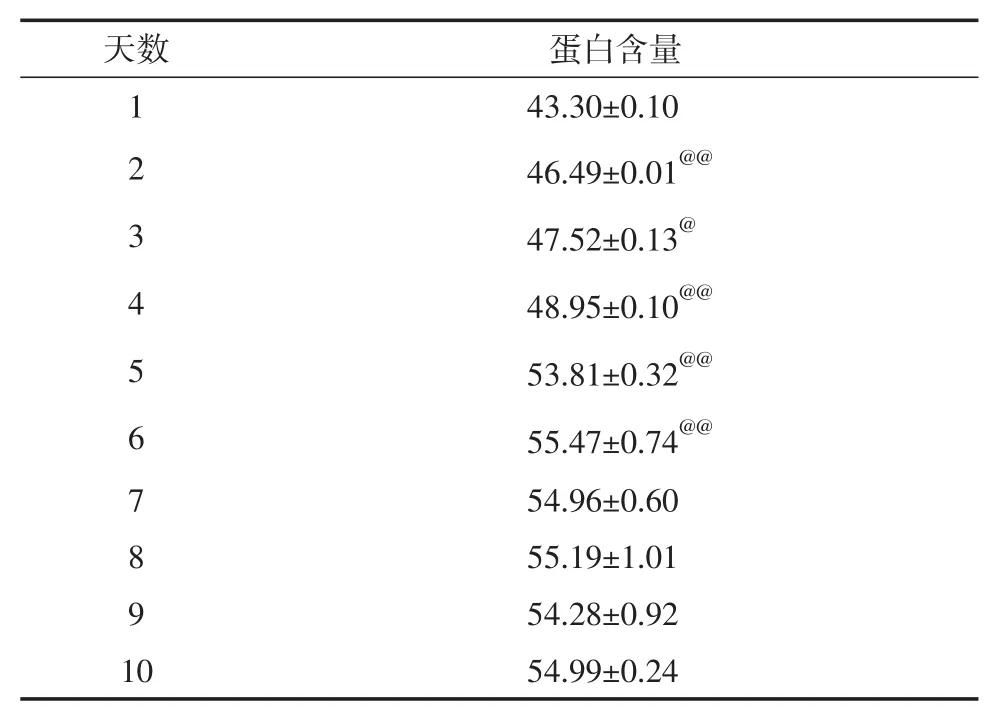
表1 本研究不同分化天数后C2C12肌管总蛋白含量的变化结果(g/cm2,±SD)Table 1 Protein Content of Different Differentiation Time in C2C12
注:@表示与前一天细胞总蛋白比较,有显著差异(P<0.05);@@表示与前一天细胞总蛋白比较,有极显著差异(P<0.01)。
43.30±0.10 46.49±0.01@@47.52±0.13@48.95±0.10@@53.81±0.32@@55.47±0.74@@54.96±0.60 55.19±1.01 54.28±0.92 54.99±0.24 1 2 3 4 5 6 7 8 9 1 0
2.2 不同浓度谷氨酰胺孵育后C2C12肌管总蛋白含量变化由表2数据可知,与4 mmol/L组相比,0 mmol/L组、2 mmol/L组C2C12肌管总蛋白含量极显著降低(P<0.01),10 mmol/L组C2C12肌管总蛋白含量极显著升高(P<0.01)。因此,谷氨酰胺的补充浓度为10 mmol/L。
2.3 谷氨酰胺孵育加电刺激后C2C12肌管总蛋白含量变化
由表3数据可知,与Con组蛋白含量相比,Gln、Es18和
Es24组极显著升高(P<0.01),Es6组极显著降低(P<0.01),
Es0组无显著变化(P>0.05)。与Gln相比,Gln+Es18、Gln+ Es24组蛋白含量均极显著升高(P<0.01),Gln+Es6组蛋白含量极显著降低(P<0.01),Gln+Es0组无显著变化(P>0.05)。Gln+Es组各收样时间点的蛋白含量变化趋势与Es组相似,但整体水平上升,且Gln+Es6组的蛋白含量显著高于Es6组(P<0.05)。
表2 不同浓度谷氨酰胺孵育后C2C12肌管总蛋白含量变化(±SD)Table 2 Total Protein Content with Different Concentration of Glutamine

表2 不同浓度谷氨酰胺孵育后C2C12肌管总蛋白含量变化(±SD)Table 2 Total Protein Content with Different Concentration of Glutamine
注:与4 mmol/L组(正常培养组)比较,#表示有显著差异(P<0.05);##表示有极显著差异(P<0.01)。
蛋白含量(g/cm2)34.37±0.96##36.59±0.83##38.87±0.20 38.63±0.34 38.25±0.01 41.93±0.43##39.20±0.86 39.17±0.45 39.30±0.11 GLN浓度(mmol/L)0 2 4 6 8 1 0 12 16 20
表3 谷氨酰胺孵育加电刺激后C2C12肌管总蛋白含量的变化(g/cm2、±SD)Table 3 Effects of Glutamine and Electrical Stimulation on the Protein Content
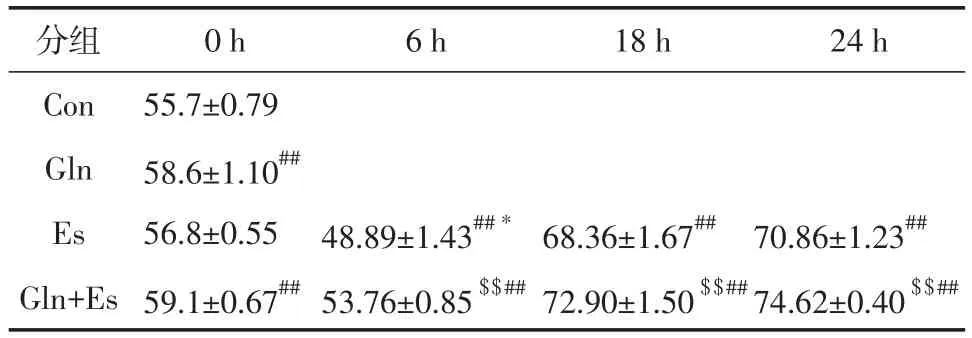
表3 谷氨酰胺孵育加电刺激后C2C12肌管总蛋白含量的变化(g/cm2、±SD)Table 3 Effects of Glutamine and Electrical Stimulation on the Protein Content
70.86±1.23##74.62±0.40$$##分组Con Gln Es Gln+Es 0 h 55.7±0.79 58.6±1.10##56.8±0.55 59.1±0.67##6 h 18 h 24 h 48.89±1.43##*53.76±0.85$$##68.36±1.67##72.90±1.50$$##
2.4 谷氨酰胺孵育加电刺激后C2C12肌管mTOR mRNA表达变化
由表4数据可知,Gln组mTOR mRNA相对表达率显著高于Con组(P<0.05)。Es0组mTOR mRNA相对表达率略低于Con组(P>0.05),Es6组略高于Con组(P>0.05),但显著高于Es0组(P<0.05);Es18组极显著高于Con组(P<0.01)。Gln+Es组与Es组相比,mTOR mRNA相对表达率大体趋势相同,先上升后下降,但Es组是在电刺激后18 h达到高峰,而Gln+Es组是在电刺激后6 h达到高峰。说明,谷氨酰胺促进电刺激后肌管mTOR的提前激活。
2.5 谷氨酰胺孵育加电刺激后C2C12肌管S6K1 mRNA表达变化
由表5数据可知,Gln组S6K1 mRNA相对表达率显著高于Con组(P<0.05)。Es0组S6K1 mRNA相对表达率略低于Con组(P>0.05),Es6组显著高于Con组(P<0.05),Es18组略高于Con组(P>0.05),但仍显著高于Es0组(P<0.05)。Gln+Es组与Es组相比,S6K1 mRNA相对表达率大体趋势相同,先上升后下降,但整体表达水平显著上升(P<0.05)。此外,Gln+Es中各组与Gln组相比,均无显著差异(P>0.05),说明,电刺激对谷氨酰胺孵育的C2C12肌管S6K1 mRNA表达无显著影响。

表5 谷氨酰胺孵育加电刺激后C2C12肌管S6K1 mRNA相对表达率比较Table 5 Expression of mTOR mRNA in C2C12 Myotubes
3 分析与讨论
谷氨酰胺是人体含量最多的条件性必需氨基酸,主要在骨骼肌中合成,是增长肌肉力量的必需营养素,与运动能力有密切的联系。关于运动中谷氨酰胺的代谢,需根据运动类型分析。1)短时间大强度运动(<l h)后血浆谷氨酰胺水平普遍上升。一方面原因是大强度运动产生大量氨,促使谷氨酸与氨合成增加,血浆谷氨酰胺水平上升;另一方面,运动导致体内水分丢失、循环血量减少,亦是其上升的原因。2)长时间(≥1 h)运动后血浆谷氨酰胺水平普遍下降。其原因是机体对谷氨酰胺的利用率上升,同时,谷氨酰胺合成酶的最大活性下降。3)在超长时间运动中,机体开始适应运动,且糖原得到及时补充,因此,谷氨酰胺消耗和生成接近平衡,表现为运动后无明显变化。运动机体中骨骼肌大量消耗能量物质的同时,蛋白质降解大于合成,机体处于负氮平衡。而谷氨酰胺是氮流动的重要载体和蛋白合成前体,当机体合成的谷氨酰胺不能满足其自身需求时,需适时的补充外源性谷氨酰胺[1,3]。因此,补充外源性谷氨酰胺对运动机体维持正常功能起到非常重要的作用。补充谷氨酰胺可促进蛋白合成,抑制蛋白降解,这与国内、外许多实验结论相符合[2,31]。
氨基酸不但是蛋白质合成的必需前体物质,也可作为信号因子和调节因子参与蛋白质代谢。作为调控因子的氨基酸可以调控代谢通路中细胞内蛋白合成酶的活性,如某些成分的mRNA表达[22]。研究证明,mTORC1是核内体和溶酶体的表面调控因子,mTORC1一旦激活,继而调控下游蛋白翻译起始和/或翻译延伸因子的磷酸化和活性,mTORC1主要下游因子有4E-BP1、S6K1、eIF2a等[7]。HeLa细胞模型的研究证明,谷氨酰胺可通过激活mTOR而促进细胞蛋白合成,mTOR激活主要依赖做为必需氨基酸的谷氨酰胺的吸收和快速流出[13,15,25]。然而,谷氨酰胺调控骨骼肌质量的具体机制尚不完全清楚,肌肉收缩如何影响mTOR通路的机制也存有疑问,激素的变化、钙离子含量的高低、机械收缩-电变化、组织细胞局部低氧、营养状况等均可能与之相关[14]。本研究发现,S6K1在运动后发生显著变化的时间点不同,但共同点是S6K1在运动结束后的变化具有延迟性[20,25]。另外,有研究证明,骨骼肌S6K1激活与上游因子mTOR激活并不一定存在绝对一致性[6],在mTOR激活的情况下,S6K1并不一定激活[16]。

图1 谷氨酰胺孵育加电刺激后C2C12肌管蛋白含量及mTOR信号通路的指标变化柱状图Figure 1.Effects of Glutamine and Electrical Stimulation on mTOR and S6K1 Protein
本实验结果显示,Gln组蛋白含量极显著高于Con组,可见,谷氨酰胺可促进蛋白合成,抑制蛋白降解。与Con组蛋白含量相比,Es6组极显著下降,Es18、Es24组蛋白含量极显著上升,说明,本实验应用的电刺激方案,电刺激后6 h可引起骨骼肌蛋白降解,总蛋白含量下降,而电刺激后18 h合成大于降解,蛋白含量上升。机体运动时,骨骼肌中能量物质大量被消耗,引起蛋白质降解大于合成,机体处于负氮平衡,表现为骨骼肌总蛋白含量的下降。运动结束后,蛋白质的降解和合成之间新的平衡被重新建立[6],骨骼肌总蛋白含量不再处于下降趋势[8,10],随着时间的延长,总蛋白含量上升。Gln+Es组各时间点的蛋白含量变化趋势与Es组相似,但整体水平有所上升,且Gln+Es6组的蛋白含量显著高于Es6组,说明,谷氨酰胺补充有利于电刺激后C2C12肌管蛋白含量的维持和升高。
与蛋白含量的结果相似,谷氨酰胺可促进C2C12肌管mTOR mRNA表达。氨基酸不但是蛋白质合成的必需前体物质,也可作为信号因子和调节因子参与蛋白质代谢。单独电刺激后即刻,C2C12肌管mTOR mRNA未大量表达,而是从电刺激后6 h开始表达上升,电刺激后18 h已大量表达。肌肉收缩影响mTOR通路机制目前还不清楚,激素的变化、钙离子含量的高低、机械收缩-电变化、组织细胞局部低氧、营养状况等均可能与之相关。Gln+Es组与Es组相比,mTOR mRNA相对表达率大体趋势相同,先上升后下降,但Es组是在电刺激后18 h达到峰值,而Gln+Es组是在电刺激后6 h达到峰值,说明,谷氨酰胺可以使电刺激后C2C12肌管mTORmRNA表达提前。有研究显示,在运动后恢复期摄入富含亮氨酸的EAA+CHO混合溶液时,mTOR信号通路进一步增强,可引起更大的肌肉蛋白质合成[9,21]。可见,营养与运动结合具有增强mTOR通路的作用。
与mTOR mRNA表达相似,Gln组与Es6组的S6K1 mRNA相对表达率显著高于Con组。Gln+Es组与Es组相比,S6K1 mRNA相对表达率大体趋势相同,呈现先上升后下降,但整体表达水平显著上升。单独谷氨酰胺或电刺激均通过mTOR通路影响mTOR mRNA表达,继而影响S6K1 mRNA表达,谷氨酰胺补充使电刺激后C2C12肌管S6K1 mRNA表达上升进一步增加。有研究发现,S6K1在运动后发生显著变化的时间点不同,但共同点是S6K1在运动结束后的变化具有延迟性[12,18,30]。此外,Gln+Es中各组与Gln组相比,均无显著差异,说明,电刺激对谷氨酰胺孵育的C2C12肌管S6K1 mRNA表达无显著影响。
总之,运动训练中合理补充一定量的谷氨酰胺对运动员非常重要,但过量补充只能造成谷氨酰胺的过分代谢,增加肝脏代谢负担[11,17,24,28]。虽然,谷氨酰胺可增加运动后机体的蛋白代谢,但仍无可靠数据证实谷氨酰胺可减轻运动损伤造成的疼痛。虽然,谷氨酰胺是运动员营养补剂之一,但仍无充足数据支持关于谷氨酰胺补充的营养处方制定。因此,补充谷氨酰胺的关键所在是确定不同情况下补充谷氨酰胺的剂量和时间。此外,mTOR mRNA与S6K1 mRNA的表达并不完全一致,因此,谷氨酰胺是否会通过其他通路或因子影响蛋白合成仍需更多研究证实。
4 结论
1.单独补充谷氨酰胺和单独电刺激均可增加C2C12肌管中蛋白质含量、mTORm RNA和S6K1 mRNA的表达。推断谷氨酰胺和电刺激可通过mTOR通路促进C2C12肌管蛋白合成,进而促进肌管恢复。
2.单独电刺激后,C2C12肌管mTOR mRNA相对表达率在电刺激后6 h达高峰,而S6K1 mRNA相对表达率在电刺激后18 h达高峰。可见,mTOR通路中mTOR mRNA表达和S6K1 mRNA表达在时间上不同步。
3.谷氨酰胺与电刺激联合作用后,肌管蛋白含量进一步增加,且mTOR mRNA表达提前达到峰值,S6K1 mRNA稳定表达在高水平。谷氨酰胺联合电刺激通过mTOR信号通路促进mTOR mRNA的表达,进而促进下游因子S6K1 mRNA表达,进一步促进C2C12肌管蛋白合成和肌管恢复。
[1]冯炜权.某些氨基酸的代谢特点和运动营养——运动生物化学动态之二[J].北京体育大学学报,2000,23(3):353-356.
[2]关尚一,张少生,李秋利,等.mTOR/p70s6k通路与运动诱导的肌肉蛋白质合成[J].中国组织工程研究与临床康复,2009,13(24):4738-4741.
[3]孟思进,余龙江,曹二来.mTOR介导的骨骼肌蛋白质翻译调控[J].现代生物医学进展,2009,9(6):1157-1160.
[4]赵贤,李世昌,李小英.mTOR信号传导通路及运动对其影响的分子机制综述[J].体育学刊,2008,15(6):108-112.
[5]赵艳.C2C12骨骼肌细胞中胰岛素刺激下Ca~(2+)的作用研究[D].杭州:浙江大学,2007.
[6]朱一力.骨骼肌mTOR信号通路在运动后变化规律及对蛋白合成调控机制[D].北京:北京体育大学,2008.
[7]BODINE S C,STITT T N,GONZALEZ M,et al.Akt/mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo.[J].Nat cell biol,2001,3(11):1014-1019.
[8]CORRADETTI M N,GUAN K.Upstream of the mammalian target of rapamycin:Do all roads pass through mTOR?[J].Oncogene,2006,25(48):6347-6360.
[9]DREYER H C,DRUMMOND M J,PENNINGS B,et al.Leucine-enriched essential amino acid and carbohydrate ingestion following resistance exercise enhances mTOR signaling and protein synthesis in human muscle[J].Am J Physiol-Endocrinol M,2008,294(2):E392-E400.
[10]FINGAR D C,SALAMA S,TSOU C,et al.Mammalian cell size is controlled by mTOR and its downstream targets S6K1 and 4EBP1/eIF4E.[J].Gene Dev,2002,16(12):1472-1487.
[11]GONCALVES SILVA L M,ALVES DA SILVA C A,DA SILVA A,et al.Photobiomodulation protects and promotes differentiation of C2C12 myoblast cells exposed to snake venom[J].Plos One,2016,11:e01528904.
[12]HERNANDEZ J M,FEDELE M J,FARRELL P A.Time course evaluation of protein synthesis and glucose uptake after acute resistance exercise in rats.[J].J appl physiol,2000,88(3):1142-1149.
[13]HORIE M,WARABI E,KOMINE S,et al.Cytoprotective Role of Nrf2 in Electrical pulse stimulated C2C12 myotube[J].Plos One,2015,10:e014483512.
[14]HU S,TAI C,LI Y,et al.Progranulin compensates for blocked IGF-1 signaling to promote myotube hypertrophy in C2C12 myoblasts via the PI3K/Akt/mTOR pathway[J].Febs Letters,2012,586(19):3485-3492.
[15]HULMI J J,TANNERSTEDT J,SELANNE H,et al.Resistance exercise with whey protein ingestion affects mTOR signaling pathway and myostatin in men[J].JAppl Physiol,2009,106(5):1720-1729.
[16]LANG S M,KAZI A A,HONG-BROWN L,et al.Delayed Recovery of skeletal muscle mass following hindlimb immobilization in mTOR heterozygous mice[J].Plos One,2012,7:e389106.
[17]LI M,VERDIJK L B,SAKAMOTO K,et al.Reduced AMPKACC and mTOR signaling in muscle from older men,and effect of resistance exercise[J].Mech Ageing Dev,2012,133(s11-12):655-664.
[18]MASCHER H,ANDERSSON H,NILSSON P A,et al.Changes in signalling pathways regulating protein synthesis in human muscle in the recovery period after endurance exercise[J].ACTA Physiol,2007,191(1):67-75.
[19]NAKAJO T,YAMATSUJI T,BAN H,et al.Glutamine is a key regulator for amino acid-controlled cell growth through the mTOR signaling pathway in rat intestinal epithelial cells[J].Biochem Bioph Res Co,2005,326(1):174-180.
[20]NICKLIN P,BERGMAN P,ZHANG B,et al.Bidirectional transport of amino acids regulates mTOR and autophagy[J].Cell,2009,136(3):521-534.
[21]OGASAWARA R,KOBAYASHI K,TSUTAKI A,et al.mTOR signaling response to resistance exercise is altered by chronic resistance training and detraining in skeletal muscle[J].J Appl Physiol,2013,114(7):934-940.
[22]POLAK P,HALL M N.mTOR and the control of whole body metabolism[J].Curr Opin Cell Biol,2009,21(2):209-218.
[23]REILING J H,SABATINI D M.Stress and mTORture signaling[J].Oncogene,2006,25(48):6373-6383.
[24]RUNDQVIST H C,LILJA M R,ROOYACKERS O,et al.Nutrient ingestion increased mTOR signaling,but not hVps34 activity in human skeletal muscle after sprint exercise.[J].Physiological Reports,2013,1(5):e76.
[25]TALVAS J,OBLED A,FAFOURNOUX P,et al.Regulation of protein synthesis by leucine starvation involves distinct mechanisms in mouse C2C12 myoblasts and myotubes[J].J Nutr,2006,136(6):1466-1471.
[26]VIGANO A,RIPAMONTI M,DE PALMA S,et al.Proteins modulation in human skeletal muscle in the early phase of adaptation to hypobaric hypoxia[J].Proteomics,2008,8(22):4668-4679.
[27]WACKERHAGE H,RENNIE M J.How nutrition and exercise maintain the human musculoskeletal mass[J].J Anatomy,2006,208(4):451-458.
[28]WANG D,YIN Y,YANG Y,et al.Resveratrol prevents TNF-alpha-induced muscle atrophy via regulation of Akt/mTOR/FoxO1 signaling in C2C12 myotubes[J].Int Immunopharmacol,2014,19(2):206-213.
[29]WANG X,PROUD C G.A novel mechanism for the control of translation initiation by amino acids,mediated by phosphorylation of eukaryotic initiation factor 2B[J].Mol Cell Biol,2008,28(5):1429-1442.
[30]YAO K,YIN Y,CHU W,et al.Dietary arginine supplementation increases mTOR signaling activity in skeletal muscle of neonatal pigs[J].J Nutr,2008,138(5):867-872.
[31]ZHANG H,STALLOCK J P,NG J C,et al.Regulation of cellular growth by the Drosophila target of rapamycin dTOR.[J]. Gene dev,2000,14(21):2712-2724.
Effects of Glutamine and Electrical Stimulation on Protein Content Pathway in C2C12
目的: CC 22 CC1122肌管为细胞模型,探讨电刺激模拟运动与谷氨酰胺补充对 CC 22 CC1122肌管蛋白质含量及mmTTOORR通路的影响,进一步探明谷氨酰胺补充与蛋白质代谢之间的关系。方法:谷氨酰胺孵育分化 55天的肌管4488 hh后,给予一次电刺激(1155 VV,3300 mmss, 33 HHzz,9900 mmiinn)。分别在电刺激后 00 hh、 66 hh、1188 hh和2244 hh收样。实验共1100组,单独对照组(CCoonn);单独谷氨酰胺组(GGllnn);单独电刺激后不同时间点取样组(EEss 00、EEss 66、EEss1188、EEss2244);谷氨酰胺孵育加电刺激后不同时间点取样组(Gllnn++EEss 00、Gllnn++EEss 66、Gllnn++EEss1188、Gllnn++EEss2244)。BBCCAA法测定各组肌管蛋白含量;RTT--PPCCRR法测定各组mTOR mmRRNNAA表达量及其下游因子 SS 66 KK 11 mmRRNNAA表达量。结果: 11)与CCoonn相比,GGllnn组的蛋白含量、mmTTOORR及 SS 66 KK 11 mmRRNNAA均显著升高( PP< 00..0055)。 22)单独电刺激(EEss)后,随收样时间延长,肌管蛋白含量呈现先下降后上升趋势。EEss 66极显著下降( PP< 00..0011),EEss1188极显著上升( PP< 00..0011)。而mmTTOORR和 SS 66 KK 11 mmRRNNAA的表达没有下降,呈现先上升后恢复正常的趋势。 33)谷氨酰胺和电刺激(Gllnn++EEss)联合作用后,无论是蛋白含量,还是mmTTOORR及 SS 66 KK 11 mmRRNNAA表达,具有与单独电刺激相似的作用趋势,且Gllnn++EEss各组数值均高于EEss各组( PP< 00..0055)。此外,EEss组mmTTOORR表达在电刺激后1188 hh达高峰,而Gllnn++EEss组在 66 hh达高峰。结论: 11)单独电刺激、单独补充谷氨酰胺、两者的联合作用,均可通过mmTTOORR通路中mTOR mmRRNNAA和 SS 66 KK 11 mmRRNNAA表达上升,增加蛋白合成,促进蛋白含量上升及肌管恢复。 22)谷氨酰胺使电刺激后 CC 22 CC1122肌管mTOR mmRRNNAA表达提前, SS 66 KK 11 mmRRNNAA表达稳定处于高水平。
谷氨酰胺补充,mmTTOORR,电刺激, CC 22 CC1122肌管
Objective:This paper discusses the effects of glutamine and electrical stimulation on protein content and mTOR pathway in C2C12,and provides theoretical reference for how glutamine improving sports performance and recovery.Method:After 5 days of differentiation,C2C12 myotubes were incubated in 4mM or 10mM dose of glutamine for 48 hours,and then myotubes were stimulated to contract 90mins at 15v,3Hz,30ms.Samples were colllected in 0h,6h,18h,and 24h respectively after electrical stimulation.Therefore,there were 10 groups,including control group(Con),glutamine group(Gln),electrical stimulation group of different time point(sEs0 Es6,Es18,Es24),glutamine plus electrical stimulation of different time points(Gln+Es0,Gln+Es6,Gln+Es18,Gln+ Es24).BCAProteinAssay Kit was used to measure total protein conten(tµg/cm2).mTOR mRNAand S6K1 mRNA were measured by RT-PCR.The expression of each transcript was measured by the 2-ΔΔCt method using the threshold cycle(Ct)value.Results:1)Total protein content,mTORmRNA and S6K1mRNA expression of Gln was greater than that of Con(P<0.05).2)With the extension of collecting time after electrical stimulation(Es),muscle protein content showed a trend of decline followed by rise.That of Es6 decreased significantly(P<0.01),but that of Es18 increased significantly(P<0.01).The expression of mTOR and S6K1 mRNArose first,and then came back to normal level.3)The trends of protein content,mTORmRNA and S6K1mRNA of Es was similar with Gln+Es,but the overall level rose(P<0.05).And the mTOR mRNA expression of Es reached the peak happened in 18 hour,while Gln+Es reached the peak in 6 hour.Conclusion:1)Electrical stimulation,glutamine can promote expression of mTOR mRNAand S6K1 mRNAthrough mTOR pathway,increase protein synthesis,and promote the rise of protein content and recovery.2)Glutamine can make the expression of mTORmRNA advance in C2C12 muscle tube after electrical stimulation,and the expressionof S6K1mRNAstableinahighlevel.
glutamine;mTOR;electricalstimulation;C2C12muscletube
1002-9826(2017)01-0104-07
10.16470/j.csst.201701013
G804.7
:A
2016-05-05;
:2016-10-31
董合玲,女,讲师,博士,主要研究方向为运动营养生化及信号通路传导。
1.暨南大学体育学院,广东广州510632;2.华南师范大学体育科学学院,广东广州510631 1.Jinan University,Guangzhou 510632,China;2.South China Normal University,Guangzhou 510631,China.
