猪圆环病毒2型Cap基因的克隆与原核表达
2017-02-10杨克礼段正赢田永祥周丹娜刘泽文袁芳艳
杨克礼,时 代,段正赢,田永祥*,周丹娜,郭 锐,刘泽文,袁芳艳,刘 威,孟 丽
(1.湖北省农业科学院 畜牧兽医研究所 动物胚胎工程与分子育种湖北省重点实验室,湖北 武汉 430064;2.河南省信阳市浉河区畜牧局,河南 信阳464000)
猪圆环病毒2型Cap基因的克隆与原核表达
杨克礼1,时 代2,段正赢1,田永祥1*,周丹娜1,郭 锐1,刘泽文1,袁芳艳1,刘 威1,孟 丽1
(1.湖北省农业科学院 畜牧兽医研究所 动物胚胎工程与分子育种湖北省重点实验室,湖北 武汉 430064;2.河南省信阳市浉河区畜牧局,河南 信阳464000)
利用PCV2鄂州株的基因序列设计特异性引物,分别在上、下游引物中加入SacI和HindIII酶切位点,扩增出PCV2鄂州株的ORF2基因;将该片段克隆至pET-28a原核表达载体,经PCR、酶切鉴定,成功构建了阳性重组表达质粒pET-ORF2。将其转入大肠杆菌Rosetta中,经IPTG诱导,SDS-PAGE电泳分析确定重组蛋白大小为34.5 kD,主要以包涵体的形式表达。优化后确定最佳诱导条件为:37 ℃,至OD值0.4~0.6时加入终浓度为1 mmol/L的 IPTG,诱导5 h。表达产物经His-tag镍柱纯化后进行Western-blot分析,结果表明表达的重组蛋白能够与PCV2标准阳性血清发生特异性反应,具有良好的反应原性。
猪圆环病毒2型;Cap基因;克隆;原核表达
猪圆环病毒(Porcine circovirus, PCV)是目前已知的最小的病毒之一,可以分为PCV1和PCV2[1-2]。其中,PCV1没有致病性,但感染之后可以产生抗体,广泛存在于猪体内,在猪肾传代细胞系中检出率也非常高;PCV2则有很强的危害性,由其引发的PMWS在全世界范围内都有流行[3],给养猪行业带来了非常大的危害。PCV2引起的一系列疾病也给我国的养猪业造成了巨大的影响,带来了严重的经济损失[4]。
但是,目前尚无有效的应对PCV2的手段,无法很好地控制PCV2疫情的传播[5]。随着PCV2引起的相关疾病的流行情况日益严峻,提前判断、及时掌握PCV2的流行趋势就变得非常关键,研发一种PCV2快速简便的诊断方法的需求非常迫切。
PCV有两个最大的开放阅读框,即ORF1和ORF2,它们分别编码Rep和Cap蛋白[6]。两种血清型病毒的Rep蛋白的同源性达到了86%,而Cap蛋白的同源性只有65%,且ORF2部分含有与病毒分型有关的抗原表位[7],因此,可以用来建立血清型检测方法,用于检测PCV2。
早期有研究人员利用截短的Cap蛋白建立了一种检测PCV2的ELISA方法[8-9],但是截短后的基因不能完整地保留Cap蛋白的抗原性,因此在检测过程中很可能会出现检出率不高、漏检等问题。本研究设计了一对特异性引物,成功扩增出PCV2鄂州株完整的ORF2基因片段,并将其连接到pET-28a载体,构建了原核表达质粒,诱导表达出完整的Cap蛋白,保留了其全部的抗原性,这为建立特异性强、检出率高的检测PCV2血清抗体的间接ELISA方法奠定了基础。
1 材料与方法
1.1 载体、菌株
pET-28a载体、大肠杆菌E.coliDH5α菌株、PCV2鄂州株均由湖北省农业科学院保存;E.coliRosetta (DE3)感受态细胞购自北京康为世纪生物科技有限公司; pMD-18T载体购自大连宝生物公司。
1.2 主要试剂
限制性内切酶SacI、HindIII购自大连宝生物公司; Preminx Taq酶、DL 2000 Marker、DL 5000 Marker、1000 bp DNA ladder、His融合蛋白纯化高亲和力镍填充树脂购自北京康为世纪生物科技有限公司;基因组提取试剂盒购自Axygen公司;琼脂糖凝胶回收试剂盒、酵母提取物、胰蛋白胨、琼脂粉、IPTG等均购自武汉创百科生物有限责任公司;其它化学试剂为国产分析纯试剂,购自有关商业公司。
1.3 引物设计
根据本实验室保存的PCV2 鄂州株的全基因测序结果,使用DNAMAN和Primer Premier 5.0软件设计了1对引物,可以扩增出PCV2 ORF2的完整基因片段。分析pET-28a质粒图谱,分别在上、下游引物设计了SacI和HindIII酶切位点。引物交由上海生工生物工程有限公司合成,将上、下游引物分别命名为P1、P2,其中P1为5′-CGAGCTCATGACGTATCCAAGGAGGC-3′(下划线处为SacI酶切位点);P2为5′-CCCAAGCTTTTAGGGTTTAAGTGGGGG-3′(下划线处为HindIII酶切位点)。
1.4 病毒总DNA的提取
取本实验室保藏的PCV2 HBEZ株病毒适量,利用病毒DNA提取试剂盒,按说明书操作抽提病毒DNA,立即用于PCR扩增或置-20 ℃冰箱保存备用。
1.5 扩增ORF2基因
以提取的PCV2 DNA为模板,用引物P1、P2扩增完整的ORF2基因片段; PCR反应体系为: Premix Taq 12.5 μL、上游引物P1 1 μL、下游引物P2 1 μL、DNA 3 μL、ddH2O 7.5 μL,总体积25 μL。
将上述PCR反应体系振荡混匀后离心,在PCR仪器上按照如下反应程序进行扩增:94 ℃ 3 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。反应结束后,取7 μL产物在1%的琼脂糖凝胶上电泳进行检测,拍照并记录反应结果。
1.6 PCR产物的回收与纯化
利用凝胶回收试剂盒,按照说明书操作,进行PCR产物的回收与纯化。
1.7 重组表达质粒的构建与鉴定
分别用SacI、HindIII双酶切pMD-ORF2质粒和提取的pET-28a载体质粒;酶切产物经胶回收后,用Solution I在16 ℃下连接过夜,将ORF2基因插入表达载体pET-28a上。取5 μL连接产物,转化至100 μL大肠杆菌Rosetta感受态细胞中。挑取单个菌落培养,提取质粒,分别做PCR及酶切鉴定,选取阳性质粒,送至上海生工生物工程有限公司进一步测序确证,将阳性重组表达质粒命名为pET-ORF2。
1.8 重组蛋白的诱导表达
1.8.1 IPTG诱导表达 挑取鉴定正确的pET-ORF2单菌落,接种于5 mL含有100 mg/mL的Kan抗性LB液体培养基中,在37 ℃下以200 r/min振荡培养过夜;之后,按照1∶100比例接种Kan/LB液体培养基,37 ℃ 200 r/min培养约3 h,待OD600值为0.6~0.8时,加入终浓度为1 mmol/L的IPTG开始诱导表达,同时设置空载体菌诱导和未诱导对照。诱导5 h后,取1 mL菌液于EP管中,处理后进行SDS-PAGE分析。
1.8.2 IPTG浓度的优化 按照上述方法诱导重组蛋白的表达,加入不同终浓度的IPTG,分别设置0.4、0.6、0.8、1.0 mmol/L四个不同浓度,其余条件相同;待培养5 h后,分别取1 mL菌液于EP管中,处理后进行SDS-PAGE分析。
1.8.3 诱导时间的优化 按照上述方法诱导重组蛋白的表达,加入确定的最佳浓度的IPTG开始诱导,在相同条件下继续培养,分别于诱导后3、4、5、6 h时在无菌环境下取1 mL诱导菌液于EP管中,处理后进行SDS-PAGE分析。
1.9 重组蛋白的可溶性分析
收集1 mL诱导后的菌液,在4 ℃下以12000 r/min离心5 min,收集重组菌体,漩涡振荡悬浮菌体,冰浴中进行超声波破碎,每次超声2 s,间隔2 s,裂解至菌液至澄清。将裂解后的菌液于4 ℃下以12000 r/min离心5 min,分别收集上清和沉淀。向沉淀中加入和上清等体积的PBS重悬,然后加入5×SDS-PAGE上样缓冲液,混匀后煮沸10 min,在4 ℃下冷却2 min,然后以12000 r/min离心1 min。取10 μL进行SDS-PAGE电泳分析。
1.10 重组蛋白的纯化
大量诱导表达重组蛋白,将溶解后的包涵体溶液利用康为世纪His-tag融合蛋白纯化高亲和力镍填充树脂按照说明书方法进行纯化。收集目的蛋白洗脱液,用SDS-PAGE检测蛋白纯度,用紫外分光光度计测定纯化后蛋白质的浓度。
1.11 Western Blotting分析
取纯化Cap蛋白进行SDS-PAGE电泳后,取下凝胶,不经考马斯亮蓝染色,直接将蛋白电转印至硝酸纤维素膜上,用5%的脱脂奶粉在37 ℃下封闭2 h,用TBST洗涤3~5次;用1∶100稀释的抗PCV2阳性血清作为一抗,在37 ℃下孵育1~2 h,用TBST洗涤3~5次;放入1∶2000稀释的二抗(HRP标记过的羊抗猪IgG)稀释溶液中,在37 ℃下作用1~2 h,用TBST洗涤3~5次;将NC膜进入底物液中,避光显色5 min左右,至目的条带清晰可见且背景颜色不深时,加入去离子水,终止反应。
2 结果与分析
2.1 ORF2基因的扩增结果
用设计的引物,从提取的病毒总DNA中特异性扩增PCV2 ORF2基因,经琼脂糖凝胶电泳检测,可见大小为720 bp的目的基因条带,与预计片段大小一致,且无其它杂带(见图1)。
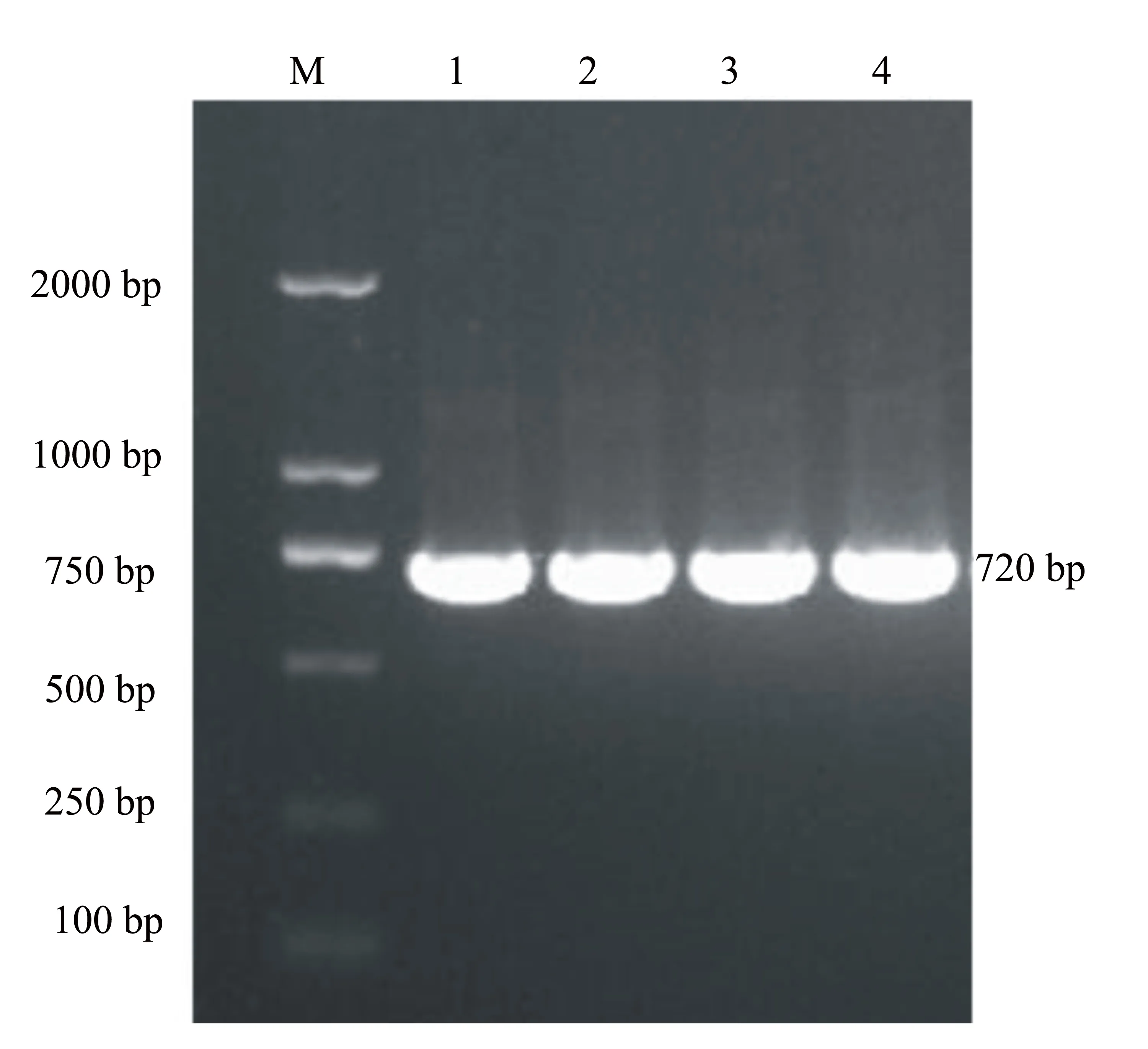
M: DL 2000 Marker; 1~4: PCV2 ORF2基因扩增产物。
2.2 克隆质粒的构建和鉴定
将扩增的ORF2基因和pMD-18T载体连接后,连接产物转化DH5α后,小量提取克隆质粒,进行PCR鉴定,获得与ORF2基因预期大小相同(720 bp)的目的片段;经SacI/HindIII双酶切鉴定,获得了两条条带,分别为2600 bp和720 bp,与预期大小相同。对测序结果进行分析,结果表明pMD-ORF2构建成功,且读码框完全正确(见图2)。
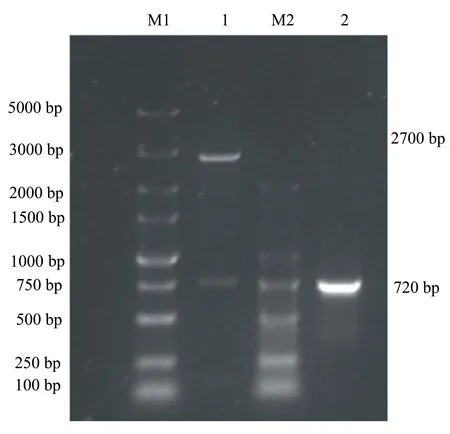
M1: DL 5000 Marker; M2: DL 2000 Marker; 1:pMD-ORF2双酶切产物; 2: pMD-ORF2质粒PCR产物。
2.3 重组表达质粒的构建与鉴定
使用SacI/HindIII酶从测序正确的克隆质粒pMD-ORF2中切下ORF2基因片段,切胶回收后和同样经过SacI/HindIII双酶切的pET-28a载体片段经Solution I连接,然后将其转化入Rosetta(DE3),小量提取质粒,经双酶切鉴定,获得了4900 bp和720 bp大小的两条条带,与预期大小相同。测序结果分析表明,表达载体pET-ORF2构建成功(见图3)。
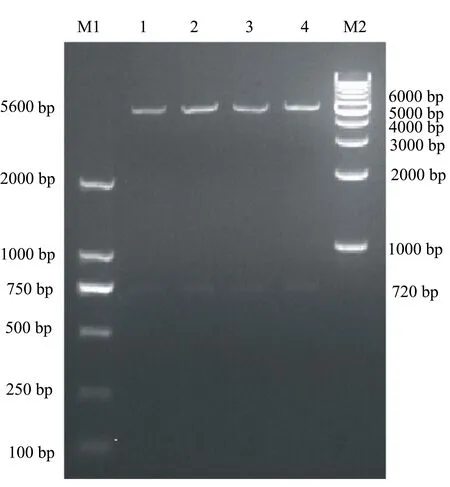
M1: DL 2000 Marker; M2:1000 bp DNA ladder;1~4: pET-ORF2双酶切产物。
2.4 目的基因的诱导表达与分析
将重组菌接种于Kan/LB培养基,在37 ℃下振荡培养,经过IPTG诱导表达后,收集表达菌体,处理后进行SDS-PAGE电泳分析。由图4可见,重组菌在34.5 kD处有明显的表达条带,与预期的蛋白分子量大小一致。
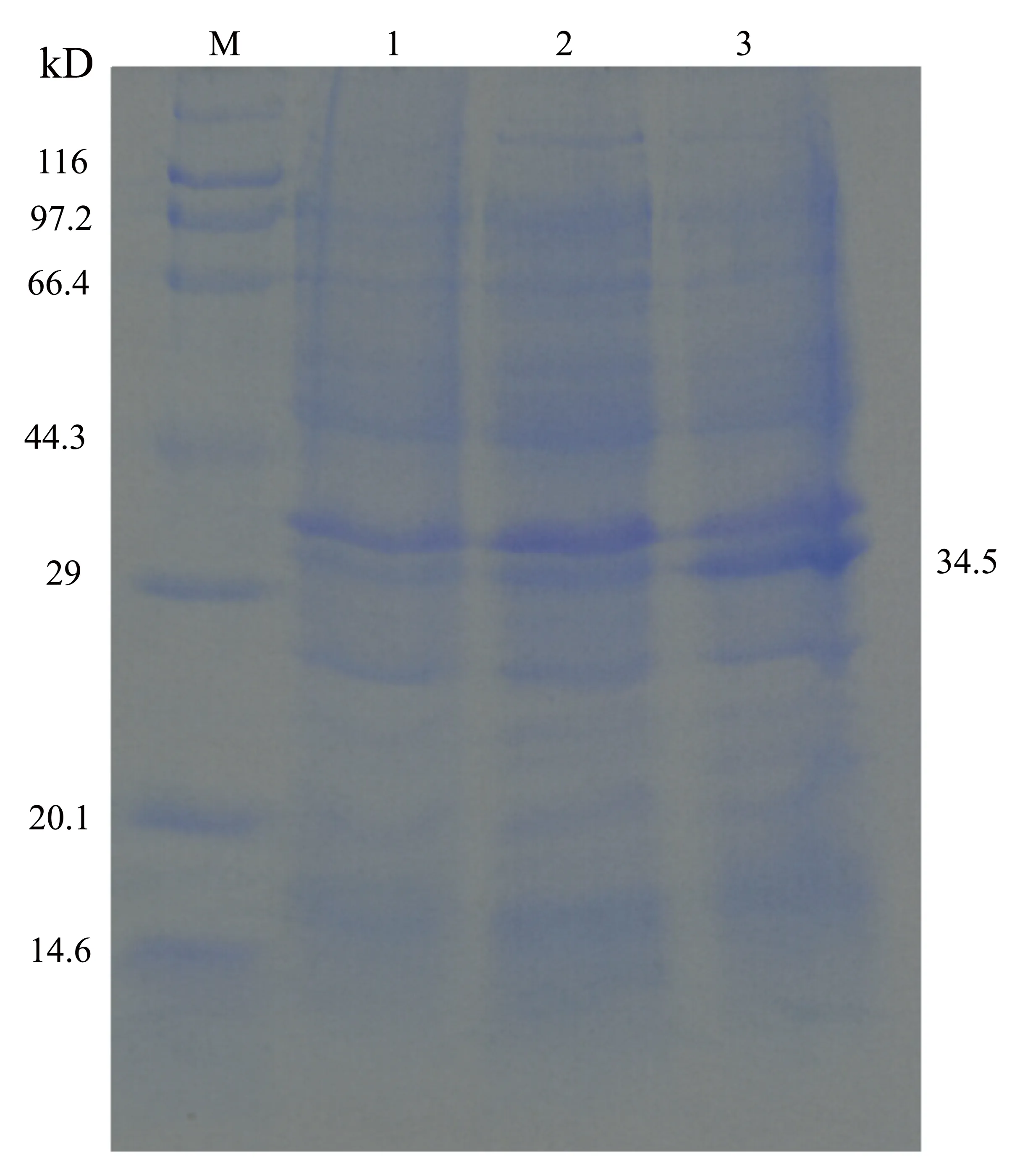
M:低分子量蛋白Marker; 1:空载体pET-28a诱导4 h后产物;
2.5 诱导剂IPTG浓度的确定
SDS-PAGE分析结果显示,当IPTG浓度为1.0 mmol/L时,表达量最大(见图5)。
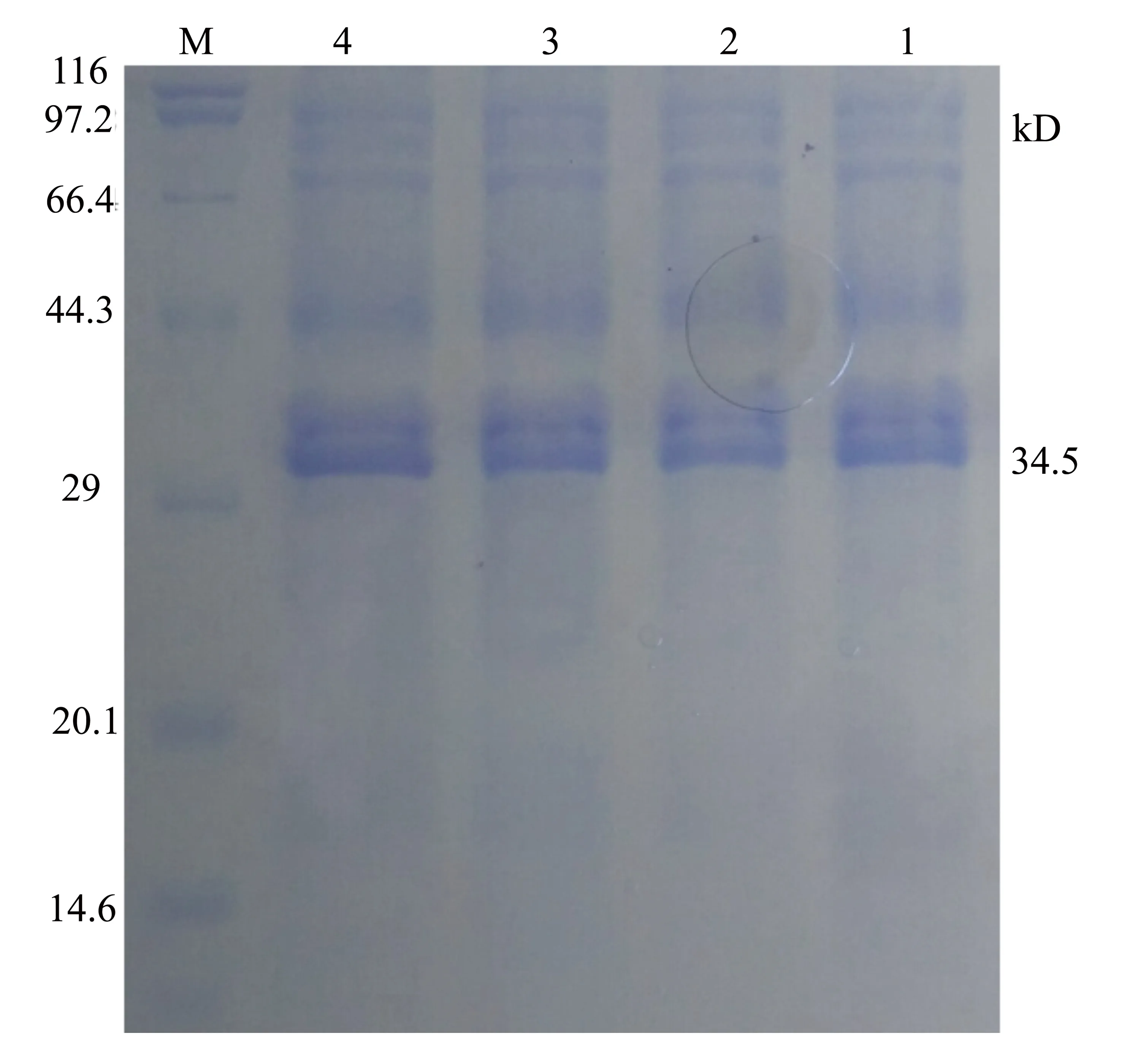
M:低分子量蛋白Marker; 1~4:诱导剂终浓度分别为0.4、0.6、0.8、1.0 mmol/L时诱导5 h后的产物。
图5 不同浓度诱导剂IPTG诱导重组蛋白产物SDS-PAGE分析结果
2.6 IPTG诱导时间的优化和可溶性结果
使用1.0 mmol/L IPTG开始诱导菌液,分别于诱导后3、4、5、6 h时,在无菌环境下取1 mL诱导菌液于EP管中,菌液处理后进行SDS-PAGE电泳分析。结果表明,蛋白的表达量在诱导开始后一段时间内随着诱导时间的增加而增加,但当到达一定时间后,目的蛋白的表达量增加不再明显,重组蛋白在诱导5 h后获得了较高的蛋白表达(见图6)。
根据确定的最佳IPTG诱导浓度和最佳诱导时间诱导重组菌表达,经过超声波破碎得到了包涵体沉淀和上清。向包涵体中加入和上清同体积的PBS重悬,处理后进行SDS-PAGE电泳分析,结果表明,Cap蛋白以包涵体的形式表达,在上清中表达量很少。
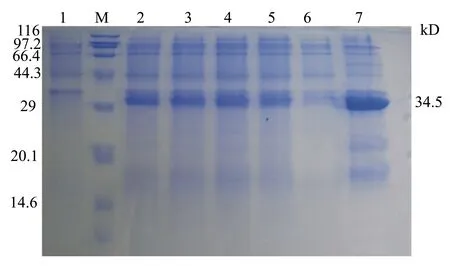
M:低分子量蛋白Marker; 1:诱导前重组蛋白; 2~5:重组蛋白诱导后3、4、5、6 h的表达产物; 6:上清样品; 7:包涵体样品。
图6 不同诱导时间诱导的重组蛋白及可溶性分析结果
2.7 重组蛋白的纯化与鉴定
按照确定的最佳诱导剂浓度和诱导时间,大量表达目的蛋白,收集菌体,经超声波破碎处理之后,弃上清,加入Inclusion Body Binding Buffer溶解包涵体。将溶解后的蛋白溶液通过His-tag融合蛋白纯化高亲和力镍填充树脂,按照说明书操作,纯化目的蛋白,纯化完成后,进行SDS-PAGE检测,结果显示获得了纯度较高的单一的Cap蛋白条带(见图7)。
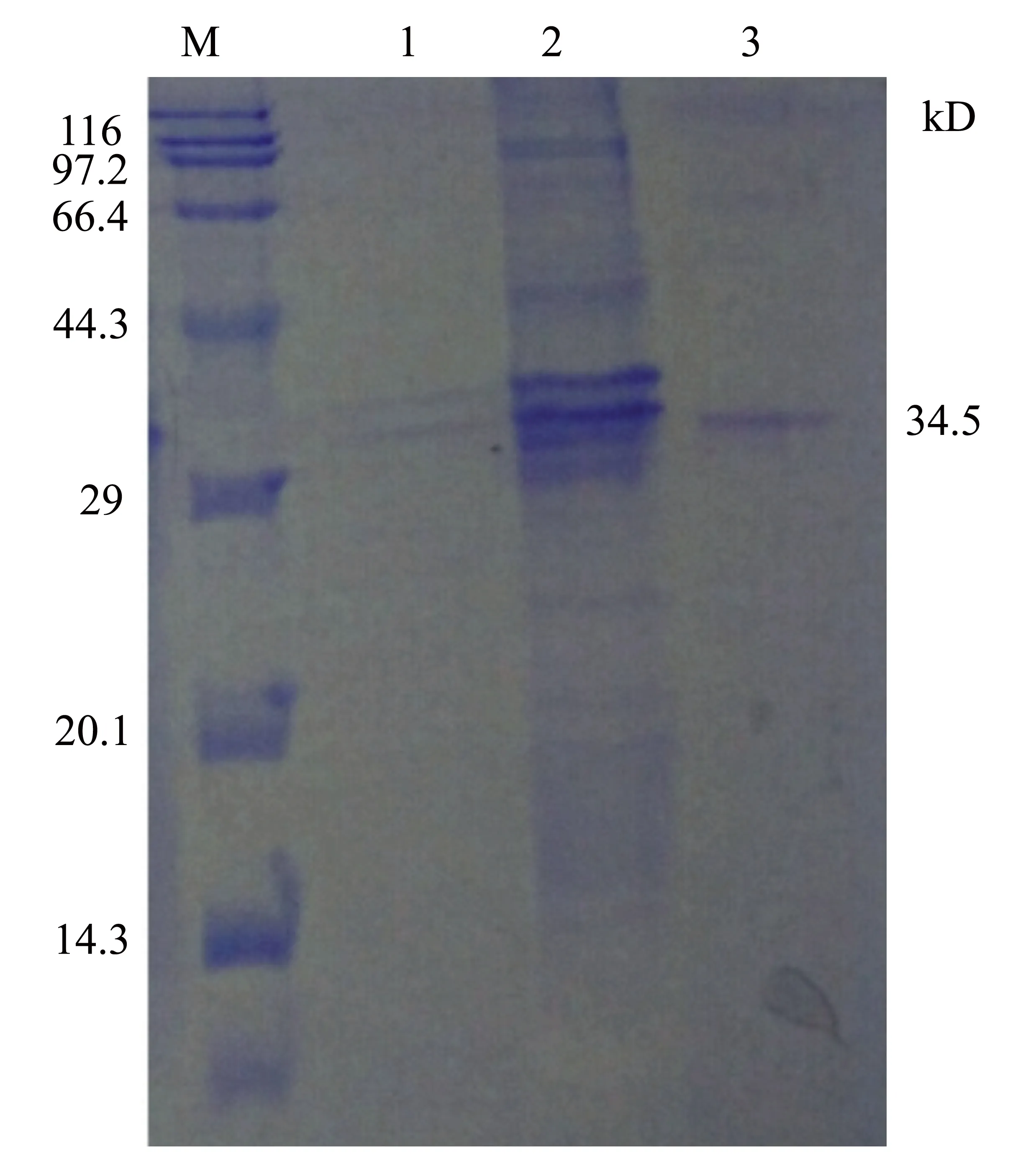
M:低分子量蛋白Marker; 1:穿流液;2:纯化前蛋白; 3:纯化后蛋白。
图7 His标签重组蛋白NI柱纯化产物SDS-PAGE分析结果
对纯化后的重组Cap蛋白及空载体pET-28a诱导表达产物进行Western Blotting检测分析,检测结果显示,重组蛋白在大约34.5 kD处出现单一的特异性条带,而pET-28a空载体诱导的菌体蛋白没有出现任何条带。表明重组Cap蛋白正确表达和纯化(见图8)。使用紫外分光光度计测定纯化后的蛋白浓度,结果为0.46 mg/mL。
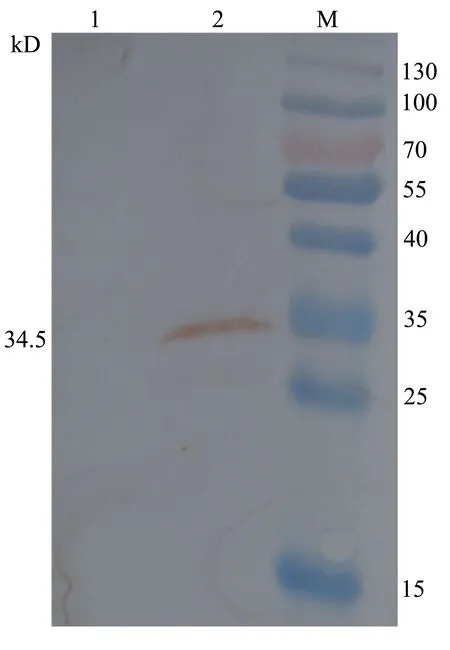
M:低分子量蛋白Marker; 1:空载体pET-28a诱导产物; 2:纯化后重组蛋白。
图8 纯化后重组蛋白Western-Blot分析结果
3 讨论
PCV两种基因型之间ORF1所编码的Rep蛋白的同源性达到了86%,这就使得两种基因型之间存在抗原交叉性,因此若用全病毒作为抗原来检测抗体,就不能很好地区别出两种基因型的感染。PCV2感染不会导致细胞病变,对宿主细胞的感染程度和感染率都维持在比较低的水平,由于病毒体积很小,使得细胞培养和纯化都比较困难。所以,使用PCV2全病毒作为诊断抗原的难度也比较大。有关研究表明,两种基因型的ORF2段基因同源性较低,且在PCV2 ORF2基因中存在4个主要抗原位点,其中的2个位点都是针对PCV2的特异性位点[10],可以有效地区分出PCV1和PCV2,由ORF2编码的Cap蛋白在两者之间没有抗原交叉性。
Cap蛋白是病毒的衣壳蛋白,可以通过原核表达系统进行表达。对ORF2序列的分析发现,在其氨基端的核定位序列的41个密码子中存在11个大肠杆菌的稀有密码子;有资料显示,稀有密码子的存在会影响外源基因的表达[11]。前期有学者通过去除ORF2氨基端的稀有密码子,通过在BL21大肠杆菌表达系统获得了具有一定抗原性的截短Cap蛋白[12]。截短表达虽然降低了表达的难度,但它是一种探索性研究,截掉的基因如果存在抗原位点,则会导致获得的截短表达蛋白免疫学功能的缺失。因为没有保留Cap蛋白完整的抗原性,因此用截短的Cap蛋白作为抗原建立ELISA方法,会出现PCV2检出率和准确率降低等问题。
笔者先后尝试使用几种表达菌株进行表达,结果发现将表达质粒pET-ORF2转化入大肠杆菌Rosetta菌株,通过优化诱导条件,能够获得完整表达的Cap蛋白,这样就可以完整地保留Cap全部的抗原性[13]。以此Cap蛋白包被酶标板,建立特异性检测PCV2的ELISA方法,与截短的Cap蛋白相比,此全长Cap蛋白是更为理想的包被抗原。
PCV2 ORF2表达的Cap蛋白氨基端有稀有密码子的存在,利用普通大肠杆菌(BL21)表达系统无法表达出完整的Cap蛋白。韩凌霞等对截短型Cap蛋白表达进行了研究,将Cap基因羧基部分连接到pGEX-6p-1载体,导入BL21感受态细胞,表达出了具有部分抗原性的截短Cap蛋白[14]。为了获得完整的Cap蛋白,本研究将含有完整ORF2基因的表达质粒pET-ORF2导入Rosetta感受态细胞,在37 ℃下利用IPTG诱导可以表达出完整的Cap蛋白。进一步研究确定,在IPTG终浓度1 mmol/L、温度37 ℃条件下诱导5 h, Cap蛋白的表达量最高。
本研究发现,表达出的PCV2 Cap蛋白是以包涵体的形式存在的,具有免疫学活性,可以用于进一步的试验研究。在目前PCV2流行的严峻形势下,未发现PCV2感染的猪场应制定合理的免疫程序,做好消毒工作,严密监视;如果出现阳性感染病例,则应及时淘汰病猪并作无害化处理;对于PCV2污染猪场,应根据养殖场的实际情况,制定净化方案,避免PCV2的进一步传播。
[1] Tischer I, Rasch R, Toehtermann G. Characterization of papovavirus and picornavirus-like particles in permanent pig kidney cell lines [J]. ZbI Bakt Hyg Abt Ovig A, 1974, 226(2): 153-167.
[2] 殷震,刘景华.动物病毒学[M].第2版.北京:科学出版社,1997:1175-1180.
[3] Choi C, Chae C, Clark E G. Porcine postweaning multisystemic wasting syndrome in Korean pig: detection of porcine circovirus 2 infection by immunohistochemistry and polymerase chain reaction [J]. Vet Diagn Invest, 2000, 12(2): 151-153.
[4] Rohde W, Randles J W, Langridge P, et al. Nucleotide sequence of a circular single-stranded DNA associated with coconut foliar decay virus [J]. Virology, 1990, 176(2): 648-651.
[5] 郎洪武,张广川,吴发权,等.断奶猪多系统衰弱综合征血清抗体检测[J].中国兽医科技,2000,30(3):3-5.
[6] Mankertz A, Buhk H J, Blaess G, et al. Transcription analysis of porcine circovirus (PCV) [J]. Virus Genes, 1998, 16 (3): 267-276.
[7] Meehan B M, Creelan J L, McNulty M S, et al. Sequence of porcine circovirus DNA: affinities with plant circoviruses [J]. J Gen Virol, 1997, 78: 221-227.
[8] Nawagitgul P, Harms P A, Morozov I, et al. Modified indirect porcine circovirus type 2 based and recombinant Capisid protein based enzyme-linkde immunosorbent assays for detection of antibodies to PCV[J]. Clin Diagn Lab Immunol, 2002, 9(1): 33-40.
[9] Blanchard P, Mahe D, Cariolet R, et al. An ORF2 protein-based ELISA for porcine circovirus type 2 antibodies in post-weaning multisystemic wasting syndrome[J]. Vet Microbiol, 2003, 94: 183-194.
[10] Mahé D, Blanchard P, Truong C, et al. Differential recognition of ORF2 protein from type 1 and type 2 porcine circoviruses and identification of immunorelevant epitopes [J]. J Gen Virol, 2000, 81: 1815-1824.
[11] 冷雪,崔晓华,黄海龙,等.猪圆环病毒2型吉林地区地方株ORF2基因的克隆、测序及其在原核细胞中的表达[J].中国兽医学报,2007,29(4):469-472.
[12] 高超,高云航,么乃全,等.猪圆环病毒2型ORF2基因原核表达蛋白间接ELISA检测方法的建立及应用[J].中国兽医学报,2008,28(8):888-891,905.
[13] 赵玲,朱玲,郭万柱,等.猪圆环病毒2型Cap蛋白的表达及在ELISA中的初步应用[J].畜牧兽医学报,2011,42(6):808-814.
[14] 韩凌霞,陈艳,崔尚金,等.猪II型圆环病毒全基因组序列分析及其ORF1和ORF2基因的克隆与表达[J].中国预防兽医学报,2004,26(1):10-13.
(责任编辑:黄荣华)
Cloning and Prokaryotic Expression of GeneCapin Porcine Circovirus Type 2
YANG Ke-li1, SHI Dai2, DUAN Zheng-ying1, TIAN Yong-xiang1*, ZHOU Dan-na1,GUO Rui1, LIU Ze-wen1, YUAN Fang-yan1, LIU Wei1, MENG Li1
(1. Hubei Provincial Key Laboratory of Animal Embryo Engineering and Molecular Breeding, Institute of Animal Husbandry and Veterinary, Hubei Academy of Agricultural Sciences, Wuhan 430064, China; 2. Shihe Animal Husbandry Bureau of Xinyang City in Henan Province, Xinyang 464000, China)
According to the complete genome of Porcine Circovirus Type 2 (PCV2) strain HBEZ, a pair of specific primers were designed to amplifyORF2 gene in HBEZ, andSacIandHindIIIwere used in the primers.ORF2 gene fragment was cloned to the prokaryotic expression vector pET-28a to construct the recombinant plasmid pET-ORF2. PCR and restrict enzyme identification confirmed that the recombinant plasmid was constructed successfully. Then pET-ORF2 was transformed intoE.colistrain Rosetta. After being induced by IPTG, the recombinant protein with the molecular weight of 34.5 kD could express mainly in the form of inclusion body in SDS-PAGE electrophoresis. The best inducement conditions were acquired as follows: bacterial culture at 37 ℃, adding 1 mmol/L IPTG when the OD-value was between 0.4 and 0.6, and inducement by IPTG for 5 h. The expression product Cap protein was purified by His-tag Ni-column and then was examined by Western-blot. The results showed that the expressed recombinant protein could react specifically with the polyclonal antibody against PCV2, and it possessed a good reactogenicity.
Porcine circovirus type 2; GeneCap; Cloning; Prokaryotic expression
2016-07-12
科技部重点专项课题(2016YFD0500703);湖北省农业科技创新中心项目(2016-620-000-001-026);湖北省科技支撑计 划(公益性科技研究类)项目(2014BKB063);动物胚胎及分子育种湖北省重点实验室开放课题(2016ZD156)。
杨克礼(1976─),男,安徽怀远人,副研究员,研究方向为动物传染病。*通讯作者:田永祥。
S852.659.2
A
1001-8581(2017)01-0096-06
