81份烟草种质资源遗传多样性分析
2017-02-10张铭真李晓辉杨铁钊徐世晓
张铭真,李晓辉,王 袁,杨铁钊,徐世晓
(河南农业大学 烟草学院,河南 郑州 450002)
81份烟草种质资源遗传多样性分析
张铭真,李晓辉,王 袁,杨铁钊,徐世晓*
(河南农业大学 烟草学院,河南 郑州 450002)
从250对引物中筛选出64对SSR引物,分析了81份烟草种质资源的遗传多样性。结果表明:64对SSR引物在81份烟草种质材料中共扩增出269个基因位点,观测杂合度(Ho)平均值为0.3545,预期杂合度(He)的平均值为0.5425,Shannon’s信息指数(I=0.997)和Nei’s多样性指数(H=0.5391)较高,遗传分化系数(Fst=0.1454)较高,基因流(Nm=1.4699)较小,遗传相似系数较小(0.53~0.90)。说明81份烟草种质的遗传多样性较高,居群间的遗传分化水平较高,大部分位点表现出偏离Hardy-Weinberg平衡,杂合度不足,居群间有较小的基因流。
烟草;种质资源;荧光SSR;遗传多样性
烟草是我国的一大经济作物,种植面积较大;但烟草育种面临亲本匮乏、集中,育成品种遗传基础狭窄等问题,因此拓宽栽培品种的遗传基础是今后稳产、优质、抗逆烟草新品种育种工作的关键。种质资源多样性高有利于挑选适合新环境的种类和品种,可为培育适应新环境的新品种提供亲本材料[1]。烟草种质资源遗传多样性是烟草生产可持续发展的物质保障[2]。传统的烟草育种主要依赖于植物表型选择和抗性鉴定,育种周期长,经验要求较高,且极易受到病虫以及气候条件的限制,选择效率较低[3]。分子标记辅助选择利用与目标性状相连锁的分子标记,可以对育种材料从DNA水平上进行高效选择。SSR分子标记辅助选择近年来在烟草上得到了较多应用,例如:2007年Bindler等[4-5]和Tong等[6]利用SSR标记分别在烟草类型间(烤烟与晒烟)和类型内(烤烟与烤烟)构建了高密度的分子标记图谱; Johnson等[7]利用与烤烟Coker371-Gold中黑胫病抗性基因紧密连锁的SSR标记对K326进行了分子标记辅助育种; Moon等[8]利用46对SSR引物分析了54份烟草属、3种类型材料的遗传多样性;童治军等[9]利用普通烟草(K326)及其2个祖先中基因组序列数据,探索了基因组SSR位点分布情况,为SSR分子标记的应用提供了参考;文轲等[10]利用SSR技术,挖掘了烟草抗CMV基因,并找到了1个与抗性基因遗传距离较近的分子标记。在上述研究的基础上,我们采用荧光SSR分子标记法和ABI-3500xl遗传分析仪对81份烟草种质材料(包括烤烟、晒烟、白肋烟、雪茄烟、香料烟五种类型)的遗传多态性进行了检测,以期确定烟草种质材料间的遗传背景差异,为建立烟草分子标记辅助育种体系以及拓宽烟草育种遗传基础奠定理论基础。
1 材料与方法
1.1 试验材料
共81份,包含5种烟草类型,分别来自美国、中国、日本、古巴、波兰等国家;其中烤烟50份,晒烟11份,白肋烟10份,香料烟5份,雪茄烟5份(表1)。将各供试材料的种子播于河南农业大学试验园区大棚;以品种为单位采集烟草苗期幼嫩叶片于2 mL离心管中,并迅速放入液氮罐中冷冻,带回实验室置于-70 ℃超低温冰箱中保存备用。

表1 供试的烟草种质资源材料
1.2 试验方法
1.2.1 基因组DNA的提取 将采集到的烟草幼叶用液氮冷冻后,置于磨样机上研磨;待叶片磨碎后用TaKaRa新型植物基因组DNA提取试剂盒[由宝生物工程(大连)有限公司生产]提取基因组DNA。经2%琼脂糖凝胶电泳检测其完整性后,用紫外分光光度计检测提取到的DNA的纯度与浓度,将其稀释至10 ng/μL,在-20 ℃下保存备用。
1.2.2 PCR扩增与引物筛选 采用Bindler等[4-5]公开发表的引物及童治军[12]设计的SSR引物,引物合成由苏州金唯智生物有限公司完成。
SSR-PCR反应体系为10 μL,包括:2 μL基因组DNA、0.6 μL Mg2+、1 μL 10×Buffer、0.15 μL dNTP、0.1 μL rTaq酶、带荧光标记的M13正向引物0.1 μL、正向引物0.05 μL、反向引物0.15 μL。PCR程序如下:94 ℃预变性5 min;94 ℃模板变性30 s、55 ℃ 退火30 s、72 ℃ 延伸30 s,共30个循环;72 ℃延伸5 min,4 ℃保存。退火温度各引物不同。进而以不同品种的8个烟草种质材料进行引物筛选,最终选出条带清晰、多态性高的SSR引物,对所有材料进行遗传多样性分析。
1.2.3 毛细管电泳检测及数据分析 吸取2 μL PCR产物,将其加入到有6 μL变性剂的384孔板中,95 ℃变性5 min。用ABI-3500xl自动分析仪对PCR产物进行检测。用Genographer软件进行试验条带读取。在不同位点上将有条带的记录为1,无条带的记为0。根据分子量大小对扩增结果读带,从大到小依次记为A、B、C、…;只有1条带的为纯合子,记为AA、BB、CC、...;两条带的为杂合子,记为AB、BC、AC、…。统计每个引物在不同个体中的扩增情况。利用Popgene 3.2软件计算遗传多样性指标;用NTSYS-pc Version 2.10e对81份烟草种质材料进行聚类分析。
2 结果与分析
2.1 PCR扩增与引物筛选结果
本实验从250对SSR引物中筛选出64对条带清晰、杂带少且多态性高的引物。图1为其中部分引物的筛选结果。
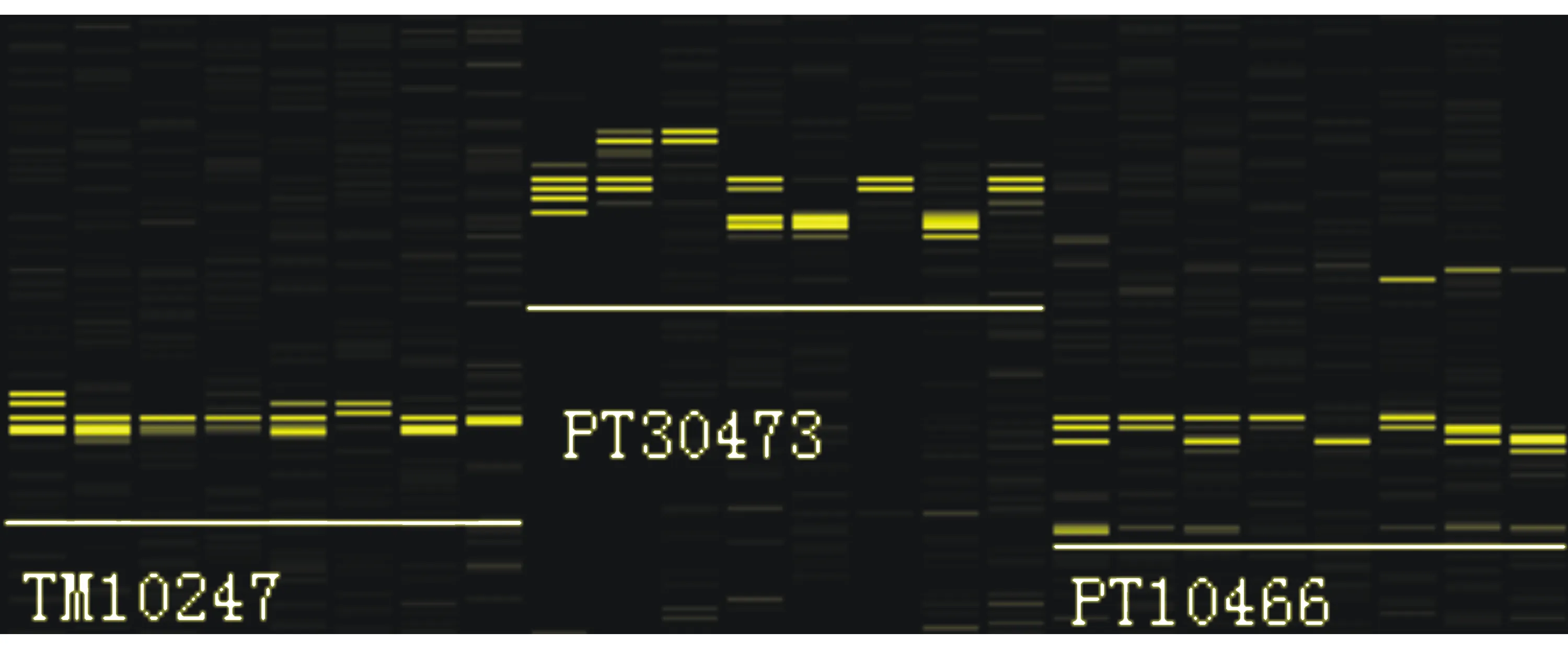
图1 部分引物筛选结果
2.2 SSR标记的遗传多样性分析
由81份烟草种质资源的遗传多样性分析结果(表2)可知:64对SSR引物共检测出401个基因位点;等位基因数(Na)的平均值为4.1719个,其中位点TM10912及TM10606的等位基因数最多,为12个;有效等位基因数(Ne)的平均值为2.5322个,其中TM10285的有效等位基因数最少(1.131),而位点PT30173的有效等位基因数最多,为6.3208;观测杂合度(Ho)的变化范围为0.0123~0.9753,平均值为0.3545;预期杂合度(He)的变化范围为0.1166~0.847,平均值为0.5425;平均Nei’s多样性指数(H)为0.5391;平均Shannon’s信息指数(I)为0.997。不同位点间遗传参数存在差别,He的平均值大于0.5,表明烟草种质资源的遗传多样性较高。
2.3 基于SSR标记的烟草遗传多样性的聚类分析及主成分分析
根据64对SSR引物扩增数据统计结果,利用NTSYSpc Version 2.10e软件,采用UPGMA法聚类得到81份烟草种质的聚类树状图(见图2)。在相似系数(GS)0.643处可划分为两个类群,其中豫烟12号与豫烟12号×K346的相似系数最大,为0.90,遗传差异较小,亲缘关系较近; Vranjska Jaka与K326的相似系数最小,为0.53,遗传差异明显,亲缘关系较远。对81份烟草种质材料进行基于0、1数据矩阵的PCA分析,结果如图3所示。根据位置近则亲缘关系近,位置远则亲缘关系远的原则[13],将81份烟草种质材料划分为3个类群,其中类群a包含11份种质,其中有2份烤烟种质;类群b共有12份烟草种质,都为晾晒烟类型;类型c共有58份烟草种质,其中包括10份晾晒烟种质、48份烤烟类型种质。
2.4 烟草种质的遗传分化
由81份烟草种质的遗传分化结果(见表3)可知:其遗传分化系数(Fst)的变化范围为0.015~0.5398,平均值为0.1454,即有14.54%的遗传变异存在于居群间,85.46%的变异存在于居群内。烟草居群间的基因流(Nm)的变化范围为0.2131~16.4481,平均值为1.4699,基因流较小,表明居群间的基因交流程度较弱,以TM10051位点的基因流最大。居群内偏离H-W平衡的程度(Fis)为-1~1,其中以PT30186位点的Fis值最高,说明该位点在各居群内偏离H-W平衡的程度最大,纯合度高;以TM10081及TM10286位点的Fis值最低,说明这2个位点偏离H-W平衡的程度最小,杂合度偏高;偏离H-W平衡的程度的平均值为0.2,多数位点表现为纯合度偏高。总居群偏离H-W平衡的程度(Fit)为-0.809~0.984,其中以PT30186位点的Fit值最大,表明该位点在总居群纯合度偏高;以TM10268位点的Fit值最小,表明该位点杂合度偏高。Fit的平均值为0.3411,说明总居群杂合子较少。
2.5 居群间遗传距离、遗传一致度及不同居群UPGMA聚类分析
为了进一步分析烟草种质资源居群间的遗传关系,根据烟草种质类型,将其分为5个居群,即烤烟、晒烟、白肋烟、香料烟、雪茄烟类型。计算了5个居群间的遗传距离(GD)和遗传一致度(GI),结果(表4)表明:烤烟与晒烟的遗传距离最高(0.2946),遗传一致度最低,为0.7448;香料烟与晒烟2个居群的遗传距离最小(0.1533),遗传一致度最高,为0.8579。
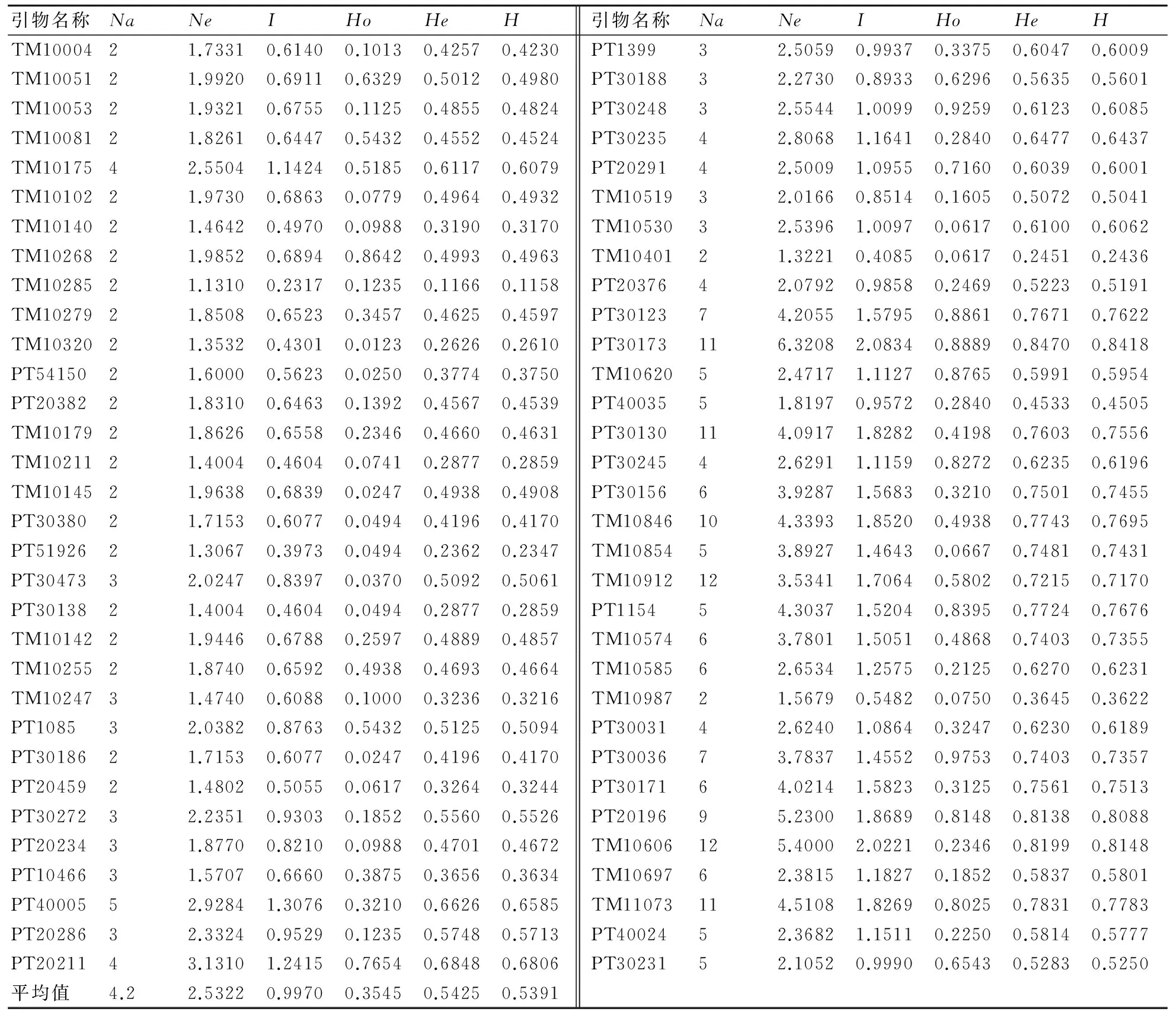
表2 烟草种质资源的遗传多样性
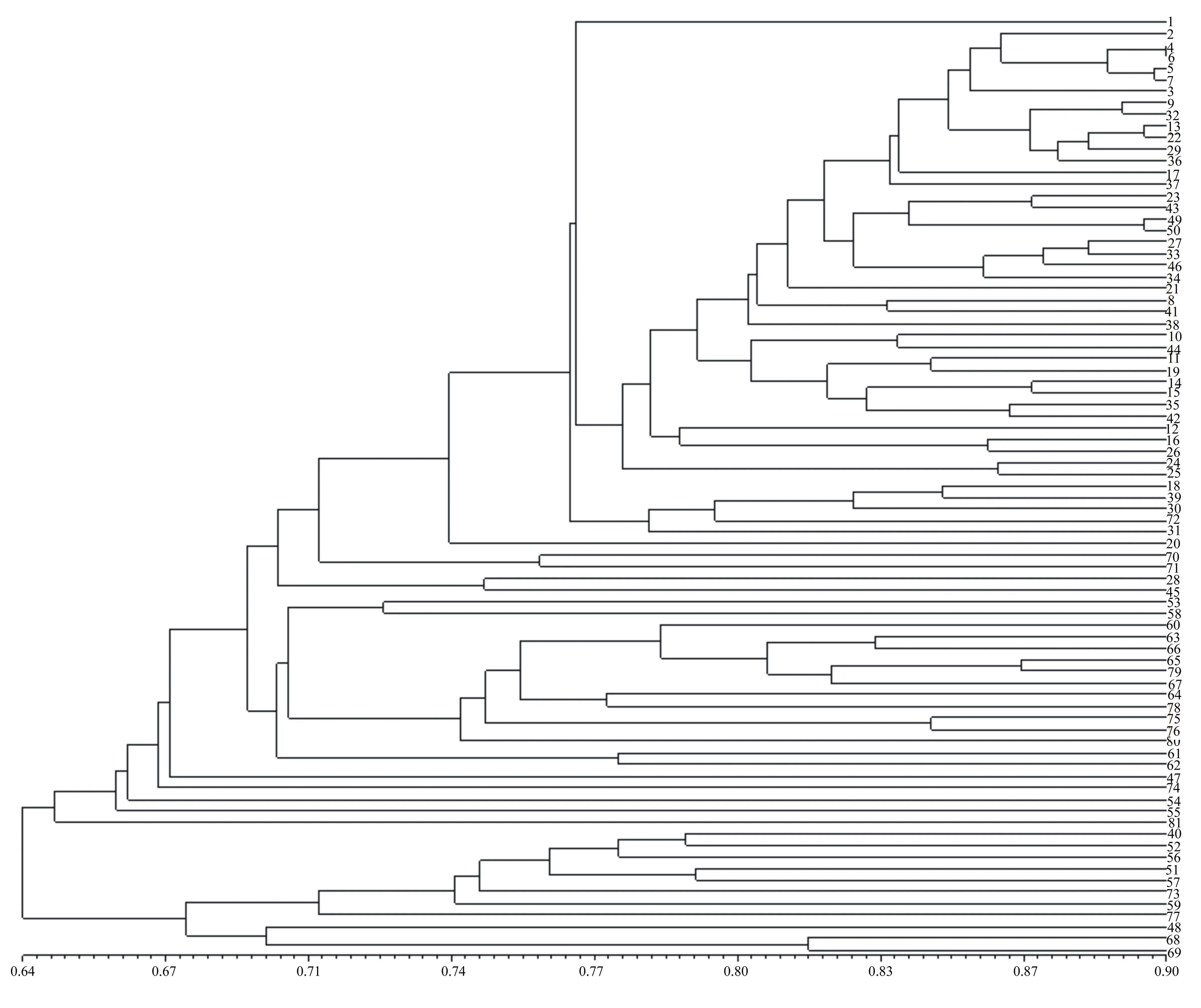
图2 81份烟草种质材料SSR标记遗传相似(GS)聚类图
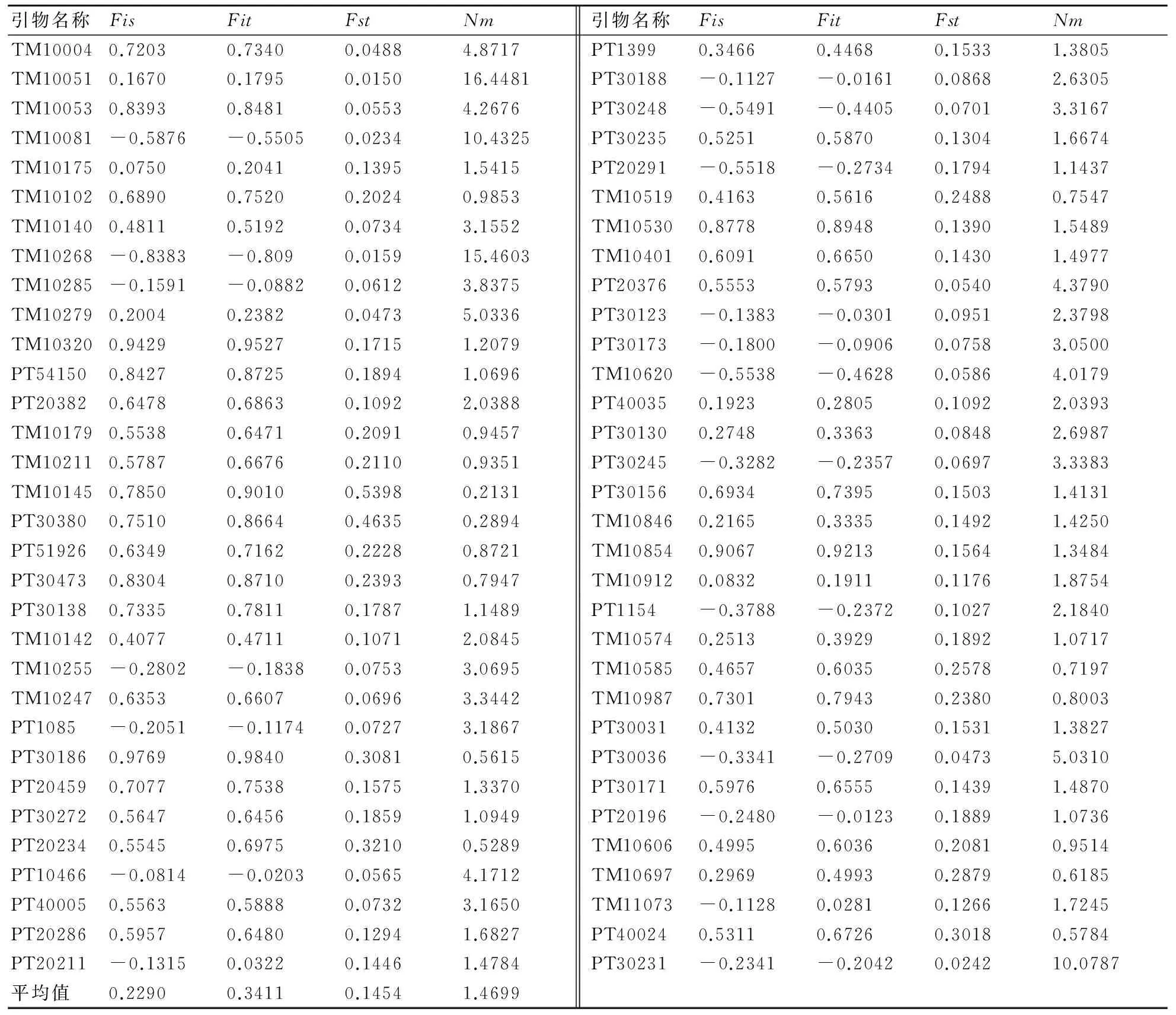
引物名称FisFitFstNm引物名称FisFitFstNmTM100040.72030.73400.04884.8717PT13990.34660.44680.15331.3805TM100510.16700.17950.015016.4481PT30188-0.1127-0.01610.08682.6305TM100530.83930.84810.05534.2676PT30248-0.5491-0.44050.07013.3167TM10081-0.5876-0.55050.023410.4325PT302350.52510.58700.13041.6674TM101750.07500.20410.13951.5415PT20291-0.5518-0.27340.17941.1437TM101020.68900.75200.20240.9853TM105190.41630.56160.24880.7547TM101400.48110.51920.07343.1552TM105300.87780.89480.13901.5489TM10268-0.8383-0.8090.015915.4603TM104010.60910.66500.14301.4977TM10285-0.1591-0.08820.06123.8375PT203760.55530.57930.05404.3790TM102790.20040.23820.04735.0336PT30123-0.1383-0.03010.09512.3798TM103200.94290.95270.17151.2079PT30173-0.1800-0.09060.07583.0500PT541500.84270.87250.18941.0696TM10620-0.5538-0.46280.05864.0179PT203820.64780.68630.10922.0388PT400350.19230.28050.10922.0393TM101790.55380.64710.20910.9457PT301300.27480.33630.08482.6987TM102110.57870.66760.21100.9351PT30245-0.3282-0.23570.06973.3383TM101450.78500.90100.53980.2131PT301560.69340.73950.15031.4131PT303800.75100.86640.46350.2894TM108460.21650.33350.14921.4250PT519260.63490.71620.22280.8721TM108540.90670.92130.15641.3484PT304730.83040.87100.23930.7947TM109120.08320.19110.11761.8754PT301380.73350.78110.17871.1489PT1154-0.3788-0.23720.10272.1840TM101420.40770.47110.10712.0845TM105740.25130.39290.18921.0717TM10255-0.2802-0.18380.07533.0695TM105850.46570.60350.25780.7197TM102470.63530.66070.06963.3442TM109870.73010.79430.23800.8003PT1085-0.2051-0.11740.07273.1867PT300310.41320.50300.15311.3827PT301860.97690.98400.30810.5615PT30036-0.3341-0.27090.04735.0310PT204590.70770.75380.15751.3370PT301710.59760.65550.14391.4870PT302720.56470.64560.18591.0949PT20196-0.2480-0.01230.18891.0736PT202340.55450.69750.32100.5289TM106060.49950.60360.20810.9514PT10466-0.0814-0.02030.05654.1712TM106970.29690.49930.28790.6185PT400050.55630.58880.07323.1650TM11073-0.11280.02810.12661.7245PT202860.59570.64800.12941.6827PT400240.53110.67260.30180.5784PT20211-0.13150.03220.14461.4784PT30231-0.2341-0.20420.024210.0787平均值0.22900.34110.14541.4699
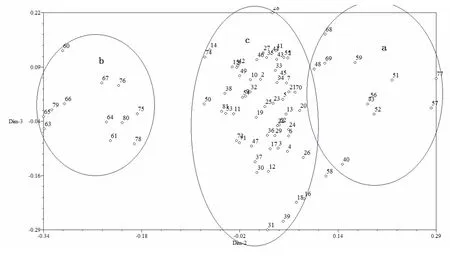
图3 81份烟草种质材料的二维主成分分析结果
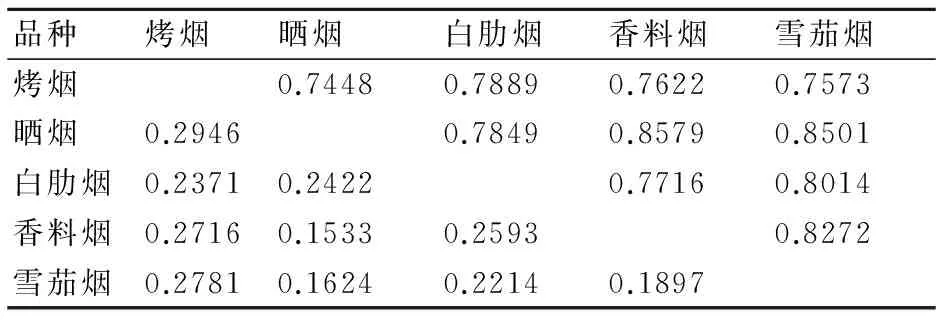
品种烤烟晒烟白肋烟香料烟雪茄烟烤烟0.74480.78890.76220.7573晒烟0.29460.78490.85790.8501白肋烟0.23710.24220.77160.8014香料烟0.27160.15330.25930.8272雪茄烟0.27810.16240.22140.1897
注:表中右上三角数据为遗传一致度,左下三角数据为遗传距离。
根据DNA扩增统计结果,采用POPGEN 1.31软件计算出5个居群的遗传一致度分布在0.7448~0.8579之间。遗传聚类图(图4)显示:白肋烟与烤烟聚在一起,这两类居群的遗传距离较近;香料烟、晒烟及雪茄烟居群聚集在一起,香料烟与晒烟居群的遗传距离较近。
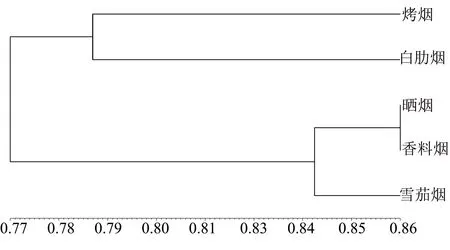
图4 基于遗传一致度的5个居群的UPGMA聚类图
3 讨论与结论
3.1 烟草种质的遗传多样性
遗传多样性是指种内不同群体和个体间的遗传多态性程度,即指种内基因的变化,包括种内显著不同的居群间和同一居群内的遗传变异[14]。本研究中81份烟草种质的遗传相似系数变化范围在0.53~0.90,烤烟种质内遗传差异较小,相似性较高,这与以往的研究结果[15-17]一致。分析其原因,主要为:烟草亲本集中,由各个主体亲本直接或者间接育成的品种占育成品种总数的97%以上[18],地方种质及特异种质在育种中所占比例较小,从而造成烤烟种质内遗传背景狭窄;另外,人为选择压力使得一些多样化性状丢失。本研究的聚类结果显示,各个国家的烟草种质交织在一起,并没有以种质的地理因素聚类,说明烟草种质的遗传分类与地理因素关系不大,主要与种质的亲缘关系有关,这与肖炳光等[19]的研究结果类似。世界主产烟国家的烟草育种基本上是在美国早期育成品种的基础上发展起来的,而我国烟草育种也主要利用从美国引进的优质多抗品种作为亲本选育品种,故而地理因素对烟草种质遗传多样性差异的影响不大。
3.2 不同烟草类型种质间的遗传分化
本研究结果显示,5个烟草类型种质间的遗传相似性范围在0.7448~0.8579之间,晒烟、香料烟、雪茄烟居群之间的遗传距离较小,这3个居群聚为一类,而白肋烟与烤烟居群聚为另一类。该结果表明,种质间的遗传差异不完全取决于栽培类型间的差异,而与种质演化有关[20]。不同栽培类型的烟草种质,主要因调制方式不同导致化学性质有所差异,但是在基因组水平上差异较小。Ren等[21]利用AFLP标记分析了烟草属种内种间的遗传变异程度,聚类分析时同一类群包含不同类型的烟草品种。在本研究中,81份烟草种质资源的遗传变异主要发生在居群内,且居群间的基因流较小。由于人为划分烟草类型,不同类型烟草种质间较少杂交,故而基因流较小。多数位点表现偏离H-W平衡,H-W平衡可以用来反映交配系统对基因型频率的影响程度[22]。烟草种质资源大部分位点均表现为偏离H-W平衡,杂合度不足,纯合体所占比例较高。因此,在以后的育种工作中,应当多利用类群间遗传差异大的亲本进行杂交,既能够提高烟草不同类型居群间的基因流,也能够充分利用杂交优势,选育更多优质、抗病的烟草新品种。
[1] 刘纪麟.玉米育种学[M].北京:中国农业出版社,2000:143-175.
[2] 郑殿升,杨庆文,刘旭.中国作物种质资源多样性[J].植物遗传资源学报,2011,12(4):497-500,506.
[3] 危文亮,赵应忠.分子标记在作物育种中的应用[J].生物技术通报,2000(2):12-16,22.
[4] Bindler G, der Hoeven V R, Gunduz I, et al. A microsatellite marker based linkage map of tobacco [J]. Theor Appl Genet, 2007, 114: 341-349.
[5] Bindler G, Plieske J, Bakaher N, et al. A high density genetic map of tobacco (NicotianatabacumL.) obtained from large scale microsatellite marker development [J]. Theor and Appl Genet, 2011, 123: 219-230.
[6] Tong Z J, Yang Z M, Chen X J, et al. Large-scale development of microsatellite markers inNicotianatabacumand construction of a genetic map of flue-cured tobacco [J]. Pla Bre, 2012, 131: 674-680.
[7] Johnson E S, Wolff M F, Wernsman E A, et al. Marker-assisted selection for resistance to black shank disease in tobacco [J]. Pla Dise, 2002, 86: 1303-1309.
[8] Moon H S, Nicholson J S, Lewis R S. Use of transferableNicotianatabacumL. microsatellite markers for investigating genetic diversity in the genusNicotiana[J]. Geno, 2008, 51: 547-559.
[9] 童治军,焦芳婵,肖炳光.普通烟草及其祖先中基因组SSR位点分析[J].中国农业科学,2015,48(11):2108-2117.
[10] 文轲,张志明,任民,等.烤烟CMV抗病基因QTL定位[J].中国烟草科学,2016,34(3):55-59.
[11] 郝晨阳,王兰芬,贾继增,等.SSR荧光标记和银染技术的比较分析[J].作物学报,2005,31(2):144-149.
[12] 童治军.烟草微卫星标记的开发与利用[D].杭州:浙江大学,2012:89-236.
[13] 陈斐,魏臻武,李伟民,等.基于SSR标记的苜蓿种质资源遗传多样性与群体结构分析[J].草地学报,2013,21(4):759-768.
[14] 董玉琛,刘旭.中国作物野生近缘植物及其保护[M].北京:中国林业出版社,1998:24-29.
[15] 肖炳光,卢江平,卢秀萍,等.烤烟品种的RAPD分析[J].中国烟草学报,2000,6(2):10-15.
[16] 何川生,何兴金,葛颂,等.烤烟品种资源的RAPD分析[J].植物学报,2001,43(6):610-614.
[17] 陈雅琼,王卫峰,丁安明,等.基于SSR荧光标记分析我国主要审(认)定烤烟及白肋烟品种遗传多样性[J].中国烟草学报,2013,19(2):98-105.
[18] 王元英,周健.中美主要烟草品种亲源分析与烟草育种[J].中国烟草学报,1995,2(3):11-21.
[19] 肖炳光,杨本超.利用ISSR标记分析烟草种质的遗传多样性[J].中国农业科学,2007,40(10):2153-2161.
[20] 王志德,牟建民,戴培刚,等.部分烟草核心种质RAPD分析[J].中国烟草学报,2003,9(4):20-25.
[21] Ren N, Timko M P. AFLP analysis of genetic polymorphism and evolutionary relationships among cultivated and wildNicotianaspecies [J]. Geno, 2001, 44: 559-571.
[22] Stark A E. A clarification of the Hardy-Weinberg law [J]. Gene, 2006, 174: 1695-1697.
(责任编辑:黄荣华)
Analysis of Genetic Diversity of 81 Tobacco Germplasm Resources
ZHANG Ming-zhen, LI Xiao-hui, WANG Yuan, YANG Tie-zhao, XU Shi-xiao*
(College of Tobacco Science, Henan Agricultural University, Zhengzhou 450002, China)
The genetic diversities of 81 tobacco germplasm resources were analyzed by using 64 pairs of polymorphic SSR primers screened from 250 pairs of SSR primers. The results revealed that a total of 269 genetic loci were amplified in 81 tobacco materials through 64 pairs of polymorphic SSR primers. The average observed heterozygosity (Ho) was 0.3545 per primer pair, and the average expected heterozygosity (He) was 0.5425 per primer pair. The Shannon’s information index (I=0.997), Nei’s diversity index (H=0.5391) and genetic differentiation coefficient (Fst=0.1454) were relatively high, while the gene flow (Nm=1.4699) and genetic similarity coefficient (0.53~0.90) were relatively low. The above results indicated that the genetic diversities of 81 tobacco germplasm resources were relatively high, the genetic differentiation level among different populations was relatively high, most loci seriously deviated from Hardy-Weinberg equilibrium, their heterozygosity was low, and the gene flow among different populations was less.
Tobacco; Germplasm resources; Fluorescent SSR marker; Genetic diversity
2016-08-05
中国烟草总公司重大项目“高抗根结线虫病优质烤烟新品种选育”(110201402004)。
张铭真(1992─),女,研究生,从事烟草研究工作。*通讯作者:徐世晓。
S572.024
A
1001-8581(2017)01-0062-07
