三种园林植物对夜间光照的响应与适应特征
2017-02-08陈良华杨万勤何书惠
陈良华, 曹 艺, 杨万勤,*, 张 健, 何书惠
1 四川农业大学生态林业研究所,四川省林业生态工程重点实验室, 成都 611130 2 四川农业大学长江上游生态安全协同创新中心, 成都 611130
三种园林植物对夜间光照的响应与适应特征
陈良华1, 2, 曹 艺1, 杨万勤1, 2,*, 张 健1, 2, 何书惠1
1 四川农业大学生态林业研究所,四川省林业生态工程重点实验室, 成都 611130 2 四川农业大学长江上游生态安全协同创新中心, 成都 611130
光污染是城市生态系统中重要的污染类型,目前的研究集中在光污染对人类健康、昆虫生活史、生活习性、活动规律等方面,对植物生理生态的效应研究则较少。以凤仙花(Impatiensbalsamina)、小叶栀子(Gardeniajasminoides)、夏菊(Dendranthemamorifolium)为研究对象,研究白光LED灯从每天18:00—24:00照光(T1处理)、每天18:00—次日8:00照光(T2处理)以及自然光周期(CK)等3种光环境条件下,3种植物生物量积累与分配、开花特征、色素含量、碳氮含量及其比值(C/N比)、抗氧化酶等方面的响应与适应特征。结果表明,T1和T2处理增加了凤仙花的生物量(分别为CK的1.4和1.9倍),降低了叶片和茎的N含量,增加了叶片的C/N比(分别为CK的1.2和1.9倍),降低了叶片的色素含量;T1处理延迟了凤仙花的花期,T2处理条件下凤仙花不开花。T1和T2处理虽然没有影响小叶栀子的花期,但增加了花的数量,减小了花的平均重量,花的C/N比显著增加(T2处理为CK的1.3倍);T2处理降低了小叶栀子叶片的叶绿素a、b及总叶绿素含量,增加了丙二醛的含量(T2处理为CK的1.7倍)。夏菊的生物量及生理特征受到T1和T2处理的影响最小,但T1和T2处理均抑制了夏菊开花。这些结果表明凤仙花和夏菊开花对光污染引起光周期的变化比较敏感,凤仙花的生长和养分特征也受到夜间光照的显著影响,光污染对小叶栀子的叶片造成了显著伤害。总的来讲,与T2相比,T1处理对3种植物的负面影响较小,在城市照明的管理过程中,可以根据需要缩短夜间光照的时间,既可以节约能源,又可以减小对植物生理生态的负面影响。
光污染;园林植物;白光LED;光周期
园林景观植物是城市生态系统的重要组成部分,在美化环境、净化空气、缓减“热岛”效应等方面发挥着重要的作用。这类植物不仅受到高温、干旱、重金属污染等环境胁迫的影响,同时也受到光污染的影响。光污染是指现代城市建筑和夜间照明产生的溢散光、反射光和眩光等对人、动物、植物造成的干扰或负面影响的现象[1],全球的光污染正以每年6%的速度递增[2]。光环境的变化扰乱了动植物正常有序的生物钟节律,可能会影响城市生态系统的平衡。目前光污染的效应研究主要集中在对人的健康,动物种群结构、活动节律和行为等方面[3-4],光照强度、持续时间、光谱组成会引起不同的光污染效应[5-7]。对于植物而言,光源不仅作为植物合成有机碳的能源,还作为环境信号调节着植物的生长发育,现有研究表明,光污染会影响植物的生长发育、物候特征、群落组成[8-11],还会对植物抗逆性反应的敏感性产生负面影响[12-13]。夜间光照破坏了植物暗期的完整性,可能会导致植物生理和代谢的紊乱,然而,目前对光污染条件下植物的生理响应特征研究非常缺乏。
白光LED作为一种新型光源,具有发光效率高、体积小、节约能源等一系列优点,已大量应用于我国室内外照明等领域,已逐步取代白炽灯、荧光灯等传统照明设备,成为节能、环保、智能化照明的代表[14-15]。目前大多白光LED灯是基于单色蓝光LED,涂上一层黄色或黄绿素的磷光剂而成[16]。然而,Falchi等[6]认为光污染的程度主要取决于光源的光谱组成,金属卤素灯和LED灯都能发出蓝光,而蓝光对动物的伤害较大,植物对LED这种新型照明光源的响应与适应研究却非常少。小叶栀子(Gardeniajasminoides)、凤仙花(Impatiensbalsamina)、夏菊(Dendranthemamorifolium)均是城市园林绿化、景观配置的常见花卉,也是日中性植物(小叶栀子[17])和短日照植物(凤仙花[18]和夏菊[19])的典型代表,基于它们对光周期的敏感性差异,提出“凤仙花和夏菊比小叶栀子对光污染在生长及生理特征方面将受到更大的负面影响”的假说。因此,本研究以这3种花卉为研究对象,从开花特征、生物量积累与分配、碳氮比、生理特征等多方面研究这3种植物对夜间LED光照的响应与适应,探究不同光周期敏感类型花卉对夜间光照的响应差异及生理机理。研究结果对于认识园林植物对光污染的响应与适应,提高绿化植物配置的合理性。
1 材料与方法
1.1 实验材料与盆栽实验
2013年10月初,凤仙花、小叶栀子、夏菊购买于成都市温江区花卉市场。将长势基本一致(含高度、冠幅以及主根长度)、健康无病虫害、处于盛花期的小叶栀子和夏菊移栽到30 cm的圆台型花盆,盆栽用土为成都平原冲积土,每盆装8 kg匀质土壤。凤仙花为一年生花卉,于2014年4月份进行播种育苗,所用土壤为上述土壤。在移栽或播种后开始进行夜间光照实验,分为3个处理:CK,不进行外源光照处理;T1处理,从每天的18:00到24:00进行光照处理;T2处理,从每天18:00到次日8:00进行光照处理。光源来自36 W LED路灯,光谱组成如图1,其红光区、绿光区和蓝光区分别占11.75%、83.24%和5.01%(SPEC1000A光谱测试仪)。路灯安装于离地面3 m处,光照强度为140 lx(地面1.5 m处实测,使用仪器为TES-1332A照度计)。每种植物每个处理3次重复,每个重复3株植物。实验地点在四川农业大学成都校区4教B区楼顶,该区域属亚热带季风气候,夏季高温多雨,冬季低温少雨,平均气温15.9 ℃,平均降雨量972 mm,平均相对湿度84%,平均风速1.3 m/s。

图1 LED路灯光谱组成Fig.1 Spectral distribution curve of the LED lamp
1.2 实验方法与数据处理
1.2.1 物候的观察
于开花季节每天观察并记录小叶栀子、凤仙花、夏菊的开花数量,收集凋落的花朵。
1.2.2 生物量测定
小叶栀子和夏菊经10个月处理期、凤仙花经4个月处理期后,于2014年8月初,每个处理随机选择3株植物,将选定植物分为根、茎、叶、花等4部分,经自来水冲洗干净后利用去离子水进行润洗,将所有清洁后的植物器官放入烘箱中,于105 ℃杀青30 min之后调整到70 ℃烘干至恒重并称重,生物总量为这4部分器官干重的总和,根冠比为根生物量与地上部分生物量的比值。
1.2.3 生理指标及C、N元素含量的测定
实验处理结束时,每个处理随机选择3株植物的第3片完全展开的叶片(由上到下)用于叶绿素、超氧化物歧化酶(SOD)、过氧化物酶(POD)、丙二醛(MDA)等生理指标的测定[20]。利用丙酮提取法测定叶绿素及类胡萝卜素含量,四氮唑蓝(NBT)光化还原法测定SOD活性,愈创木酚法测定过氧化物酶(POD)活性,双组分分光光度法测定MDA含量。各指标的测定均重复3次。
在各器官生物量测定结束后,将各部分器官分别磨碎过筛(100目),细粉用于C、N含量测定。分别采用重铬酸钾外加热法和凯氏定氮法测定植物各器官的C和N含量。
1.2.4 数据处理和统计分析
采用SPSS 16.0统计软件对各物种3个处理的数据进行单因素方差分析(one-way ANOVA), 并用Duncan法进行处理间差异显著性检验(α=0.05)。
2 结果与分析
2.1 开花特征
CK条件下,凤仙花于2014年6月5日开始开花,T1处理在实验处理期间没有开花,苗木收获后剩余苗木仍然进行实验处理,发现T1处理于2014年9月5日开始开花,但T2处理条件下凤仙花至2014年年底都未开花。CK条件下的夏菊于2014年6月10开始开花,而T1和T2处理至2014年年底均未开花。3个处理的小叶栀子均在2014年5月下旬开花,花期均持续到2014年6月中下旬。但是,与CK相比,T2处理显著增加了小叶栀子的开花数量(表1),却显著减小了花朵的平均重量(P<0.05)。
2.2 生物量积累与分配
与CK相比,T1和T2处理显著增加了凤仙花叶干重、茎干重、地上部生物量以及总生物量(P<0.05)(表1),T1条件下这些指标分别是CK的2.77、1.37、1.39、1.36倍,T2条件下这些指标分别是CK的3.54、1.92、1.87和1.90倍。但是,T1和T2处理对凤仙花根干重以及根冠比影响均不显著。与CK相比,除花的重量和数量以外,T1和T2处理均没有显著影响小叶栀子各器官的干物质积累、总生物量以及根冠比。与CK相比,T2处理显著增加了夏菊的茎干重(P<0.05),对其它器官的干物质积累、总生物量以及根冠比无显著影响。
2.3 碳氮含量及其比值
如表2所示,与CK相比,T1和T2均没有显著影响凤仙花的叶C含量,但均显著降低了其叶N的含量(P<0.05),导致了叶片中C/N比的显著升高;T1处理均没有显著影响凤仙花的茎C和茎N含量,但T2均显著降低了凤仙花的茎C含量和茎N的含量(P<0.05),因而T1和T2处理均没有显著影响凤仙花茎中的C/N比。与CK相比,T1和T2处理不同程度地降低了小叶栀子的叶C含量,均没有显著影响其叶片的N含量,因此T1和T2处理均显著降低了小叶栀子叶片的C/N比(P<0.05);与叶片相反,T1和T2处理下,小叶栀子的茎C含量没有显著变化,但茎N含量均显著降低,因而T1和T2处理均显著增加了小叶栀子茎的C/N比(P<0.05);T2处理没有显著影响花的C含量,但显著降低了花的N含量(P<0.05),因而T2处理显著增加了小叶栀子花的C/N比。对于夏菊而言,T1处理仅显著降低了夏菊叶片的C含量(P<0.05),而对其N含量没有显著影响,也没有显著影响夏菊叶片的C/N比;此外,T1和T2处理均没有显著影响夏菊茎的C、N含量及其比值。
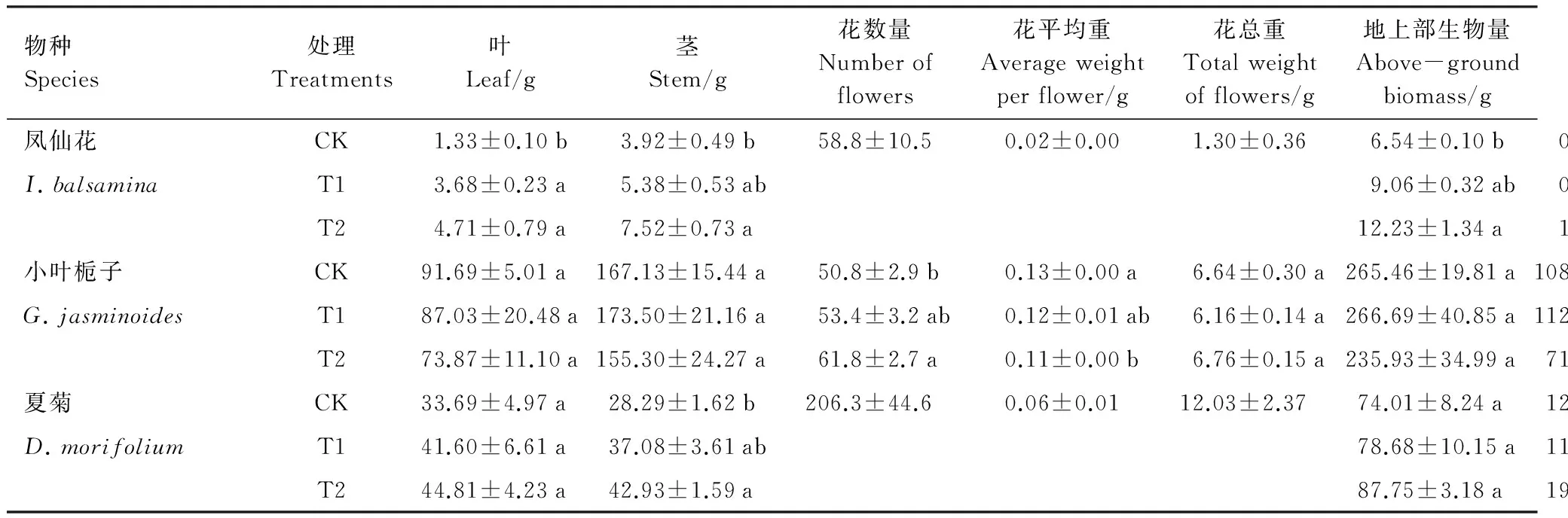
表1 夜间光照处理对3种园林植物生物量积累与分配的影响
每个物种处理间不含相同字母表示处理间差异显著(P<0.05)
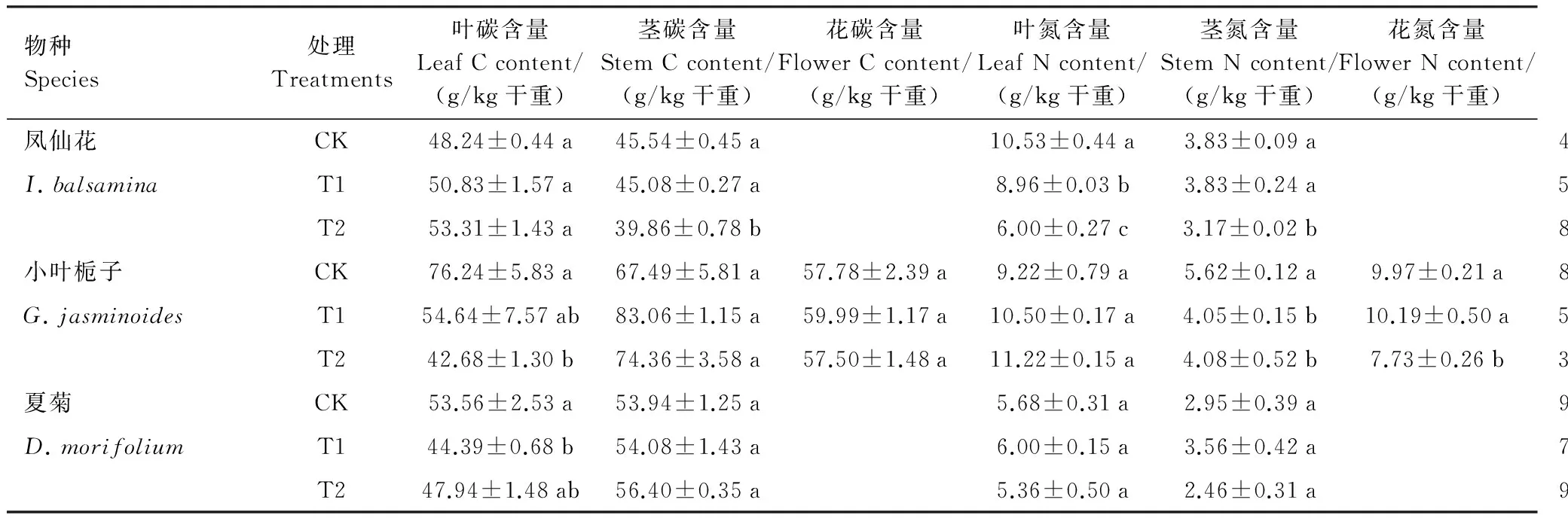
表2 夜间光照处理对3种园林植物地上部分碳和氮含量的影响
2.4 叶绿素含量及其比值
与CK相比,T1处理没有显著影响凤仙花叶绿素a、叶绿素b、类胡萝卜素和总叶绿素含量(表3),但显著增加了叶绿素a与b的比值(P<0.05);T2处理显著降低了凤仙花叶片的叶绿素a、叶绿素b、类胡萝卜素和总叶绿素含量(P<0.05),降低幅度分别为27%、33%、33%和29%。T2处理也显著降低了小叶栀子的叶绿素a、叶绿素b和叶绿素总量(P<0.05)。T1和T2处理均没有显著影响夏菊的各种色素含量及其比值。值得注意的是,T1和T2处理不同程度的增加了凤仙花、小叶栀子和夏菊的叶绿素a/b,也不同程度增加了小叶栀子和夏菊的类胡萝卜素与叶绿素的比值。
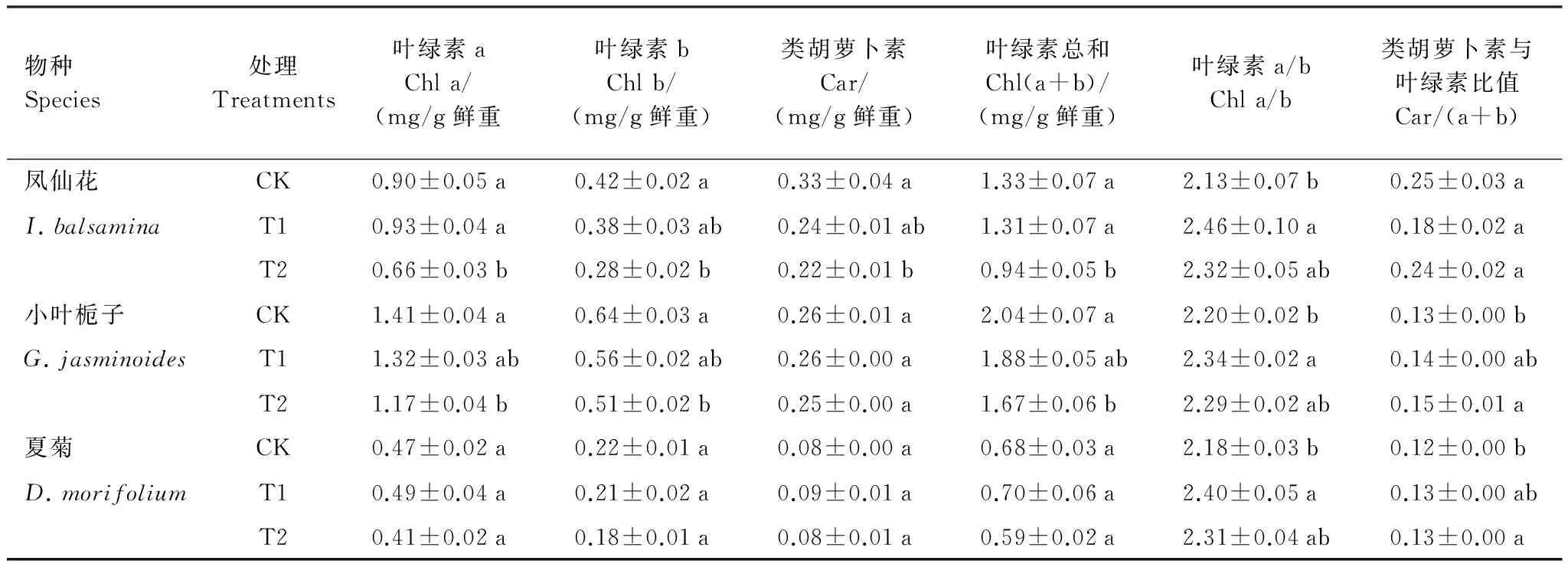
表3 夜间光照处理对3种园林植物地上部分色素含量及其比值的影响
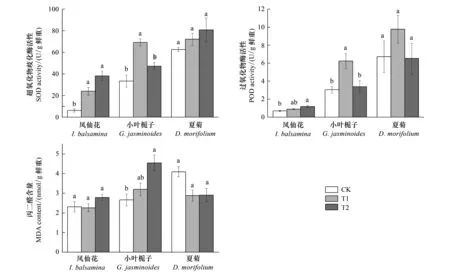
图2 夜间光照处理对3种园林植物抗氧化酶活性及丙二醛含量的影响Fig.2 The effects of night illumination on activity of antioxidant enzymes and malondialdehyde (MDA) content in leaves of three garden plants
2.5 酶活性及伤害指标
如图2所示,与CK相比,T1和T2处理不同程度地增加了凤仙花叶片SOD和POD的活性,其MDA的含量并没有显著改变。T1处理显著增加了小叶栀子叶片SOD和POD的活性,该条件下MDA的含量与CK无显著差异;T2处理条件下,SOD和POD活性与CK无显著差异,MDA的含量却显著上升。对于夏菊而言,T1和T2处理均没有显著影响其叶片的SOD和POD活性,也没有影响叶片中MDA的含量。
3 讨论与结论
本研究发现,夜间光照对凤仙花、小叶栀子以及夏菊生物量的影响存在种间差异,小叶栀子和夏菊的生物量受到的影响小,但凤仙花在夜间光照的条件下生物量增加,T2条件下达显著水平,但3种植物根冠比并没有受到显著影响,表明夜间光照没有影响生物量在地上和地下器官的分配。不同植物生物量对夜间光照的响应差异可能与不同植物对夜间弱光的利用效率相关,凤仙花作为喜光植物,夜间光照延长了凤仙花光合作用的时间,增加了凤仙花光合产物的积累从而增加了其总生物量。陈芳和彭少麟[21]也发现6种城市灌木对夜间人工光照存在敏感性差异,夜间光照增加了大多数植物的叶面积和叶片生物量;Kim等[22]发现22:00—02:00的夜间光照促进了Cymbidium的营养生长,增加了其叶片数、叶片宽度、假鳞茎数及鳞茎的大小。然而,夜间光照不同程度地降低了凤仙花叶片的N含量,增加了C/N比,养分含量的降低可能是因生物量增加而导致的稀释效应,在整个实验处理期间并没有施肥,生物量增加可能引起了凤仙花养分吸收、积累与分配的变化。夜间光照条件下,凤仙花叶片C/N比的增加表明了N素利用效率的提高,张智猛等[23]和Chen等[24]也发现当植物器官中N含量降低时,植物的C/N比通常会增加,N素使用效率会提高。另一方面,夜间光照虽然增加了凤仙花的营养生长,但却显著影响了凤仙花的开花节律,T1处理延迟了凤仙花的花期,T2条件抑制了凤仙花开花,这与其短日照植物的生物学特性相符[18]。此外,夜间光照的两个处理均显著抑制了菊花开花,表明菊花的开花节律比凤仙花对夜间光照更为敏感,夜间光照缩短了暗期的长度,改变了正常的光周期环境,影响了凤仙花和菊花花器官的形成和开放[8]。对于小叶桅子而言,夜间光照显著降低了叶片的C/N比,增加了茎和花的C/N比,说明夜间光照影响了C、N在器官之间的分配和积累,并降低了N素在叶片中的利用效率[25],这可能与T2条件下小叶桅子地上生物量及总生物量略微下降有关。值得注意的是,夜间光照虽然没有显著影响小叶桅子的花期,但夜间光照显著影响了小叶桅子花朵的数量、重量及C/N比,表明夜间光照对小叶桅子生殖生态方面可能产生了潜在的影响,可能会影响植物的繁育特性及其适合度,本研究的小叶桅子是观赏类的不结籽品种,因而没有进一步研究夜间光照对生殖分配的影响。
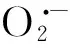
综上所述,夜间光照(尤其是通宵光照)不同程度的影响了凤仙花、小叶桅子、夏菊的形态生长、生物量积累、开花节律以及C、N积累特征,3种植物对夜间光照表现出了不同的适应和响应特征。夜间光照促进了凤仙花的营养生长,导致凤仙花延迟开花或不开花,表现出了“短日照植物”的特征;夏菊的生物量及生理特性受到的影响最小,但夜间光照抑制了开花,证实这种花卉开花受光周期信号的调节最敏感;夜间光照虽然没有影响小叶桅子的开花节律,但显著影响了花朵的数量及质量,其叶片也受到了显著的氧化伤害。由此可见,“凤仙花和夏菊比小叶栀子对光污染在生长及生理特征方面将受到更大的负面影响”的假说是不准确的,凤仙花和夏菊只是在开花节律上对光周期更为敏感,而小叶栀子作为日中性植物虽然开花节律没有受到光污染的影响,但其生理特性及繁育特征可能受着显著的影响。因此,光污染条件下,在园林植物的搭配过程中,不仅需要考虑园林植物对光周期的反应类型,还需要考虑植物对夜间光照的生理适应性,同时需要进行合理的水肥管理,以维持养分平衡。总体来看,持续到半夜的光照处理比通宵光照处理对植物的负面影响较小,在城市照明的管理过程中,可以根据客观需要缩短夜间光照的时间,既可以节约能源,又可以减小对城市生态系统的负面影响。
致谢:徐睿、胡相伟、李俊、谭灵杰等同学帮助实验测试分析,朱鹏副研究员对文章写作给予帮助,特此致谢。
[1] 张式军. 光污染——一种新型的环境污染. 城市问题, 2004, (6): 31-34.
[2] Gaston K J, Davies T W, Bennie J, Hopkins J. Review: reducing the ecological consequences of night-time light-pollution: options and developments. Journal of Applied Ecology, 2012, 49(6): 1256-1266.
[3] Longcore T, Rich C. Ecological light pollution. Frontiers in Ecology and the Environment, 2004, 2(4): 191-198.
[4] Davies T W, Bennie J, Inger R, De Ibarra N H, Gaston K J. Artificial light pollution: are shifting spectral signatures changing the balance of species interactions? Global Change Biology, 2013, 19(5): 1417-1423.
[5] Gerrish G A, Morin J G, Rivers T J, Patrawala Z. Darkness as an ecological resource: the role of light in partitioning the nocturnal niche. Oecologia, 2009, 160(3): 525-536.
[6] Falchi F, Cinzano P, Elvidge C D, Keith D M, Haim A. Limiting the impact of light pollution on human health, environment and stellar visibility. Journal of Environmental Management, 2011, 92(10): 2714-2722.
[7] Solano Lamphar H A, Kocifaj M. Light pollution in ultraviolet and visible spectrum: effect on different visual perceptions. PLoS One, 2013, 8(2): e56563.
[8] Mattson N S, Erwin J E. The impact of photoperiod and irradiance on flowering of several herbaceous ornamentals. Scientia Horticulturae, 2005, 104(3): 275-292.
[9] Hölker F, Wolter C, Perkin E K, Tockner K. Light pollution as a biodiversity threat. Trends in Ecology & Evolution, 2010, 25(12): 681-682.
[10] Brouwer B, Ziolkowska A, Bagard M, Keech O, Gardeström P. The impact of light intensity on shade-induced leaf senescence. Plant, Cell & Environment, 2012, 35(6): 1084-1098.
[11] Sarala M, Tahkokorpi M, Niinimaa A, Laine K, Taulavuori E, Taulavuori K. Street lamp light does not delay autumnal leaf colouration ofBetulapendula. Trees, 2013, 27(4): 1193-1199.
[12] Futsaether C M, Vollsnes A V, Kruse O M O, Otterholt E, Kvaal K, Eriksen A B. Effects of the Nordic photoperiod on ozone sensitivity and repair in different clover species studied using infrared imaging. AMBIO: A Journal of the Human Environment, 2009, 38(8): 437-443.
[13] Vollsnes A V, Eriksen A B, Otterholt E, Kvaal K, Oxaal U, Futsaether C M. Visible foliar injury and infrared imaging show that daylength affects short-term recovery after ozone stress inTrifoliumsubterraneum. Journal of Experimental Botany, 2009, 60(13): 3677-3686.
[14] 李雯雯. 白光LED应用于植物景观照明——以北方乔木为例[D]. 天津: 天津大学, 2011.
[15] Oh J H, Yang S J, Do Y R. Healthy, natural, efficient and tunable lighting: four-package white LEDs for optimizing the circadian effect, color quality and vision performance. Light: Science & Applications, 2014, 3(2): e141.
[16] Pawson S M, Bader M K F. LED lighting increases the ecological impact of light pollution irrespective of color temperature. Ecological Applications, 2014, 24(7): 1561-1568.
[17] Makridou E P, Economou A S, Bodson M, Verhoyen M N J. Flower initiation and development inGardeniaplants as affected by photoperiod and night temperature. Acta Horticulturae, 2000, 515: 99-103.
[18] Nanda K K, Krishnamoorthy H N. Photoperiodic studies on growth and development ofImpatiensbalsaminaL. Planta, 1967, 72(4): 338-343.
[19] De Moura F B, Da Silva Vieira M R, Júnior W S E, Da Silva L F, De Oliveira R H, Da Rocha A T, Da Costa F B. Cultivars, conduction, photoperiodic and quality chrysanthemum in Brazil. Journal of Horticulture and Forestry, 2014, 6(6): 53-57.
[20] Chen L H, Han Y, Jiang H, Korpelainen H, Li C Y. Nitrogen nutrient status induces sexual differences in responses to cadmium inPopulusyunnanensis. Journal of Experimental Botany, 2011, 62(14): 5037-5050.
[21] 陈芳, 彭少麟. 城市夜晚光污染对行道树的影响. 生态环境学报, 2013, 22(7): 1193-1198.
[22] Kim Y J, Lee H J, Kim K S. Night interruption promotes vegetative growth and flowering ofCymbidium. Scientia Horticulturae, 2011, 130(4): 887-893.
[23] 张智猛, 万书波, 宁堂原, 戴良香. 氮素水平对花生氮素代谢及相关酶活性的影响. 植物生态学报, 2008, 32(6): 1407-1416.
[24] Chen L H, Dong T F, Duan B L. Sex-specific carbon and nitrogen partitioning under N deposition inPopuluscathayana. Trees, 2014, 28(3): 793-806.
[25] 郭子武, 陈双林, 杨清平, 李迎春. 密度对四季竹叶片C、N、P化学计量和养分重吸收特征的影响. 应用生态学报, 2013, 24(4): 893-899.
[26] 曾小平, 赵平, 蔡锡安, 饶兴权, 刘惠, 马玲, 李长洪. 25种南亚热带植物耐阴性的初步研究. 北京林业大学学报, 2006, 28(4): 88-95.
[27] 王建华, 任士福, 史宝胜, 刘炳响, 周玉丽. 遮荫对连翘光合特性和叶绿素荧光参数的影响. 生态学报, 2011, 31(7): 1811-1817.
[28] 潘瑞炽, 王小菁, 李娘辉. 植物生理学(第四版). 北京: 高等教育出版社, 2002: 252-253.
[29] Edge R, McGarvey D J, Truscott T G. The carotenoids as anti-oxidants—a review. Journal of Photochemistry and Photobiology B: Biology, 1997, 41(3): 189-200.
[30] Chen L H, Hu X W, Yang W Q, Xu Z F, Zhang D J, Gao S. The effects of arbuscular mycorrhizal fungi on sex-specific responses to Pb pollution inPopuluscathayana. Ecotoxicology and Environmental Safety, 2015, 113: 460-468.
[31] De Temmerman L, Vandermeiren K, D′Haese D, Bortier K, Asard H, Ceulemans R. Ozone effects on trees, where uptake and detoxification meet. Dendrobiology, 2002, 47: 9-19.
[32] Gaston K J, Bennie J, Davies T W, Hopkins J. The ecological impacts of nighttime light pollution: a mechanistic appraisal. Biological Reviews, 2013, 88(4): 912-927.
[33] Queval G, Issakidis-Bourguet E, Hoeberichts F A, Vandorpe M, Gakière B, Vanacker H, Miginiac-Maslow M, Van Breusegem F, Noctor G. Conditional oxidative stress responses in the Arabidopsis photorespiratory mutantcat2 demonstrate that redox state is a key modulator of daylength-dependent gene expression, and define photoperiod as a crucial factor in the regulation of H2O2-induced cell death. The Plant Journal, 2007, 52(4): 640-657.
Responses and adaptive status of three garden plants exposed to night illumination
CHEN Lianghua1, 2, CAO Yi1, YANG Wanqin1, 2,*, ZHANG Jian1, 2, HE Shuhui1
1KeyLaboratoryofEcologicalForestryEngineeringofSichuanProvince,InstituteofEcology&Forestry,SichuanAgriculturalUniversity,Chengdu611130,China2CollaborativeInnovationCenterofEcologicalSecurityintheUpperReachesofYangtzeRiver,SichuanAgriculturalUniversity,Chengdu611130,China
Light pollution is one of the most serious pollutants in urban ecosystems. Existing research in this field has mainly focused on the effects of light pollution on human health, life cycles, and behavior and actions of insects or other animals, whereas information regarding its effects on the physiology and ecology of plants is lacking. We usedImpatiensbalsamina,Gardeniajasminoides, andDendranthemamorifoliumto document biomass accumulation and allocation, blossoming, pigmentation, C and N content (and C/N ratio), and activities of antioxidant enzymes in response to night illumination produced by a white LED from 18:00 to 24:00 (T1 treatment), from 18:00 to 08:00 the following day (T2 treatment), and natural photoperiod (control; CK). The main results were as follows: (1) Compared to CK, T1 and T2 increased the biomass ofI.balsaminaby 1.4 and 1.9 times, respectively, and the C/N ratio in leaves by 1.2 and 1.9 times, respectively, but decreased the N content in leaves and stems, and content of pigments in leaves. The T1 treatment delayed florescence, and the T2 treatment inhibited flowering. (2) Although neither T1 nor T2 affected the florescence ofG.jasminoides, night illumination increased the average number of flowers and decreased average weight per flower. Compared to CK, T2 significantly increased the C/N ratio in flowers and content of malondialdehyde (MDA), although it decreased chlorophyll a, b, and total chlorophyll content in leaves. (3) Biomass and physiological traits were not obviously affected inD.morifolium. However, both T1 and T2 inhibited flowering. These results indicated that flowering of bothI.balsaminaandD.morifoliumwere sensitive to the altered photoperiodism induced by nighttime illumination. In addition, growth and nutrient status ofI.balsaminawas negatively affected by nighttime illumination, and there was a detrimental effect on the leaves ofG.jasminoides. Generally, when compared to T2, the T1 treatment exerted fewer negative impacts on the three species. Therefore, in urban light management, we should shorten the duration of illumination to the degree it is practical. This will not only save electric energy, but also lessen the negative influence on the physiology and ecology of garden plants.
light pollution; night illumination; white LED; photoperiodism
国家自然科学基金资助项目(31300513);国家“十二五”科技支撑计划课题资助项目(2011BAC09B05)
2015-08-26;
2016-12-02
10.5846/stxb201508261778
* 通讯作者Corresponding author.E-mail: scyangwq@163.com
陈良华, 曹艺, 杨万勤, 张健, 何书惠.三种园林植物对夜间光照的响应与适应特征.生态学报,2017,37(2):549-556.
Chen L H, Cao Y, Yang W Q, Zhang J, He S H.Responses and adaptive status of three garden plants exposed to night illumination.Acta Ecologica Sinica,2017,37(2):549-556.
