土壤水分梯度对灰胡杨光合作用与抗逆性的影响
2017-02-08王海珍徐雅丽牛建龙
王海珍,韩 路,徐雅丽,牛建龙,于 军
新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,塔里木大学植物科学学院, 阿拉尔 843300
土壤水分梯度对灰胡杨光合作用与抗逆性的影响
王海珍*,韩 路,徐雅丽,牛建龙,于 军
新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,塔里木大学植物科学学院, 阿拉尔 843300
以塔里木盆地珍稀渐危种灰胡杨(PopuluspruinosaSchrenk)幼苗为材料,采用盆栽方法研究土壤水分梯度对灰胡杨光合特征及抗逆性的影响。结果表明:(1) 灰胡杨净光合速率(Pn)、蒸腾速率、气孔导度、胞间CO2浓度和光能利用率均随土壤水分递减而降低,重度干旱比适宜水分依次降低了35.53%、25.32%、48.18%、15.62%和40.92%;而光合午休程度则明显增强,Pn下降主要是由非气孔因素限制造成。轻度干旱能够提高灰胡杨水分利用效率(WUE)3.05%,维持相对较高的Pn和WUE。(2) 随土壤水分递降,灰胡杨光照生态幅缩窄,CO2补偿点升高,RuBP再生受限,光与CO2利用效率、Rubisco活性和光合效率降低。与适宜水分相比,中度与重度干旱下最大净光合速率(Pnmax)、表观量子效率、光饱和点、羧化效率、光合能力(Amax)、光呼吸速率、最大羧化效率、最大电子传递速率和磷酸丙糖利用率均显著降低(P<0.05),其中Pnmax、Amax和生化参数分别降低了42.65%、38.26%、57.10%;63.01%、65.88%、73.43%。(3) 土壤干旱显著降低了灰胡杨的枝水势和光合色素含量(P<0.01),并且改变了光系统反应中心色素的组成比例,膜脂过氧化程度显著增强(P<0.01)。灰胡杨主要通过积累大量脯氨酸和可溶性蛋白质参与渗透调节来减轻土壤干旱对光合机构的损伤。重度干旱对灰胡杨叶片光合系统造成了不可逆的伤害,严重抑制了其正常生长和光合作用。综上所述,塔里木干旱荒漠区灰胡杨生长适宜的土壤相对含水量为60%─65%,符合极端干旱区植被恢复与高效节水的管理原则。
灰胡杨;土壤水分梯度;气体交换;光合响应参数;渗透调节物质
随着全球气候变迁、干旱发生频繁,水分短缺已成为干旱区限制植物生长发育与分布的关键因素[1]。塔里木盆地地处欧亚大陆腹地,是我国典型的干旱荒漠区,沿塔里木河上游两岸呈走廊状分布着大片的天然灰胡杨林,是流域植被自然演替进程中近顶级的天然乔木群落。灰胡杨(PopuluspruinosaSchrenk)是杨柳科(Salicaceae)杨属(Populus)中最古老、最原始的荒漠河岸林树种,为我国首批确定的388种珍稀渐危种[2],其已成为抵御风沙、遏制沙化、维护区域生态平衡、保护生物多样性和保障绿洲农牧业生产的重要屏障。自从20世纪50年代以来,受区域人口增长和经济发展的驱使,大规模水土资源开发,致使塔里木河改道断流、地下水位和土壤水分大幅下降,导致塔里木河沿岸植被衰败、生物多样性锐减、灰胡杨种群数量正在迅速减少,甚至出现了大面积死亡。土壤水分是影响植物光合作用、水分代谢及物质转运等光合生理过程的重要生态因子,水分胁迫下光合效率显著降低、生长受抑[3]。土壤水分到底是怎样影响灰胡杨的生长与生理生态过程及生理机制,已成为当前迫切需要解决的问题。目前,国内外学者针对胡杨光合、水分与抗逆生理及生态适应机制等方面开展了广泛研究[4-10],而关于土壤水分梯度对灰胡杨光合生理与抗逆性的影响及光合生理参数与土壤水分的定量关系、响应机制尚未见报道。本文以塔里木河上游灰胡杨幼苗为试材,采用人工控制试验模拟灰胡杨生境系列水分条件,研究不同土壤水分梯度下灰胡杨的光合特征与抗逆性能,探讨其光合特性对土壤水分梯度的响应规律和抵御干旱的生态对策,试图阐明灰胡杨适应干旱荒漠环境的生理机制与生长适宜的水分条件,以期为塔里木荒漠区灰胡杨林的水分管理与种群恢复保护、更新复壮及改善日趋恶化的生态环境提供理论依据。
1 材料与方法
1.1 试验区概况
试验在塔里木大学农业试验站进行。该站位于塔克拉玛干沙漠北缘、塔里木河上游(40°35′N,80°50′E;海拔1 006 m)的阿拉尔垦区,属典型暖温带大陆性干燥气候。区内光热资源丰富,昼夜温差大。年日照时数2 750─3 029 h,年太阳总辐射达5.89×105J/cm2,≥0 ℃的有效积温为4 132.7 ℃,平均气温≥10 ℃的持续日数为201 d,年平均降雨量<50 mm,年平均蒸发量>2 500 mm;风沙灾害频繁,春、夏季多大风天气,是该地区风沙危害的主要季节。灰胡杨主要集中分布于塔里木河上游两岸,呈阶梯状分布着幼龄林、中龄林、成熟林和过熟林,且距离河岸越远其幼龄所占比例越低。生长季(4─10月)对离河岸不同距离的灰胡杨林下0─100 cm土壤水分测定,河岸幼龄林下1 m土壤含水量为19.41%─25.71%,随远离河岸逐渐降低,依次为13.28%─17.32%、8.76%─12.62%、4.05%─7.07%,至稀疏衰败林土壤含水量为0.65%─2.37%。
1.2 试验设计
试验材料为塔里木盆地荒漠优势树种——灰胡杨的2年生幼苗,株高75─85 cm、地径0.5─0.8 cm。盆栽直径28 cm、高30 cm,盆土为林地土壤,盆中装等量过筛棕钙土(含水量0.84%)15 kg。土壤容重1.33 g/cm3、土壤有机质1.201%、全氮0.057%、全磷0.089%、pH 8.35、总盐量0.137%、田间持水量(θf)24.43%。
试验在塔里木大学农业试验站自制人工防雨棚中进行,选择大小基本一致的苗木于3月下旬植入塑料桶中。模拟灰胡杨自然生境土壤水分设计系列土壤水分梯度:①适宜水分(H1,75%—80%θf),土壤含水量(θt)为18.32%—19.54%;②轻度干旱(H2,60%—65%θf),θt为14.66%—15.88%;③中度干旱(H3,45%—50%θf),θt为10.99%—12.21%;④重度干旱(H4,30%—35%θf),θt为7.33%—8.55%。采用随机区组设计,不同水分处理均设6次重复,每桶3株苗,并设置对照。各水分处理置于相同光照条件下,阴雨天用防雨棚遮挡。苗木栽植后浇水使之正常萌发与生长,然后按试验设计进行土壤水分梯度处理。
1.3 测定方法与指标
1.3.1 土壤水分参数测定与控制
盆栽土壤含水量用烘干法测定,田间持水量用环刀法测定。根据田间持水量(θf)与占θf%计算出系列土壤水分梯度下的土壤含水量(θt),然后根据盆栽土壤含水量与装盆土壤重量(15 kg)及θt、盆重、苗重计算出各土壤水分梯度的盆栽重量控制试验范围。各盆边缘均直立一根塑料管,用于将补充的水分直接灌入盆底,以防止表面补水快速蒸发而影响试验精度。6月1日之前缓苗期均充分灌溉,保证苗木正常生长;之后按设计的4种水分梯度控制试验,每天20:00利用电子称称量测盆重量,根据连续2次称重的差值以及控水上限计算补水量,用固定容器补充水分以控制土壤水分在设定范围内。
1.3.2 气体交换参数测定
8月中旬选择晴朗天气于8:00—20:00用Li-6400型便携式光合仪(Li-COR,USA)测定盆栽苗木成熟叶的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)等指标及光合有效辐射(PAR)、大气CO2浓度(Ca)、气温(Tair)、叶温(TLeaf)、空气相对湿度(RH)、叶片内外水汽压差(VPD)等微气象参数。每处理测定3株,每株测定新梢上标记好的2片位置相同的成熟叶。试验中为减少测定时间造成的误差,各处理先只测1盆,全部处理测定完成后再测第2盆(第2重复),依次循环进行。叶片水平的瞬时水分利用效率WUE=Pn/Tr;光能利用率LUE=Pn/PAR。气孔限制值(Ls)=1-Ci/Ca[11]。
1.3.3 光响应曲线的测定
自然光诱导1—1.5 h后,于北京时间9:30—13:00采用开放式气路,设定温度为25℃、大气CO2浓度为(370±5) μmol/mol,应用Li-6400 红蓝光光源提供不同的光合有效辐射(PAR),梯度设置为3000、2800、2500、2000、1500、1000、500、200、100、50、20和0 μmol m-2s-1,分别测定灰胡杨成熟叶Pn(μmol m-2s-1),然后用直角双曲线修正模型[12]拟合所测定的光响应曲线,得出最大净光合速率(Pnmax)、表观量子效率(AQY)、暗呼吸速率(Rd)、光补偿点(LCP)和光饱和点(LSP)等参数。
1.3.4 CO2响应曲线的测定
选取与测定光响应相同部位的叶片,控制条件与光响应相同,应用Li-6400液化CO2钢瓶提供不同的CO2浓度,分别在CO2浓度为2 000、1800、1600、1300、1000、800、600、400、200、150、100、50和0 μmol·mol-1的条件下,测定光合有效辐射(PAR)为1500 μmol m-2s-1时灰胡杨成熟叶Pn(μmol m-2s-1),然后用直角双曲线修正模型[12]拟合所测定的CO2响应曲线,得出光合能力(Amax)、羧化效率(CE)、光呼吸速率(Rp)、CO2补偿点(Γ)和饱和点(CSP)。为了给出灰胡杨成熟叶的生化参数,我们借助光合助手拟合CO2响应曲线,得到最大羧化速率(Vcmax)、最大电子传递速率(Jmax)和磷酸丙糖利用效率(TPU)。
1.3.5 小枝水势、叶绿素、可溶性糖、可溶性蛋白质、游离脯氨酸及丙二醛含量测定
混合式教学不同于混合式学习,混合式教学是从教师的主导地位出发,借助网络技术手段帮助学生提高教学效率[1]。混合式教学改变了以往以板书讲授为主的传统的授课方式,利用发达的网络将教学与网络相结合,通过线上教学以及在线学习的支持,使得教学方式迎来了转变,教学效果获得提升。现今正在提倡教师和学习者的双主体地位教学[2],如何将混合式教学更好地应用到中小学中成为众多学者研究的热点。本文借助于可视化的研究软件CiteSpace分析2007-2017年知网收录的混合式教学和中小学相关的研究文献,分析研究的趋势和热点[3],并对代表作者、机构之间的联系进行可视化研究。
8月于9:00—11:00从各水分处理的灰胡杨幼苗中,选择粗细大小基本一致的当年新萌枝进行水势测定, 重复3次。测定仪器为植物压力室(SKPM 1400,UK)。
8月采集各水分处理幼苗相同部位的叶片带回实验室,叶绿素含量用80%丙酮浸提、分光光度计测定[13];游离脯氨酸(Pro)、可溶性糖(SS)、可溶性蛋白质(SP)含量分别采用磺基水杨酸提取酸性茚三酮显色法、硫酸-蒽酮比色法、考马斯亮蓝G-250染色法[13];丙二醛(MDA)含量采用硫代巴比妥酸(TBA)比色法测定[13]。
1.3.6 数据分析
用SAS 6.12进行方差分析,多重比较采用DUNCAN法。
2 结果与分析
2.1 土壤水分梯度对灰胡杨光合作用日进程的影响
土壤水分梯度下灰胡杨Pn、Tr、Gs日变化趋势一致,均呈“单峰”型(图1)。一天中Pn、Tr、Gs均从8:00逐渐上升,分别于12:00─14:00、12:00和10:00时达到峰值,之后逐渐降低,Gs峰值出现时间明显早于Pn、Tr。与Pn、Tr、Gs日变化趋势不同,Ci日变化呈典型的“V”字型,呈现出早晚高、午间低的变化趋势。土壤水分明显影响了灰胡杨Pn、Tr、Gs和Ci,随土壤水分降低Pn、Tr、Gs、Ci值均降低。H3和H4下灰胡杨Pn峰值明显提早于H1、H22 h,峰值比H1分别降低17.53%和30.73%。各水分处理下的Pn、Tr、Gs、Ci日均值依次为H4
2.2 土壤水分梯度对灰胡杨光合作用-光响应参数的影响
植物光合作用-光响应曲线可表征植物对环境资源的利用能力。图2可见,在低光合有效辐射(PAR<200 μmol m-2s-1),土壤水分梯度下灰胡杨Pn随着PAR的增加近似呈线性增加;而后随PAR增加Pn呈曲线式缓慢升高,当PAR上升到一定数值(接近LSP),曲线则渐趋平缓后降低。不同土壤水分处理灰胡杨Pn对PAR的响应不同,H1与H2处理Pn稳定在较高水平且随PAR增大的变化不大,而H3与H4处理Pn表现出随PAR增大而明显下降趋势;同一PAR下随土壤水分降低,Pn降幅增大。利用直角双曲线修正模型拟合土壤水分梯度下灰胡杨光合作用的光响应曲线并计算出相应参数(表1)。不同土壤水分处理灰胡杨LSP、AQY和Pnmax差异显著(P<0.05)。随土壤水分降低,H2、H3、H4Pnmax与LSP、AQY分别比H1下降了24.69%、42.65%、63.01%; 11.83%、32.72%、48.56%;4.92%、8.20%、18.03%。尽管LCP、Rd在不同水分处理下差异不显著,但均明显降

图1 土壤水分梯度对灰胡杨气体交换特性的影响Fig.1 Effects of soil water gradients on gas exchange characteristics of P.pruinosa

图2 土壤水分梯度对灰胡杨叶片光合作用——光响应曲线与CO2响应曲线的影响Fig.2 Effects of soil water gradients on light and CO2 response curves of P.pruinosa
低,H2、H3、H4LCP分别比H1下降了46.13%、47.15%、57.31%。统计分析表明,干旱荒漠区灰胡杨Pnmax与LSP、AQY、LCP呈显著正相关(P<0.05),与Rd呈不显著的正相关(P>0.05)(图3)。
利用直角双曲线修正模型拟合土壤水分梯度下灰胡杨光合作用—CO2响应曲线(图2B)、特征参数(表2)和运用Farquhar等[14]生化模型拟合CO2响应曲线得到的生化参数(表2)。由图2B可见,土壤水分梯度下灰胡杨Pn对Ci的响应趋势相似,低Ci时(Ci<200 μmol·mol-1)Pn随Ci增加近似呈直线增加,之后Pn随Ci增大速率逐渐减缓。当Ci上升到一定的数值时,Pn曲线则渐趋平缓后降低。不同土壤水分处理灰胡杨Pn对Ci的响应不同,相同CO2浓度下随土壤水分降低,Pn降幅增大,表明灰胡杨RuBP羧化酶活性与碳同化能力随土壤水分减少而降低。表2可见,不同土壤水分处理显著影响了灰胡杨CO2响应参数(CE、Amax、Rp、Vcmax、Jmax、TPU) (P<0.05),但对CSP、Γ和Jmax/Vcmax影响不显著(P>0.05)。随土壤水分降低,CE、Amax、Rp、Vcmax、Jmax和TPU均显著降低,相反Γ则明显增大。其中CE、Vcmax和Jmax降幅较大,H2、H3、H4比H1分别降低了31.38%、69.65%、75.64%;33.07%、66.39%、73.74%;13.75%、64.51%、80.81%,表明重度干旱严重影响了灰胡杨的碳同化效率、电子传递速率和磷酸丙糖利用效率,导致其光合生理功能减弱、Amax极显著降低。统计分析表明,灰胡杨Amax与CE、CSP、Rp、Vcmax、Jmax、TPU、Jmax/Vcmax均呈显著正相关(P<0.05),但与Γ呈显著负相关(P<0.05),其中Amax与TPU、Jmax的相关系数最大(r=0.9996*、0.9871*)。

表1 土壤水分梯度对灰胡杨幼苗光合作用—光响应参数的影响(平均值±标准差,n =3)
AQY: 表观量子效率 Aapparent quantum efficiency;Pnmax: 最大净光合速率 Maximum net photosynthetic rate; LSP:光饱和点 Light saturation point; LCP:光补偿点 Light compensation point;Rd: 暗呼吸速率 Dark respiration rate;R2: 决定系数 Determination coefficient; H1:适宜水分 Normal soil water;H2:轻度干旱 Light drought;H3:中度干旱 Moderate drought;H4:重度干旱 Severe drought; 同一列中,不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)
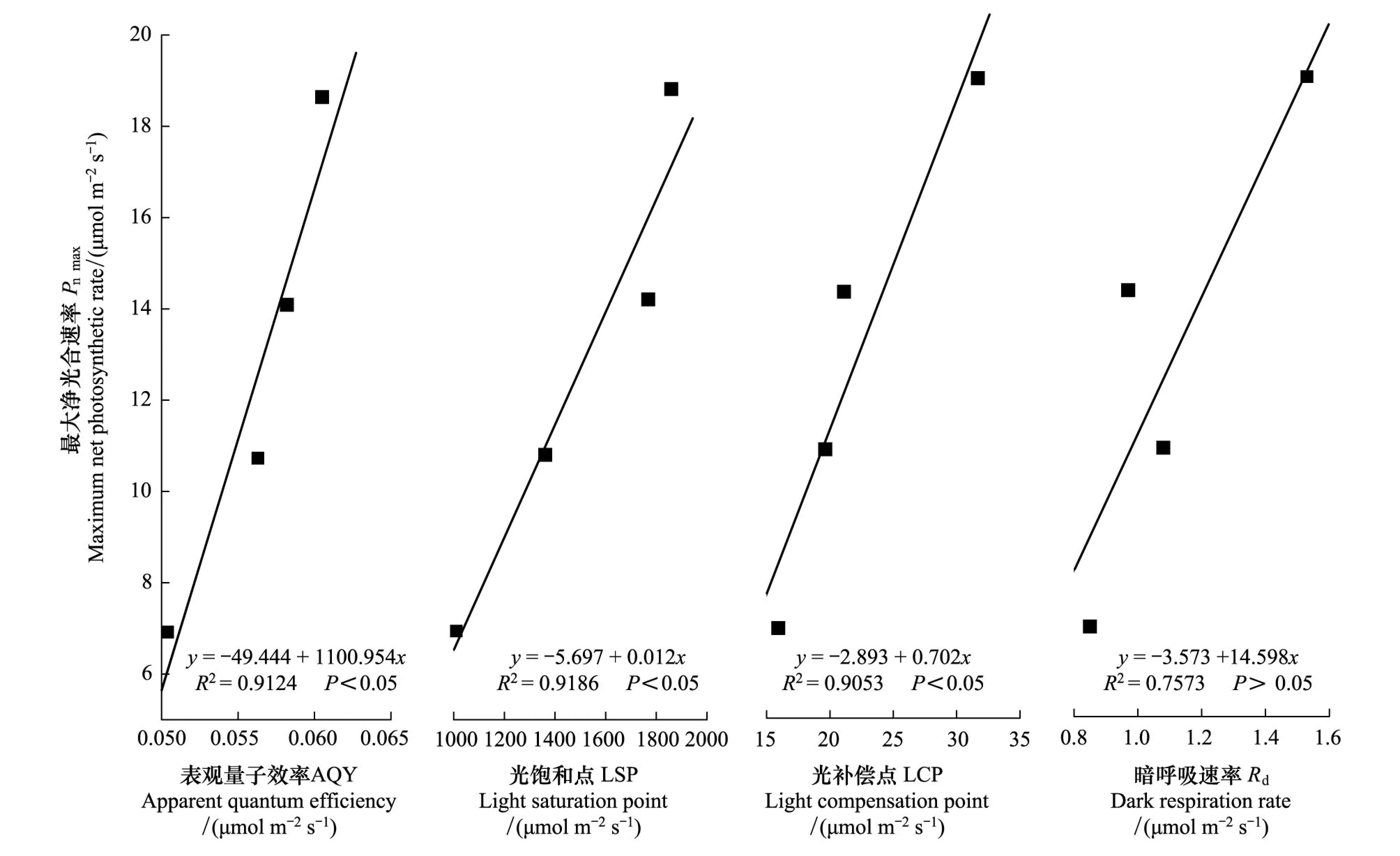
图3 灰胡杨幼苗光合作用——光响应参数间的相关分析(平均值±标准差,n =3)Fig.3 Relationships among light response parameters in P.pruinosa (mean± SD,n =3)

处理TreatmentCE/(molm-2s-1)CSP/(μmol/mol)Amax/(μmolm-2s-1)Γ/(μmol/mol)Rp/(μmolm-2s-1)Vcmax/(μmolm-2s-1)Jmax/(μmolm-2s-1)TPU/(μmolm-2s-1)Jmax/VcmaxH10.213±0.017Aa1176.86±14.63a39.89±2.01Aa62.34±3.11a12.05±0.15Aa116.25±2.15Aa161.23±6.98a14.97±0.61Aa10.73±0.41aH20.146±0.015Ab1067.38±13.49a35.25±1.73Aa74.65±3.31a9.22±0.38Bb77.81±2.97Bb139.06±5.25a12.94±0.45Aa10.85±0.46aH30.065±0.010Bc1005.34±18.62a24.63±1.27Bb85.37±4.16a5.21±0.17Cc39.07±1.81Cc57.23±2.91b8.92±0.71Bb6.54±0.35aH40.052±0.010Bc972.65±11.29a13.61±0.65Cc91.48±4.43a4.11±0.21Cc30.52±1.94Cc30.95±1.81b5.13±0.59Cc6.24±0.32a
CE: 羧化效率 Carboxylation efficiency;CSP:CO2饱和点 CO2saturation point;Amax:光合能力 Photosynthetic capacity;Γ:CO2补偿点 CO2compensation point;Rp:光呼吸速率 Photorespiratory rate;Vcmax:最大羧化速率 Maximum carboxylation rate;Jmax:最大电子传递速率 Maximum electron transport rate;TPU:磷酸丙糖利用率 Triose-phosphate utilization rate
2.4 土壤水分梯度对灰胡杨光合色素含量的影响
表3可见,灰胡杨叶绿素a(chla)、叶绿素b(Chlb)、类胡萝卜素(Car)含量及其比值均随土壤水分减少而降低,H3、H4处理显著影响灰胡杨光合色素含量,各指标降幅均较大,其中chla降幅高达77.50%。灰胡杨Chla、Chlb、Car、Chl(a+b)和Chla/b在H1、H2间无显著差异(P>0.05),但H1、H2的Chla、Chlb、Car、Chl(a+b)均与H3、H4差异显著(P<0.05),H3与H4差异也显著(P<0.05)。表明中度与重度干旱下灰胡杨光合色素合成受阻或降解增多,叶绿体受到一定程度损伤。同时,H2、H3、H4灰胡杨Chla含量降幅(11.74%、33.83%、77.50%)均高于Chlb(8.15%、21.28%、49.82%),即Chlb含量相对稳定,表明灰胡杨光系统反应中心比捕光天线系统更易受土壤水分亏缺的影响,这是导致其光合能力与LUE降低的原因之一。

表3 土壤水分梯度对灰胡杨幼苗叶片光合色素含量的影响(平均值±标准偏差,n=5)
2.5 土壤水分梯度对灰胡杨枝水势、渗透调节物质与丙二醛含量的影响
图4可见,不同土壤水分对灰胡杨小枝水势(Ψp)产生极显著的影响(P<0.01),H1Ψp最高(-1.14 MPa)。随土壤水分下降,Ψp逐渐降低,H3、H4降至-1.65 MPa、-2.24 MPa,分别比H1降低了44.74%、96.05%。随土壤水分降低,灰胡杨叶片中可溶性糖(SS)、游离脯氨酸(Pro)、可溶性蛋白质(SP)和丙二醛(MDA)含量均显著增加(图5),各生理指标增幅不同。H1与H2处理SS、Pro、SP和MDA含量均未达显著差异(P>0.05),表明轻度干旱未明显影响灰胡杨正常生理功能。但随着干旱加剧,SS、Pro、SP和MDA含量显著升高。SS和SP在H3、H4与H1间差异显著(P<0.05),H3、H4的SS、SP分别比H1增长了65.87%、70.29%和96.77%、130.98%。H3、H4的Pro和MDA含量均与H1、H2差异达极显著水平(P<0.01),且H3与H4间差异也极显著(P<0.01)。H3、H4的Pro和MDA含量分别比H1升高了46.74%、252.64%和139.88%、189.42%。3种渗透调节物质中SP和Pro含量增幅最大,表明Pro和SP是灰胡杨抵御土壤干旱的主要渗透调节物质。同时,H4处理下MDA增幅是H1的2.89倍,表明重度干旱下活性氧引起光合色素严重降解(表3)和膜脂过氧化,光合机构膜系统遭到损伤。
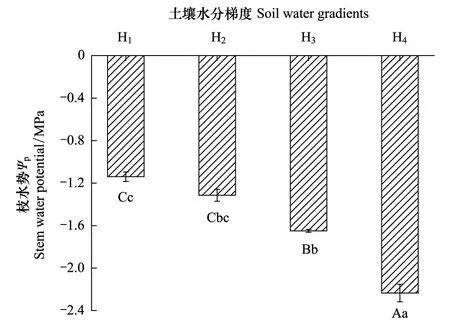
图4 土壤水分梯度对灰胡杨小枝水势(Ψp) 的影响(平均值±标准偏差,n =3)Fig.4 Effects of soil water gradients on stem water potential (Ψp) of P.pruinosa (mean ± SD,n =3)不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)

图5 土壤水分梯度对灰胡杨叶片SS、Pro、SP和MDA含量的影响(平均值±标准偏差,n =3)Fig.5 Effects of soil water gradients on free proline, soluble sugar, soluble protein and malondialdehyde contents of P.pruinosa leaves (mean ± SD,n =3)
3 结论与讨论
灰胡杨作为塔里木河流域生态关键种之一,主要分布于塔里木河流域的上游区域,在水分梯度上形成有规律的分异格局,且中下游基本已失去了踪影。因此,探讨灰胡杨适应极端干旱荒漠环境的生理生态机制和生存条件对保护珍稀渐危物种和促进区域生态恢复具有重要的意义。
光合作用是植物有机物质积累、生长发育的基础,受植物本身生理特性和环境因素的共同影响, 其中土壤水分是影响光合生理过程的重要因素[15]。在水分条件较好时(H1),灰胡杨能充分利用各种环境资源,保持高光合效率;随土壤水分降低,灰胡杨Pn、Tr、Gs、Ci和LUE均降低,水分条件越差,光合参数则降幅越大,但降幅Gs>Pn>Tr>Ci,表明随土壤水分下降,灰胡杨通过自我调节降低Gs并相应降低枝水势(图4)从而降低Tr,以减少体内水分散失来应对土壤干旱,但同时也限制了CO2的吸收,导致Ci、Pn与LUE降低。同时,光合“午休”程度随土壤水分递减而加剧,中度与重度干旱下表现尤为明显,这是灰胡杨在长期进化过程中形成的一种自我保护方式。通过补光色素复合体LHCII的可逆性脱离,导致光合系统的反应速度降低与光合效率下降及减少水分损失,使其在低水强光环境下避免受到损伤以求得继续生存[16-17]。WUE在一定程度上衡量或评价植物对环境水分状况变化的适应能力和能量的转换效率[18]。轻度干旱下灰胡杨WUE有所提高,因为当土壤水分减少时,气孔通过关闭来降低水分散失并使通过气孔进入叶片的CO2减少、引起Ci下降,致使Tr(25.32%)大于Pn降幅(10.42%),从而提高WUE。这与李志军等[19]、Rouhi等[20]研究结果一致,但与李菊艳等[21]报道胡杨在70%—80%田间持水量下WUE最高不同,这是不同物种光合特性与生态适应性存在差异所致。但随土壤水分降低(H3、H4),灰胡杨Pn大于Tr降幅(图1)致使WUE随之降低。可见,轻度干旱灰胡杨采取了降低Gs和Tr,牺牲部分光合生产能力以提高WUE来抵御干旱逆境。
干旱、高温、强光、CO2及O3浓度升高等环境胁迫均能影响植物光合作用——光-CO2响应参数,光-CO2响应参数能较好地反映逆境条件下植物的光合潜能、CO2与光能利用能力、光合电子传递与光合磷酸化活性及光抑制水平高低等特性[12,22-23]。伍维模等[6]报道土壤水分胁迫显著影响胡杨与灰胡杨AQY、Pnmax、LSP,而对LCP、Rd无显著影响,而陈亚鹏[8]等指出胡杨生化参数随地下水埋深增加而增大,但不同地下水位间无显著差异。本试验应用直角双曲线修正模型对灰胡杨光和CO2响应曲线拟合表明,不同土壤水分处理显著影响了灰胡杨光合作用,同一PAR下随土壤水分降低,Pn降幅增大,表明土壤干旱加重了灰胡杨光抑制发生强度、降低Rubisco活性与碳同化能力。灰胡杨光与CO2响应参数总体随土壤水分下降而降低,但CO2补偿点则增大。表明随土壤水分降低,灰胡杨光抑制程度增强,光合潜能、光能转化效率、电子传递速率、光合磷酸化活性、磷酸丙糖利用效率和RuBP再生、消耗过剩能量的能力降低,可有效利用PAR和CO2范围缩窄,导致其在低水强光的荒漠环境下膜脂过氧化程度增大(图5)、光合生理功能减弱和光合效率下降。试验中也发现重度干旱灰胡杨出现明显的叶色发黄、脱落等症状。但LCP与Rd的降低,可使其对弱光利用能力有所提高和减少对光合产物的消耗[24],这在一定程度上增强了其对资源的有效利用和抵御干旱胁迫能力。Jmax和Vcmax比值一直被认为是衡量N素在叶片光合系统内部分配格局的一个重要指标,该比值代表着光合作用内部电子传递和Rubisco能力(RuBP再生和消耗)间的一种功能平衡[25]。随土壤水分下降其Jmax/Vcmax降低,表明灰胡杨仅将光合系统中少量N素分配给用于羧化作用的Rubisco,可能是土壤水分亏缺引起羧化能力下降的原因之一。此外,土壤水分梯度下灰胡杨Pnmax与伍维模等[6]报道结果相似,但LSP却远低于Ma等[5]报道结果,且远远高于伍维模等[6]报道的结果。其原因在于光响应曲线拟合时,Ma等[5]采用一元二次回归模型,拟合LSP 是利用曲线中Pn达到最大值时所对应的PAR值,从而使结果远高于直角双曲线修正模型;伍维模等[6]采用的非直角双曲线模型是一条没有极点的渐进线,利用直线y=Pnmax与弱光下的线性方程的交点所对应X轴的数值为LSP,使结果远低于直角双曲线修正模型和实测值。直角双曲线修正模型能较好地拟合土壤水分梯度下Pn-PAR响应过程(R2>0.993)及其响应参数,其与实测光响应曲线吻合度最高,且克服了非直角双曲线模型无法拟合Pn随PAR增加而降低的缺点,拟合效果最佳(图2,表1)。因此,在光响应模型的应用中,应根据实际生境条件选择最为合适的拟合模型,以最大限度地保证拟合光响应特征参数的正确性。
叶绿素含量和比例在一定程度上能反映植物光能利用、制造有机物与适应、利用环境因子的能力。灰胡杨Chla、Chlb、Car含量及叶绿体类囊体膜上光系统反应中心色素和聚光色素的组成比例随土壤水分下降而降低,土壤水分越低则降低越显著,表明轻度干旱对灰胡杨光合器官结构与功能影响甚微,但中度与重度干旱则影响较大,尤其重度干旱光合器官结构与功能的损伤明显增大,这与光合特征研究结果相一致。同时,随土壤水分降低,灰胡杨Chla含量降幅均高于Chlb,Car也大幅降低,表明灰胡杨光系统反应中心比捕光天线系统更易受损,膜脂过氧化程度增大(图5),这也是导致其光合能力和LUE降低的原因之一。水势(Ψp)是植物水分状况的重要指标之一,Ψp能够用来判断植物水分亏缺的程度。土壤水分越低,灰胡杨Ψp降低越显著,表明灰胡杨对干旱区土壤水分变化敏感。Ψp与Pn、Tr、Gs、Ci、LUE、Pnmax均呈极显著的正相关(P>0.01),表明土壤水分下降而引起的水势下降直接影响了灰胡杨的光合生理过程。不少研究认为环境胁迫常常直接作用于叶绿体。干旱逆境下,植物碳同化能力减弱以及PSⅡ活性降低导致激发能上升而引发能量代谢失调,产生过量的活性氧(ROS),造成膜脂过氧化作用加剧,导致生物膜结构与功能破坏,从而降低植物光合能力[26-28],其是光合作用非气孔限制的主要原因[23]。Campos等研究指出干旱胁迫下渗透调节物质脯氨酸(Pro)和可溶性糖(SS)的积累增加,有助于清除干旱胁迫条件下植株体内的活性氧,避免细胞膜质过氧化[27];陈敏等指出塔里木河中游3种植物(胡杨、柽柳和芦苇)通过积累脯氨酸与可溶性糖来增强抗旱性,且二者在抵御干旱胁迫过程中存在相互补偿关系[29]。试验发现,灰胡杨渗透调节物质对土壤水分响应存在差异,H2渗透调节物质增幅圴高于MDA,表明这些渗透调节物质能较快地清除活性氧,共同稳定了光合作用机构的功能,维持较高Pn。但随土壤水分降低,渗透调节物质与MDA均显著升高,但增幅Pro>MDA>SP>SS,表明土壤干旱下灰胡杨以积累大量Pro来保护细胞质内许多酶免受伤害和增强组织的抗脱水力,阻止了蛋白质分解与变性,从而维持了机体内环境的相对稳定。可见,土壤干旱下渗透调节物质积累是灰胡杨清除活性氧、维持生物膜结构和功能正常而采取的一种有效防御措施。但试验中发现,土壤水分梯度下灰胡杨出现了叶色发黄症状(H3),H4则出现明显叶色发黄、脱落症状,表明中度与重度干旱已对灰胡杨生物膜结构与功能造成一定程度的损伤,严重抑制了其正常的光合作用。综合以上分析,塔里木干旱荒漠区灰胡杨生长适宜的土壤水分为田间持水量的60%—65%,此土壤水分能保证灰胡杨同时获得较高的光合效率和WUE来适应荒漠逆境,也符合极端干旱区植被恢复、高效节水的管理原则。
[1] 李林芝,张德罡,辛晓平,闫玉春,杨桂霞,李瑾,王旭. 呼伦贝尔草甸草原不同土壤水分梯度下羊草的光合特性. 生态学报,2009,29(10):5271-5279.
[2] 苏培玺,张立新,杜明武,毕玉蓉,赵爱芬,刘新民. 胡杨不同叶形光合特性、水分利用效率及其对加富CO2的响应. 植物生态学报,2003,27(1): 34-40.
[3] 裴斌,张光灿,张淑勇,吴芹,徐志强,徐萍. 土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响. 生态学报,2013,33(5):1386-1396.
[4] 王海珍,韩路,李志军,彭杰,马春晖. 塔里木河上游胡杨与灰杨光合水分生理特性. 生态学报,2009,29(11):5843-5850.
[5] Ma H C,Fung L,Wang S S,Altman A,Hüttermann A. Photosynthetic response ofPopuluseuphraticato salt stress. Forest Ecology and Management, 1997,93(1/2):55-61.
[6] 伍维模,李志军,罗青红,韩路. 土壤水分胁迫对胡杨、灰叶胡杨光合作用——光响应特性的影响. 林业科学,2007,43(5):30-35.
[7] Bogeat-Triboulot M B,Brosché M,Renaut J,Jouve L,Thiec D L,Fayyaz P,Vinocur B,Witters E,Laukens K,Teichmann T,Altman A,Hausman J F,Polle A,Kangasjärvi J,Dreyer E. Gradual soil water depletion results in reversible changes of gene expression,protein profiles,ecophysiology,and growth performance inPopuluseuphratica,a poplar growing in arid regions. Plant Physiology,2007,143(2):876-892.
[8] 陈亚鹏,陈亚宁,徐长春,李卫红,付爱红. 塔里木河下游地下水埋深对胡杨气体交换和叶绿素荧光的影响. 生态学报,2011,31(2):344-353.
[9] Gries D,Zeng F,Foetzki A,Arndt S K,Bruelheide H,Thomas F M,Zhang X,Runge M. Growth and water relations ofTamarixramosissimaandPopuluseuphraticaon Taklamakan desert dunes in relation to depth to a permanent water table. Plant,Cell & Environment,2003,26(5):725-736.
[10] Overdieck D,Ziche D,Yu R D. Gas exchange ofPopuluseuphraticaleaves in a riparian zone. Journal of Arid Land,2013,5(4):531-541.
[11] Berry J A,Downton W J S. Environmental regulation of photosynthesis // Govindjee,ed. Photosynthesis,VolⅡ. Development,Carbon Metabolism and Plant Productivity. New York:Academic Press,1982:263-343.
[12] 叶子飘. 光合作用对光和CO2响应模型的研究进展. 植物生态学报,2010,34(6):727-740.
[13] 高俊凤. 植物生理学实验指导. 北京:高等教育出版社,2006,122-125.
[14] Farquhar G D,von Caemmerer S,Berry J A. A biochemical model of photosynthetic CO2assimilation in leaves of C3species. Planta,1980,149(1):78-90.
[15] Sofo A,Dichio B,Montanaro G,Xiloyannis C. Photosynthetic performance and light response of two olive cultivars under different water and light regimes. Photosynthetica,2009,47(4):602-608.
[16] 许大全. 光合作用效率. 上海:上海科学技术出版社,2002.
[17] Chen Y,Xu D Q. Two patterns of leaf photosynthetic response to irradiance transition from saturating to limiting one in some plant species. New Phytologist,2006,169(4):789-798.
[18] 郑海雷,黄子琛,董学军. 毛乌素沙地油蒿和牛心朴子生理生态学研究. 植物生态学与地植物学学报,1992,16(3):197-208.
[19] 李志军,罗青红,伍维模,韩路. 干旱胁迫对胡杨和灰叶胡杨光合作用及叶绿素荧光特性的影响. 干旱区研究,2009,26(1):45-52.
[20] Rouhi V,Samson R,Lemeur R,van Damme P. Photosynthetic gas exchange characteristics in three different almond species during drought stress and subsequent recovery. Environmental and Experimental Botany,2007,59(2):117-129.
[21] 李菊艳,赵成义,孙栋元,闫映宇,张曾强,李君. 水分对胡杨幼苗光合及生长特性的影响. 西北植物学报,2009,29(7):1445-1451.
[22] Mishra K B,Iannacone R,Petrozza A,Mishra A,Armentano N,Vecchia G L,Trtílek M,Cellini F,Nedbal L. Engineered drought tolerance in tomato plants is reflected in chlorophyll fluorescence emission. Plant Science,2012,182:79-86.
[23] 张仁和,郑友军,马国胜,张兴华,路海东,史俊通,薛吉全. 干旱胁迫对玉米苗期叶片光合作用和保护酶的影响. 生态学报,2011,31(5):1303-1311.
[24] Brodribb T,Hill R S. Light response characteristics of a morphologically diverse group of southern hemisphere conifers as measured by chlorophyll fluorescence. Oecologia,1997,110(1):10-17.
[25] Wullschleger S D. Biochemical limitations to carbon assimilation in C3plants-a retrospective analysis of theA/Ci curves from 109 species. Journal of Experimental Botany,1993,44(5):907-920.
[26] Babita M,Maheswari M,Rao L M,Shanker A K,Rao D G. Osmotic adjustment,drought tolerance and yield in castor (RicinuscommunisL.) hybrids. Environmental and Experimental Botany,2010,69(3):243-249.
[27] de Campos M K F,de Carvalho K,de Souza F S,Marur C J,Pereira L F P,Filho J C B,Vieira L G E. Drought tolerance and antioxidant enzymatic activity in transgenic‘Swingle’ citrumelo plants over-accumulating proline. Environmental and Experimental Botany,2011,72(2):242-250.
[28] 杜伟莉,高杰,胡富亮,郭德林,张改生,张仁和,薛吉全. 玉米叶片光合作用和渗透调节对干旱胁迫的响应. 作物学报,2013,39(3):530-536.
[29] 陈敏,陈亚宁,李卫红,陈亚鹏,何斌,湾疆辉. 塔里木河中游地区3种植物的抗旱机理研究. 西北植物学报,2007,27(4):747-754.
Effects of soil water gradient on photosynthetic characteristics and stress resistance ofPopuluspruinosain the Tarim Basin, China
WANG Haizhen*,HAN Lu,XU Yali,NIU Jianlong,YU Jun
KeyLaboratoryofBiologicalResourceProtectionandUtilizationofTarimBasin,XinjiangProductionandConstructionGroups,CollegeofPlantScience,TarimUniversity,Alar843300,China
Water deficit is a major limiting factor in vegetation recovery and reconstruction in the Tarim Basin in the extremely arid desert region of northwest China.PopuluspruinosaSchrenk is an ecologically important species growing in this region. However, theP.pruinosapopulation has been declining in recent years because of the low underground water table, mainly caused by increased human water consumption. Currently, the mechanisms underlying the decline in photosynthesis ofP.pruinosaunder soil water declines are not clear. The objective of our study was to investigate the effects of the soil water gradient on photosynthesis, and the relationship between photosynthesis and soil water content. Our study will enhance our understanding of the photo-physiological characteristics ofP.pruinosaexposed to soil water declines and provide valuable information for the protection of this vulnerable species. Saplings ofP.pruinosawere planted in pots under four different soil water gradients. The effects of the soil water declines on the photosynthetic characteristics and stress resistance ofP.pruinosawere evaluated by analyzing gas exchange, photosynthetic light and CO2response curves, pigments, stem water potential, and osmotic adjustment substances. The results showed that: (1) The net photosynthetic rate(Pn), transpiration rate, stomatal conductance, intercellular CO2concentration, and light use efficiency ofP.pruinosadecreased with a gradual decrease in soil water content by 35.53%, 25.32%, 48.18%, 15.62%, and 40.92%, respectively, under severe soil drought in comparison to normal soil water content(CK). However, the phenomenon of "noon break" was apparent, and non-stomatal limitation was responsible for a reduction inPn. Water use efficiency(WUE) could be improved by 3.05% under mild drought conditions relative to the CK, andPnwas maintained at a high level. (2) Light ecological amplitude decreased, CO2compensation point increased, ribulose 1,5-diphosphate (RuBP) regeneration was limited, and light/CO2utilization efficiency, rubisco activity, and photosynthetic efficiency ofP.pruinosadecreased with a decrease in soil water content. Compared to the CK, light response parameters(maximum net photosynthetic rate [Pnmax], apparent quantum efficiency [AQY], light saturation point [LSP], carboxylation efficiency [CE], Photosynthetic capacity [Amax], photorespiratory rate [Rp], maximum carboxylation rate [Vcmax], maximum electron transport rate [Jmax], and triose-phosphate utilization rate [TPU]) significantly decreased(P< 0.05). Notably,Pnmax,Amax, and biochemical parameters of photosynthesis decreased by 42.65%, 38.26%, and 57.10% (moderate drought) and 63.01%, 65.88%, and 73.43% (severe drought), respectively. (3) Stem water potential and pigment content were significantly reduced(P< 0.01), the pigment composition proportion of the light reaction center was altered, and membrane lipid peroxidation(MDA) was significantly enhanced(P< 0.01) with decreasing soil water content.P.pruinosamainly accumulated proline and soluble protein to eliminate reactive oxygen and alleviate the impairment of the photosynthetic apparatus under soil drought. Irreversible damage was caused to the photosynthetic system ofP.pruinosa, and normal photosynthesis was seriously inhibited under severe drought. Therefore, declines in soil water content resulted in drought stress and reduced photosynthetic ability. This indicated that the decline in theP.pruinosapopulation might be caused by the lower soil moisture. In conclusion, the soil water content for maintaining higherPnand WUE inP.pruinosaforestlands should be approximately 60%─65% of the field capacity in the Tarim arid-desert region to adhere to the management principles of efficient water conservation and vegetation restoration in extremely arid areas.
Populuspruinosa; soil water gradient; gas exchange; light-CO2response parameters; osmotic adjustment substance
国家科技支撑计划资助项目(2014BAC14B00);国家自然科学基金资助项目(31260058, 30960033);中国科学院“西部之光”人才培养项目(RCPY201209)
2015-07-29;
日期:2016-06-13
10.5846/stxb201507291597
* 通讯作者Corresponding author.E-mail: whzzky@163.com
王海珍,韩路,徐雅丽,牛建龙,于军.土壤水分梯度对灰胡杨光合作用与抗逆性的影响.生态学报,2017,37(2):432-442.
Wang H Z,Han L,Xu Y L,Niu J L,Yu J.Effects of soil water gradient on photosynthetic characteristics and stress resistance ofPopuluspruinosain the Tarim Basin, China.Acta Ecologica Sinica,2017,37(2):432-442.
