无机盐在HZSM-5催化乙酸环己酯水解反应中的作用
2017-02-08王志苗张东升王延吉
提 飞, 李 芳, 王志苗, 张东升, 薛 伟, 王延吉
(河北工业大学 化工学院 河北省绿色化工与高效节能重点实验室, 天津 300130)
无机盐在HZSM-5催化乙酸环己酯水解反应中的作用
提 飞, 李 芳, 王志苗, 张东升, 薛 伟, 王延吉
(河北工业大学 化工学院 河北省绿色化工与高效节能重点实验室, 天津 300130)
考察了无机盐(NaBr、ZnSO4、NaHSO4)对HZSM-5催化乙酸环己酯水解制备环己醇反应的影响。结果表明,无机盐可以增加反应体系的极性,抑制乙酸环己酯热分解副反应(β-消除反应)过渡态的生成,从而提高环己醇的选择性。同时,无机盐会破坏HZSM-5表面B酸中心,降低其催化活性。单独使用NaHSO4对乙酸环己酯水解反应也具有较好的催化性能,在适宜条件下,乙酸环己酯转化率达到63.8%,环己醇选择性达到90.9%;重复使用时,由于乙酸在反应体系中的积累,乙酸环己酯转化率有所降低,环己醇选择性基本不变。
环己醇; 乙酸环己酯; 水解; 环己烯; 硫酸氢钠
环己醇是一种重要的化工产品,用于生产己二酸、己内酰胺等的中间原料,工业上主要采用环己烷氧化法和环己烯水合法生产。环己烷氧化法以空气作为氧化剂,存在选择性差、能耗高等缺点[1-2];此外,空气还可与原料形成爆炸混合物,存在安全隐患。Asahi公司开发了环己烯水合制备环己醇的工艺[3],在能耗和安全等方面具有显著的优势。但是,由于热力学限制,环己烯单程转化率仅为12%左右[4];并且,环己烯与水互溶性较差,水合反应速率较慢。为克服环己烯水合过程的缺点,研究人员将环己烯与羧酸,如甲酸、乙酸等反应生成相应的环己基羧酸酯,再经水解反应制备环己醇,如式(1)所示。该过程称之为环己烯间接水合,可以克服上述环己烯直接水合反应的缺点,得到较高的环己醇收率[5-7]。Imam等[8]模拟了经由甲酸环己酯的环己烯间接水合过程,认为该过程的能耗远低于环己烯直接水合工艺,非常有发展前景。杜文明等[9]使用HZSM-5为催化剂,由环己烯经甲酸环己酯“一锅法”制备环己醇,环己醇收率可达40%。Chakrabarti等[10]研究了由环己烯经由乙酸环己酯制备环己醇的方法,将乙酸环己酯与正丁醇发生酯交换反应生成环己醇,同时还得到副产物乙酸丁酯。杨丽红[11]考察了由环己烯经乙酸环己酯间接水合制备环己醇反应,发现HZSM-5可以高效地催化环己烯与乙酸的酯化反应;在优化的条件下,环己烯转化率为69.1%,乙酸环己酯选择性可达98.3%,但在第二步反应,即乙酸环己酯水解反应中主要产物是环己烯,环己醇选择性仅为30.4%。在其它一些研究[12-14]中,乙酸环己酯水解被用作探针反应来评价催化剂,并未提及环己烯的生成,这可能是由于他们所采用的反应温度较低(80℃)的缘故。靳敬敬等[15]发现,向该反应体系中加入磺酸功能化酸性离子液体[HSO3bmim]HSO4可以增加环己醇的选择性,在适宜条件下,乙酸环己酯转化率为81.6%,环己醇选择性为79.7%;并且,离子液体的加入抑制了HZSM-5表面积炭的生成,提高了催化剂的稳定性;此外,加入中性离子液体[Bmim]BF4或[Bmim]Br作为助剂,环己醇选择性大大提高,分别为99.7%和99.5%,但乙酸环己酯转化率不同程度地下降。Yang等[16]考察了离子液体[HSO3bmim]HSO4催化乙酸环己酯水解反应性能,在乙酸环己酯转化率为80.2%时,环己醇选择性为96.6%。作者认为,其高选择性可归因于反应体系由于加入离子液体而具有的高极性,抑制了乙酸环己酯热分解副反应(β-消除反应)过渡态的生成,从而提高了乙酸环己酯水解反应的选择性。

(1)
综上所述,在乙酸环己酯水解反应中,离子液体可作为助剂使HZSM-5催化乙酸环己酯转化率和环己醇选择性得到大幅度的提高;酸性离子液体也可单独作为催化剂,促进乙酸环己酯高效地转化为环己醇。但是离子液体的制备过程复杂,成本较高。考虑到离子液体在反应中的作用机理,认为类似的无机盐也可起到提高反应体系极性,抑制乙酸环己酯热分解反应的作用。因此,笔者选择了几种无机盐,如NaBr、ZnSO4和NaHSO4,考察了其对乙酸环己酯水解制备环己醇的影响,并考察了NaHSO4单独作为催化剂时的乙酸环己酯水解反应。
1 实验部分
1.1 化学试剂及催化剂
乙酸环己酯,Acros公司产品;硫酸氢钠、硫酸锌、溴化钠,天津市科密欧化学试剂开发中心产品。HZSM-5,南开大学催化剂厂产品,n(SiO2)/n(Al2O3)=25。
1.2 催化剂活性评价及产物分析
将一定量的乙酸环己酯、去离子水和HZSM-5及无机盐放入内衬聚四氟乙烯的反应釜中,密封后用N2置换体系中的空气,然后搅拌同时升温至设定温度进行反应。反应一定时间后停止加热,并用冰水浴冷却反应釜至室温(<30℃,下同),泄压。过滤除去反应体系中的催化剂,取上层油相,采用Agilent 7890B气相色谱仪进行定性定量分析。KB-Wax 毛细管柱(30 m×0.25 mm),程序升温,初始温度80℃,以10℃/min升温至200℃,保持20 min;氢火焰离子检测器(FID),检测器温度200℃;气化室温度200℃;载气+补充气流速30 mL/min;进样量0.2 μL;分流比1/20。
1.3 催化剂表征
采用Micromeritics公司AutoChem II 2920型化学吸附仪对样品进行氨程序升温脱附(NH3-TPD)表征。首先在500℃ He气氛中进行表面净化,然后在110℃吸附NH3;用He气吹扫除去物理吸附的NH3,然后以10℃/min升温至500℃,采用TCD检测脱附的NH3。
采用NICOLET公司NEXUS-470型傅里叶变换红外光谱仪进行吸附吡啶红外光谱(Py-IR)表征,以测定HZSM-5表面酸中心类型。DTGS检测器,分辨率4 cm-1,扫描次数32。将样品充分研磨后制成自撑片(约20 mg),并放入以 CaF2为窗口的石英红外池中,在400℃、低于10-3Pa下处理1.5 h,降至室温;在室温下吸附吡啶蒸气30 min,然后在温度200℃、压力低于10-2Pa下净化1 h,室温下摄谱。
采用Rigaku公司D/MAX 2500型X射线衍射仪进行HZSM-5的XRD表征。
2 结果与讨论
以HZSM-5为催化剂,考察了几种无机盐对乙酸环己酯水解反应的影响,结果列于表1。

表1 无机盐在HZSM-5催化乙酸环己酯水解反应中的作用Table 1 Effect of inorganic salts in hydrolyzation of cyclohexyl acetate over HZSM-5
m(HZSM-5)=1.2 g;V(Cyclohexyl acetate)=8 mL (54.6 mmol);V(H2O)=24 mL (1333 mmol);T=130℃;t=5 h
1) Without HZSM-5 catalyst
由表1可知,当不使用催化剂时(No.1),乙酸环己酯水解反应活性较差,乙酸环己酯主要发生热分解反应生成了环己烯。向反应体系中加入HZSM-5(No.2),乙酸环己酯转化率大幅度增加,但产物中环己醇选择性比不使用催化剂时反而有所降低,说明HZSM-5更有利于促进乙酸环己酯的热分解反应。为提高反应体系的极性,抑制乙酸环己酯热分解反应过渡态的形成,从而提高环己醇的选择性,向反应体系中加入无机盐。向反应中加入0.4 mol/L NaBr时(No.3),环己醇选择性升高至48.0%,但乙酸环己酯转化率降低为56.1%,说明NaBr的加入抑制了乙酸环己酯热分解副反应,同时也降低了HZSM-5催化剂的活性。向反应中加入0.3 mol/L ZnSO4时,环己醇选择性大幅度提高至75.3%,但此时乙酸环己酯转化率只有4.1%。考虑到离子液体[HSO3bmim]HSO4对本反应具有良好的催化性能[15],采用具有相同阴离子的NaHSO4作为助剂(0.3 mol/L),相对于只使用HZSM-5的反应,环己醇选择性增加至42.8%;并且,与NaBr、ZnSO42种无机盐助剂不同的是,乙酸环己酯转化率非但没有降低,反而略有增加至67.7%。继续增加NaHSO4的用量,乙酸环己酯转化率和环己醇选择性均持续升高。当NaHSO4浓度为1.0 mol/L 时,环己醇选择性为54.1%,此时乙酸环己酯转化率为73.2%。上述结果表明,NaHSO4的加入提高了反应体系极性,抑制了热分解副反应,同时增加了反应活性。
为解释上述3种盐对HZSM-5催化乙酸环己酯水解反应影响存在差异的原因,对反应前后的HZSM-5催化剂进行了表征。
图1为新鲜HZSM-5及添加无机盐催化乙酸环己酯水解反应后HZSM-5催化剂的NH3-TPD曲线。由图1可以看出,新鲜HZSM-5的NH3-TPD曲线上存在2个脱附峰,低温峰对应198℃左右的弱酸中心,高温脱附峰对应389℃左右的中强酸中心;添加无机盐后反应回收的HZSM-5分子筛的NH3-TPD曲线发生了显著的变化。向反应体系中添加NaHSO4后催化乙酸环己酯水解反应回收的HZSM-5的NH3-TPD曲线上中强酸中心对应的脱附峰变弱,而弱酸中心脱附峰则变宽,脱附峰温度升高至206℃;添加NaBr后催化反应回收HZSM-5的NH3-TPD曲线的变化与添加NaHSO4的相似;添加ZnSO4后的回收HZSM-5的NH3-TPD曲线上对应于高脱附温度的中强酸中心几乎完全消失,对应于低脱附温度的弱酸中心数量则大大增加,相应的NH3脱附温度也升高了。上述变化说明,在HZSM-5催化乙酸环己酯水解反应体系中加入无机盐对HZSM-5表面酸中心产生了影响,并且不同无机盐的影响程度不同。尹双凤等[17]指出,HZSM-5表面的中强酸中心为B酸中心,弱酸中心为L酸。图1显示,无机盐破坏了HZSM-5表面的B酸中心,但增加了L酸中心数量。其中,ZnSO4的影响最为显著。

图1 新鲜HZSM-5及加入无机盐后催化乙酸环己酯 水解反应回收HZSM-5的NH3-TPD曲线Fig.1 NH3-TPD profiles of fresh HZSM-5 and used HZSM-5 for catalytic cyclohexyl acetate hydrolyzation with inorganic salts added(1), (2), (3) HZSM-5 affected by ZnSO4, NaBr and NaHSO4 respectively; (4) Fresh HZSM-5
为了证实HZSM-5表面B酸中心的变化,采用Py-IR考察了乙酸环己酯水解反应前后的HZSM-5分子筛表面酸中心性质,结果如图2和表2所示。

图2 新鲜HZSM-5及加入无机盐后催化乙酸环己酯 水解反应回收HZSM-5的Py-IR谱Fig. 2 Py-IR spectra of fresh HZSM-5 and used HZSM-5 for catalytic cyclohexyl acetate hydrolyzation with inorganic salts added(1) Fresh HZSM-5; (2), (3), (4) HZSM-5 affected by NaHSO4, NaBr and ZnSO4 respectively
由图2可知,新鲜HZSM-5的Py-IR谱出现1455 cm-1和1545 cm-12个吸收峰,表明其表面同时存在L酸中心和B酸中心;而回收HZSM-5的Py-IR谱中,L酸中心对应吸收峰变强,B酸中心对应吸收峰则不同程度地变弱。从表2可见,向乙酸环己酯水解反应中加入无机盐后回收HZSM-5表面L酸中心、B酸中心的数量的变化趋势与NH3-TPD表征分析结果吻合。

表2 新鲜HZSM-5及加入无机盐后催化乙酸环己酯 水解反应回收HZSM-5表面酸中心数量Table 2 Acidic site amount on the surface of fresh HZSM-5 and used HZSM-5 for catalytic cyclohexyl acetate hydrolyzation with inorganic salts added
SB,SL—IR peak areas of B-acid and L-acid respectively
无机盐对HZSM-5表面酸中心的影响是其阳离子与表面H+发生离子交换的结果,薛伟等[18]则认为,HZSM-5分子筛骨架脱铝是造成其表面酸性变化的原因。HZSM-5脱铝后其表面Al—OH数量减少,B酸中心减少;但由于脱除的铝物种仍然留在分子筛的孔道中,形成的非骨架铝产生了新的L酸中心。根据回收分子筛L酸中心数量变多的表征结果(见图2)可以认为,脱铝也是无机盐对HZSM-5酸中心产生影响的一种方式。
综上所述,向乙酸环己酯水解反应中加入NaBr和ZnSO4,由于极性增加,乙酸环己酯热分解反应受到抑制,进而提高了环己醇的选择性。但是,由于NaBr和ZnSO4对HZSM-5的离子交换和脱铝作用,破坏了HZSM-5表面的B酸中心,因此其催化活性下降,乙酸环己酯转化率降低。NaHSO4的作用则与前两者不同。从NH3-TPD和Py-IR表征结果可知,NaHSO4的存在也破坏了HZSM-5表面的B酸中心,但乙酸环己酯转化率却并未降低,并随着NaHSO4用量的增加而升高。这是由于NaHSO4在水溶液中可以电离出H+,显酸性,因此NaHSO4应该具有催化乙酸环己酯水解反应的作用。为了验证该结论,采用NaHSO4为催化剂,评价了乙酸环己酯水解反应,结果示于图3。
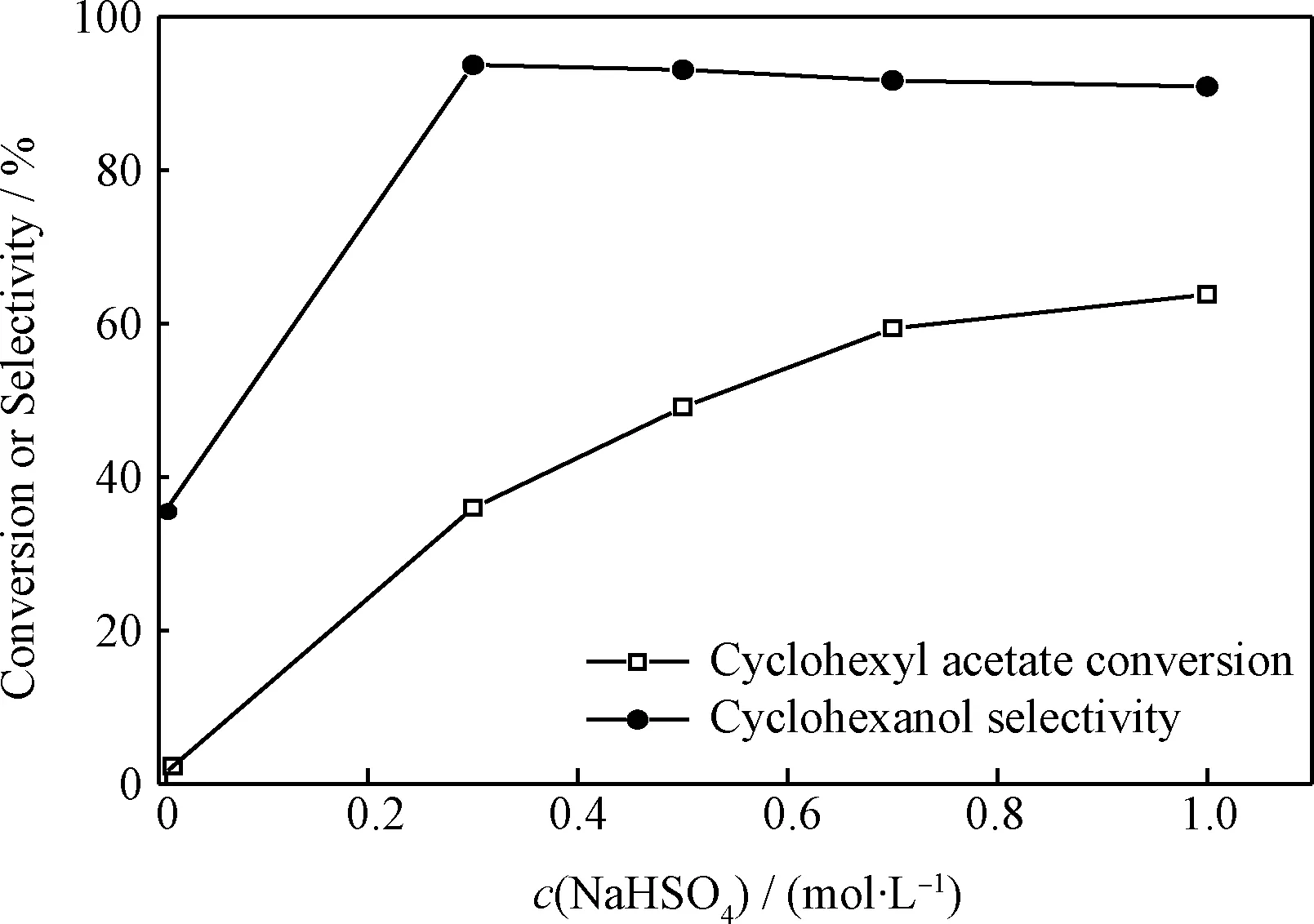
图3 NaHSO4催化乙酸环己酯水解反应性能Fig.3 Catalytic performance of NaHSO4 for hydrolyzation of cyclohexyl acetateV(Cyclohexyl acetate)=8 mL (54.6 mmol);V(H2O)=24 mL (1333 mmol); T=130℃; t=5 h
由图3可知,NaHSO4对乙酸环己酯水解反应具有催化活性,乙酸环己酯转化率随NaHSO4用量的增加而增加。当NaHSO4浓度为1.0 mol/L时,乙酸环己酯转化率为63.8%;而水解反应生成环己醇的选择性则由于NaHSO4的加入迅速增加,随着NaHSO4用量继续增加又略有降低。不加入NaHSO4时,环己醇选择性为34.3%;当NaHSO4浓度为0.3 mol/L时,环己醇选择性达到93.7%;当NaHSO4浓度提高至1.0 mol/L时,环己醇选择性降为90.9%。这说明NaHSO4有利于环己醇的生成,但同时也可以催化乙酸环己酯热分解反应,并且该副反应对NaHSO4用量更为敏感。
NaHSO4可作为乙酸环己酯水解反应的催化剂,在与HZSM-5催化剂具有相近活性的条件下,环己醇选择性远远优于使用HZSM-5。但是,NaHSO4的回收利用比HZSM-5繁琐。由于乙酸环己酯水解反应是一个水、油两相反应,乙酸环己酯和产物环己醇均存在于有机相,而NaHSO4则存在于水相,因此采用分相的方法将有机物与水溶液分离后,对NaHSO4水溶液进行了再次使用,考察其催化性能的稳定性,结果如图4所示。从图4可见,随着重复使用次数的增加,环己醇选择性基本不变,使用第6次时仍可达到95.1%,而乙酸环己酯转化率则逐渐降低。使用新鲜NaHSO4溶液时,乙酸环己酯转化率为59.6%;重复使用至第6次时,乙酸环己酯转化率为54.4%。当乙酸环己酯发生水解反应,或者发生热分解副反应时,都会生成乙酸,而将NaHSO4溶液与油相分离进行再利用时,生成的乙酸会保留在NaHSO4溶液中,随着重复使用次数的增加,乙酸含量越来越高。因此,将含乙酸的NaHSO4溶液再次用于催化乙酸环己酯水解反应时,会因乙酸的存在更加有利于逆反应的进行,从而使得乙酸环己酯转化率有所降低。

图4 NaHSO4催化乙酸环己酯水解反应重复使用性能Fig.4 Re-usability of NaHSO4 for catalytic hydrolyzation of cyclohexyl acetateV(Cyclohexyl acetate)=8 mL (54.6 mmol);V(H2O)=24 mL (1333 mmol); c(NaHSO4)=1.0 mol/L;T=130℃; t=5 h Cyclohexanol selectivity; Cyclohexyl acetate conversion
3 结 论
(1)向HZSM-5催化乙酸环己酯水解反应体系中加入无机盐(如NaBr、ZnSO4、NaHSO4)可抑制热分解副反应,提高水解生成环己醇的选择性。同时,NaBr和ZnSO4会由于离子交换和脱铝作用破坏HZSM-5表面的B酸中心,从而降低了其催化活性,导致乙酸环己酯转化率不同程度地降低。NaHSO4也可破坏HZSM-5表面B酸中心,但由于NaHSO4本身产生的酸性也可催化该反应,乙酸环己酯转化率反而有所增加。并且,随着NaHSO4用量的增加,乙酸环己酯转化率和环己醇选择性均持续升高。
(2)使用NaHSO4催化乙酸环己酯水解反应,在适宜条件下,乙酸环己酯转化率为63.8%,环己醇选择性为90.9%,远优于HZSM-5催化剂。将NaHSO4溶液分离后重复使用,环己醇选择性基本不变,乙酸环己酯转化率逐渐降低。这是由于副产的乙酸随NaHSO4溶液在反应体系中积累,有利于逆反应的发生,从而降低了乙酸环己酯转化率。
[1] LI J, YANG L, LI F, et al. Hydration of cyclohexene to cyclohexanol over SO3H-functionalized imidazole ionic liquids[J].Reaction Kinetics, Mechanisms and Catalysis, 2015, 114(1): 173-183.
[2] 薛伟, 王冬冬, 王延吉, 等. 由苯一步制备环己醇的催化过程[J].石油学报(石油加工), 2008, 24(增刊): 73-78. (XUE Wei, WANG Dongdong, WANG Yanji, et al. The one-pot synthesis of cyclohexanol from benzene[J].Acta Petrolei Sinica (Petroleum Processing Section), 2008, 24(Suppl): 73-78.)
[3] MAKOTO M, TOMOYUKI I. New catalytic technologies in Japan[J].Catal Today, 1999, 51(3-4): 369-375.
[4] 娄舒洁, 肖超贤, 孙耿, 等. 由苯制备环己醇新途径[J].催化学报, 2013, 34(1): 251-256. (LOU Shujie, XIAO Chaoxian, SUN Geng, et al. A new method for preparation of cylohexanol from benzene[J].Chinese Journal of Catalysis, 2013, 34(1): 251-256.)
[5] STEYER F, SUNDMACHER K. VLE and LLE data set for the system cyclohexane + cyclohexene + water + cyclohexanol + formic acid + formic acid cyclohexyl ester[J].J Chem Eng Data, 2005, 50(4): 1277-1282.
[6] STEYER F, SUNDMACHER K. Cyclohexanol production via esterification of cyclohexene with formic acid and subsequent hydration of the esters reaction kinetics[J].Ind Eng Chem Res, 2007, 46(4): 1099-1104.
[7] STEYER F, FREUND H, SUNDMACHER K. A novel reactive distillation process for the indirect hydration of cyclohexene to cyclohexanol using a reactive entrainer[J].Ind Eng Chem Res, 2008, 47(23): 9581-9587.
[8] IMAM R A, FREUND H, GUIT R P M, et al. Evaluation of different process concepts for the indirect hydration of cyclohexene to cyclohexanol[J].Org Process Res Dev, 2013, 17(3): 343-358.
[9] 杜文明, 薛伟, 李芳, 等. 由环己烯经甲酸环己酯制备环己醇催化反应研究[J].河北工业大学学报, 2012, 41(4): 34-39. (DU Wenming, XUE Wei, LI Fang, et al. Study on the catalytic synthesis of cyclohexanol from cyclohexene via cyclohexyl formate[J].Journal of Hebei University of Technology, 2012, 41(4): 34-39.)
[10] CHAKRABARTI A, SHARMA M M. Cyclohexanol from cyclohexene via cyclohexyl acetate: Catalysis by ion-exchange resin and acid-treated clay[J].Reactive Polymer, 1992, 18(2): 107-115.
[11] 杨丽红. B酸离子液体催化环己烯水合反应[D].天津: 河北工业大学, 2013.
[12] KIMURA M, NAKATO T, OKUHARA T. Water-tolerant solid acid catalysis of Cs2.5H0.5PW12O40for hydrolysis of esters in the presence of excess water[J].Appl Catal A, 1997, 165: 227-240.
[13] HARA M, YOSHIDA T, TAKAGAKI A, et al. A carbon material as a strong protonic acid[J].Angew Chem Int Ed, 2004, 43(22): 2955-2958.
[14] YANG Q, KAPOOR M P, SHIROKURA N, et al. Ethane-bridged hybrid mesoporous functionalized organosilicas with terminal sulfonic groups and their catalytic applications[J].J Mater Chem, 2005, 15(6): 666-673.
[15] 靳敬敬, 李芳, 杨丽红, 等. HZSM-5催化乙酸环己酯水解反应. 石油学报(石油加工), 2014, 30(1): 169-174. (JIN Jingjing, LI Fang, YANG Lihong, et al. Hydrolyzation of cyclohexyl acetate over HZSM-5 catalyst[J].Acta Petrolei Sinica (Petroleum Processing Section), 2014, 30(1): 169-174.)
[16] YANG F, XUE W, ZHANG D, et al. Hydrolysis of cyclohexyl acetate to cyclohexanol with high selectivity over SO3H-functionalized ionic liquids[J].Reaction Kinetics, Mechanisms and Catalysis, 2016, 117(1): 329-339.
[17] 尹双凤, 林浩, 于中伟. 锌含量对 Zn/HZSM-5催化剂性能的影响[J].催化学报, 2001, 22(1): 57-61. (YIN Shuangfeng, LIN Hao, YU Zhongwei. Effect of zinc content on properties of Zn/HZSM-5 zeolite catalyst[J].Chinese Journal of Catalysis, 2001, 22(1): 57-61.)
[18] 薛伟, 王冬冬, 李芳, 等. 由苯“一锅法”制备环己醇催化反应研究——ZnSO4对HZSM-5催化环己烯水合反应的影响[J].高校化学工程学报, 2011, 25(6): 1026-1032. (XUE Wei, WANG Dongdong, LI Fang, et al. Study on the one-pot catalytic synthesis of cyclohexanol from benzene——Influence of ZnSO4on the hydration of cyclohexene catalyzed by HZSM-5[J].Journal of Chemical Engineering of Chinese Universities, 2011, 25(6): 1026-1032.)
The Role of Inorganic Salts in Hydrolyzation of Cyclohexyl Acetate Over HZSM-5
TI Fei, LI Fang, WANG Zhimiao, ZHANG Dongsheng, XUE Wei, WANG Yanji
(HebeiProvincialKeyLaboratoryofGreenChemicalTechnologyandHighEfficientEnergySaving,SchoolofChemicalEngineeringandTechnology,HebeiUniversityofTechnology,Tianjin300130,China)
Effect of inorganic salts (such as NaBr, ZnSO4and NaHSO4) on catalytic hydrolyzation of cyclohexyl acetate to cyclohexanol over HZSM-5 catalyst was studied. It is found that the inorganic salts could prohibit the formation of the transition state for the side reaction (pyrolysis of cyclohexyl acetate to cyclohexene, aβ-elimination reaction) by increasing the polarity of the reaction system, and thus high cyclohexanol selectivity was obtained. At the same time, inorganic salts destroyed the acid sites of Brønsted type on the surface of HZSM-5, resulting in the decrease of its catalytic activity. NaHSO4also showed good catalytic performance when it was employed as catalyst alone in this reaction, with cyclohexyl acetate of 63.8% and cyclohexanol selectivity of 90.9% under the certain conditions. When NaHSO4was recycle used, cyclohexanol selectivity changed little, while cyclohexyl acetate conversion decreased with recycle times increasing, which could be attributed to the accumulation of acetic acid in the reaction system.
cyclohexanol; cyclohexyl acetate; hydrolyzation; cyclohexene; sodium hydrogen sulfate
2016-04-14
国家自然科学基金项目(21236001,21176056)、河北省自然科学基金项目(B2015202228)和河北省高校百名优秀创新人才项目(BR2-208)资助
提飞,男,硕士研究生,从事分子筛催化相关研究
薛伟,男,教授,从事环境催化及反应过程强化等方向的研究;Tel:022-60202419;E-mail:weixue@hebut.edu.cn
1001-8719(2017)01-0085-06
O643.3; TQ233.1
A
10.3969/j.issn.1001-8719.2017.01.012
