小容量注射剂内包材相容性试验
2017-02-08孙丽艳于海瑶李雨晴
张 竹 孙丽艳 于海瑶 李雨晴
小容量注射剂内包材相容性试验
张 竹 孙丽艳 于海瑶 李雨晴
目的 考察小容量注射剂内包材与药品的稳定性,相容性。方法 通过液相色谱,分析不同提取条件,内包材有关物质的变化及存储过程中可见异物和微粒的增长情况。结果 通过7个品种小容量针剂的长时间相容性比对,BHT在灭菌和储存过程中未发生迁移。结论 溴化丁基胶塞作为目前企业生产应用的内包装材料对小容量制剂质量无明显影响,总体相容性良好。
内包材;相容性;高效液相色谱;溴化丁基胶塞;BHT
药瓶包装材料是指直接接触药品的包装材料和容器,主要包括各种材料制作的瓶、袋、内塞等包装容器,以及触及药品的充填物、衬垫等物质。由于药品包装材料伴随着药品的生产、流通和使用的全过程,因此,药品包装材料的材质组成配方、原辅料选择及生产工艺等因素,已成为影响药品质量的潜在因素,对人体的健康可能产生一定的影响,也可能造成严重的医疗危害。另一方面,药品生产企业抓药品质量一直以生产和加工过程为中心,对药品包装材料的生产环节和所选用药品包装材料的材质并未给予足够的重视。本研究就小容量注射剂使用的内包装材料进行了考察分析,以期引起药学工作者的关注[1-3]。
目前,企业生产的小容量注射剂使用的内包装材料基本都是溴化丁基胶塞与低硼硅玻璃管制注射剂西林瓶。故此次实验选择了质量较好的药用溴化丁基胶塞生产厂家湖北华强科技有限公司,该厂生产的溴化丁基胶塞配方中所用的抗氧剂为BHT(2,6-二叔丁基-4-甲基酚)。曾有资料报道,BHT可能在灭菌和储存过程中发生迁移,影响药物的稳定性,甚至危害人体健康。为此,本研究采用高效液相色谱法检测胶塞在灭菌前后BHT的迁移和储存过程中BHT在药液中的含量变化情况,以及其他未知有关物质的变化,以确定该包材对药品质量的影响程度,确保药品的稳定性和安全性。
1 仪器与试药
安捷伦液相色谱谱仪(1200,RRLC),DAD检测器;立式压力蒸气灭菌器;XA205电子分析天平;KQ500VDE双频数控超声波清洗液器;TU1901紫外分光光度计;XGIS型多功能安瓿灭菌器;GWF5J微粒分析仪;SC4000A型澄明度检测仪;S210型酸度计;铝盖(生产厂家:烟台耀民工贸有限公司);化丁基胶塞(生产厂家:湖北华强科技有限公司,批号:201305037);西林瓶(生产厂家:山东鲁王药用玻璃制品有限公司;批号:100311);BHT对照品(Lot Number:81216)。
2 药用溴化丁基胶塞与药品相容性实验
2.1 色谱条件 Agilent SB-C18色谱柱(5 μm,4.6 mm× 50 mm),流动相为水(A)-乙腈(B)(10:90)系统,等度洗脱。体积流量为1.0 ml/min,检测波长为278 nm,进样量为10 μl,柱温为30 ℃。
2.2 对照品溶液的制备 精密称取对照品BHT 10.66 mg,用甲醇定容于100 ml容量瓶中,制成0.1 mg/ml的对照品溶液,备用。
2.3 供试品溶液 ①肌氨肽苷注射液,批号:20131101,规格5 ml:8.75 mg(多肽):1.25 mg(次黄嘌呤);②骨肽注射液,批号:20130201,规格2 ml:10 mg;③蜂毒注射液,批号:20130201,规格2 ml:0.5 mg;④人参多糖注射液,批号:20130201,规格2 ml:6 mg;⑤肝水解肽注射液,批号:20130601,规格2 ml:20 mg;⑥小牛血去蛋白提取物注射液,批号:20131101,规格2 ml:80 mg;⑦氨甲环酸注射液,批号:20130701,规格5 ml:0.25 g。供试品溶液均为长春博奥生化药业有限公司生产。
2.4 方法学考察
2.4.1 线性关系考察 取2.2项下对照品溶液,精密吸取5 ml置100 ml容量瓶中,加甲醇稀释至刻度,摇匀,按2.1项下色谱条件下,精密吸取1、2、5、8、10、20 μl,分别注入色谱仪中,测定色谱峰面积,以对照品进样量为横坐标,峰面积为纵坐标,绘制标准曲线,并计算出回归方程。试验结果见表1。
结果显示,除去第6组(106.60 ng)值,BHT的进样量在5.33~53.30 ng范围内有良好的线性关系,进样量为5.33 ng时基线噪声是4.7,故5 ng也可认为是最低检出限。

表1 标准曲线检测结果表
2.4.2 精密度试验 取2.2项下对照品溶液10 μl,重复进样6次,测得RSD为0.35%,提示仪器精密度良好。
2.4.3 稳定性试验 将2.2项下对照品溶液至室温,放置1、6、24、36 h后,分别进样10 μl,测得RSD为1.75%,方法显示BHT对照品甲醇溶液36 h内稳定。
2.4.4 回收率试验 精密量取2.2项下对照品溶液5 ml,置10 ml容量瓶中加甲醇稀释至刻度,摇匀,再分别精密吸取稀释后的溶液0.5、0.8、1.2 ml置25 ml容量瓶中,加肝水解肽注射液至刻度,摇匀,分别注入色谱仪中,测定其峰面积,做平行样,按标准曲线公式x=A(平均峰面积)+5.7059/0.8700计算出BHT的量。试验结果见表2。
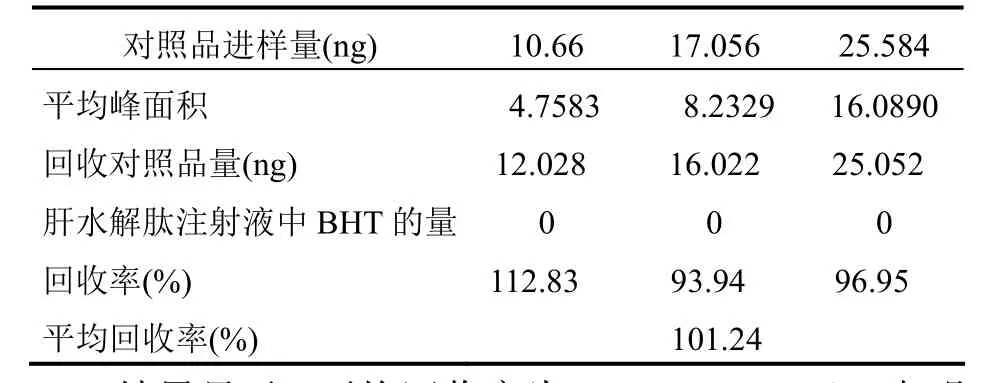
表2 样品加BHT对照溶液回收试验
结果显示,平均回收率为101.24%(n=3),表明BHT在肝水解肽注射液中可定量检出。
3 药用溴化丁基胶塞中BHT与有关物质检测试验
3.1 超声试验 分别称取胶塞10、15、20 g,各18份,剪碎,其中9份用水定容于10 ml容量瓶中,分别超声30 min、1 h和2 h,另外9份用甲醇定容,分别以45.80 kHz功率超声相同时间,进样。结果显示,溴化丁基胶塞中的BHT在水与甲醇提取中均未检出;水超声提取溴化丁基胶塞未检出有关物质,而甲醇超声提取的溴化丁基胶塞溶液检出有关物质,其量随胶塞量的增加而增加,表明胶塞中的有关物质溶于甲醇不溶于水;甲醇超声提2 h后有关物质检出量与含量均减少,表明检出的有关物质不稳定,长时间在热的甲醇中易分解或挥发;因溴化丁基胶塞中有关物质溶于甲醇不溶于水,故小容量水针剂使用溴化丁基胶塞的有关物质不会游离到药液中[4]。
3.2 高温灭菌实验 分别称取胶塞10、15、20 g,各3份,剪碎,置250 ml输液瓶中,加水15 ml,密封,置高压灭菌锅中灭菌,温度121 ℃,灭菌时间30 min,灭菌完成后放至室温,过滤,进样。溴化丁基胶塞在水中经121 ℃高压灭菌30 min后,水溶液中未检出BHT与有关物质。
4 内包材相容性试验
4.1 内包材灭菌前后相容性试验 分别用注射用水冲洗干燥的100 ml碘量瓶,取灌装前样品液3份,每份50 ml,先用微粒分析仪检测不溶性微粒数量[5];再用澄明度检测仪在照度2000~3000 LX条件下检测可见异物,并记录可见异物数量;pH值与含量测定值为中间体数据;再取药液灌装后经121 ℃灭菌15 min放冷后的样品,同法检验,pH值与含量测定值为成品数据。检测结果用t检验判断灭菌前后两组数据是否存在显著性差异,来判断内包材与样品的相容性。试验结果(表3)显示,灭菌前后经t检验法统计pH值、不溶性微粒、含量均无差异性;可见异物灭菌前后均未检出。故在121 ℃灭菌15 min条件下,使用的内包材与样品相容。
4.2 内包材长期相容性试验 取留样样品分别在0、6、9、12、24个月进行留样检测,主要检测pH值、可见异物、不溶性微粒、含量的变化情况,以考察内包材对样品溶液的相容性。pH值与含量检测结果用相对标准偏差分析方法,当相对标准偏差值小于2%时,则认为使用的内包材长期使用与药液相容。不溶性微粒检测结果,分别按10 μm和25 μm绝对平均增长数量与绝对平均增长数量的限度百分数来判断,内包材在长期储存条件下,是否有脱落、溶出等其他因素使不溶性微粒增加,试验结果见表4~9。
通过表4~9对不同品种在阴凉处放置过程中检测结果得知,留样样品的pH值、含量的相对标准偏差值均小于2%,可知使用的内包材对留样的pH值和含量均无影响;胶塞外观、可见异物检查储存前后均无变化;可知使用的内包材对留样的胶塞外观、可见异物均无影响;肝水解肽注射和蜂毒注射液不溶性微粒10 μm和25 μm绝对平均增长数量为2.3个/支和2个/支,其他品种均无增加;肝水解肽注射和蜂毒注射液绝对平均增长数量的限度百分数为0.038%、0.25%和0.33%、0.38%,其他品种平均增长数量的限度百分数均为零;可知内包材在长期储存条件下对不溶性微粒无影响,故不能得出内包材有颗粒脱落、溶出或其他因素使不溶性微粒增加的结论。
5 讨论
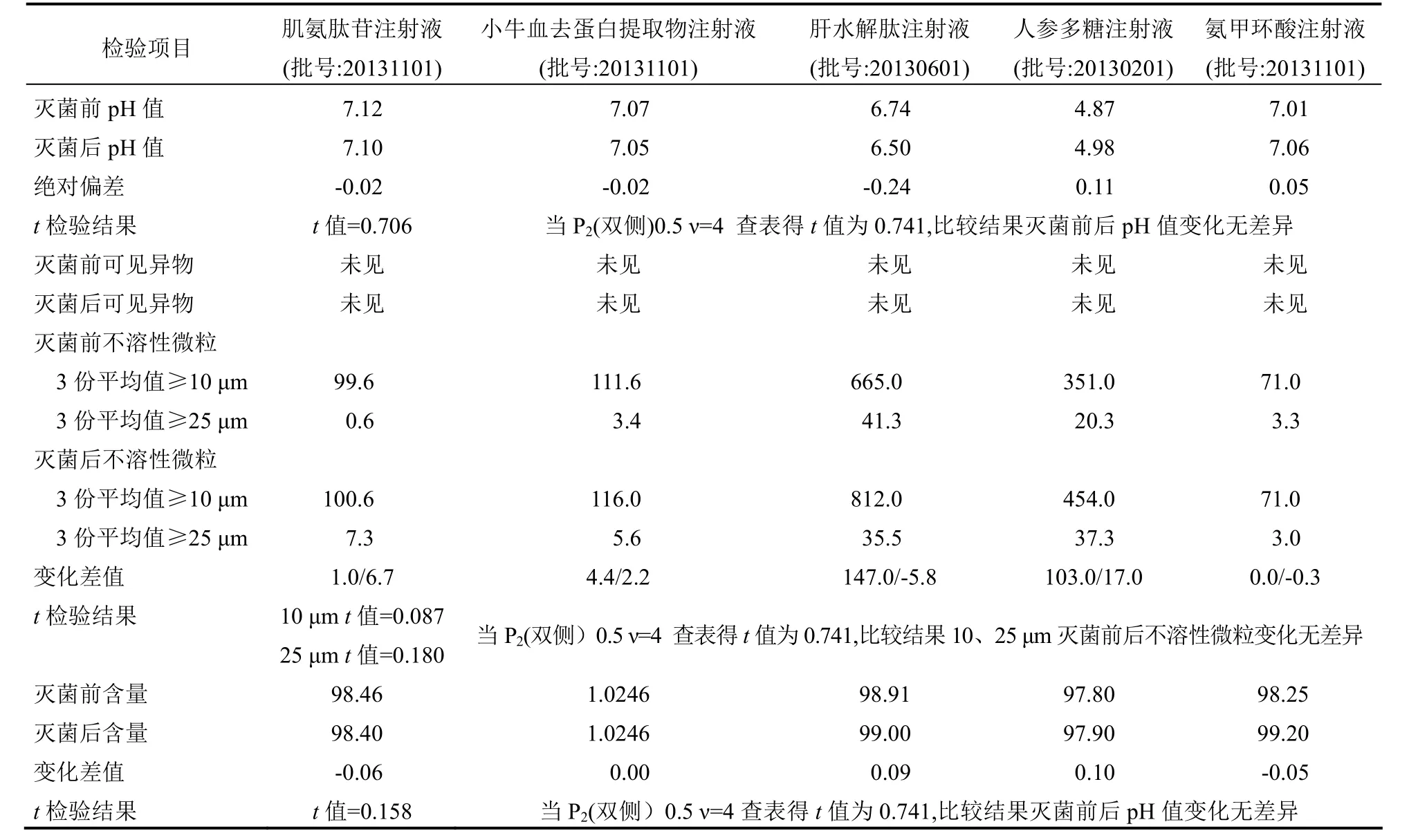
表3 内包材料灭菌前后相容性试验
因第一次做相容性试验,实验设计上还存在一些问题,主要是样本数量不够,每一个品种都应增加样本的批次,特别是对pH值较高的肌氨肽苷注射

表4 肝水解肽注射液内包材长期相容性试验结果

表5 肌氨肽苷注射液内包材长期相容性试验结果
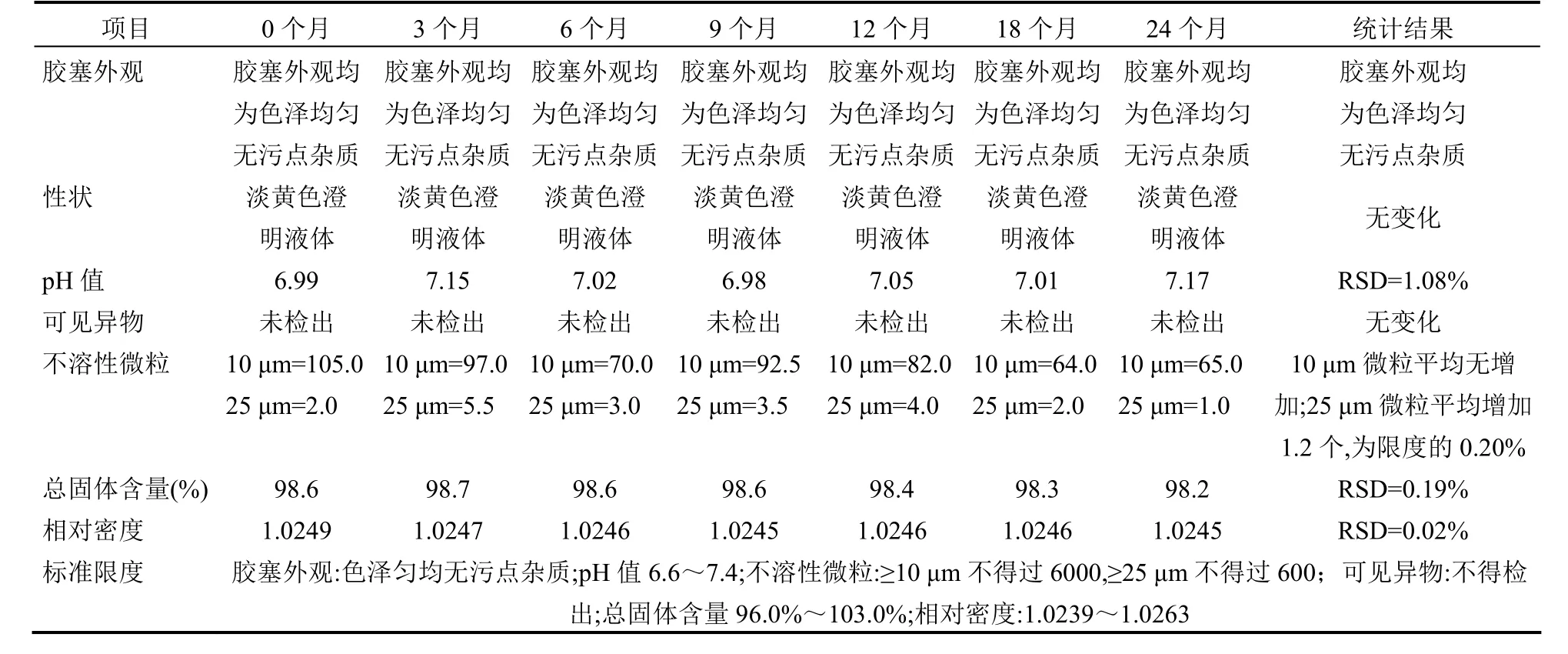
表6 小牛血去蛋白提取物注射液内包材长期相容性试验结果

表7 人参多糖注射液注射液内包材长期相容性试验结果
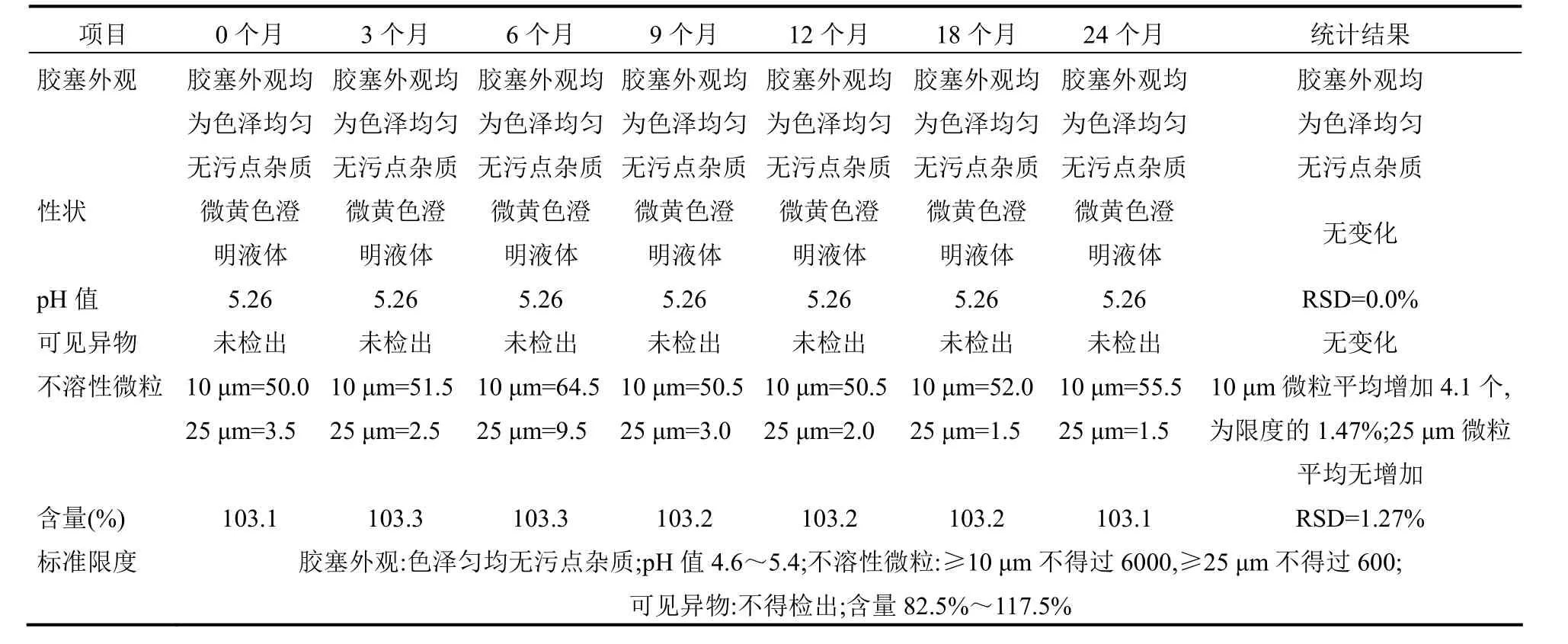
表8 蜂毒注射液注射液内包材长期相容性试验结果
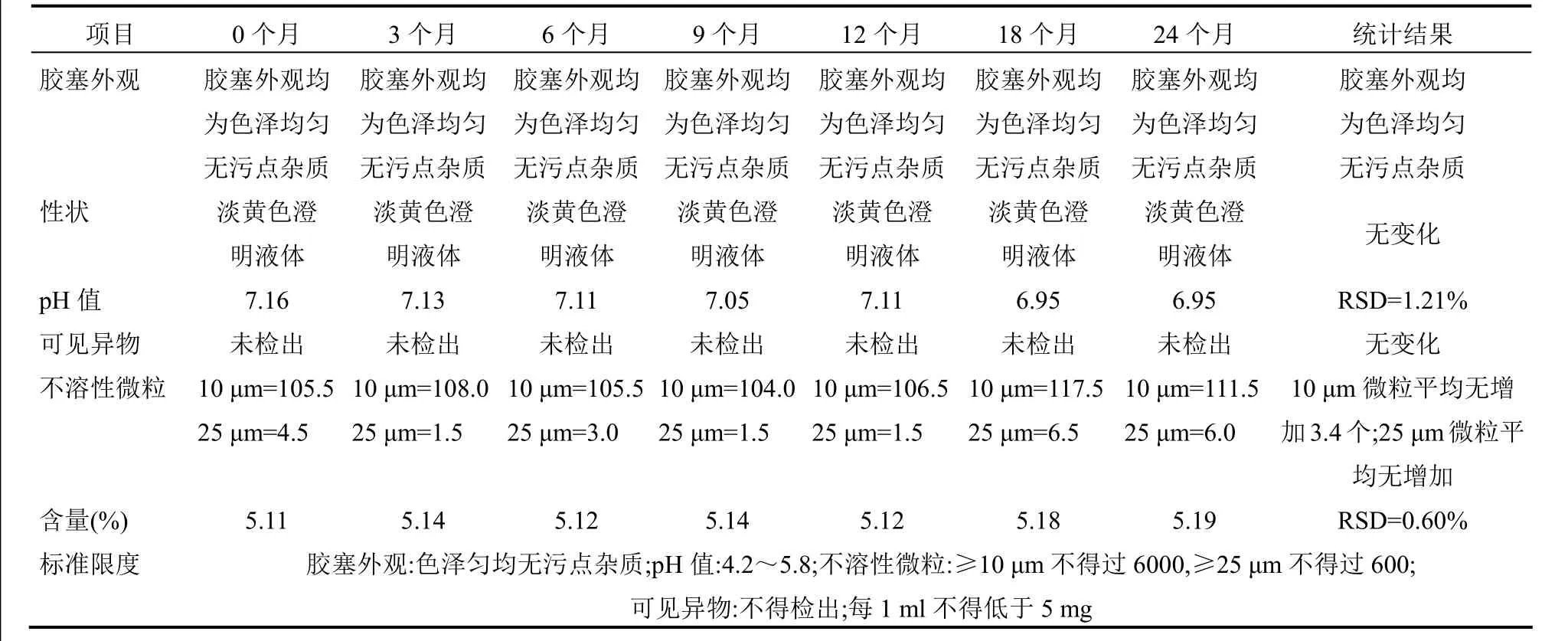
表9 骨肽注射液注射液内包材长期相容性试验结
液与pH值较低的蜂毒注射液侧重进行更为详细的试验考察。用覆膜丁基胶塞与中硼硅玻璃管制注射剂瓶作对照进行考察试验,进一步了解两者之间是否存在差异,以提高药品质量,保证用药安全。
[1] 黄惠华,田维荣,晏马成.药品包装材料对液体制剂质量的影响[J].药学实践杂志,2004,22(6):352-354.
[2] 纪立伟,胡欣.我国药用丁基胶塞的应用现状和存在的问题[J].中国药业,2003,12(12):25-26.
[3] 赵霞,胡昌勤,金少鸿.对考察要用丁基胶塞与药物相容性的思考与建议[J].中国药事,2007,21(10):810-812.
[4] 张思娟,陈琳,曹建.紫杉醇注射液配套输液器中邻苯二甲醇二辛酯的溶出性考察[J].中国药房,2008,19(9):698-700.
[5] 王启师,胡征,解加扬.微粒是丁基胶塞影响输液质量的关键因素[J].中国药业,2003,12(5):24.
Small capacity injection in packaging compatibility test
Zhang Zhu Sun Liyan Yu Haiyao Li Yuqing
Objective Small capacity injection in packaging material and drug stability, compatibility.Methods Through liquid chromatography,analysis of different extract conditions,packaging material about the change of material and storage within the visible foreign matter,and the growth of the particles in the process.Results Through seven varieties of small capacity injection compatibility than for a long time,butylated hydroxytoluene did not occur in the process of sterilization and storage migration.Conclusion Brominated butyl rubber stopper as current production application of the inner packing material for small capacity does not affect the quality,the overall compatibility is good.
The packaging material;Compatibility;HPLC;Brominated butyl rubber plug;BHT
长春市食品药品检验中心,辽宁长春 130012
张竹(1984-),本科学历,主管药师。研究方向:药物分析。E-mail:qijiouruola@sohu.com
【DOI】10.12010/j.issn.1673-5846.2017.01.004
