2-脱氧葡萄糖通过降低有氧糖酵解增强白血病K562/ADM耐药细胞对阿霉素的敏感性
2017-02-08张雪燕艾子莺苟泽鹏赵怀顺魏虎来
张雪燕,艾子莺,苟泽鹏,陈 静,易 娟,赵怀顺,魏虎来
(1.兰州大学基础医学院,甘肃省新药临床前研究重点实验室;2.兰州军区机关医院门诊部,甘肃 兰州 730000)
2-脱氧葡萄糖通过降低有氧糖酵解增强白血病K562/ADM耐药细胞对阿霉素的敏感性
张雪燕1,艾子莺1,苟泽鹏2,陈 静1,易 娟1,赵怀顺1,魏虎来1
(1.兰州大学基础医学院,甘肃省新药临床前研究重点实验室;2.兰州军区机关医院门诊部,甘肃 兰州 730000)
目的 研究2-脱氧葡萄糖(2-deoxy-D-glucose, 2-DG)通过抑制糖代谢增强白血病K562/ADM多药耐药细胞对阿霉素(adriamycin,ADM)敏感性的作用及机制。方法 以白血病K562/ADM及其亲本K562细胞为靶细胞模型,MTT法检测细胞增殖活性,葡萄糖、乳酸、己糖激酶测试盒分析葡萄糖消耗量、乳酸生成量和己糖激酶(hexokinase,HK)活性。Western blot法检测哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)表达和磷酸化(p-mTOR)以及葡萄糖转运体-4(glucose transporter-4,GLUT-4)的表达。结果 与亲本K562细胞相比,白血病K562/ADM耐药细胞HK活性、GLUT-4表达水平和有氧糖酵解能力增强。2-DG能够明显抑制K562/ADM及K562细胞的HK活性、葡萄糖消耗量和乳酸生成量,呈时间-浓度依赖性地抑制白血病细胞的增殖活性。低剂量2-DG和ADM可诱导K562/ADM细胞mTOR高表达及磷酸化水平增高,但2-DG与ADM联合则可有效对抗ADM诱导的K562/ADM 细胞mTOR高表达和磷酸化,并可降低GLUT-4的表达,提高K562/ADM细胞对阿霉素的敏感性。结论 2-DG通过竞争性抑制HK活性和抵抗ADM诱发的代偿性mTOR活化,降低GLUT-4表达,有效阻断有氧糖酵解途径而降低K562/ADM耐药细胞的增殖活性、增强其对化疗药物的敏感性。
2-脱氧葡萄糖;阿霉素;多药耐药性;有氧糖酵解;mTOR; GLUT-4;白血病
恶性肿瘤为维持肿瘤细胞无限增殖的物质和能量需要,表现出了不同于正常细胞的能量代谢特征,活跃的糖酵解是其最典型的生化特征。1924年Warburg首次报道,即使在氧供充足的条件下,与正常细胞相比肿瘤细胞也表现出更强的糖酵解活性,并将这一现象称为肿瘤的“有氧糖酵解”,或称为瓦尔堡(Warburg)效应[1]。大量研究表明肿瘤细胞增强的有氧酵解与肿瘤的发生、发展、疗效及预后等密切相关[2]。活跃的有氧糖酵解可有效提供肿瘤细胞增殖所需能量,同时糖酵解过程中的中间产物也为肿瘤细胞合成蛋白质和脂肪所利用,满足其无限增殖的需要;此外糖代谢产生的乳酸可酸化肿瘤细胞微环境,有利于肿瘤细胞的浸润和转移[2-4]。因此,阻断肿瘤细胞活跃的有氧糖酵解途径有可能成为新的抗肿瘤或增强抗肿瘤效果的有效措施。
我们前期研究已证实白血病K562/ADM耐药细胞的有氧酵解活性远高于其敏感的亲本K562细胞,有氧糖酵解的增强可能与其耐药性相关[5]。己糖激酶(HK)催化糖酵解途径的第1步代谢反应,也是糖酵解的第1个限速酶。2-DG为葡萄糖2位羟基被氢取代的葡萄糖类似物,可与葡萄糖竞争性地结合HK而抑制细胞葡萄糖分解活性,阻断糖酵解途径。多项研究表明2-DG具有化疗增敏或逆转肿瘤细胞耐药性的作用[6-7]。但当前有关有氧糖酵解在白血病细胞耐药性中的作用及分子机制尚不明确,本文在前期研究基础上,以药物敏感的白血病K562细胞为参照,探讨2-DG对白血病多药耐药K562/ADM细胞阿霉素敏感性的影响及其可能的分子机制。
1 材料与方法
1.1 材料 白血病多药耐药细胞株 K562/ADM细胞及其亲本敏感株K562细胞由兰州大学医学实验中心保存。2-DG(源叶生物科技有限公司),ADM(深圳万乐制药公司),RIPA细胞裂解液(北京索来宝科技有限公司),BCA定量试剂盒(碧云天生物公司),葡萄糖、乳酸、己糖激酶测试盒(南京建成生物工程研究所),兔抗人GLUT-4、mTOR、p-mTOR (Ser2448)(英国ImmunoWay公司),鼠抗人β-actin、辣根过氧化物酶(HRP)标记的羊抗兔和羊抗鼠二抗(北京中杉金桥生物技术有限公司),ECL超敏发光液(美国Millipore公司),新生牛血清(兰州荣晔生物科技公司),无酚红RPMI 1640培养液(美国Gibco BRL公司)。全自动酶标仪(美国Bio-Tek公司)
1.2 方法
1.2.1 细胞培养 K562和K562/ADM细胞常规培养于含10%新生牛血清的RPMI 1640完全培养液中,置37℃、体积分数为0.05的CO2和饱和湿度条件下培养,取对数生长期细胞用于实验。K562/ADM细胞定期用ADM(9.2 μmol·L-1)刺激以保持其高多药耐药性,无ADM 培养液继续培养2周后用于实验。
1.2.2 MTT法检测细胞增殖活性 实验设对照组、不同浓度的2-DG组、ADM组和2-DG与ADM联合组。取对数生长期细胞,调整浓度至1×108·L-1接种于96孔细胞培养板,按实验设计加入药物培养24 h和48 h,离培养终点4 h加入MTT,继续培养4 h,加入100 g·L-1SDS(含0.01 mol·L-1HCl)过夜,全自动酶标仪于570 nm处测吸光度值,并计算细胞增殖抑制率。
1.2.3 葡萄糖消耗量的检测 细胞分组同前。取对数生长期细胞,调整细胞浓度至1.2×108·L-1,接种于细胞培养瓶,无酚红RPMI 1640培养液中培养48 h后离心收集培养液,混匀,用于葡萄糖消耗量的测定。根据葡萄糖测定试剂盒说明,96孔板中加入相应试剂,37℃,孵育15 min,于505 nm波长下,全自动酶标仪测定各孔吸光度值。葡萄糖消耗量=(无细胞培养基中葡萄糖浓度-细胞培养液中葡萄糖浓度)×培养基体积。相对葡萄糖消耗抑制率/%=(不加药组葡萄糖消耗量-加药组葡萄糖消耗量)/不加药组葡萄糖消耗量×100%。
1.2.4 乳酸生成量检测 实验分组、细胞培养液的收集同葡萄糖检测,根据乳酸测试盒说明进行操作。对待测培养液进行5、10、20倍稀释,选取A值在0.05~0.35的理想取样范围,本实验采用20倍稀释结果,530 nm条件下自动酶标仪测定标准品和样品吸光度值。相对乳酸产量抑制率/%=(不加药组乳酸产量-加药组乳酸产量)/不加药组乳酸产量×100%。
1.2.5 HK活性测定 取对数生长期细胞,调整细胞浓度至1.2×108·L-1,接种于细胞培养瓶中,加入不同浓度的2-DG培养48 h,离心收集细胞沉淀,PBS洗涤,细胞裂解液抽提总蛋白,BCA法定量。根据HK测试盒说明,96孔板中加入相应试剂,340 nm条件下全自动酶标仪测定各孔吸光度,计算HK活性,全蛋白质浓度标化HK活性。
1.2.6 Western blot检测蛋白表达水平 离心收集细胞,PBS洗涤,细胞裂解液抽提总蛋白,BCA法测定蛋白含量,加入蛋白上样缓冲液,混匀,100℃煮沸5 min,每个样分别取25 μg上样,4%~10% SDS-PAGE凝胶电泳分离,转印至PVDF膜,50 g·L-1脱脂奶粉室温封闭1 h后加入相应一抗,4℃孵育过夜,PBS-T洗涤3次,每次5 min,分别加入羊抗兔或羊抗鼠二抗室温孵育2 h,PBS-T洗涤3次,每次10 min,ECL显影,以目的蛋白与内参蛋白β-actin光密度的比值表示目的蛋白的相对表达量。

2 结果
2.1 2-DG抑制白血病细胞的增殖活性 2-DG能够抑制白血病K562及K562/ADM细胞的增殖,且呈时间-剂量依赖关系(Fig 1)。 2-DG处理24 h和48 h后,K562细胞的IC50分别为(8.79±0.82) mmol·L-1和(4.31±0.80)mmol·L-1,K562/ADM细胞为(22.45±1.20)mmol·L-1和(8.58±0.35)mmol·L-1。2-DG对K562细胞的增殖抑制活性强于K562/ADM细胞。

Fig 1 Inhibitory effects of 2-DG on leukemia K562 sensitive cells and K562/ADM resistant cells
A:K562 cells; B:K562/ADM cells
2.2 2-DG抑制HK活性降低葡萄糖有氧糖酵解流量 K562/ADM细胞的HK活性明显高于K562细胞(P<0.01),其活性分别为(78.87±6.08)U·g-1Pro和(39.94±1.74)U·g-1Pro。2-DG能降低两种细胞的HK活性,且对K562/ADM细胞HK活性的抑制作用更为明显(Fig 2)。糖代谢流量检测结果表明2-DG明显降低K562/ADM细胞和K562细胞的葡萄糖消耗量及乳酸产量,但对K562/ADM细胞的抑制率略低于K562细胞(Fig 2),可能是由于K562/ADM细胞的基础有氧糖酵解高于K562细胞的缘故。上述结果提示2-DG能够通过抑制己糖激酶活性而降低糖酵解流量,减低细胞能量供应。此外Fig 2显示2-DG与ADM联合可进一步降低细胞葡萄糖消耗和乳酸生成,提示2-DG联合ADM干扰糖有氧酵解可能增敏化疗药物对白血病细胞的抑制效应。
2.3 2-DG增强K562/ADM细胞对ADM的敏感性 如Fig 3A和3B所示,应用2-DG抑制HK活性均可明显增强K562/ADM细胞和K562细胞对ADM的敏感性。与单用ADM相比,0.5 mmol·L-1和2 mmol·L-12-DG与ADM联合应用后K562细胞增殖抑制率分别平均增高(1.36±0.44) 倍和(1.90±0.86)倍,而K562/ADM耐药细胞增殖抑制率则平均增高(2.44±0.34)倍和(4.96±0.76)倍,2-DG对K562/ADM细胞的增敏效果高于K562细胞(P<0.01,Fig 3C)。提示2-DG抑制有氧糖酵解是降低K562/ADM细胞耐药性的有效途径。
2.4 2-DG联合ADM抑制ADM诱发的mTOR表达和磷酸化增高 如Fig 4所示,2-DG的应用可以增加K562和K562/ADM细胞mTOR表达及磷酸化(p-mTOR)。同时发现,ADM明显增强K562/ADM细胞mTOR的表达和磷酸化,但仅轻度影响K562细胞。经ADM处理后,K562/ADM细胞mTOR及p-mTOR水平分别提高(3.56±0.14)倍及(3.33±0.22)倍,而K562细胞仅增高(1.68±0.05)倍和(1.96±0.06)倍。尽管2-DG和ADM单独应用均可诱导K562细胞和K562/ADM细胞mTOR表达及磷酸化(p-mTOR)增高,但二者联合应用却可明显抵抗单一用药引起的mTOR表达及磷酸化增高,以K562/ADM耐药细胞尤为明显。联合应用ADM和2-DG,细胞mTOR表达及磷酸化水平均被抑制至接近基础水平。
GLUT-4是细胞摄入葡萄糖的重要转运蛋白,也是mTOR信号通路的下游底物分子[8-9]。Fig 4显示,K562/ADM细胞GLUT-4的表达水平高于K562敏感细胞(P<0.05)。ADM单独或与2-DG联合应用,均对K562细胞GLUT-4的表达无明显影响,但两者联合用药则明显降低K562/ADM细胞GLUT-4的表达水平。上述结果提示2-DG联合ADM降低细胞mTOR、p-mTOR和GLUT-4表达,减低细胞葡萄糖的摄入,从而抑制细胞糖酵解供能,可能是其增强白血病耐药细胞药物敏感性的重要作用机制。
3 讨论
与正常细胞相比肿瘤细胞具有高消耗葡萄糖和偏好糖酵解供能的特点,有氧糖酵解是肿瘤细胞能量代谢的重要特征,肿瘤细胞的生长、增殖和侵袭等恶性表型高度依赖增强的有氧糖酵解[1-4]。据此提出了采用阻断糖酵解途径的策略抗肿瘤的思路。2-DG作为天然葡萄糖的类似物可被肿瘤细胞高度摄取,能够和葡萄糖竞争性结合己糖激酶,但不能转化为磷酸果糖而使得糖酵解停止,同时消耗大量己糖激酶,造成细胞内ATP生成减少,细胞内能量缺失而抑制肿瘤生长及促进肿瘤细胞凋亡[3-4]。本文研究证实己糖激酶抑制剂2-DG能够抑制白血病K562敏感细胞和K562/ADM耐药细胞的增殖,2-DG联合阿霉素能够明显提高白血病多药耐药K562/ADM细胞对阿霉素的敏感性,克服其耐药性。2-DG抑制HK活性会导致糖酵解和磷酸戊糖途径的双重抑制,前者的抑制可以减少细胞对葡萄糖的摄取,限制能量的产生,同时降低乳酸分泌,增加细胞外环境pH,下调H+-ATP相偶联的酶和转运蛋白的功能,增加细胞对药物的吸收和效率;后者的抑制减少了细胞增殖所需的关键分子5-磷酸核糖合成,限制核酸的合成速度,同时还能够减少NADPH的合成,降低细胞对药物的解毒能力和对氧化损伤的防御能力[3-4]。2-DG通过抑制HK活性进而阻断糖酵解途径、降低细胞内ATP的生成,影响细胞增殖-死亡相关信号通路是其抗肿瘤作用的主要机制。

Fig 2 Effects of 2-DG alone or combined with ADM on aerobic glycolysis in leukemia K562 sensitive cells and K562/ADM resistant cells(48 h)
A,B,C:K562 cells,D,E,F:K562/ADM cells.*P<0.05,**P<0.01vsADM alone group;#P<0.05,##P<0.01vs2-DG/0.5 mmol·L-1treated group;▲P<0.05,▲▲P<0.01vsControl

Fig 3 2-DG increases sensitivity of K562/ADM and K562 cells to ADM(48 h)
A:K562 cells;B:K562/ADM cells;C:The comparison of increased folds of inhibitory rate between K562/ADM and K562 cells*P<0.05,**P<0.01vscombination of ADM and 2-DG with ADM alone,#P<0.05,##P<0.01vsK562 with K562/ADM cells.
1958年Landau等首次报道2-DG的抗肿瘤作用,但长期以来2-DG单一用药疗效较差,用药剂量较高,严重限制了其临床推广和应用[4]。有关2-DG对耐药性肿瘤细胞作用的研究更为少见。依赖ABC转运蛋白家族成员介导的主动药物外排是肿瘤耐药现象发生的主要机制,研究报道2-DG对化疗药物具有增敏效应,并逆转耐药细胞的耐药性,其机制可能与细胞药物转运蛋白表达减少、ATP生成降低进而抑制药物转运蛋白的“泵出”功能有关[4,6,7]。此外,研究发现肿瘤中普遍存在PI3K/AKT/mTOR 信号通路的异常活化,PI3K 和mTOR 协同调控肿瘤的生长、增殖和耐药等特性,mTOR是细胞内诸多信号通路的交汇点,是细胞营养摄取、能量代谢、增殖、生长和分化等的综合性控制节点[10-13]。异常活化的mTOR可经转录因子c-Myc、HIF-1(hypoxia-inducible factor-1)等调控细胞糖酵解过程的代谢酶活性及转运体功能[9-10],通过代谢代偿、凋亡抵抗等多种方式增强细胞的生长或增殖能力,导致肿瘤细胞抵抗药物的杀伤效应[12-14]。本研究发现低剂量2-DG单独应用能够促进mTOR表达及磷酸化(p-mTOR),这可能是导致2-DG单一用药疗效较差、用药剂量较高的原因;同时ADM明显增强K562/ADM细胞mTOR表达和磷酸化水平,提示该信号分子的高表达和激活可能与K562/ADM细胞耐药性的发生密切相关。mTOR 高表达和活化后,经由其下游代谢相关分子介导,代偿性的导致有氧糖酵解流量增加,有氧糖酵解的增强又可以通过迅速产生ATP、酸化细胞外环境、加强核酸蛋白质合成的中间代谢产物等多种方式引起肿瘤细胞对化疗药物的抵抗[3-4]。本文证实2-DG与ADM联合应用可明显抵抗ADM诱发的K562/ADM细胞mTOR表达和磷酸化增强,降低mTOR信号通路下游分子GLUT-4的表达,抵抗肿瘤细胞的代谢代偿,协同性地提高该耐药细胞对阿霉素的敏感性、逆转其耐药性。尽管2-DG作为经典的HK抑制剂被使用,但其对细胞作用的机制复杂,有报道称2-DG还具有激活AMPK、抑制自噬、抑制细胞的糖基化、干扰蛋白质的组装等作用[15]。因此,2-DG增强肿瘤细胞药物敏感性的确切分子机制尚有待进一步研究。
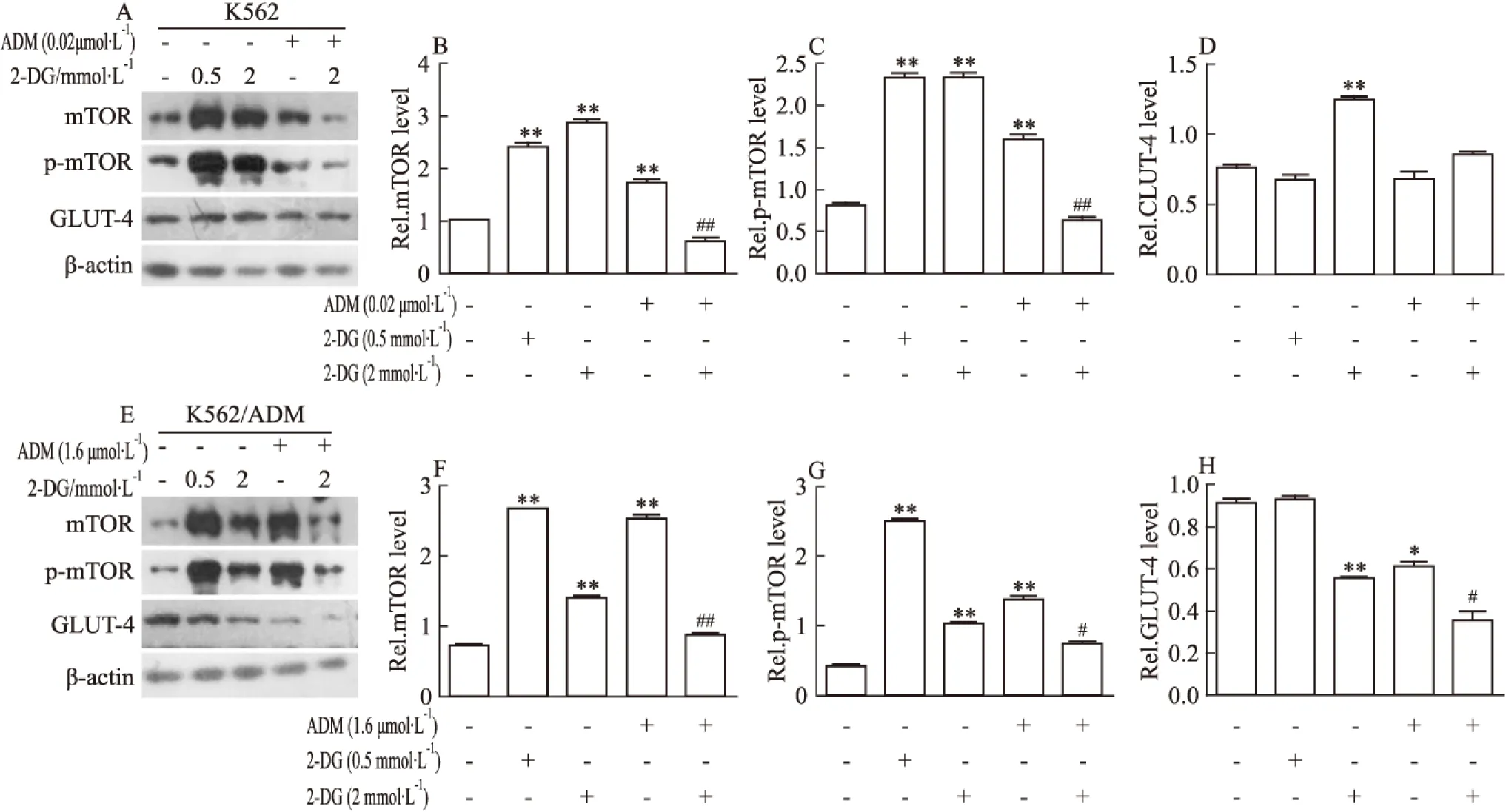
Fig 4 Expression and phosphorylation of mTOR and GLUT-4 expression in K562/ADM and K562 cells treated with 2-DG and/or ADM
A,B,C,D: mTOR,p-mTOR and GLUT-4 levels in K562;E,F,G,H: mTOR,p-mTOR and GLUT-4 levels in K562/ADM.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsADM alone group
综上所述,与亲本细胞相比,白血病K562/ADM耐药细胞HK活性和有氧糖酵解增强,2-DG不仅通过竞争性抑制HK活性干扰糖酵解途径,而且能抑制ADM诱导的mTOR高表达和磷酸化介导的代谢代偿,而抑制K562/ADM耐药细胞的增殖和降低其耐药性,增强白血病耐药细胞对化疗药物的敏感性。
( 致谢:本文实验在兰州大学基础医学院甘肃省新药临床前研究重点实验室完成,在此表示由衷的感谢。)
[1] Vander Heiden M G,Cantley L C,Thompson C B. Understanding the Warburg effect:the metabolic requirements of cell proliferation[J].Science,2009,324(5930):1029-33.
[2] Hsu P P, Sabatini D M. Cancer cell metabolism:Warburg and beyond[J].Cell,2008,134:703-7.
[3] Hamanaka R B,Chandel N S. Targeting glucose metabolism for cancer therapy[J].JExpMed,2012,209(2):211-5.
[4] Zhao Y,Butler E B,Tan M. Targeting cellular metabolism to improve cancer therapeutics[J].CellDeathDis,2013,4:e532.
[5] Zhang X Y,Ai Z Y,Chen J,et al. Glycometabolic adaptation mediates the insensitivity of drug-resistant leukaemia K562/ADM cells to adriamycin via the AKT-mTOR/c-Myc pathway[J].MolMedRep,2016:in press.
[6] 申 勇,孙伟莉,袁 超,等. 99mTc-MIBI评价2-脱氧-D-葡萄糖对鼻咽癌耐药株多药耐药的逆转作用及机制[J].中国药理学通报,2015,31(10):1433-8.
[6] Shen Y,Sun W L,Yuan C,et al.Evaluation of reversal effect of 2-DG on multidrug resistance by detecting uptake of 99mTc-MIBI in HNE-1 /DDP cells[J].ChinPharmacolBul,2015,31(10):1433-8.
[7] 程 秀,刘 浩,方 琳,等. 2-DG 增强乳腺癌细胞对阿霉素化疗敏感性的作用[J]. 中国药理学通报,2010,26(10): 1371-6.
[7] Cheng X,Liu H,Fang L,et al.2-DG enhances chemosensitivity of breast cancer cells to adriamycin[J].ChinPharmacolBull,2010,26(10):1371-6.
[8] Chen W,Gueron M. The inhibition of bovine heart hexokinase by 2-deoxy-D-glucose-6-phosphate:characterization by 31P NMR and metabolic implications[J].Biochimie,1992,74(9-10):867-73.
[9] Yeung S J,Pan J,Lee M H. Roles of p53,MYC and HIF-1 in regulating glycolysis-the seventh hallmark of cancer[J].CellMolLifeSci:CMLS,2008,65(24):3981-99.
[10]Duvel K,Yecies J L,Menon S,et al. Activation of a metabolic gene regulatory network downstream of mTOR complex 1[J].MolCell,2010,39(2):171-83.
[11]Martin D E,Hall M N. The expanding TOR signaling network[J].CurrOpinCellBiol,2005,17(2):158-66.
[12]Cerella C,Gaigneaux A,Dicato M,Diederich M. Antagonistic role of natural compounds in mTOR-mediated metabolic reprogramming[J].CancerLett,2015,356(2 Pt A):251-62.
[13]王传振,马淑梅,石 群,等.2-脱氧葡萄糖联合雷帕霉素诱导结肠癌 HCT-116 细胞的凋亡作用研究[J].世界临床药物,2015,36(6):400-4.
[13]Wang C Z,Ma S M,Shi Q,et al. Anti-tumor effect of 2-deoxy-D-glucose combined with rapamycin against the colon cancer HCT-116 cell lines[J].WorldClinDrugs,2015,36(6):400-4.
[14]Estan M C,Calvino E,de Blas E,et al. 2-Deoxy-D-glucose cooperates with arsenic trioxide to induce apoptosis in leukemia cells:involvement of IGF-1R-regulated Akt/mTOR,MEK/ERK and LKB-1/AMPK signaling pathways[J].BiochemPharmacol,2012,84(12):1604-16.
[15]Chen K,Xu X,Kobayashi S,et al. Caloric restriction mimetic 2-deoxyglucose antagonizes doxorubicin-induced cardiomyocyte death by multiple mechanisms[J].JBiolChem,2011,286(25):21993-2006.
2-Deoxyglucose improves sensitivity of leukemia drug-resistant K562/ADM cells to adriamycin by blocking aerobic glycolysis
ZHANG Xue-yan1, AI Zi-ying1, GOU Ze-peng2, CHEN Jing1, YI Juan1, ZHAO Huai-shun1, WEI Hu-lai1
(1.SchoolofBasicMedicalScience,LanzhouUniversity,KeyLaboratoryofPreclinicalStudyforNewDrugsofGansuProvince,Lanzhou730000,China; 2.OutpatientDepartment,InstitutionHospitalofLanzhouMilitaryRegion,Lanzhou730000,China)
Aim To investigate the effect of 2-deoxy-D-glucose(2-DG) on the sensitivity of leukemia multidrug resistant K562/ADM cells to adriamycin by inhibiting glycolytic pathway as well as its molecular mechanisms.Methods The leukemia drug-resistant K562/ADM cells and parental K562 cells were used as the target cell models. The cell proliferating activity was assessed with an MTT colorimetric assay, and the glycolysis including glucose consumption,lactate export,and hexokinase activity was determined by glucose, lactic acid and hexokinase(HK) testing kits. The expression and phosphorylation of mammalian target of rapamycin(mTOR) and glucose transporter-4(GLUT-4) expression were analyzed by western blot.Results K562/ADM drug-resistant cells possessed higher HK activity,GLUT-4 expression level and aerobic glycolic ability than K562 sensitive cells. 2-DG treatment markedly inhibited HK activity,glucose consumption, and lactate export both in K562 cells and K562/ADM cells, and suppressed the proliferation of the two cells in a time-and concentration-dependent manner. Low concentration of 2-DG or adriamycin could increase the expression and phosphorylation of mTOR. However, the co-administration of 2-DG and adriamycin markedly counteracted adriamycin-mediated enhancement of mTOR expression and phosphorylation and down-regulated GLUT-4 expression in K562/ADM cells,and 2-DG dramatically improved the sensitivity of K562/ADM cells to cytotoxicity.Conclusion 2-DG inhibits the proliferation of drug-resistant K562/ADM cells and enhances the sensitivity to adriamycin by blocking aerobic glycolysis pathway through inhibiting hexokinase activity, counteracting adriamycin-stimulated increased expression and phosphorylation of mTOR and downregulating GLUT-4 expression.
2-deoxy-D-glucose;adriamycin;multidrug resistance; aerobic glycolysis;mTOR;GLUT-4;leukemia
时间:2016-12-27 16:13
http://www.cnki.net/kcms/detail/34.1086.R.20161227.1613.044.html
2016-08-12,
2016-12-20
国家自然科学基金资助项目(No 81541025,81141053); 兰州大学中央高校基本科研业务费专项资金资助项目(No lzujbky-2014-136)
张雪燕(1979-),女,博士,讲师,研究方向:细胞分子生物学,E-mail: yan730000@163.com; 魏虎来(1962-),男,硕士,教授,博士生导师,研究方向: 细胞分子生物学,通讯作者,E-mail: weihulai@lzu.edu.cn
10.3969/j.issn.1001-1978.2017.01.022
A
1001-1978(2017)01-0126-07
R329.24;R343.23;R733.7;R977.6;R979.14
