细胞周期调节因子基因在H9c2心肌细胞肥大过程中的时相性表达变化
2017-02-08李敬美丁圆媛潘夕春陈晓红张海港
李敬美,丁圆媛,潘夕春,刘 雅,陈晓红,张海港
(1.第三军医大学药学院药理教研室,2.药物研究所与药剂学教研室,重庆 400038)
细胞周期调节因子基因在H9c2心肌细胞肥大过程中的时相性表达变化
李敬美1,丁圆媛1,潘夕春1,刘 雅2,陈晓红1,张海港1
(1.第三军医大学药学院药理教研室,2.药物研究所与药剂学教研室,重庆 400038)
目的 观察血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)诱导H9c2心肌细胞肥大过程中细胞周期调控因子mRNA的时相性表达。方法 Ang Ⅱ (1.0 μmol·L-1) 刺激H9c2细胞,分别于0 min、5 min、10 min、30 min、1 h、2 h、3 h、6 h、12 h、24 h、48 h,罗丹明标记鬼笔环肽染色并检测细胞面积;Real-time PCR法检测细胞周期蛋白(cyclin)B、D、E,细胞周期蛋白依赖性激酶(cyclin-dependent kinases,CDK)1、2、4、6,以及CDK抑制因子p21 mRNA的表达变化情况。结果 随着Ang Ⅱ刺激时间的延长,H9c2细胞面积逐渐增大;细胞周期调节因子均于刺激后出现短暂反应性表达增加,周期蛋白E与CDK2、CDK4 mRNA在5 min时达到峰值,周期蛋白D mRNA在10 min时达到峰值,随后一直呈减少趋势;CDK6与周期蛋白B mRNA表达出现双峰现象,分别于5 min和30 min达第一峰,随后表达减少,于2 h达最低点,接着又表达增加,于12 h达第二峰。p21 mRNA表达量于30 min达峰值,随后逐步减少,3 h时表达最低,之后又缓慢增加。结论 Ang Ⅱ诱导H9c2心肌细胞肥大发生的病理过程与细胞周期调控因子的震荡性表达相关,各因子共同促进细胞肥大反应。
心肌肥大;心肌细胞;细胞周期;细胞周期蛋白;细胞周期蛋白依赖性激酶;细胞周期蛋白依赖性激酶抑制因子p21
心肌肥大(cardiac hypertrophy)是冠心病、高血压、心律失常等众多心血管疾病的独立危险因素,然而其病理生理机制尚未完全阐明。传统观点认为心肌细胞是一种终末分化细胞,出生后不久即退出细胞周期,近年研究表明在受到病理刺激后心肌细胞可以重新进入细胞周期[1-3],DNA及蛋白质合成增加,但一般不发生分裂,表现为心肌细胞肥大。我们前期研究证实,细胞周期蛋白依赖性激酶抑制因子1a (cyclin-dependent kinase inhibitor 1a, CDKN1a,p21) 在血管紧张素Ⅱ(angiotensinⅡ,Ang Ⅱ)诱导H9c2细胞肥大及异丙肾上腺素灌注诱导的小鼠心肌肥大模型中均异常表达;调控p21能有效抑制H9c2细胞肥大反应,减轻小鼠心肌肥大。鉴于细胞周期是非常复杂而精细的调节过程,有大量周期调节蛋白参与其中,细胞周期依赖性蛋白激酶(cyclin-dependent kinase, CDK) 是核心成员,与细胞周期蛋白(cyclin)、CDK抑制因子(CDK inhibitor,CKI) 等组成了细胞周期调控的网络系统;CDK的激活依赖于cyclin,同时CDK的活性可以被CKI所抑制[4-6]。心肌肥大是心脏对机械负荷及其神经体液因子的改变,进而维持适当收缩的代偿反应以致失代偿的动态发展的复杂病理生理过程,而目前对细胞周期调节因子尚缺少连续性系统观察,难以揭示心肌肥大发生过程中细胞周期改变的时空规律。本研究拟利用血管紧张素(angiotensin,Ang) Ⅱ诱导H9c2心肌细胞,动态观察心肌肥大发展过程中cyclin B/D/E、CDK 1/2/4/6、p21 mRNA的表达变化,寻找其表达变化规律,进一步揭示心肌细胞肥大机制,为基于调控细胞周期防治心肌肥大的治疗策略提供实验依据。
1 材料与方法
1.1 材料
1.1.1 仪器与试剂 CFX Connect real-time PCR仪、SmartSpec 3000型分光光度计、SYBR GREEN定量超混液(Bio-Rad公司,美国);DMI3000B型荧光倒置显微镜(Leica公司,德国);3111型二氧化碳培养箱(Thermo公司,美国);3K18型离心机(Sigma公司,德国);XDS-200C型显微镜(蔡康光学仪器有限公司,上海);血管紧张素Ⅱ(MedChem Express公司,美国);胎牛血清(Hyclone公司,美国);DMEM培养基(Gibco公司,美国);罗丹明标记的鬼笔环肽(Sigma公司,美国);DAPI染色液(碧云天生物技术公司,江苏);RNAiso Plus、RNA逆转录试剂盒(TaAaRa公司,日本)。
1.1.2 试验细胞 大鼠心肌细胞株H9c2购自中国科学院上海细胞库。
1.2 方法
1.2.1 细胞的分组与处理 将H9c2细胞分别以1×104和3×105的密度接种于24孔和12孔培养板,置于37℃、5% CO2的培养箱中孵育24 h后换无血清培养基,培养24 h后用Ang Ⅱ(1.0 μmol·L-1)分别孵育0 min、5 min、10 min、30 min、1 h、2 h、3 h、6 h、12 h、24 h、48 h。
1.2.2 细胞面积的检测 将细胞取出无菌室,吸弃培养基,磷酸盐缓冲液(PBS)洗涤2次;4%多聚甲醛固定30 min。PBS洗涤2次;0.5%TritonX-100室温孵育15 min,20 mg·L-1罗丹明标记的鬼笔环肽避光染色40 min,PBS洗涤3次后DAPI染色5 min。荧光显微镜下观察细胞,采用Image J软件测量50个细胞的面积,取平均值。
1.2.3 Real-time PCR检测细胞周期因子mRNA表达变化 使用Primer 5.0进行引物设计,引物由上海生工生物工程有限公司合成,序列如下:

PrimernameForwardprimer(5′⁃3′)Reverseprimer(5′⁃3′)Annealingtemperatureβ⁃actinCGTAAAGACCTCTATGCCAACATAGGAGCCAGGGCAGTAATC58℃CDK1TCTTCGCTCGTTAAGAGTTACATCTGCCAGTTTGATTGTTC58℃CDK2GTTGACGGGAGAAGTTGTGGGCTTGACGATGTTAGGGTGAT58℃CDK4CTACGGACATACCTGGACAAAAATCTAGGCCGCTTAGAAACT58℃CDK6GTGGAAGTTCAGACGTGGATCAAGCATTTCAGAAGGAGGT58℃CyclinBCAGGCTTTCTCCGATGTGATTGCTCTTCCTCCAGTTGTCTG58℃CyclinD1GCCCTCCGTTTCTTACTTCACTCCTCTTCGCACTTCTGCT58℃CyclinEGTCAACGACACGGGAGAAGTAGCAGCGAGGACACCATAAG58℃p21GGTGATGTCCGACCTGTTCCACGCTCCCAGACGTAGTTGC58℃
如前所述处理细胞,RNAiso Plus提取细胞总RNA。按照RNA逆转录试剂盒操作说明书合成cDNA,按如下程序进行PCR反应:95℃,3 min;45个循环(95℃,10 s;58℃,30 s;72℃,30 s);72℃,10 min;添加熔解曲线。采用 2-ΔΔCt法计算mRNA的相对表达量。
2 结果
2.1 AngⅡ刺激H9c2细胞面积增加 对照组H9c2细胞呈梭形、多角形。随着Ang Ⅱ刺激时间的延长,H9c2细胞面积逐渐增大(Fig 1A);Ang Ⅱ刺激10 min,H9c2细胞面积较对照组增大(P<0.05),当刺激至24~48 h,细胞面积达对照组的2.5~3.0倍(Fig 1B)。
2.2 AngⅡ诱导H9c2心肌细胞cyclin B/D/E基因的时相性表达 Ang Ⅱ刺激H9c2细胞cyclin B mRNA的时相性表达呈现明显的“波峰”和“波谷”,初始逐渐增加至30 min达峰值,较对照组增加了70%;而后表达量减少,2 h时表达最低,基本恢复正常水平。之后随着Ang Ⅱ刺激时间延长,cyclin B mRNA表达逐渐升高,6 h时出现第二次峰值之后表达量又逐渐减小,48 h出现表达量的第二个“波谷”(Fig 2A)。cyclin D mRNA表达量先是缓慢增加,10 min升至最高点,较对照组增加了25%;随后急剧下降,到1 h时其表达量仅为正常对照组的一半,并维持于低水平,从3 h开始,cyclin D mRNA表达量缓慢回升,至24 h基本恢复至正常水平;但48 h时,其表达量再次降低 (Fig 2B)。Ang Ⅱ处理H9c2细胞后,cyclin E mRNA表达瞬时升高,5 min时表达量即达到对照组的3倍;随后其表达量随着时相点的延长逐渐减少,3 h时降至正常水平以下并维持至6 h;随后在12 h恢复接近正常水平 (Fig 2C)。
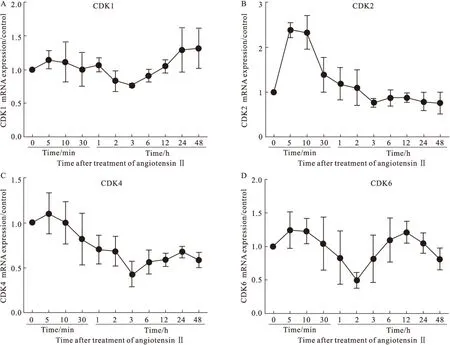
2.3 AngⅡ诱导H9c2心肌细胞CDK 1/2/4/6基因的时相性表达 在Ang Ⅱ刺激H9c2细胞5 min即诱导CDK 1/2/4/6 mRNA表达增高,其中CDK2 mRNA表达增加最为明显,较对照组增加1.5倍;随后CDK 1/2/4和6的mRNA表达开始下降,在3 h时CDK1 mRNA表达降至最低位,仅为正常对照组的70%,后又迅速升高,于24~48 h达到正常对照组1.5倍。随着Ang Ⅱ刺激时间延长,CDK2和CDK4 mRNA表达呈现“阶梯式”下降,3 h时达最低点,与对照组相比,分别降低了30%和60%,而后虽有小幅度升高,但总体维持于较低水平。CDK6 mRNA表达量在 Ang Ⅱ刺激5 min之后逐步降低,2 h时达最低点,而后升高至12 h后又呈现下降趋势 (Fig 3)。
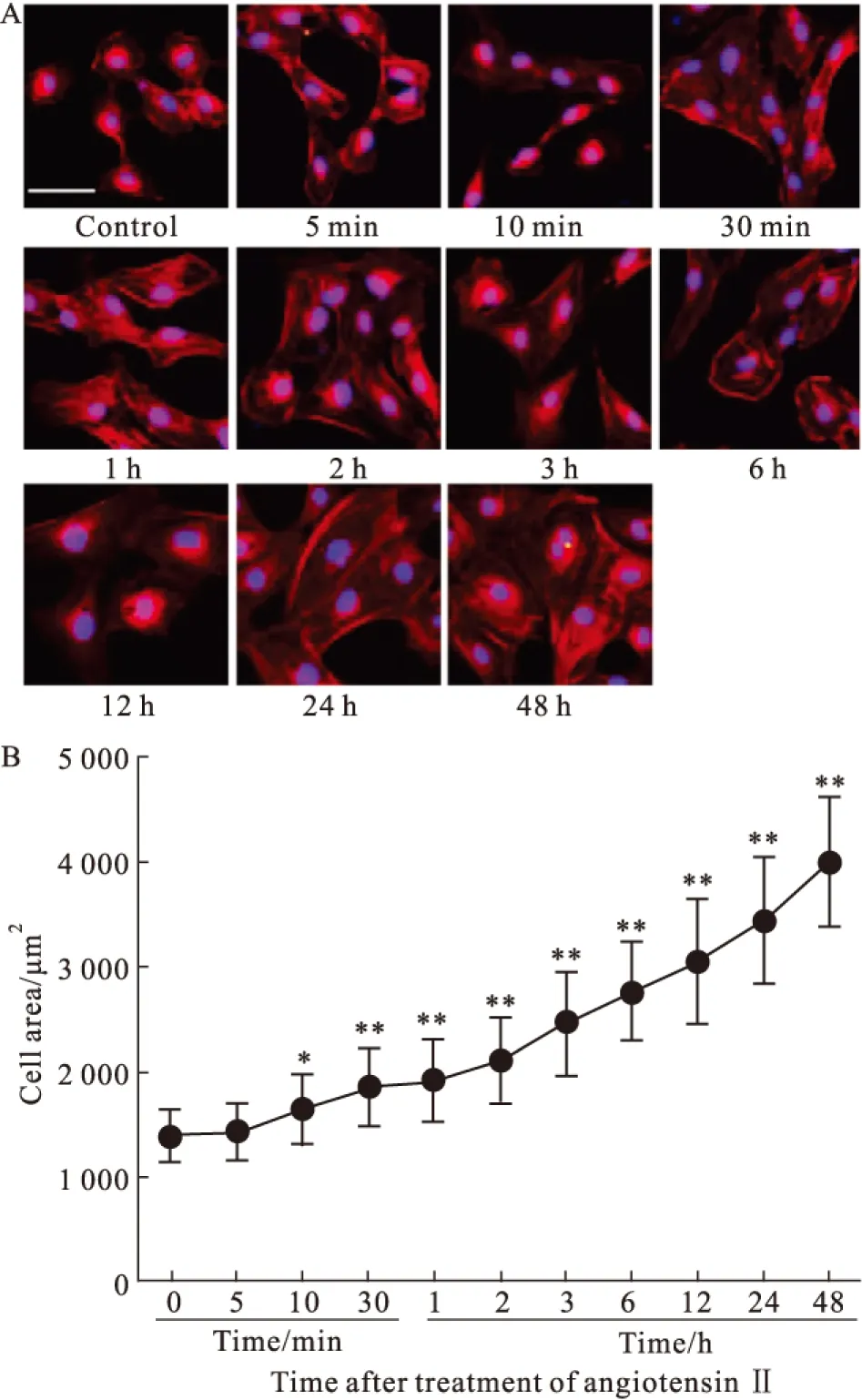
Fig 1 Increase of H9c2 cell areas treated with angiotensin Ⅱ
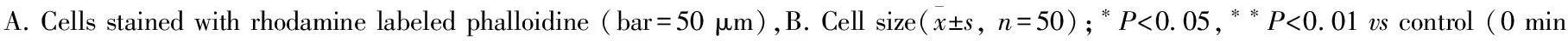
2.4 AngⅡ诱导H9c2心肌细胞p21 基因的时相性表达 Ang Ⅱ诱导H9c2细胞p21 mRNA表达逐渐增加,刺激30 min时p21 mRNA表达达峰值,较对照组增加了70%;之后随着刺激时间的延长,p21 mRNA表达量急剧减少,至3 h时相比对照组降低了50%,之后虽有缓慢增加,但是均维持在较低水平 (Fig 4)。
3 讨论
心肌肥大在细胞水平上指心肌细胞体积增大而无细胞分裂的一种现象,是多因素参与调节的复杂病理生理过程[7-8]。各种病理因素刺激循环及心肌局部的儿茶酚胺及Ang Ⅱ水平增加,促进全身微动脉收缩、增加外周血管阻力,诱导心肌肥大的发生发展。H9c2 细胞源于BD1X大鼠胚胎心脏组织,是兼具心肌和骨骼肌功能的特异心肌细胞株系,能够良好模拟乳大鼠原代心肌细胞的生物学特性且能够分裂,因此被广泛应用于心肌肥大的研究。本实验中AngⅡ作用于H9c2细胞,随着刺激时间的延长,H9c2体积逐渐增大,且出现“双核”现象,提示心肌肥大的细胞模型复制成功。
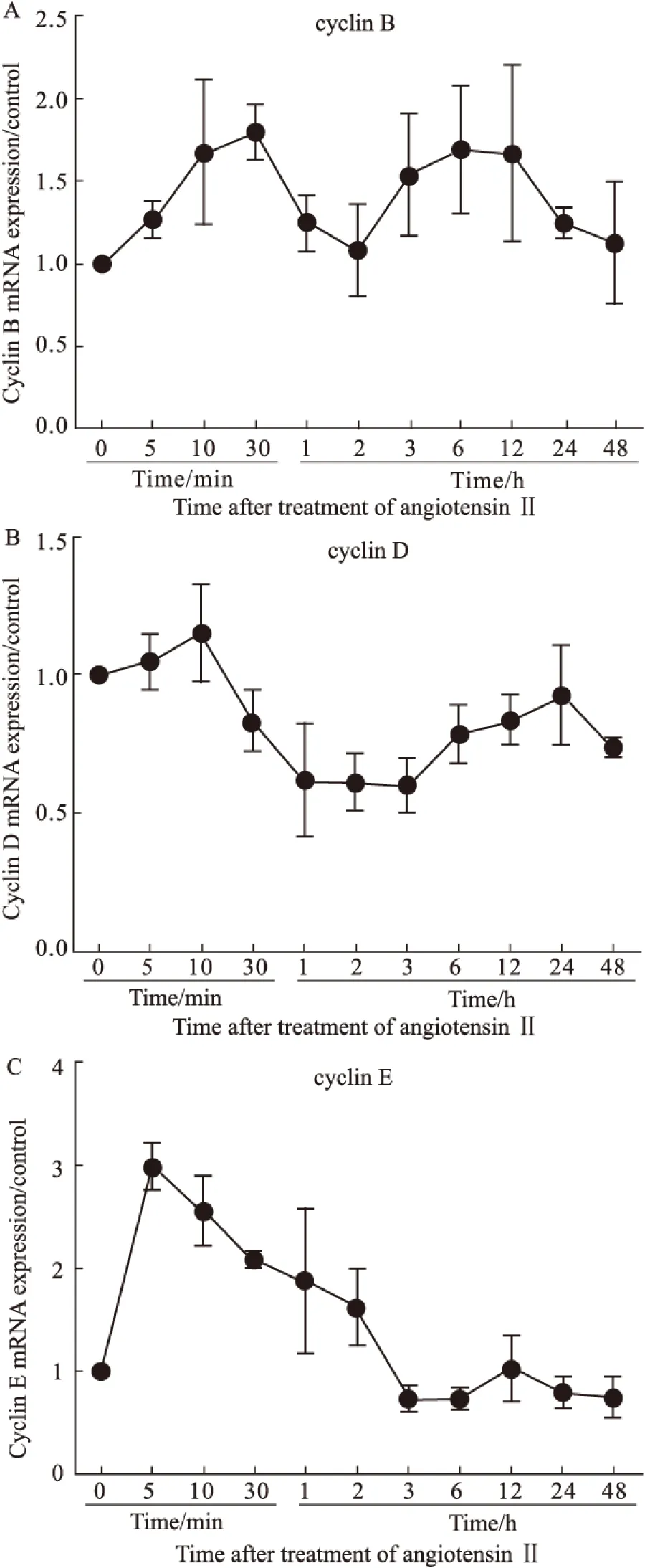
Fig 2 mRNA expressions of cyclin B, D and E in H9c2 cells treated with angiotensin Ⅱ
Cyclin、CDK、CKI 是细胞周期调控的内源性分子,三者在细胞周期中相互协调,形成复杂的调控网络。在细胞周期不同时期,细胞周期调控点有不同cyclin/CDK复合物形成[9];截至目前,已经确定的CDKs就达21种[10],但仅有CDK1/2/4/6参与细胞周期的调控[11-12];CDK被激活之后发挥蛋白激酶活性,在cyclin/CDK复合物中作为催化亚基。cyclin是一类呈细胞周期特异性或时相性表达、累积与分解的蛋白质,在cyclin/CDK复合物中作为调节亚基。细胞周期蛋白cyclin D在细胞周期开始启动时首先被合成,与其相应的周期蛋白激酶CDK4或CDK6结合形成复合物,在G1中至晚期发挥作用[13];cyclin E是另一种G1期细胞周期蛋白,激活激酶CDK2,共同作用于G1晚期[14];cyclin B能与CDK1结合,组成复合物MPF(maturation promoting factor),促进细胞进入有丝分裂期,cyclin B作为细胞增殖必不可少的调控蛋白,主要于G2末期发挥作用[14]。

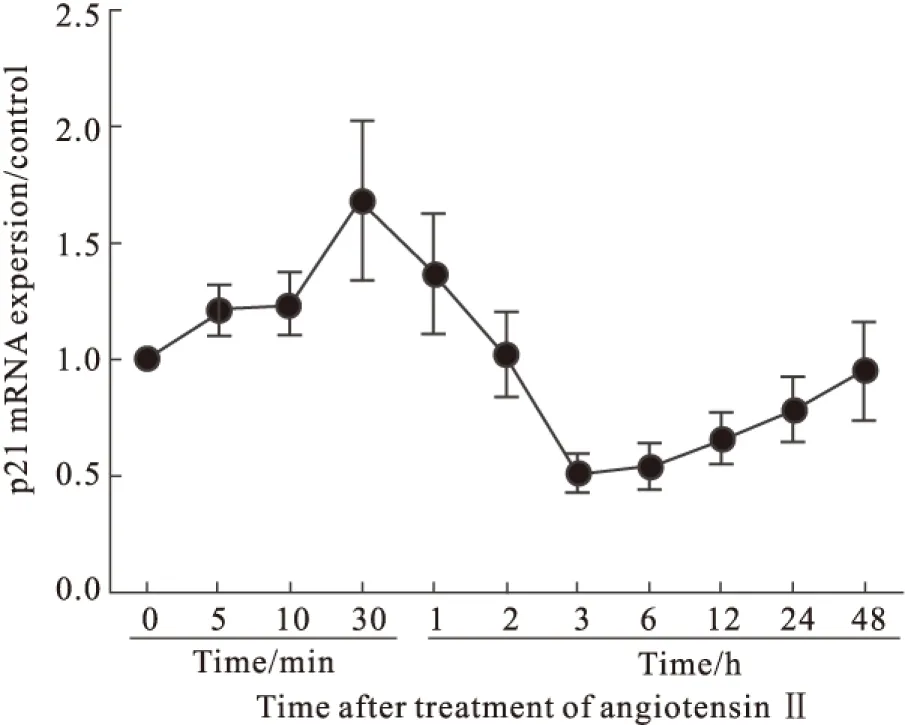

本研究发现,在AngⅡ刺激10 min内,H9c2细胞内CDK4、CDK6、cyclin D mRNA的合成逐步增加。这些周期调节因子能够促进多种与蛋白质、DNA合成密切相关的酶的转录,为细胞进入S期做准备。在AngⅡ刺激2h内,cyclin E与CDK2均处于高表达,这与细胞中核内复制有关;而cyclin B与CDK1在刺激3h后一直处于高水平表达,可促进细胞进入M期,完成细胞质分裂的需要。p21属于CKI中的Cip/Kip家族成员,可以广泛地作用于CDK-cyclin复合物并抑制它们的活性,特别是作用于G1期的CDK 4/6-cyclin D复合物导致细胞周期阻滞,阻止损伤DNA的复制[10,15]。本实验中随着AngⅡ刺激时间的延长,p21基因表达于30 min达峰值,随后逐步减少,3h时表达最低,之后又缓慢增加,但一直维持低水平表达。因此,随着AngⅡ刺激时间的延长,心肌细胞可以重新进入细胞周期,通过G1/S检查点,进入了S期,合成核酸和蛋白质,促进心肌细胞发生肥大反应;但是重返细胞周期的肥大心肌细胞无法顺利通过G2/M检测点,导致细胞核分裂而胞质未能完成分裂,因而出现部分双核细胞。这提示重返细胞周期的心肌细胞没有顺利的完成细胞分裂,其细胞周期再次被阻滞了;而p21WAF1/CIP1基因是目前已知最广泛的细胞周期抑制因子,其对细胞周期复杂而又精细的调节作用,广泛影响细胞周期发展的各阶段。p21是通过竞争性与细胞周期蛋白依赖性激酶(CDK)结合,影响cyclins的磷酸化,从而影响细胞周期的运行[14]。在本研究中发现,随着AngⅡ刺激时间的延长,细胞周期调控因子CDKs、cyclins、p21 mRNA均呈波动性的表达,且重返细胞周期的心肌细胞并未完成胞质分裂,而是再次被阻滞,这是细胞周期正、负调控因子之间的相互作用的结果,与其在细胞中的表达变化分不开,在心肌肥大过程中p21基因震荡性表达参与细胞周期的调控。
本研究结果显示,在病理性刺激下,心肌细胞周期各调控因子基因表达水平呈时相性震荡,共同促进心肌细胞重返细胞周期。本研究同时提示,在持续病理性刺激下,即使一些细胞周期正调控因子表达水平持续升高,细胞周期仍然被阻滞,致使细胞无法正常分裂,最终导致心肌细胞肥大。因此尚需对在心肌肥大过程中细胞周期调控因子之间的相互作用进行深入探讨,为心肌肥大治疗提供新的策略。
(致谢:本研究在第三军医大学药学院药理学教研室完成,感谢张海港教授在本文完成过程中给予的指导和建议。)
[1] Estrella N L, Clark A L, Desjardins C A, et al. MEF2D deficiency in neonatal cardiomyocytes triggers cell cycle re-entry and programmed cell deathinvitro[J].JBiolChem, 2015,290(40): 24367-80.
[2] Li Y, Hu S, Ma G, et al. Acute myocardial infarction induced functional cardiomyocytes to re-enter the cell cycle[J].AmJTranslRes, 2013, 5(3): 327-35.
[3] Zebrowski D C, Engel F B. The cardiomyocyte cell cycle in hypertrophy, tissue homeostasis, and regeneration[J].RevPhysiolBiochemPharmacol, 2013, 165: 67-96.
[4] Di Stefano V, Giacca M, Capoqrossi M C, et al. Knockdown of cyclin-dependent kinase inhibitors induces cardiomyocyte re-entry in the cell cycle[J].JBiolChem, 2011, 286(10): 8644-54.
[5] Quereda V, Porlan E, Malumbres M et al. An essential role for Ink4 and Cip/Kip cell-cycle inhibitors in preventing replicative stress[J].CellDeathDiffer, 2016, 23(3): 430-41.
[6] Xu H, Wang Z, Jin S, et al. Dux4 induces cell cycle arrest at G1 phase through upregulation of p21 expression[J].BiochemBiophysResCommun, 2014, 446 (1): 235-40.
[7] 王桂君,姚玉胜,王洪新.Ca2+/CaMKⅡ信号通路在肿瘤坏死因子-α诱导心肌肥大中的作用[J]. 中国药理学通报,2010,26(3):387-91.
[7] Wang G J,Yao Y S,Wang H X. Ca2+/calmodulin-dependent kinase Ⅱ are involved in tumor necrosis factor α-induced cardiomyocyte hypertrophy in rats[J].ChinPharmacolBull, 2010, 26(3): 387-91.
[8] 罗佳妮,周四桂,陈少锐,等. 短链脂酰辅酶A脱氢酶与心肌肥大关系的初步探索[J]. 中国药理学通报,2013,29(5):637-42.
[8] Luo J N, Zhou S Z, Chen S R, et al. Relationship between short-chain acly-coenzyme A dehydrogenase and myocardial hypertrophy [J].ChinPharmacolBull, 2013, 29(5): 637-42.
[9] Hinrichsen R, Hansen A H, Hauns S, et al. Phosphorylation of pRb by cyclin D kinase is necessary for development of cardiac hypertrophy[J].CellProlif, 2008, 41(5): 813-29.
[10]Karimian A, Ahmadi Y, Yousefi B. Multiple functions of p21 in cell cycle, apoptosis and transcriptional regulation after DNA damage[J].DNARepair, 2016, 42: 63-71.
[11]Pavlides S C, Lecanda J, Daubriac J, et al. TGF-β activates APC through Cdh1 binding for Cks1 and Skp2 proteasomal destruction stabilizing p27kip1 for normal endometrial growth[J].CellCycle, 2016, 15(7): 931-47.
[12]Lee E W, Lee M S, Camus S, et al. Differential regulation of p53 and p21 by MKRN1 E3 ligase controls cell cycle arrest and apoptosis[J].EMBOJ, 2009, 28(14): 2100-13.
[13]Liu X, Tang Z, Zou P, et al. Bcl-1 rearrangement and cyclin D1 protein expression in multiple myeloma precursor cell[J].JTonqjiMedUniv, 2000, 20(2): 128-31.
[14]Ahuja P, Sdek P, Maclellan W R. Cardiac myocyte cell cycle control in development, disease and regeneration[J].PhysiolRev, 2007, 87(2): 521-44.
[15]Oyama K, Takahashi K, Sakurai K. Hydrogen peroxide induces cell cycle arrest in cardiomyoblast H9c2 Cells, which is related to hypertrophy[J].BiolPharmBull, 2011, 34(4): 501-6.
Temporal expressions of cell cycle regulators mRNA during hypertrophic process of H9c2 rat cardiomyocytes induced by angiotensin Ⅱ
LI Jing-mei1, DING Yuan-yuan1, PAN Xi-chun1, LIU Ya2, CHEN Xiao-hong1, ZHANG Hai-gang1
(1.DertofPharmacology,CollegeofPharmacy,ThirdMilitaryMedicalUniversity; 2.InstituteofMateriaMedica,CollegeofPharmacy,ThirdMilitaryMedicalUniversity,Chongqing400038,China)
Aim To observe the mRNA expressions of cell cycle regulators at different time points during the hypertrophic process of H9c2 rat cardiomyoctes induced by angiotensin Ⅱ stimulation. Methods H9c2 myocytes were stimulated with 1.0 μmol·L-1angiotensin Ⅱ (Ang Ⅱ) for scheduled time. Cells were stained by Rhodamine labeled phalloidin and the cell area was measured by ImageJ software. mRNA expression levels of cyclin B, D, E, cyclin dependent kinase (CDK) 1, 2, 4, 6, and CDK inhibitor p21 were determined by real-time PCR at different time points (0, 5, 10, 30 min, and 1, 2, 3, 6, 12, 24, 48 h). Results H9c2 cell size increased soon after stimulation of Ang Ⅱ; mRNA expressions of cyclin E, CDK4 and CDK2 all reached the peak at 5min after stimulation of Ang Ⅱ; mRNA expression of cyclin D was increased dramatically at 10 min, followed by a decrease trend. However, the mRNA expression of cyclin B and CDK6 both showed two peaks, a p21 mRNA level was up to the peak at 30 min, and the expression was lowest at 3h. Although its expression increased gradually after 3h, p21 mRNA remained low level. Conclusion mRNA expression levels of the cell cycle regulators fluctuate and jointly facilitate the hypertrophic process of cardiomyocytes.
cardiac hypertrophy; cardiomyocytes; cell cycle; cyclin; cyclin dependent kinase; cyclin dependent kinase inhibitor p21
时间:2016-12-27 16:13
http://www.cnki.net/kcms/detail/34.1086.R.20161227.1613.024.html
2016-09-07,
2016-11-10
国家自然科学基金资助项目(No 30973524);重庆市基础与前沿研究计划项目(No cstc2013jcyjA10094)
李敬美(1992-),女,硕士,研究方向:心血管药物药理学,E-mail:jingmei382@163.com; 张海港(1970-),男,博士,教授,博士生导师,研究方向:心血管药物药理学,通讯作者,Tel:023-68752365,E-mail:hg001zhang@163.com
10.3969/j.issn.1001-1978.2017.01.012
A
1001-1978(2017)01-0063-06
R-332;R322.11;R329.28;R341;R345.57;R542.202.2
