HPA轴编程及其有关表观遗传修饰机制与创伤后应激障碍发病的研究进展
2017-02-08王宣尹吴丽丽
王宣尹,吴丽丽,严 灿
(广州中医药大学基础医学院中医基础理论教研室,广东 广州 510060)
HPA轴编程及其有关表观遗传修饰机制与创伤后应激障碍发病的研究进展
王宣尹,吴丽丽,严 灿
(广州中医药大学基础医学院中医基础理论教研室,广东 广州 510060)
全世界范围内灾难性事件的频发使得创伤后应激障碍(PTSD)已经成为一个重要的公共卫生问题。作为一种与应激有关的精神性疾病,PTSD是基因和环境(尤其是早期负性经历)共同作用的结果,表观遗传修饰发挥着重要作用。基于下丘脑-垂体-肾上腺(HPA)轴在PTSD发病中的核心作用,该文对国内外近年来有关HPA轴相关基因表观遗传学与PTSD发病之间关系的研究进行综述,以期为今后PTSD的防治提供思路和理论参考。
创伤后应激障碍;下丘脑-垂体-肾上腺轴;早期负性经历;易感基因;表观遗传学;DNA甲基化
创伤后应激障碍(post-traumatic stress disorder,PTSD)是指个体经历了对生命有威胁的灾难性事件或受到了严重的创伤后,长期存在应激障碍的一种精神性疾病,以闯入性症状、回避性症状、易激惹为核心症状[1],其诊断标准主要参照《DSM-IV诊断标准》[2]。近些年,随着恐怖袭击、地区战争、重大自然灾害、虐童、绑架等突发性灾难事件的频发,PTSD的患病率已高达25%,终生患病率可达5%-10%[3]。PTSD具有发病率高、病程长、难以治愈、自杀率高等特点,使得患者的身心健康及日常生活受到严重影响,并给患者家庭和社会带来了极大的负担。下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴在PTSD的发病中具有重要作用,而且目前认为PTSD是基因和环境共同作用的结果。鉴于此,本文对国内外近年来有关HPA轴相关基因表观遗传学与PTSD发病之间关系的研究进行综述,以期为今后PTSD的防治提供思路和理论参考。
1 PTSD的HPA轴病理性改变
严重创伤性应激事件是PTSD发生的必要因素之一,为了规避应激对机体稳态的破坏HPA轴的反馈和负反馈功能发挥着重要作用(Fig 1),并已成为人们研究PTSD所关注的重点。近年来的研究发现,PTSD的发病以及出现的记忆减退、恐惧增强等精神症状都与HPA轴调节功能的改变有着密切关系[4]。大量的研究表明,PTSD患者与其他应激个体不同,表现为基础糖皮质激素(glucocortieoids,GCs)水平降低和HPA轴负反馈增强[5],这种特定的神经内分泌模式使得PTSD有别于抑郁症等其它精神疾患。临床研究发现,PTSD患者海马、杏仁核和内侧前额叶皮层均出现糖皮质激素受体(glucocorticoid receptor,GR)表达异常的现象[1],而脑脊液中促肾上腺皮质激素释放激素(corticotropin-releasing hormone,CRH)浓度明显且持续升高,存在CRH反应超敏化,这使得GR敏感性增加并导致GCs对HPA轴负反馈增强[6-7]。PTSD样行为大鼠在下丘脑、海马 CA1 和 CA3 区、杏仁核等脑区亦出现CRH和CRH 1型受体(CRHR1)mRNA的高表达[8-9]。GCs水平的降低以及中枢神经系统CRH活动的增强可能导致PTSD的一些关键症状,如条件性恐惧反应、惊跳反应增强、暴露于应激原的敏感性增强以及易激惹等[10]。HPA轴负反馈增强可通过作用于杏仁核、海马等脑区使个体对创伤事件的记忆强化和巩固,而且伴有强烈的主观痛苦体验,这种痛苦可能使其心理活动反应增强且恢复延缓,影响机体整合创伤体验的能力,最终导致PTSD的发生[11]。

Fig 1 Regulation to stress of HPA axis
2 HPA轴编程及其有关表观遗传修饰机制与PTSD发病
近年来的研究认为,PTSD 是基因和环境因素共同作用的结果[12]。早期负性经历(early life adversity,ELA)属于环境因素的一部分,主要是指个体出生早年所经历的不良生活事件,还包括个体出生前所经历的负性生活事件。大量研究发现[13],拥有ELA的受试人群患PTSD的风险系数明显高于从未暴露于重大或长期负性事件的受试者,揭示了环境(尤其是早期负性经历)在PTSD发病中的重要作用。青春期和儿童时期经历创伤事件在成年时期发生PTSD的概率分别为13.3%和17%[14]。Meta分析表明,遭受过ELA的个体更容易罹患PTSD[15-16],而早期恐惧经历是PTSD回避行为长期改变的预测性指标[17]。ELA在个体成长过程中发挥着重要作用,可以在日后很长一段时间内对神经心理产生损害效应,影响个体成年后学习记忆、性格特征、情绪、面对急性应激的行为表现(如恐惧感等)以及对应激损伤的易感性,与PTSD的发病密切相关[18-20]。
ELA可通过影响HPA轴及其高位调节中枢如海马、杏仁核等,使HPA轴功能发生改变或重新编程(re-programming)[21-22]。HPA轴一旦被编程,即使撤除编程因素,HPA轴功能也会长期维持升高或低下的异常状态[23]。HPA的编程效应可干扰机体正常的应激适应性反应,影响个体后续的生长发育,增加日后对神经、内分泌、心血管等系统疾病的易感性[24]。研究发现[23],母鼠的多哺育行为使幼鼠成年后海马GR表达升高,增强了GC负反馈的敏感性,降低了下丘脑CRH的表达。在应激状态下,HPA轴反应更温和,在行为上也较少出现恐惧;而低哺育行为母鼠的后代成年后海马GR表达减少,在应激状态下,HPA轴的反应也更为剧烈,由此说明HPA轴功能被编程。此外,青少年期经历的创伤性应激可导致焦虑水平升高、学习与记忆功能受损,引发HPA轴功能失调。其机制之一可能与海马CRHR1表达下调有关,这可能是个体成年后更易出现应激相关的情绪与认知障碍的原因[25]。
表观遗传学是近年来有关精神疾病易感性研究的一个热点。研究表明[26],发育过程形成的疾病易感性可以在基因表型与环境生活事件的相互作用中产生,进而导致包括PTSD在内的多种精神障碍的发生[13]。表观遗传学的主要调节机制包括 DNA甲基化、组蛋白修饰、染色质重塑以及非编码RNA等[27],其中,DNA甲基化在心理应激中的研究最为深入。一般认为,DNA甲基化与基因沉默相关联,而去甲基化则与基因表达活性增加相关联[28]。基因转录的激活在DNA水平多表现为该基因启动子序列去甲基化,而启动子甲基化后则抑制基因转录。哺乳动物中DNA甲基化主要发生在胞嘧啶-鸟嘌呤二核苷酸簇的密集区(CpG岛),在多种DNA甲基转移酶(DNMTs)的介导下使 CpG二核苷酸5′端的胞嘧啶转变为 5′甲基胞嘧啶。DNA甲基化是环境应激反应的重要表观遗传调节因子,为人类ELA影响成年后行为提供了分子机制[29-30]。研究发现,PTSD患者相当一部分基因的DNA甲基化水平异于常人[31]。出生早期获得较少母性关爱的大鼠,成年后海马中GRmRNA和蛋白表达下降;GR基因外显子1启动子区序列DNA 甲基化程度增高,降低了GR基因的转录水平,抑制了负反馈,并最终改变了HPA轴对应激的反应性[32]。而母性好(如舔舐、梳理幼鼠毛发)的♀大鼠后代表现得对环境刺激不太敏感、少忧虑、较正常的HPA轴反应以及较高的GR表达水平,且海马区GR启动子外显子17甲基化程度低,其中16CpG位点甲基化程度明显低于对照组。以上研究说明,早期经历对人和大鼠GR甲基化的影响具有普遍性[33]。有研究发现[34],胎儿暴露于母体应激的宫内环境可以编程并改变特异性糖皮质激素受体基因(NR3C1)和11β-羟基类固醇脱氢2型酶(11β-HSD2)的DNA甲基化水平。大鼠妊娠第1周给予应激刺激,其♂子代出生时下丘脑CRH基因表达增加,成年时NR3C1基因表达减少;进一步分析发现该子代下丘脑CRH基因启动子区甲基化水平降低,而NR3C1基因启动子区DNA甲基化水平升高[35]。此外,ELA可以使下丘脑NR3C1持续甲基化,抑制CRH升高[36]。临床研究发现[37],在儿童期有不良事件经历的自杀者,其海马GR mRNA表达下降,GR1F剪切子mRNA表达下降,海马NR3C1启动子区甲基化水平升高。以上研究表明[13,38],ELA导致DNA甲基化修饰可通过HPA轴编程效应,改变与HPA轴密切相关的CRH和GR等重要基因的表达,破坏HPA轴的自我平衡机制,增加个体成年后罹患PTSD等多种精神系统疾病的风险(Fig 2)。当然,这种作用还与灾难性事件的数量、类型、持续时间和强度有关。
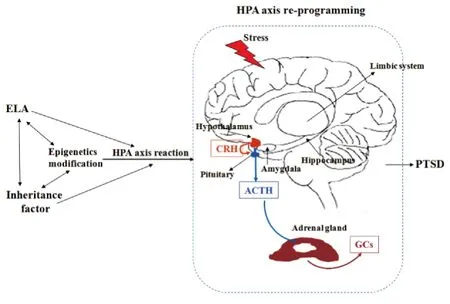
Fig 2 Epigenetics modification,HPA axis re-programming and PTSD
3 与HPA轴相关易感基因的有关表观遗传修饰机制与PTSD发病
基因与环境的共同作用对HPA轴的深远影响是通过表观遗传修饰的关键调控基因而实现的[39]。HPA轴的活性受到一系列基因多态性的调控,与HPA轴相关的易感基因主要包括FKBP5基因、NR3C1基因、CRHR1基因以及CRHBP基因[40-43](Tab 1)。其它相关易感基因还有黑皮质素受体基因(MC2R基因)[44]以及阿黑皮素基因(POMC基因)、CRHR2基因、FKBP4基因、信号转导和转录激活因子5B基因(STAT5B基因)[45]、热休克蛋白90基因[46](包括HSP90AB1、HSP90AA1、HSP90A1B)等,这些基因的多态性与PTSD易感性之间的关系还有待进一步研究。
表观遗传机制能够打开或关闭一个候选基因的转录和翻译,从而起到调控HPA轴功能的作用。PTSD中表观遗传学修饰的主要方式是DNA甲基化和组蛋白修饰,其中DNA甲基化是目前研究相对较多的表观遗传学机制。
3.1 NR3C1 ELA会引起NR3C1许多启动子区域的DNA甲基化水平改变,从而诱发包括PTSD在内的多种与应激有关的疾病[39]。NR3C1基因中外显子1F启动子被选为最具有生物相关性的GR基因启动子甲基化分析区域,该区域对应大鼠GR基因的外显子17。在孕期护理出现变化时,大鼠海马内该区域的甲基化水平相应会产生差异[2]。此外,有研究发现[36],在小鼠NR3C1的近端启动子上有2个小的CpG岛与压力诱导DNA甲基化有关,其中接近最远端的1个CpGs能够作为早期生活压力诱导的甲基化模板。目前多数研究结果显示,ELA会引起外周血和脑组织中的NR3C1外显子1F启动子甲基化水平升高(和其它与压力有关的疾病相关联,如抑郁症)[39],而运用皮质醇可引起早期生活压力小鼠下丘脑一系列典型GR靶基因活化的现象,表明在早期生活压力下GR上调的转录潜能很大[36]。在PTSD患者的外周血单核细胞中,NR3C1外显子的1F启动子甲基化水平普遍较低,与较高的GR基因活性一致[2];而且PTSD患者治疗前的NR3C1外显子1F启动子甲基化水平与PTSD症状的严重程度有相关性[47],而外显子1F启动子甲基化水平的升高也能很好地预测精神疗法的效果[39]。有研究发现[39],长期患有PTSD的人群T细胞的NR3C1外显子1B和1C甲基化水平偏低,并且这种现象在PTSD治愈前后无差异。这可能提示了NR3C1外显子1B和1C具有对PTSD更加稳定的长期效应。
3.2 FKBP5 FKBP5蛋白作为一种共同分子伴侣蛋白,与热休克蛋白90(HSP90)结合形成成熟的GR复合物。FKBP5能够通过调节GR和皮质醇结合的亲和力以及GR核转运来平衡HPA轴[2]。近年来,很多研究发现FKBP5对PTSD的影响不仅仅局限于基因多态性,还表现在表观遗传方面,特别是DNA的甲基化。有研究指出,FKBP5启动子高水平的甲基化与低水平的皮质醇浓度密切相关。对PTSD患者治疗前后的结果显示,治疗后FKBP5基因的甲基化位点出现了明显的差异,有疗效者显示FKBP5启动子的甲基化水平明显降低,而无疗效者则显示在治疗后一段时间FKBP5启动子甲基化水平增高的现象。通过低剂量的地塞米松试验和ACTH水平测试发现,FKBP5启动子的甲基化与垂体地塞米松反馈呈负相关,由此得出FKBP5启动子甲基化的高水平与PTSD发病密切相关的结论[47]。此外,在观察患有PTSD的退伍军人时发现,PTSD症状的改善与外周血单核细胞FKBP5基因外显子1近端启动子甲基化的下降有关[2]。

Tab1 Main susceptible genes closely related with HPA axis and PTSD
* It is thought to be used to predict the risk of PTSD after exposed to catastrophic events
也有学者提出,基因与环境的共同作用很可能是通过FKBP5基因的内含子7甲基化水平降低而实现的[2],并且这种表观遗传修饰与其早期经历应激事件的时间存在一定的关系。在早期生活压力模型上的体外转录实验时发现,施用了地塞米松的海马祖细胞能够在增殖和分化的过程中发生FKBP5基因内含子7的去甲基化,这个过程持续超过20 d。而在成年时期感受灾难暴露后的易感人群FKBP5基因内含子7则表现为持续较高的DNA甲基化。此外研究指出FKBP5基因的内含子7上临近糖皮质激素反应元件的CpG区域在有儿童时期虐待经历的易感人群中表现出低于正常人的甲基化水平,提示其与PTSD的发病有关[13]。
3.3 CRH相关基因 早期生活压力能够诱导小鼠的下丘脑小细胞CRH神经元的部分CpG区域甲基化,以防止长期暴露于压力下CRH的上调[36]。有研究指出,室旁核CRH启动子的低甲基化与早期生活压力有关,并且映射到两个临近的CpG上,该区域位于一环磷酸腺苷效应元件(cAMP response element,CRE)的二重对称轴上。后者CpG的甲基化进一步降低DNA与CRE结合蛋白(CREB)的结合能力,推测早期生活应激能够促进CREB的低甲基化,激活CRH的转录[13]。在PTSD中,CRH在杏仁核等脑区高水平的表达与启动子的低甲基化有关[13]。超过连续10 d的社会应激可使♂小鼠出现快感缺失和社交回避,这与CRH mRNA在室旁核的明显表达有密切关系,而CRH基因的高表达则与CRH近端启动子的去甲基化有关[13]。
有研究发现,早期生活压力对♂大鼠基础血浆皮质酮水平几乎没影响或影响很小,而♀大鼠的皮质酮水平则在暴露于早期生活压力之后明显增加,并明显高于早期♂对照组[13]。又有研究发现,早期创伤能明显地引起♀小鼠的回避性症状,但对CRH表达影响并不明显。相比之下,♂小鼠只有当CRH过度表达时才表现出回避症状。这提示了在早期生活压力应激中存在着性别差异。近年来越来越多的证据表明,CRH表观遗传机制有助于辨别应激反应中的性别差异,包括对PTSD的易感性[48],这也为阐释女性PTSD高风险发病率的相关机制提供了新思路。CRHBP是CRH家族中的一员,能与CRH高亲和力结合使之失活,从而调节HPA 轴在应激反应中的作用[49]。CRHBP基因的变异可能会增加经历过童年创伤的人群的自杀概率,并且该基因变异和FKBP5基因变异有加和作用。由于PTSD患者具有高度的自杀倾向,CRHBP基因也因此被认为是PTSD易感的候选基因之一[49]。
3.4 其它 母婴分离对小鼠皮质醇浓度的影响与AVP基因启动子区域的DNA甲基化水平有关[30]。在PTSD中,AVP的表达程度相对较高,有学者发现AVP表达的提高与其位于增强子区域下游的大量CpG区域的DNA甲基化水平降低有关,而且该DNA的低甲基化在1年后仍能够被检测出来[13];但也有研究报道[13],早期生活压力模型小鼠虽有AVP表达的明显升高,但并没有发现AVP基因区域的低甲基化。信号转导和转录激活因子(STAT)是一类具有信号转导和转录调节功能的蛋白质,STAT5B是JAK-STAT途径中重要的一种转录因子,也是GR的直接抑制剂,能够抑制活化的GR向细胞核内转移。PTSD患者体内STAT5B基因表达水平明显降低,这与PTSD患者GR的敏感性增强相一致[45]。
4 结语与展望
目前,全世界范围内灾难性事件的频发使得PTSD已经成为一个重要的公共卫生问题,也是影响创伤救治整体水平的重要因素之一。明确HPA轴的编程效应及其有关表观遗传修饰机制,对预防和治疗PTSD具有重要意义。基因学或表观遗传学的研究可以更好地预测PTSD易感性,进一步提高PTSD临床诊断的准确率。表观遗传学具有可逆转性[26],药物、环境等后期因素可通过改变DNA甲基化修饰,调节基因表达,从而逆转ELA对个体的持久影响,这为疾病的治疗提供了新的思路和方向;而且表观遗传学治疗药物将比现在基于症状治疗的药物拥有新的潜在的高效性和低不良反应发生率[50]。
本文仅对HPA轴相关基因的DNA甲基化修饰及其与PTSD发病之间关系的研究进行了总结,而HPA轴相关组蛋白修饰等表观遗传学机制在认知过程和早期负性经历中也发挥着重要的作用,这些都有待于进一步深入研究。
[1] Skelton K,Ressler K J,Norrholm S D,et al. PTSD and gene variants: new pathways and new thinking[J].Neuropharmacology, 2012,62(2):628-37.
[2] American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorder,fourth edition (DSM-IV)[M].WashingtonDC:APAPress,1994:393-445.
[3] Kessler R. Posttraumatic stress disorder: the burden to the individual and to society[J].JClinPsychiatry, 2000,61(suppl 5):4-12.
[4] Bomyea J,Risbrough V, Lang A J. A consideration of select pre-trauma factors as key vulnerabilities in PTSD[J].ClinPsycholRev, 2012,32(7):630-41.
[5] Klaassens E R,Giltay E J,Cuijpers P,et al. Adulthood trauma and HPA-axis functioning in healthy subjects and PTSD patients: a meta-analysis[J].Psychoneuroendocrinology, 2012,37(3):317-31.
[6] Baker D G,West S A,Nicholson W E,et al.Serial CSF corticotropin releasing hormone levels and adrenocortical activity in combat veterans with posttraumatic stress disorder[J].AmJPsychiatry,1999,156(4):585-8.
[7] 张黎明,张有志,李云峰.创伤后应激障碍的神经生物学研究进展[J]. 中国药理学通报, 2010,26(6):704-7.
[7] Zhang L M,Zhang Y Z,Li Y F. The progress of neurobiological mechanisms on PTSD[J].ChinPharmacolBull, 2010,26(6):704-7.
[8] Mountney C,Anisman H,Merali Z.Invivolevels of corticotropin-releasing hormone and gastrin-releasing peptide at the basolateral amygdala and medial prefrontal cortex in response to conditioned fear in the rat[J].Neuropharmacology, 2011,60(2-3):410-7.
[9] Karsten C A,Baram T Z. How does a neuron “know” to modulate its epigenetic machinery in response to early-life environment/ experience [J] ?FrontiersinPsychiatry, 2013,4(3):89.
[10] Yehuda R. Status of glucocorticoid alterations in post-traumatic stress disorder[J].AnnNYAcadSci, 2009,1179(1):56- 69.
[11] Yehuda R,Bierer L M,Schmeidler J,et al. Low cortical risk for PTSD in adult offspring of holocaust survivors[J].AMJPsychiatry, 2000,157(8):1252-9.
[12] 李 航,钟志鸿,杨 进,等.海马突触可塑性与创伤后应激障碍(PTSD)相关研究[J]. 基因组学与应用生物学, 2015,34(3):658-62.
[12] Li H,Zhong Z H,Yang J, et al. Research on hippocampal synaptic plasticity and traumatic stress disorder(PTSD)[J].GenomicsandAppliedBiology, 2015,34(3):658-62.
[13] Mcgowan P O. Epigenomic mechanisms of early adversity and HPA dysfunction: considerations for PTSD research [J].FrontPsychiatry, 2013,4(4):110.
[14] Maercker A,Michael T,Fehm L,et al. Age of traumatisation as a predictor of post-traumatic stress disorder or major depression in young women[J].BrJPsychiatry, 2004,184(3):482-7.
[15] Brewin C R,Andrews B,Valentine J D. Meta-analysis of risk factors for posttraumatic stress disorder in trauma-exposed adults[J].JConsultClinPsychol, 2000,68(5):748-66.
[16] Sachs-Ericsson N,Joiner T E,Cougle J R,et al. Combat exposure in early adulthood interacts with recent stressors to predict PTSD in aging male veterans[J].Gerontologist, 2016,56(1):82-91.
[17] Chen X Y,Li Y H,Li S,et al. Early fear as a predictor of avoidance in a rat model of post-traumatic stress disorder[J].BehavBrainRes, 2012,226(1):112-7.
[18] Grasso D J,Ford J D,Briggs-Gowan M J. Early life trauma exposure and stress sensitivity in young children[J].JPediatrPsychol, 2013,38(1):94-103.
[19] Moore N L,Gauchan S,Genovese R F. Adolescent traumatic stress experience results in less robust conditioned fear and post-extinction fear cue responses in adult rats. Pharmacology[J].PharmacolBiochemBehav, 2014,120(3):17-24.
[20] Subica A M. Psychiatric and physical sequelae of childhood physical and sexual abuse and forced sexual trauma among individuals with serious mental illness[J].JTraumaStress, 2013,26(5):588-96.
[21] Melinda G Arnett,Lisa M Muglia,Gloria Laryea,et al. Genetic Approaches to hypothalamic-pituitary-adrenal axis regulation[J].Neuropsychopharmacology, 2016,41(1):245-60.
[22] Zhang T Y,Labonte B,Wen X L,et al. Epigenetic mechanisms for the early environmental regulation of hippocampal glucocorticoid receptor gene expression in rodents and humans[J].Neuropsychopharmacology, 2013,38(1):111-23.
[23] 黄建华,沈自尹,蔡外娇,等. 下丘脑-垂体-肾上腺皮质轴编程研究进展及对“证”研究的意义[J]. 中华中医药杂志, 2013,28(12):3620-3.
[23] Huang J H,Shen Z Y,Cai W J,et al.Hypothalamic-pituitary-adrenal axis programmingand its application in research of“ZHENG”of traditional Chinese medicine[J].CJTCMP,2013,28(12):3620-3.[24] Godfrey K M,Inskip H M,Hanson M A. The long-term effects of prenatal development on growth and metabolism[J].SeminReprodMed, 2011,29(3):257-65.
[25] Li C T,Liu Y,Yin S P,et al. Long-term effects of early adolescent stress: dysregulation of hypothalamic-pituitary-adrenal axis and central corticotropin releasing factor receptor 1 expression in adult male rats[J].BehavBrainRes, 2015,288:39-49.
[26] Liu L,Li Y Y,Tollefsbol T O. Gene-environment interactions and epigenetic basis of human diseases[J].CurrIssuesMolBiol, 2008,10(1-2):25-36.
[27] 张均田.认知过程中的表观遗传学机制[J]. 中国药理学通报, 2015,31(1):1-7.
[27] Zhang J T. Epigenetic mechanism in cognitive function[J].ChinPharmacolBull, 2015,31(1):1-7.
[28] Xu G L,Bestor T H,Bourc'his D,et al. Chromosome instability and immunodeficiency syndrome caused by mutations in a DNA methyltransferase gene[J].Nature, 2009,402(6758):187-91.
[29] Malan-Müller S S,Hemmings S M J. Understanding posttraumatic stress disorder:insights from the methylome[J].GenesBrainBehavior, 2014,13(1):52-68.
[30] Klengel T,Pape J,Binder E B,et al. The role of DNA methylation in stress-related psychiatric disorders[J].Neuropharmacology, 2014,80(5):115-32.
[31] Smith A K,Conneely K N,Kilaru V,et al. Differential immune system DNA methylation and cytokine regulation in post-traumatic stress disorder[J].AmJMedGenetBNeuropsychiatrGenet, 2011,156B(6):700-8.
[32] Meaney M J,Szyf M. Environmental programming of stress responses through DNA methylation:life at the interface between a dynamic environment and a fixed genome[J].DialoguesClinNeurosci, 2005,7(2):103-23.
[33] Weaver I C,Cervoni N,Champagne F A,et al. Epigenetic programming by maternal behavior[J].NatNeurosci, 2004,7(8):847-54.[34] Conradt E,Lester B M,Appleton A A,et al. The roles of DNA methylation of nr3c1 and 11β-hsd2 and exposure to maternal mood disorder in utero on newborn neurobehavior[J].Epigenetics, 2013,8(12):1321-9.
[35] Gudsnuk K,Champagne F A. Epigenetic influence of stress and the social environment[J].ILARJ, 2012,53(3-4):279-88.
[36] Bockmühl Y,Patchev A V,Madejska A,et al. Methylation at the CpG island shore region upregulates Nr3c1 promoter activity after early-life stress[J].Epigenetics, 2015,10(3):247-57.
[37] McGowan P O,Sasaki A,D’Alessio A C,et al. Epigenetic regulation of the glucocorticoid receptor in human brain associates with childhood abuse[J].NatNeurosci, 2009,12(3):342-8.
[38] Mehta D,Binder E B. Gene×environment vulnerability factors for PTSD:The HPA-axis[J].Neuropharmacology, 2012,62(2):654-62.
[39] Zannas A S,Provençal N,Binder E B. Epigenetics of posttraumatic stress disorder: current evidence,challenges,and future directions[J].BiolPsychiatry, 2015,78(5):327-35.
[40] Bachamann A W,Sedgley T L,Jackson R V,et al. Glucocorticoid receptor polymorphisms and post-traumatic stress disorder[J].Psychoneuroendocrinology, 2005,30(3):297-306.
[41] White S,Acierno R,Ruggiero K J,et al. Association of CRHR1 variants and posttraumatic stress symptoms in hurricane exposed adults[J].JAnxietyDisord, 2013,27:678-83.
[42] Roy A,Hodgkinson C A,Deluca V. Two HPA axis genes,CRHBP and FKBP5, interact with childhood trauma to increase the risk for suicidal behavior[J].JPsychiatricRes, 2012,46(1):72-9.
[43] Davydow D S,Kohen R, Hough C L,et al. A Pilot investigation of the association of genetic polymorphisms regulating corticotrophin-releasing hormone with posttraumatic stress and depressive symptoms in medical-surgical intensive care unit survivors[J].JCritCare, 2014,29(1):101-6.
[44] Dores R M,Londraville R L,Prokop J,et al. Molecular evolution of GPCRs:Melanocortin/melanocortin receptors [J].JMolEndocrinology, 2014,52(3):29-42.
[45] Yehuda R,Cai G,Golier J A,et al. Gene expression patterns associated with posttraumatic stress disorder following exposure to the world trade center attacks[J].BiolPsychiatry, 2009,66(7):708-11.
[46] Breen M E,Seifuddin F,Zandi P P,et al. Investigating the role of early childhood abuse and HPA axis genes in suicide attempters with bipolar disorder[J].PsychiatricGenet, 2015,25(3):106-11.
[47] Yehuda R,Daskalakis N P,Desarnaud F,et al. Epigenetic biomarkers as predictors and correlates of symptom improvement following psychotherapy in combat veterans with PTSD[J].FrontinPsychiatry, 2013,4:118.
[48] Toth M,Flandreau E I,Deslauriers J,et al. Overexpression of Forebrain CRH during early life increases trauma susceptibility in adulthood[J].Neuropsychopharmacol, 2015,41(6):1-10.
[49] Roy A,Hodgkinson C A,Deluca V,et al. Two HPA axis genes,CRHBP and FKBP5,interact with childhood trauma to increase the risk for suicidal behavior[J].JPsychiatrRes, 2012,46(1):72-9.
[50] 吕路线,张红星.表观遗传与精神疾病[J]. 新乡医学院学报, 2012,29(7):481-4.
[50] Lyu L X,Zhang H X. Epigenetics and mental illness[J].JXinxiangMedColl, 2012,29(7):481-4.
Epigenetic pathogenesis of post-traumatic stress disorder based on the HPA aixs
WANG Xuan-yin,WU Li-li,YAN Can
(DeptofBasicTheoryofTCM,SchoolofPreclinicalMedicine,GuangzhouUniversityofChineseMedicine,Guangzhou510060,China)
Currently, the worldwide frequency of catastrophic events has made post-traumatic stress disorder (PTSD) a major public health problem. As a stress-related psychiatric disorder, PTSD is considered as the result of interaction between gene and environments (especially early life adversity). The epigenetics plays an important role in PTSD pathogenesis. Due to the core role of hypothalamic-pituitary-adrenal (HPA) axis, the research on the relationship between HPA axis epigenetics and PTSD pathogenesis in recent years was reviewed in the paper so as to provide references and thinking of the prevention and therapy for PTSD in the future.
post-traumatic stress disorder;hypothalamic-pituitary-adrenal axis;early life adversity;susceptible gene;epigenetics;DNA methylation
时间:2016-12-27 16:13
http://www.cnki.net/kcms/detail/34.1086.R.20161227.1613.010.html
2016-07-18,
2016-11-15
国家自然科学基金资助项目(No 30873207);广东省自然科学基金资助项目(No 2016A030313648);国家级大学生创新创业训练计划资助项目(No 201610572007)
王宣尹(1996-),女,硕士生,研究方向:社会心理应激损伤与中医药防治,E-mail:wxysbt9988@qq.com; 吴丽丽(1973-),女,博士,教授,硕士生导师,研究方向:社会心理应激损伤与中医药防治,E-mail:13822218911@163.com; 严 灿(1970-),男,博士,教授,博士生导师,研究方向:社会心理应激损伤与中医药防治,通讯作者,Tel:020-39358032,E-mail:yancan999@sina.com
10.3969/j.issn.1001-1978.2017.01.005
A
1001-1978(2017)01-0022-06
R-05;R394.2;R395; R641;R749.72
