高血压对大鼠脑基底动脉收缩和钠泵活性的影响
2017-02-08王海燕郭宇松王永利
王海燕,郝 亮,郭宇松,王永利,郭 炜
(1. 石家庄市第三医院药剂科,2. 河北医科大学药学院,河北 石家庄 050017)
高血压对大鼠脑基底动脉收缩和钠泵活性的影响
王海燕1,郝 亮1,郭宇松1,王永利2,郭 炜2
(1. 石家庄市第三医院药剂科,2. 河北医科大学药学院,河北 石家庄 050017)
目的 探讨高血压对大鼠脑血管收缩性的影响及其与钠泵活性的关系。方法 取♂ Wistar大鼠(WR)和自发性高血压大鼠(SHR)基底动脉环,通过Multi Myograph张力换能系统记录血管张力变化,比较两种大鼠离体脑动脉对KCl和5-羟色胺(5-HT)的收缩反应,分析高血压病变对脑血管收缩性和钠泵活性的影响。结果 与WR基底动脉相比,SHR基底动脉的KCl和5-HT量效曲线明显右移,再复K+所致血管舒张作用减弱,提示高血压病变可明显降低脑血管钠泵活性及KCl和5-HT的收缩反应;哇巴因(Ouabain,OUA)浓度依赖性收缩SHR脑血管,其量效关系曲线可经两点结合模型进行最佳拟合,Kd分别为:1.7×10-8mol·L-1和1.6×10-5mol·L-1,表明SHR脑基底动脉上存在高、低亲和力两种不同功能的钠泵。用5×10-7mol·L-1和10-4mol·L-1的OUA分别抑制高、低亲和力钠泵,仅能在SHR而非WR脑血管明显左移KCl和5-HT量效曲线,表明OUA可明显增强KCl和5-HT对脑血管的收缩作用,且OUA增强5-HT收缩SHR脑血管的作用呈明显的浓度依赖性(r=0.9393,P<0.05);在SHR脑血管,这两个浓度OUA对KCl量效曲线的左移幅度无明显差别,而对5-HT收缩量效曲线的左移幅度却有明显不同,提示仅高亲和力钠泵介导了SHR脑血管对KCl的收缩反应,而SHR脑血管对5-HT的收缩反应则由高、低亲和力两种钠泵共同参与。结论 高血压病变可明显降低脑血管对血管收缩剂的反应性,其机制可能与高血压所致钠泵活性降低或钠泵对OUA敏感性增加有关。
高血压;基底动脉;血管收缩;KCl;5-HT;哇巴因;钠泵
钠泵,即Na+/K+-ATP酶,是目前所知哇巴因(ouabain,OUA)类药物和内源性OUA类物质的唯一受体,钠泵活化可通过超极化膜电位激活钠钙交换体(NCX)的正向转运,减少细胞内Ca2+而舒张血管平滑肌[1-2],钠泵抑制可通过胞质中Na+蓄积激活NCX的反向转运,增加细胞内Ca2+而收缩血管平滑肌[3-4],因此,血管钠泵活性的改变在调节血管收缩性方面具有重要作用。众多研究已发现,高血压及其相关疾病发生后不仅可明显降低其血管钠泵活性[5],也往往伴随着脑血管结构的改变[6]。抑制钠泵活性可使细胞内Na+潴留,通过激活NCX的反向转运,升高细胞质内Ca2+浓度,进而增强血管对血管收缩剂的反应,引起血管进一步收缩[7-9];而脑血管结构改变可通过增加血管壁/腔比例和血管壁僵硬度、缩小平滑肌细胞体积及减少平滑肌细胞内肌凝蛋白含量等,改变脑血管对血管收缩剂的反应性[10-12]。
目前已证实,在原发性高血压、脑缺血和充血性心衰病人以及几种高血压动物模型血浆中内源性OUA的水平明显升高[13-18],而OUA抑制剂PST2238可明显降低盐依赖性高血压大鼠和部分原发性高血压病人的血压[19]。这些不仅提示内源性OUA升高可能与哺乳动物高血压的发病、维持和发展密切相关,也表明这种高血压所致的内源性OUA水平升高能够改变脑血管对血管收缩剂的反应。本文旨在通过观察高血压状态下大鼠脑基底动脉对经典血管收缩剂KCl和5-HT收缩反应的变化及OUA对二者的影响,探讨OUA、钠泵与血管收缩剂间的相互关系,为进一步寻找治疗高血压相关疾病的新策略提供实验依据。
1 材料与方法
1.1 材料
1.1.1 仪器 MultiMyograph System-610M(Danish Myo Technology A/S);AG135电子天平(Metter Toled公司);解剖显微镜(日本Olympus公司);Millipore纯水机(法国Millipore公司);LE5001型清醒大鼠鼠尾血压心率测定仪(西班牙Panl.s.l公司)。
1.1.2 试剂 OUA(美国Sigma公司);乙酰胆碱(美国Sigma公司);5-HT(ALEXIS);KCl(天津化学试剂厂)。
1.1.3 实验动物 Wistar大鼠(WR)为正常血压对照鼠,体质量250 g~300 g,♂,由河北医科大学实验动物中心提供(冀医动字第712065号);自发性高血压大鼠(SHR)为高血压模型鼠,6月龄,♂,由北京维通利华实验动物中心提供(许可证号:SCXK(京)2007-0001)
1.2 实验方法
1.2.1 鼠尾血压测定 用LE5001型清醒大鼠鼠尾血压心率测定仪分别测定WR和SHR的收缩压(SYS)、舒张压(DIA)和平均动脉压(MED),连续测定3次,取平均值做为实验数据。
1.2.2 血管张力的测定
1.2.2.1 标本的制备 取250 g~300 g ♂大鼠,腹腔注射戊巴比妥钠45 mg·kg,待动物麻醉后断头处死,迅速取出全部脑组织,浸泡于预冷的4℃ PSS溶液中,除去软脑膜,分离基底动脉。剪取2 mm左右的动脉环放入浴槽内,将两根直径为40 μm的钨丝穿入环腔,固定血管环在Multi Myograph浴槽内传感器的触角上,给予最适前负荷。持续向浴槽液体内通入95%O2+5% CO2混合气,浴槽内液体温度保持在(37±0.5) ℃恒定,平衡60 min,平衡期间每15~20 min用预热的PSS溶液(37℃)更换浴槽内液体1次,血管张力变化通过Myograph的张力换能系统描计在计算机上。
1.2.2.2 血管环的标准化 为了使血管环处于最佳反应状态,在正式实验前对血管进行标准化。通过旋转Myograph的螺旋测微尺逐步牵拉血管环,测得每个直径下血管环的张力变化值,通过与Myograph连接的Powerlab的内置软件计算出每根血管环的最适前负荷,最后将螺旋测微尺旋至该位置。
1.2.2.3 血管活性检测 为使血管环处于激活状态,在开始正式实验前,按仪器说明书进行初始化操作,当最终使10-2mmol·L-1去甲肾上腺素所致2次血管收缩幅度的差别小于10%时,则认为血管收缩已稳定,可用于后面实验。收缩活性不好的血管弃置不用。
1.2.2.4 血管内皮完整性的检测 血管活性检测完毕后,平衡15 min,用终浓度10-6mmol·L-1的去甲肾上腺素预收缩血管环,再加入终浓度为10-6mmol·L-1的乙酰胆碱,使预收缩的血管环产生60%~80%的舒张,则证明血管环内皮完整性较好,可进行以后的实验。
1.2.2.5 高血压对KCl收缩基底动脉量效曲线的影响 将内皮完整的WR和SHR基底动脉环固定于Multi Myograph浴槽内,待各项检测合格后,分别向浴槽内加入KCl溶液,使其终浓度分别为20、30、40、60、80、100和120 mmol·L-1的。记录两种脑血管在各浓度KCl溶液下的收缩幅度,并以KCl浓度为横坐标,以动脉环收缩幅度为纵坐标绘制量效曲线,比较高血压病变对KCl收缩脑血管作用的影响。
1.2.2.6 高血压对5-HT收缩基底动脉量效曲线的影响 将内皮完整的WR或SHR基底动脉环固定于Multi Myograph浴槽内,待各项检测合格后,分别向浴槽内加入5-HT溶液,使其灌流浓度分别为10-9、10-8、3×10-8、10-7、3×10-7、10-6、3×10-6、10-5mol·L-1的。记录两种脑血管在5-HT溶液各浓度下的收缩幅度,并以5-HT对数浓度为横坐标,以动脉环收缩幅度为纵坐标绘制量效曲线,比较高血压病变对5-HT收缩脑血管作用的影响。
1.2.2.7 OUA对SHR基底动脉张力的影响 将内皮完整的SHR脑血管固定于Multi Myograph浴槽内,待各项检测合格后,分别向浴槽内加入OUA溶液,使其灌流浓度分别为10-9、10-8、10-7、10-6、10-5、10-4、10-3mol·L-1的OUA溶液。记录血管在各个浓度OUA作用下的收缩幅度。以10-3mol·L-1的OUA引起血管收缩的幅度为100%,计算各浓度OUA作用下的收缩百分率。以OUA对数浓度为横坐标,以血管收缩百分率为纵坐标,绘制OUA量效曲线图,并用Sigmaplot绘图软件按照2个结合位点模式进行曲线拟合,从而分析SHR脑基底动脉钠泵高、低2个不同亲和力α-亚基分布的特性,为钠泵可能参与高血压影响脑血管收缩作用提供实验依据。
1.2.2.8 OUA对SHR脑血管K+-依赖性舒张的影响 K+-依赖性舒张是指将K+再加入到无K+溶液中时,可引起已被收缩的动脉环舒张。由于动脉环上的钠泵活性在K+溶液中被完全抑制,当再加入K+时钠泵被逐步激活而舒张血管,因此人们常把有无OUA存在时K+诱发的血管舒张程度差异作为评价钠泵活性的指标[20]。将内皮完整的WR或SHR基底动脉环固定于Multi Myograph浴槽内,待各项检测合格后,分别将浴槽内正常的PSS液替换为无K+的PSS液以抑制钠泵活性,孵育30 min后再向浴槽内加入新福林,使浴槽内新福林的终浓度为3×10-6mol·L-1,待血管收缩至平台期,再以浓度递增方式依次向浴槽内加入KCl溶液,使其终浓度分别为1、2、4、6、8和10 mmol·L-1来激活钠泵,记录各浓度KCl溶液所致新福林收缩幅度的变化,以血管在无K+的PSS液存在情况下新福林的收缩幅度为100%,计算各浓度KCl溶液对新福林收缩幅度的影响。另取WR或SHR基底动脉环,以含10-4mol·L-1的OUA溶液的无K+的PSS液孵育血管30 min,其他步骤同上,记录并计算在OUA存在情况下各浓度KCl对新福林收缩幅度的影响。实验结束后,分别以K+浓度为横坐标,以各浓度KCl作用下的新福林收缩幅度为纵坐标绘制各处理组的量效曲线,分别计算WR和SHR脑血管有无OUA处理两组间的曲线下面积差,并以此作为钠泵活性指标比较高血压对脑血管钠泵活性的影响[21]。
1.2.2.9 OUA对KCl收缩SHR基底动脉量效曲线的影响 将内皮完整的WR或SHR脑血管固定于Multi Myograph浴槽内,待各项检测合格后,向浴槽内加入终浓度为5×10-7mol·L-1(仅抑制高亲和力钠泵)或10-4mol·L-1(可抑制高、低亲和力钠泵)的OUA溶液,孵育30 min后,再向浴槽内加入KCl溶液,使其终浓度依次为20、30、40、60、80、100和120 mmol·L-1。记录其在KCl各浓度下的收缩幅度,并以KCl浓度为横坐标,以动脉环收缩幅度为纵坐标绘制量效曲线,从而分析参与高血压影响KCl收缩脑血管作用的钠泵亚型。
1.2.2.10 OUA对5-HT收缩 SHR基底动脉量效曲线的影响 将内皮完整的WR或SHR脑血管固定于Multi Myograph浴槽内,待各项检测合格后,向浴槽内加入终浓度为5×10-7mol·L-1(仅抑制高亲和力钠泵)或10-4mol·L-1(可抑制高、低亲和力钠泵)的OUA溶液,孵育30 min后,再向浴槽内加入5-HT溶液,使其终浓度依次为10-9、10-8、3×10-8、10-7、3×10-7、10-6、3×10-6和10-5mol·L-1,记录其在5-HT各浓度下的收缩幅度,并以5-HT对数浓度为横坐标,以动脉环收缩幅度为纵坐标绘制量效曲线,从而分析参与高血压影响5-HT收缩脑血管作用的钠泵亚型。
1.2.2.11 不同浓度OUA对5-HT收缩SHR基底动脉作用的影响 将内皮完整的WR或SHR基底动脉环固定于Multi Myograph浴槽内,待各项检测合格后,向浴槽内加入OUA溶液,使其终浓度分别为10-9、10-8、10-7、10-6、10-5、10-4、10-3mol·L-1,孵育30 min后,再向浴槽内灌流5×10-7mol·L-1的5-HT,分别记录两种脑血管在不同浓度OUA作用下5-HT所致动脉环收缩幅度的变化,并以OUA浓度为横坐标,以各浓度OUA作用下5-HT所致动脉环收缩幅度为纵坐标绘制量效曲线,进一步比较高血压病变对5-HT收缩脑血管作用的影响,并初步探讨钠泵是否参与高血压对5-HT收缩脑血管作用的影响。

2 结果
2.1 大鼠血压的测定 经LE5001型清醒大鼠鼠尾血压心率测定仪测定,SHR的收缩压(SYS)、舒张压(DIA)和平均动脉压(MED)分别为:(208.5±27.0)、(154.8±36.2)、(172.8±36.0) mmHg,明显高于WR的收缩压(117.0±6.8) mmHg、舒张压(88.5±5.6) mmHg和平均动脉压(96.5 ±4.09) mmHg(P<0.05)(Fig 1),1 mmHg=0.133 kPa,提示比较WR和SHR基底动脉对血管收缩剂的反应,可用于分析高血压病变对脑血管收缩作用的影响及其机制。
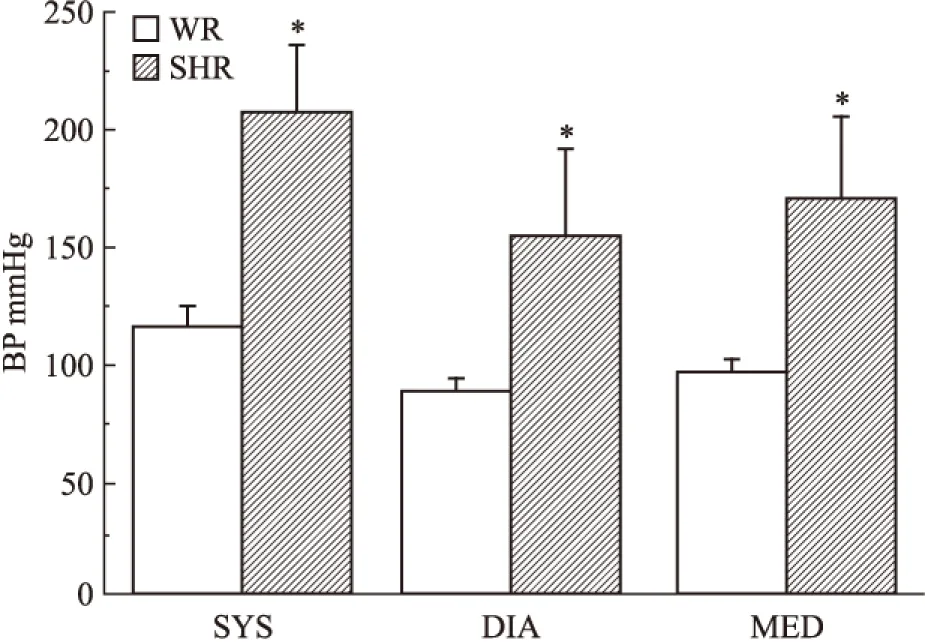
Fig 1 Comparison of blood pressure(BP) between Wistar rats(WR) and spontaneously hypertensive rats(SHR,n=6)
*P<0.05vsWR
2.2 高血压对KCl收缩基底动脉量效曲线的影响 与WR基底动脉的KCl量效曲线相比,除了20 mmol·L-1的KCl溶液外,30、40、60、80、100和120 mmol·L-1的 KCl溶液在SHR脑血管产生的收缩力依次为0.17±0.02、0.32±0.08、0.48±0.08、0.64±0.08、0.67±0.08和0.73±0.08 mN,均明显低于相应浓度KCl在WR脑血管产生的收缩力(0.42±0.152、0.84±0.19、1.19±0.23、1.49±0.24、1.50±0.22、1.46±0.22 mN)(P<0.05),使基底动脉的KCl量效曲线明显右移(Fig 2),提示高血压病变可明显降低脑血管对KCl的收缩反应,最大降低幅度可达50%。
2.3 高血压对5-HT收缩基底动脉量效曲线的影响 与WR基底动脉的5-HT量效曲线相比,除了10-9和10-8mol·L-1的5-HT溶液外,3×10-8、10-7、3×10-7、10-6和3×10-6mol·L-1的5-HT溶液在SHR脑血管产生的收缩力依次为0.14±0.02、0.41±0.06、0.89±0.16、1.90±0.25、2.05±0.29、1.78±0.24 mN,均明显低于相应浓度的5-HT在WR产生的血管收缩作用(0.37±0.09、1.50±0.21、2.78±0.40、4.41±0.55、5.35±0.38、4.90±0.98 mN)(P<0.05),使基底动脉的5-HT量效曲线明显右移(Fig 3),提示高血压病变也可明显降低脑血管对5-HT的收缩反应,最大降低幅度可达64%。
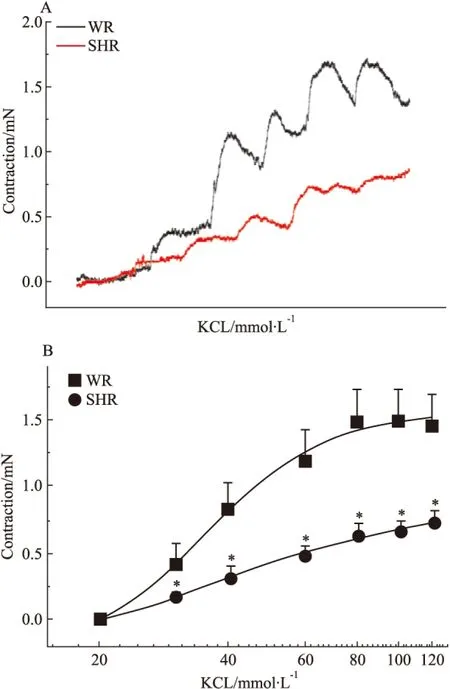
Fig 2 The effects of hypertension on cumulative concentration-response curves for contraction of isolated basilar artery rings induced by KCl in WR and SHR(n=6)
*P<0.05vsWR
2.4 OUA对SHR基底动脉张力的影响 已知钠泵在调节血管张力方面具有关键作用,且OUA为经典的钠泵抑制剂,为了探讨钠泵与血管收缩之间的关系,我们进一步观察了OUA对SHR基底动脉张力的影响。实验结果表明,10-9~10-3mol·L-1的OUA溶液可浓度依赖性引起基底动脉的收缩,且其量效关系曲线可经两点结合模型进行最佳拟合(Fig 4),提示SHR脑基底动脉存在高亲和力和低亲和力两种功能不同的钠泵,其Kd值分别为1.7×10-8mol·L-1和1.6×10-5mol·L-1,故在以后的实验中将5×10-7mol·L-1和10-4mol·L-1的OUA溶液分别用于抑制高、低亲和力钠泵亚基。
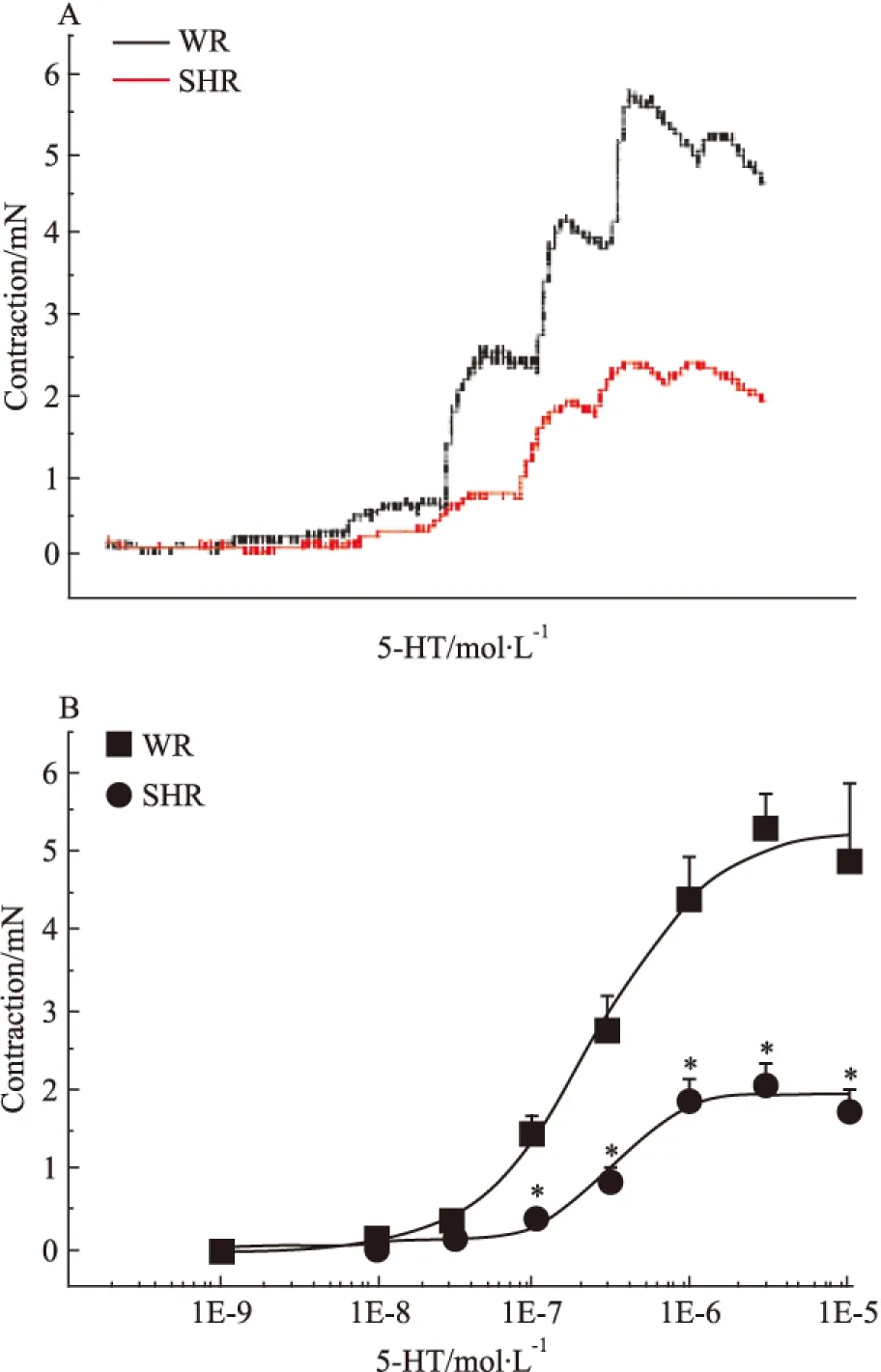
Fig 3 Effects of hypertension on cumulativ concentration-response curves for contraction of isolated basilar artery rings induced by 5-HT in WR and SHR(n=6)
*P<0.05vsWR
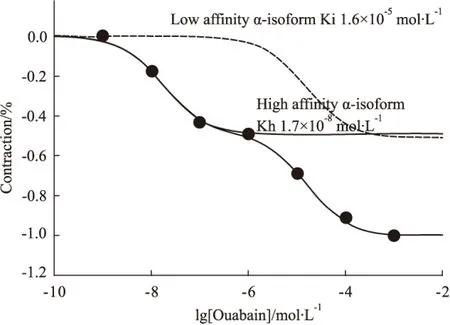
Fig 4 Cumulative concentration-response curves for contraction of isolated basilar artery rings induced by OUA in SHR
2.5 OUA对SHR基底动脉K+-依赖性舒张的影响 当去除灌流液中K+时钠泵被抑制,当再加入K+时钠泵被激活,导致膜超极化而关闭电压依赖性钙通道,进而降低细胞内钙,松弛血管,这种K+诱发的血管舒张可被用作一种间接评价血管钠泵活性的方法[20]。本实验结果表明,当新福林使基底动脉环在无K+的PSS溶液中收缩至最大值时,再以浓度递增方式依次向浴槽内加入KCl激活钠泵,计算在不同浓度KCl溶液中基底动脉环收缩幅度与最大收缩的比值。在WR血管环,此比值分别为1、0.53±0.06、0.21±0.05、0.14±0.03、0.12±0.04、0.12±0.04和0.14±0.04;在OUA预处理的WR血管环,此比值分别为1、0.94±0.02、0.82±0.03、0.53±0.08、0.26±0.08、0.18±0.04和0.18±0.04;在SHR血管环,此比值分别为1、0.78±0.07、0.53±0.07、0.23±0.06、0.14±0.03、0.15±0.03和0.17±0.05;在OUA预处理的SHR血管环,此比值分别为1、0.91±0.01、0.91±0.02、0.90±0.03、0.73±0.03、0.63±0.06和0.58±0.06。这些结果表明,各血管对K+-依赖性舒张程度依次为WR血管>SHR血管>OUA处理WR血管>OUA处理SHR血管(Fig 5A)。这些舒张结果提示,钠泵活性无论有无OUA存在,在SHR基底动脉均明显低于WR基底动脉;而根据曲线下面积(AUC)计算的钠泵活性变化值(Fig 5B)表明,OUA可明显抑制钠泵活性,10-4mol·L-1的 OUA溶液对SHR血管钠泵活性的抑制程度(4.60±0.25)明显大于其对WR血管钠泵活性的抑制程度(2.54±0.25)(P<0.05),提示高血压病变在降低脑血管钠泵活性的同时可能会提高脑血管钠泵对OUA敏感性。
2.6 OUA对KCl收缩SHR基底动脉量效曲线的影响 当用5×10-7mol·L-1的OUA溶液分别抑制WR和SHR脑血管高亲和力钠泵后,20、30、40、60、80、100及120 mmol·L-1的KCl溶液对这两种脑血管产生的收缩力依次为0、0.39±0.07、0.85±0.11、1.39±0.16、1.63±0.18、1.57±0.16、1.53±0.15 mN和0、0.48±0.12、0.91±0.21、1.53±0.22、1.69±0.28、1.56±0.31、1.56±0.31 mN,二者之间无显著性差异(P>0.05),与OUA未处理前KCl溶液对WR脑血管产生的收缩力相似,表明用OUA抑制脑血管高亲和力钠泵并不影响经典血管收缩剂KCL对正常血压大鼠基底动脉的收缩作用,但可明显增加KCl对高血压大鼠基底动脉的收缩作用(P<0.05),使SHR脑血管的KCl量效曲线明显左移(Fig 6A)。当用10-4mol·L-1的OUA溶液分别抑制WR和SHR脑血管高、低亲和力两种钠泵后,上述浓度的KCl溶液对这两种脑血管产生的收缩力依次为0、0.61±0.19、1.15±0.35、1.39±0.34、1.57±0.36、1.49±0.29、1.35±0.21 mN和0、0.54±0.28、0.96±0.22、1.46±0.34、1.60±0.30、1.65±0.30、1.69±0.29 mN,二者之间无显著性差异(P>0.05),抑制幅度不仅与5×10-7mol·L-1的OUA溶液的抑制幅度相似,且也与OUA未处理前KCl对WR脑血管产生的收缩力相似,但可明显增加KCl对高血压大鼠基底动脉的收缩作用(P<0.05),提示抑制两种亲和力钠泵对KCl所致两种大鼠脑血管收缩作用的影响与仅抑制高亲和力钠泵的影响相似(Fig 6B)。从以上结果我们不难看出,无论抑制哪种钠泵对KCl所致WR脑血管收缩力增加均无明显影响(Fig 7A),但却可明显增强KCl所致的SHR脑血管收缩力增加,使其KCl量效曲线明显左移,且两个浓度OUA的影响并无明显差别(Fig 7B),提示仅钠泵高亲和力α-亚基介导了KCl在高血压大鼠脑血管诱发的收缩反应。
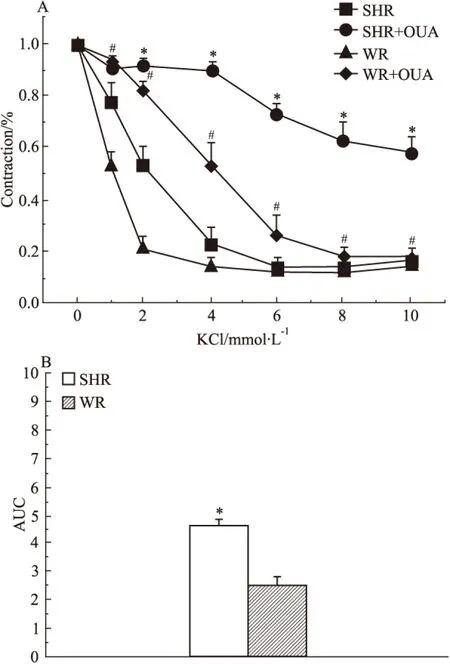
Fig 5 Effect of 0.1 mmol L-1OUA on cumulative concentration-response curves of isolated basilar artery and area under concentration response curve(AUC) contracted by KCl in WR and SHR(n=7)
A:*P<0.05vsSHR;#P<0.05vsWR;B:*P<0.05vsWR
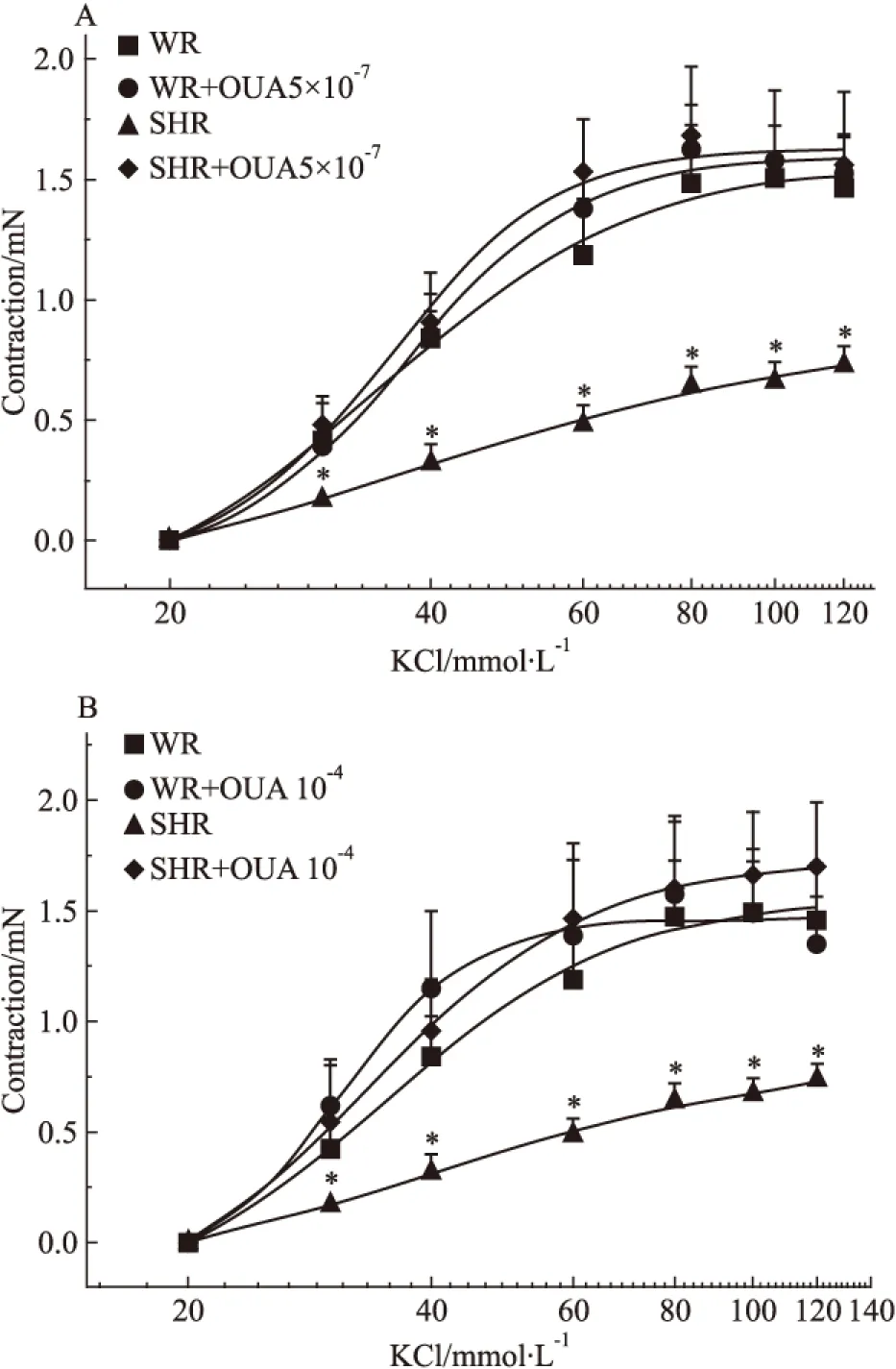
Fig 6 Effects of OUA on cumulative concentration-response curves of isolated basilar rings contracted by KCl in WR and SHR rats(n=6)
*P<0.05vsWR.A:SHR+OUA 5×10-7mol·L-1;B:SHR+OUA 10-4mol·L-1
2.7 OUA对5-HT收缩SHR基底动脉量效曲线的影响 当用5×10-7mol·L-1的OUA溶液预处理分别抑制WR和SHR脑血管高亲和力钠泵后,10-9、10-8、3×10-8、10-7、3×10-7、10-6、及3×10-6mol·L-1的5-HT溶液产生的收缩力依次为0、0.06±0.02、0.29±0.07、1.00±0.05、2.46±0.37、4.12±0.46、5.37±0.23、4.37±0.29 mN和0、0.06±0.01、0.17±0.02、0.69±0.06、1.44±0.22、2.66±0.23、3.10±0.27、2.81±0.22 mN;而用10-4mol·L-1的OUA溶液预处理分别抑制WR和SHR脑血管高、低两种亲和力钠泵后,上述浓度的5-HT溶液产生的收缩力依次为0、0.09±0.03、0.30±0.06、1.05±0.13、2.88±0.36、4.84±0.40、5.56±0.29、4.87±0.28 mN和0、0.04±0.01、0.34±0.05、0.74±0.06、1.49±0.17、3.19±0.44、4.00±0.26、3.65±0.20 mN。无论用OUA抑制高亲和力钠泵(Fig 8A),还是抑制高、低两种亲和力钠泵(Fig 8B),均不影响5-HT 所致的WR脑血管收缩(P>0.05),但却明显增强5-HT所致的SHR脑血管产生的收缩(P<0.05)。在WR脑血管,无论5×10-7mol·L-1还是10-4mol·L-1的OUA溶液预处理均对5-HT产生的收缩力无明显影响(P>0.05)(Fig 9A),但在SHR脑血管却能浓度依赖性提高5-HT产生的收缩力(P<0.05)(Fig 9B)。上述结果表明:抑制钠泵并不影响5-HT所致正常大鼠脑血管收缩,只可明显增强5-HT所致的高血压大鼠脑血管的收缩力,使其5-HT量效曲线不同程度明显左移,而且进一步提示高、低亲和力两种钠泵α-亚基均参与了5-HT在高血压大鼠脑血管诱发的收缩反应。
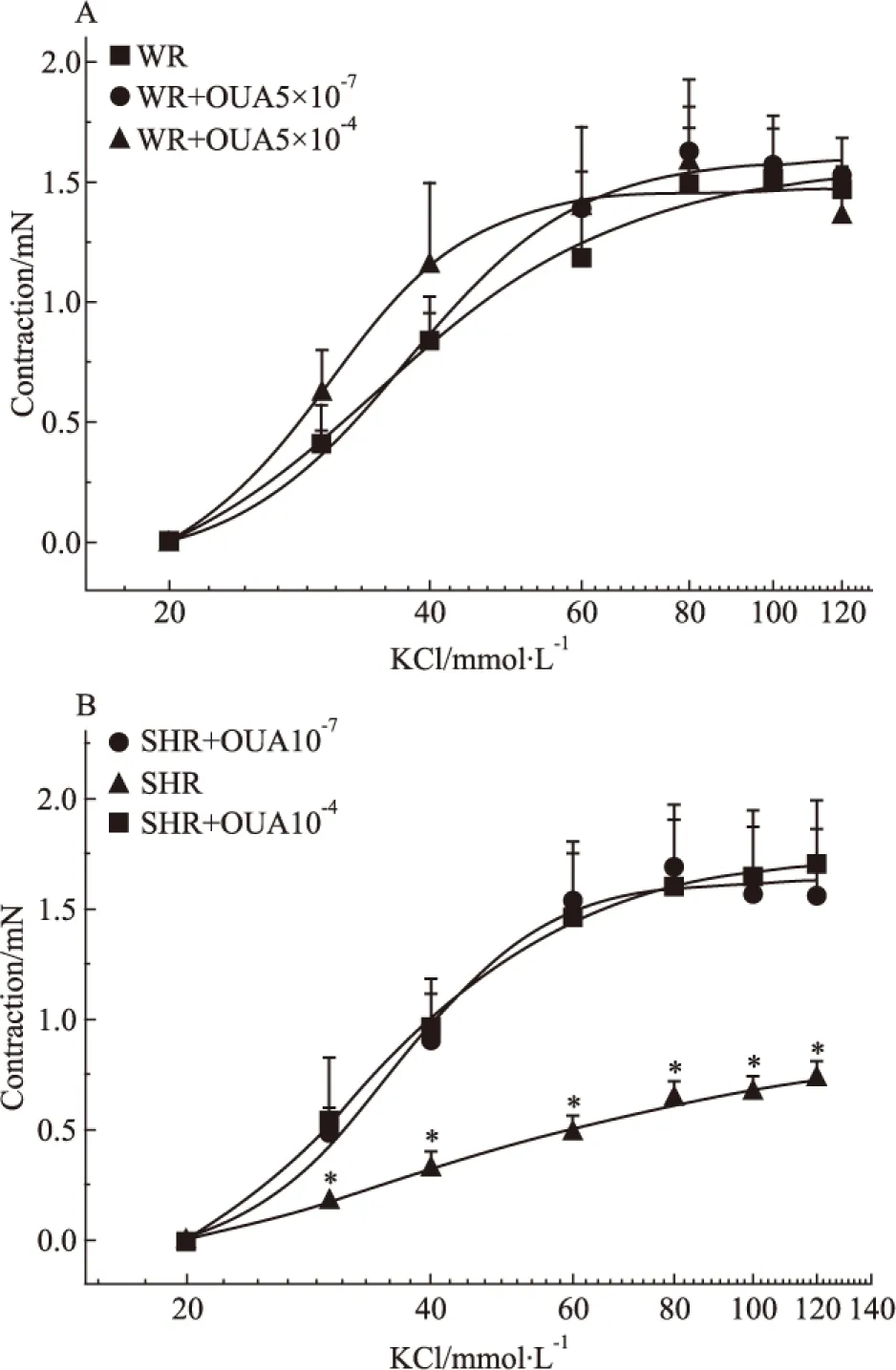
Fig 7 Effects of OUA on cumulative concentration-response curves for contraction of isolated basilar rings induced by KCl in WR and SHR rats(n=6)
*P<0.05vsWR.A:SHR+OUA 5×10-7mol·L-1;B:SHR+OUA 10-4mol·L-1
2.8 不同浓度OUA对5-HT收缩SHR基底动脉作用的影响 OUA为钠泵抑制剂,5×10-7mol·L-1和10-4mol·L-1浓度的OUA溶液不影响正常大鼠,只增强高血压大鼠脑血管对5-HT的收缩反应的原因是否为钠泵抑制的结果呢?我们分别用10-9、10-8、10-7、10-6、10-5、10-4、10-3mol·L-1的OUA溶液孵育血管30 min后,再加入5×10-7mol·L-1的5-HT溶液,比较了其在WR或SHR对5-HT收缩基底动脉作用的影响。实验结果表明,其在WR基底动脉产生的血管收缩力依次为3.95±0.47、4.04±0.49、4.51±0.48、4.64±0.40、4.40±0.43、4.64±0.43、4.19±0.38 mN,不同浓度OUA溶液对5-HT所致WR基底动脉收缩作用无明显影响;而在SHR基底动脉产生的血管收缩力依次为2.01±0.19、2.38±0.09、3.15±0.24、3.17±0.19、3.52±0.38、3.67±0.50、3.66±0.56mN,明显低于5-HT在WR基底动脉产生的收缩作用,且随着OUA浓度的增高,5-HT收缩SHR基底动脉作用逐渐增强,且呈明显的OUA浓度依赖关系(r=0.9393,P<0.05)(Fig 10)。这些结果不仅再次表明高血压病变可明显降低5-HT对脑血管的收缩作用,及钠泵可选择性参与高血压大鼠脑血管对5-HT的收缩反应,而且进一步提示高血压病变可能会增加脑血管对OUA的敏感性。
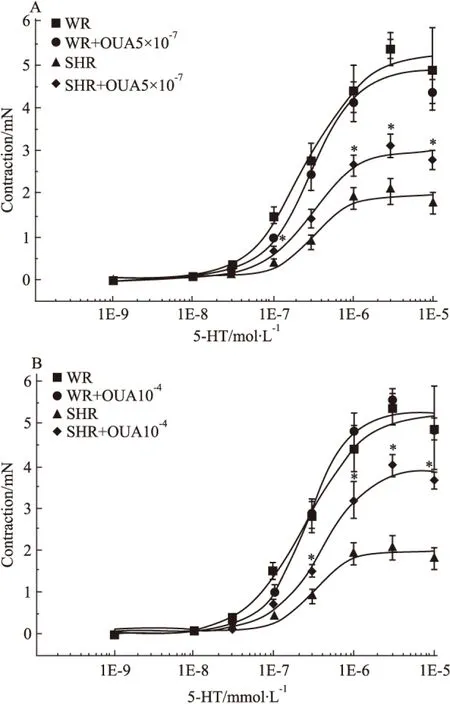
Fig 8 Effects of OUA on cumulative concentration-response curves for contraction of isolated basilar rings induced by 5-HT in WR and SHR(n=6)
*P<0.05vsSHR.A:WR+OUA 5×10-7mol·L-1;B:10-4mol·L-1
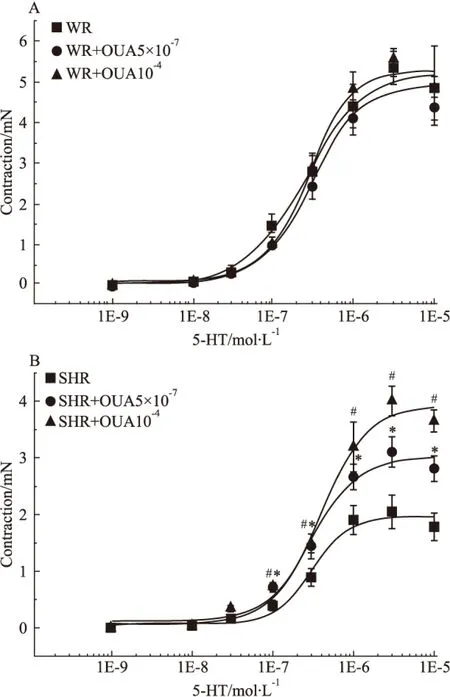
Fig 9 Effects of OUA on cumulative concentration-response curves for contraction of isolated basilar rings induced by 5-HT in WR and SHR(n=6)
#P<0.05,*P<0.05vsSHR
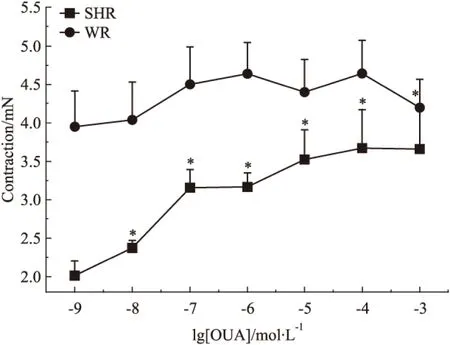
Fig 10 Cumulative concentration-response curves of isolated basilar rings induced by OUA in WR and SHR(n=6)
*P<0.05vsWR
3 讨论
某些病理状态,如高血压、脑缺血、缺氧及动脉粥样硬化等可以损伤血管,导致血管功能障碍。本实验发现高血压可使内皮完整的大鼠脑基底动脉对KCl和5-HT的量效曲线明显右移,明显降低脑血管对缩血管物质的反应性。但无论在高血压动物(SHR)还是正常血压动物(WR)的基底动脉,5-HT引起的收缩明显高于KCl引起的收缩,表明脑血管对5-HT收缩反应比对KCl的更敏感。鉴于KCl和5-HT引起血管收缩的机制分别与电压依赖性钙通道和受体操纵性钙通道的钙内流有关,且KCl和5-HT在去内皮的SHR和WR基底动脉诱发的收缩幅度几乎相同[22],所以我们推测导致这种差别的主要原因可能与两种钙通道在血管内皮细胞不同分布有关。
已知钠泵是目前所知OUA类药物和内源性OUA类物质的唯一受体,是维持细胞基本生理功能的关键酶,并在血管紧张度的维持和血管收缩中起着重要作用[23]。钠泵由α、β和γ 3个亚基构成,其中α亚基为催化亚基,目前发现有α1、α2、α3、α44种,其包含ATP、Na+、K+和OUA结合点[24]。在啮齿类动物,不同的α亚基对OUA的亲和力、离子通道动力学、以及钙的敏感性均有所不同,故分为高亲和力钠泵和低亲和力钠泵,其中α1为低亲和力钠泵α亚基,而α2、α3属于高亲和力钠泵α亚基。本研究结果也从功能学角度进一步表明,在SHR基底动脉上同时存在高亲和力和低亲和力α亚基,其Kd分别为1.7×10-8mol·L-1和1.6×10-5mol·L-1,与文献报告的高亲和力α2、α3亚基的Kh为3.8×10-8mol·L-1和低亲和力α1亚基的Kl为1.4×10-5mol·L-1基本相符[25],提示本实验所采用的5×10-7mol·L-1的OUA能抑制脑血管上高亲和力钠泵活性,而10-4mol·L-1的OUA能抑制脑血管的总泵(高亲和力钠泵+低亲和力钠泵)活性。OUA可通过抑制血管平滑肌细胞膜上的钠泵提高局部的[Na+],而局部的[Na+]累积则可通过血管的NCX促进Ca2+进入细胞,提高血管的张力,进而导致高血压的产生。
新福林在无K+溶液中诱发的血管收缩几乎可以被再加入K+引起的浓度依赖性舒张完全翻转,因为无K+时钠泵可由于其对细胞外K+的敏感性而被完全抑制,当K+再被加入时可激活钠泵而使细胞膜超极化,进而随着Ca2+的外排触发血管平滑肌舒张。这种K+诱发的血管舒张可被用作一种间接评价血管钠泵活性的方法[20-21]。在无K+溶液中再加入K+可浓度依赖性舒张由新福林收缩的基底动脉环,而且在本研究所用的所有K+浓度,这种K+诱发的脑血管舒张程度在SHR均明显低于WR,提示高血压病变可降低脑血管钠泵的活性;但10-4mol·L-1的OUA在SHR抑制这种K+诱发的基底动脉舒张程度明显大于其在WR的程度,这与文献报道的10-3mol·L-1的OUA在SHR可完全抑制,而在WR仅部分抑制K+诱发的脑血管舒张程度的结果相一致[26],提示高血压病变在降低脑血管钠泵活性的同时可能会提高脑血管钠泵对OUA敏感性。
当我们采用5×10-7mol·L-1和10-4mol·L-1的OUA溶液分别抑制脑血管的高亲和力钠泵和总泵活性后,再用不同浓度的5-HT或KCl灌流,发现2个浓度的OUA虽然对KCl和5-HT收缩正常血压大鼠脑血管的量效关系曲线无明显影响(Fig 7A,Fig 9A),但均能使KCl和5-HT收缩高血压大鼠脑血管的量效关系曲线左移,可完全或部分对抗高血压降低的KCl(Fig 6,Fig 7)或5-HT(Fig 8,Fig 9)对脑血管的收缩作用。这些结果提示,钠泵只参与了高血压大鼠脑血管对5-HT和KCl两个血管收缩剂的收缩反应,而与正常血压大鼠脑血管对这两个血管收缩剂的收缩反应无关。对于高血压降低的脑血管对KCl收缩反应,5×10-7mol·L-1的OUA可使之恢复至正常血压脑血管对KCl的收缩反应水平(Fig 6A),且随着OUA浓度增加至10-4mol·L-1后,KCl收缩高血压大鼠脑血管的量效关系曲线也不再进一步左移(Fig 6B,Fig 7B),表明只抑制高亲和力钠泵即可以完全阻断高血压降低的KCl收缩脑血管的作用,即仅高亲和力钠泵α亚基参与了高血压引起的脑血管对KCl收缩性的降低作用。对于高血压降低的脑血管对5-HT收缩反应,其量效关系曲线虽然可被5×10-7mol·L-1和10-4mol·L-1的 OUA左移(Fig 9B),但二者均不能恢复至其在正常血压脑血管对5-HT的收缩反应水平(Fig 8)。而且,当用不同浓度OUA分别孵育血管30 min后再灌流5×10-7mol·L-1的5-HT溶液,可以看到所有浓度的OUA均不影响正常血压大鼠脑血管对5-HT的收缩反应,而在高血压大鼠脑血管则不同,OUA可浓度依赖性(r=0.9393,P<0.05)增加5-HT所致的血管收缩力。这些结果提示,钠泵不仅参与了高血压所致脑血管对5-HT反应性的降低,而且是高、低亲和力钠泵共同参与了5-HT在高血压脑血管的收缩反应。钠泵抑制可通过胞质中Na+蓄积激活NCX反向转运而收缩血管平滑肌[3-4]。脑血管对5-HT的敏感性增加可能在于OUA改变了脑血管对血管收缩剂的反应[6],也可能在于OUA对血管平滑肌的直接收缩作用[27-28]。
综上所述,本研究表明高血压病变可明显降低脑血管对KCl和5-HT的收缩反应,而OUA却可增强高血压脑血管对KCl和5-HT的收缩反应,其机制可能与高血压降低钠泵活性或钠泵对OUA敏感性增加有关。且仅高亲和力钠泵介导了SHR脑血管对KCl的收缩反应,而SHR脑血管对5-HT的收缩反应则由高、低亲和力两种钠泵共同参与,也能增加脑血管钠泵对OUA的敏感性。
(致谢:本实验在河北省新药药理毒理研究实验室完成,感谢河北医科大学药学院的王永利和郭炜两位老师的指导,以及石家庄市第三医院的郝亮和郭宇松两位同志的帮助。)
[1] Mccarron J G,Halpern W. Potassium dilates rat cerebral arteries by two independent mechanisms[J].AmJPhysiol, 1990, 259(3 Pt 2): H902-8.
[2] Paulson O B, Newman E A. Does the release of potassium from astrocyte endfeet regulate cerebral blood flow[J].Science, 1987, 237(4817): 896-8.
[3] Fernández-Alfonso M S, Sánchez-Ferrer C F, Hernández M C, Marín J. Na+/Ca2+exchange mediation in the ouabain-induced contraction in human placental vessels[J].GenPharmacol, 1992, 23(3): 439-44.
[4] 孟 岩,罗 红,任晓华,王永利. Na+/K+泵参与缺氧诱发的大鼠脑血管收缩的体外研究[J]. 中国药理学通报, 2013, 29(9): 1307-12.
[4] Meng Y,Luo H,Ren X H, Wang Y L. Na+, K+-ATPase involes in contraction of rat cerebral artery induced by anoxia[J].ChinPharmacolBull, 2013, 29(9): 1307-12.
[5] Marín J, Redondo J. Vascular sodium pump: endothelial modulation and alterations in some pathological conditions[J].PharmacolTher, 1999, 84(3): 249-71.
[6] Winquist R J, Bohr D F. Structural and functional changes in cerebral arteries from spontaneously hypertensive rats[J].Hypertension, 1983, 5(3): 292-7.
[7] Leenen F H. The central role of the brain aldosterone-“ouabain” pathway in salt-sensitive hypertension[J].BiochimBiophysActa, 2010, 1802(12): 1132-9.
[8] Blaustein M P, Zhang J, Chen L, et al. The pump, the exchanger, and endogenous ouabain signaling mechanisms that link salt retention to hypertension[J].Hypertension, 2009, 53(2): 291-8.
[9] Blaustein M P, Hamlyn J M. Signaling mechanisms that link salt retention to hypertension: Endogenous ouabain, the Na+pump, the Na+/Ca2+exchanger and TRPC proteins[J].BiochimBiophysActa, 2010, 1802(12): 1219-29.
[10]Payne R A, Webb D J. Arterial blood pressure and stiffness in hypertension: is arterial structure important[J].Hypertension, 2006, 48(3): 366-7.
[11]Schiffrin E L. Remodeling of resistance arteries in essential hypertension and effects of antihypertensive treatment[J].AmJHypertens, 2004, 17(12 Pt 1): 1192-200.
[12]盖祥云,林鹏程,何彦峰,才让南加.低氧性肺动脉高压中低氧性肺血管收缩的作用[J]. 中国药理学通报, 2016, 32(6): 768-72.
[12]Gai X Y, Lin P C, He Y F, Cai R N J. Effect of hypoxic pulmonary vasoconstriction on hypoxic pulmonary hypertension[J].ChinPharmacolBull, 2016, 32(6):768-72.
[13]Hamlyn J M, Ringel R, Schaeffer J, et al. A circulating inhibitor of (Na/K) ATPase associated with essential hypertension[J].Nature, 1982, 300(5893): 650-2.
[14]Gottlieb S S, Rogowski A C, Weinberg M, et al. Elevated concentration of endogenous ouabain in patients with congestive heart failure[J].Circulation, 1992, 86(2): 420-5.
[15]Hamlyn J M, Hamilton B P, Manunta P. Endogenous ouabain, sodium balance and blood pressure: a review and a hypothesis[J].JHypertens, 1996, 14(2): 151-67.
[16]Manunta P, Stella P, Rivera R, et al. Left ventricular mass, stroke volume, and ouabain-like factor in essential hypertension[J].Hypertension, 1999, 34(3): 450-6.
[17]Schoner W. Endogenous cardiac glycosides, a new class of steroid hormones[J].EurJBiochem, 2002, 269(10): 2440-8.
[18]Saunders R, Scheiner-Bobis G. Ouabain stimulates endothelin release and expression in human endothelial cells without inhibiting the sodium pump[J].EurJBiochem, 2004, 271(5): 1054-62.
[19]Ferrari P. Rostafuroxin: an ouabain-inhibitor counteracting specific forms of hypertension[J].BiochimBiophysActa,2010, 1802(12):1254-8.
[20]Rossoni L V,Salaices M,Marín J, et al. Alterations in phenylephrine-induced contractions and the vascular expression of Na+, K+-ATPase in ouabain-induced hypertension[J].BrJPharmacol, 2002, 135(3): 771-81
[21]Webb R C, Bohr D F. Potassium-induced relaxation as an indicator of Na+-K+ATPase activity in the vascular smooth muscle[J].BloodVessels,1978, 15(1-3):198-207.
[22]Yokota Y, Imaizumi Y, Asano M, et al. Endothelium-derived relaxing factor released by 5-HT: distinct from nitric oxide in basilar arteries of normotensive and hypertensive rats[J].BrJPharmacol, 1994, 113(1): 324-30.
[23]Marín J, Redondo J. Vascular sodium pump: endothelial modulation and alterations in some pathological processes and aging[J].PharmacolTher, 1999, 84(3): 249-71.
[24]Blanco G,Mercer R W. Isozymes of the Na-K-ATPase: heterogeneity in structure, diversity in function[J].AmJPhysiol, 1998, 275(5 Pt 2):F633-50.
[25]刘 倩,郭会彩,张丽男,王永利. Na+,K+-ATP酶参与大鼠皮层神经元NMDA电流的调节[J].中国药理学通报, 2011, 27(1): 117-21.
[25]Liu Q, Guo H C, Zhang L N, Wang Y L. Comprehensive study of N-methyl-D-aspartate current involving Na+, K+-ATPase in rat cortical neuron[J].ChinPharmacolBull, 2011, 27(1):117-21.
[26]Arvola P,Pörsti I,Vuorinen P, et al. Contractions induced by potassium-free solution and potassium relaxation in vascular smooth muscle of hypertensive and normotensive rats[J].BrJPharmacol, 1992, 106(1): 157-65.
[27]Marín J,Sánchez-Ferrer C F,Salaices M. Effects of ouabain on isolated cerebral and femoral arteries of the cat: a functional and biochemical study[J].BrJPharmacol, 1988, 93(1): 43-52.
[28]Rodríguez-Maas L,Sánchez-Ferrer C F,Pareja A, et al. Neurogenic component of ouabain-evoked contractions is modulated by the endothelium[J].Hypertension, 1994, 23(1): 10-7.
Effect of hypertension on vascular contraction and sodium pump activity in rat cerebral basilar artery
WANG Hai-yan1, HAO Liang1, GUO Yu-song1, WANG Yong-li2, GUO Wei2
(1.DeptofPharmacy,theThirdHospitalofShijiazhuang, 2.SchoolofPharmacy,HebeiMedicalUniversity,Shijiazhuang050017,China)
Aim To explore the effects of hypertension on the contractibility of rat basilar artery and its interactions with the sodium pump activity.Methods The basilar artery was respectively isolated from Wistar and SHR rats,and the isometric tension of arterial rings was measured by Multi Myograph System-610M. The contractibilities of arterial rings induced by KCl or 5-HT were compared between the basilar arteries of the two groups of rats to analyze the effect of hypertension on the cerebral vascular tension and the activity of sodium pump. Results In SHR rats, the concentration-response curves of the contraction of isolated basilar artery rings induced by KCl and 5-HT were significantly shifted to right, and the relaxation of vascular tone induced by K+which was reintroduced from the external was attenuated compared with those in the WR. These results suggested that hypertension could significantly decrease the activity of the sodium pump and the contractile responses of KCl and 5-HT. OUA could contract the basilar artery in a concentration-dependent manner, and its concentration-response curve was optimally fitted by a two-site binding model: Kd was 1.7×10-8and 1.6×10-5mol·L-1, respectively. The results indicated that the two different function sodium pumps existed in the rat basilar artery: one with the high OUA affinity and the other with the low OUA affinity. If the high and low affinity sodium pumps were inhibited by 5×10-7and 10-4mol·L-1OUA, respectively, the concentration-response curves of KCl and 5-HT would shift to left in SHR rats but not in WR rats. It suggested that OUA could enhance the contraction induced by KCl and 5-HT significantly, and a concentration-dependent effect was observed in the SHR vascular contraction induced by 5-HT(r=0.9393,P<0.05). When the two concentrations of OUA were applied, there was no significant difference in the shift left of the concentration-response curves induced by KCl in the SHR cerebral vessels. However, the marked difference was shown in the shift left induced by 5-HT. The results implied that only the high affinity sodium pump was involved in the contractile response of SHR cerebral vascular to KCl, whereas, the contractile response of SHR cerebral vascular to 5-HT was induced by both high and low affinity sodium pumps.Conclusion Hypertension could lower the contractile response of the basilar artery to vasoconstrictors, and the mechanism might relate to the decreased sensitivity of the sodium pump induced by hypertension or the increased sensibility of the sodium pump to OUA.
hypertension; basilar artery; vascular contraction; KCl; 5-HT; OUA; sodium pump
时间:2016-12-27 16:13
http://www.cnki.net/kcms/detail/34.1086.R.20161227.1613.028.html
2016-09-06,
2016-11-27
王海燕(1982-),女,硕士,主管药师,研究方向:药理学,E-mail: carinawang@163.com; 郭 炜(1979-),女,博士,副教授,研究方向:药代动力学,通讯作者,E-mail: guowei8043586@sina.com
10.3969/j.issn.1001-1978.2017.01.014
A
1001-1978(2017)01-0074-10
R-332;R322.121;R329.2;R331.32;R544.1;R972.1;R977.3
