羊口疮病毒广东大浦株的分离鉴定及其遗传进化分析
2017-02-06郭璐璐崔言顺
郭璐璐 , 崔言顺
(山东农业大学动物科技学院 , 山东 泰安 271018)
由口疮病毒(ORFV)引起的羊口疮是危害严重的人兽共患病之一,该病主要发生在绵羊、山羊和多种野生动物[1],直接接触动物或接触被ORFV污染的物品是人类感染的重要原因,该病几乎在世界上所有养羊的国家都有发生。该病死亡率不高,但由于发病部位特殊严重影响被感染动物的采食及生产性能。王晴楠等[2]对我国1984-2014年羊口疮报道文献的统计分析表明,该病在我国24个省份都有发生,西北、东北及西南地区为该病的重灾区,此外,山东、广东、云南等地也出现该病的发生和流行。口疮病毒(ORFV)属于痘病毒科脊索亚科副痘病毒属的嗜上皮型双链DNA病毒,病毒粒子呈砖形或椭圆形,其表面呈绳索样纵横交错排列结构[3]。到目前为止,分离鉴定并获得全基因组序列的ORFV毒株基因组长度不一[4-5],G+C含量高达64%,都编码132个基因,在基因组的两侧末端区域的阅读框有很大差异,这些差异也许是ORFV毒力和免疫逃逸功能差异的最重要部位[4-6]。
2017年3月,在广东大浦地区某黑山羊养殖场发生了一例疑似羊口疮病毒感染的病例,我们进行了病毒的分离、鉴定和重要免疫原及毒力基因的遗传演化分析,这为该地区羊口疮的综合防控及监测提供了基础性数据。
1 材料与方法
1.1 病料的采集与处理 2017年3月在广东大浦某羊场无菌采集疑似发生口疮病羔羊的唇部增生物备用。对采集的山羊口唇部增生物剪碎、加入4 ℃预冷的无菌PBS研磨成悬液,同时加入双抗,以5 000 r/min离心10 min,用0.45 μm过滤器过滤上清液冻存于超低温冰箱,用于后续试验。
1.2 试验材料 胎牛血清和细胞培养基MEM,购自Gibco公司;青霉素/链霉素(双抗)磷酸盐缓冲液(PBS),购自美国Geneview公司;限制性内切酶EcoR I、LATaqDNA连接酶、pMD18-T载体、总DNA提取试剂盒、DNA凝胶回收试剂盒和DNA Marker,均购自TaKaRa公司。
1.3 病毒分离 OFTu细胞由华南农业大学宁章勇教授惠赠,按照文献的方法[1-2,6]进行培养。取1.2中的病料上清液1 mL接种于生长良好的OFTu细胞,37 ℃吸附1 h,吸附完成后弃上清液更换完全培养基,于37 ℃、体积分数5%CO2细胞培养箱静置培养,每天观察细胞,细胞出现病变效应(CPE),反复冻融3次,用细胞刮收集细胞,12 000 r/min离心 10 min,将上清1 mL接种到新的细胞中,连续盲传4代,直到细胞出现明显CEP,将病毒液冻存于超低温冰箱。
1.4 病毒DNA提取 按照病毒DNA/RNA提取试剂盒说明书,从1.3分离的病毒液中提取病毒DNA,获得的病毒DNA于-20 ℃保存备用。
1.5 ORFV广东大浦株ORFV 011基因和ORFV 059基因的扩增与克隆 参考GenBank中登录的羊口疮病毒基因组序列(AY386263),利用Primer 5.0软件设计引物,所有引物均由宝生物工程(大连)有限公司合成。引物信息如下,ORFV 011上游引物:5′-ATGTGGCCGTTCTCCTTATC-3′,下游引物:5′-TTAATTTATTGGCTTGCAG-3′;ORFV 059上游引物:5′-ATGGATCCACCCGAAATCAC-3′,下游引物:5′-TCACACGATGGCCGTGACCAG-3′。以总DNA提取试剂盒抽提病毒基因组DNA为模板,进行PCR扩增,采用25 μL的PCR反应体系:10×PCR缓冲液2.5 μL,dNTPs 2 μL(2.5 mmol/L),cDNA模板 1 μL,上、下游引物各 1 μL(10 μmol/L),LATaqDNA聚合酶0.2 μL(5U/μL),超纯水17.3 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火40 s,72 ℃延伸 90 s,35个循环;72 ℃终延伸10 min。反应结束后取6 μL PCR反应液在1.0%琼脂糖凝胶上电泳,检测扩增结果,经凝胶成像系统观察并记录结果。回收PCR扩增的目的片段,然后分别连接到pMD-18T载体,转化至JM109感受态细胞中,摇均提质粒,将跑胶鉴定正确的质粒送英潍捷基(上海)贸易有限公司测序。
1.6 ORFV广东大浦株ORFV 011基因和ORFV 059基因的遗传进化分析 针对ORFV 011基因和 ORFV 059基因构建进化树,选取数据库里含有全基因序列的不同ORFV分离株的ORFV 011基因和ORFV 059基因序列,这些序列经MEGA 5.0软件比对处理后用Neighbor-joining法构建系统进化树。
2 结果与分析
2.1 羊的发病情况 发病羊场养殖的是本地黑山羊,共200多只,发病羊为20只左右,发生率约为10%;发病年龄不一,从羔羊到成年羊都有。羔羊发病后由于吸奶困难,极易死亡;成年羊采食困难,消瘦。发病羊都具有类似的临床表现,在口唇部形成典型增生坏死灶,严重者在舌上形成溃疡和增生灶(见中插彩版图1),病羊几乎不能采食。
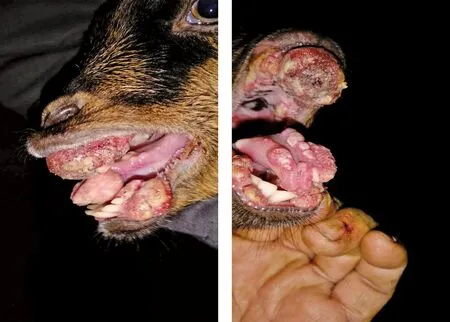
图1 发病羊的口腔、唇及舌部形成的增生坏死灶
2.2 病毒的分离 将采集的病羊痂皮组织按照前面描述的方法接种至OFTu细胞,在盲传4代后,OFTu细胞出现典型的CPE病变(见中插彩版图2),细胞出现肿胀、变圆、聚堆和死亡等现象。盲传4代后,收取病毒液,将该病毒分离株命名为ORFV-GDDP。
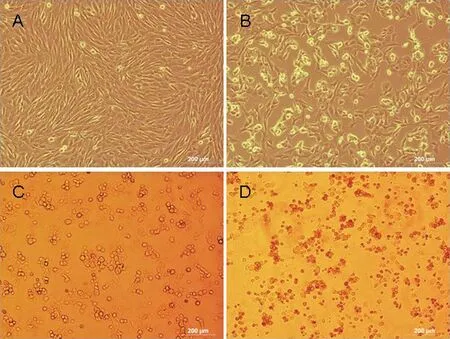
图2 感染ORFV后OFTu细胞病变
2.3 病毒的PCR鉴定 对具有标志性的ORFV 011基因和ORFV 059基因进行扩增。用设计的特异性引物对提取的病毒基因组DNA进行PCR扩增,PCR产物电泳结果显示:1,在1 000 bp至1 500 bp之间出现一条大小约为1 137 bp的特异性条带,符合ORFV 011基因大小;2,出现一条约为1 059 bp的特异性条带,符合ORFV 059基因大小(图3)。将扩增的目的条带分别胶回收、克隆以及测序。结果证明我们分离的病毒是羊口疮病毒,将其命名为ORFV-GDDP分离株,获得的序列提交至BenBank数据库,获得登录号分别为:MF034455(ORFV 011)、MF034456(ORFV 059)。
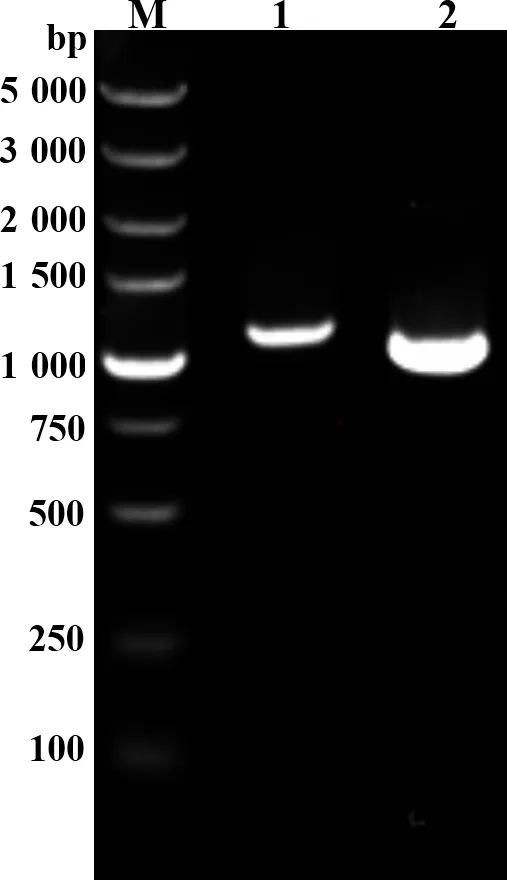
图3 ORFV 011基因和ORFV 059基因的PCR扩增结果
2.4 病毒基因的进化树分析 对ORFV 011基因和ORFV 059基因使用MEGA 5.0软件中Neighbor-joining法构建系统进化树。分离的病毒为羊口疮病毒,ORFV 011基因系统进化分析表明,GDDP株与新疆毒株xiangjian2和福建毒株FJ-YX、FZ毒株在同一分支上(图4)。ORFV 059基因系统进化分析表明,GDDP分离株与福建毒株FJ-SL和DG在同一分支上(图4)。
3 讨论
羊口疮病毒感染山羊和绵羊后,会造成口、唇、鼻、舌、乳房等部位出现丘疹、脓疮、溃疡和结痂[7],在口腔部位由于坏死、结痂和组织的修复再生多次重复发生,会形成巨大的感染性创伤修复灶,这会严重的影响山羊的采食。在本次羊群暴发的羊口疮中,口腔部位是主要的受害部位。该病毒可在牛、绵羊、山羊的肾细胞以及犊牛和羔羊的睾丸细胞上生长,并形成细胞病变[6-7], 我国早期的研究工作均采取了上述细胞进行病毒的分离和鉴定工作。2013年,汪园园等[8]报道了从120日龄羊胚胎鼻甲上分离的上皮细胞(OFTu)具有增殖ORFV效价高、细胞病变显著的特点,非常适用于ORFV的体外增殖和致病机制的研究。自此,OFTu细胞开始广泛用于ORFV的分离和鉴定。在本研究中,我们采用了该细胞进行病毒的分离和鉴定,经过4代盲传即获得了纯化病毒。经过对ORFV 011基因和059基因的扩增、测序,证明我们分离的病毒确实为羊口疮病毒。从山羊的临床表现以及后期的病毒分离、病毒编码基因的扩增和测序等多方面证明,该病为羊口疮。

图4 GDDP株ORFV011基因的进化树

图5 GDDP株ORFV059基因的进化树
经PCR扩增GDDP株ORFV的011基因和059基因,获得了其全基因序列,序列的进化分析表明,ORFV 011基因系统进化分析表明,GDDP株与新疆毒株xiangjian2和福建毒株FJ-YX、FZ毒株在同一分支上。ORFV 059基因系统进化分析表明,GDDP分离株与福建毒株FJ-SL和DG在同一分支上。由于羊口疮病毒基因组具有广泛的容纳性所造成的同源或非同源基因重组和非必须基因缺失的特殊性[5-6,9-10],我们怀疑GDDP株ORFV可能是重组病毒。后期的调查表明,大浦当地有从福建和新疆购买的山羊和绵羊,并且这些羊群也发生了羊口疮,这也进一步证明了大浦当地流行的ORFV病毒株极有可能是来源于福建和新疆等地的毒株的重组病毒。羊口疮病毒的这种特性,决定了羊口疮防控极其困难,因此制定羊口疮的综合防控措施时,必须考虑病毒流行毒株的分子特性。鉴于广东省地处亚热带、水量充沛,植物性资源丰富,近年来山羊养殖规模逐渐扩大,羊口疮造成的危害逐年增加,有必要对广东省进行ORFV系统的流行病学调查,为该地区羊口疮的综合防控提供科学的依据。
[1] Diel D G, Delhon G, Luo S,etal. A novel inhibitor of the NF-{kappa}B signaling pathway encoded by the parapoxvirus orf virus[J]. Virol, 2010, 84: 3 962-3 973.
[2] 王晴楠,张凯照,宁章勇. 我国1984-2014年羊口疮报道文献的统计分析[J]. 畜牧与兽医, 2015, 47(9): 111-113.
[3] Delhon G, Tulman E R, Afonso C L,etal. Genomes of the parapoxviruses ORF virus and bovine papular stomatitis virus[J]. J. Virol, 2004, 78: 168-177.
[4] Mercer A A, Ueda N, Friederichs S M,etal. Comparative analysis of genome sequences of three isolates of Orf virus reveals unexpected sequence variation[J]. Virus Res,2006, 116: 146-158.
[5] Chi X, Zeng X, Li W,etal. Genome analysis of orf virus isolates from goats in the Fujian Province of southern China. Front[J]. Microbiol, 2015, 6: 1 135.
[6] Zhang K, Xiao Y, Yu M,etal. Phylogenetic analysis of three orf virus strains isolated from different districts in Shandong Province, East China[J]. J Vet Med Sci, 2016,77(12):1 639-1 645.
[7] de Oliveira C H, Assis F L, Neto J D,etal. Multifocal cutaneous ORF virus infection in goats in the Amazon region, Brazil[J]. Vector Borne Zoonotic Dis, 2012, 12: 336-340
[8] 汪园园,童双,李威,等. 羊胚胎鼻甲细胞的原代培养及其在羊口疮病毒研究中的应用[J]. 中国兽医科学, 2013, 43(5): 470-475.
[9] Fleming SB, Lyttle DJ, Sullivan JT,etal. Genomic analysis of a transposition-deletion variant of orf virus reveals a 3.3 kbp region of non-essential DNA[J]. J. Gen. Viro, 1995, 76(12): 2 969-2 978.
[10] Zhao K, Li J, He W,etal. Cyclophilin B facilitates the replication of Orf virus[J]. Virol J, 2017,14(1):114.
