三疣梭子蟹(Portunus trituberculatus)肝胰腺内源酶性质的初步研究
2017-01-18杨利珠孟祥红
杨利珠, 张 莉, 黄 琳, 孟祥红
三疣梭子蟹()肝胰腺内源酶性质的初步研究
杨利珠, 张 莉, 黄 琳, 孟祥红
(中国海洋大学食品科学与工程学院, 山东青岛266003)
内源酶是三疣梭子蟹()体内重要的酶, 往往会导致梭子蟹死后肌肉组织迅速软化, 严重影响了蟹肉的贮藏品质。为了探明该酶的基本特性, 本试验从三疣梭子蟹肝胰腺中提取了粗酶, 优化了提取方法, 并对其部分酶学性质进行初步研究。结果表明: 三疣梭子蟹肝胰腺内源酶最佳浸提时间段为4~12 h, 酶比活显著高于0~4 h和12~14 h; 以酪蛋白为水解底物, 内源酶作用最适温度为65℃、最适pH范围为7.0~8.0; 丝氨酸蛋白酶特异性抑制剂, 包括大豆胰蛋白酶抑制剂(SBTI)和苯甲基磺酰氟(PMSF), 对内源酶活力的相对抑制率分别为100%、70.46%±6.27%, 显著高于其他抑制剂的相对抑制率, 推测丝氨酸蛋白酶为主要内源酶; 在硫酸铵分级沉淀中, 分别以酪蛋白和Boc-Phe-Ser-Arg-MCA为底物, 前者最适盐析浓度为0~70%, 后者为30%~70%, 酶比活显著高于其他盐浓度; 当硫酸铵浓度为40%~60%时, 盐析蛋白质含量、粗酶酶活和丝氨酸蛋白酶活均显著高于其他盐浓度。
三疣梭子蟹(); 肝胰腺; 内源酶; 性质
三疣梭子蟹()是中国经济价值最大的一种海水养殖蟹类, 约占中国梭子蟹总产量的90%左右[1], 由于其具有营养丰富和味道鲜美的特点而畅销国内外。梭子蟹因其身处海洋的特殊环境, 所以在离开高盐高氧环境后存活率便大大降低。未经任何处理的三疣梭子蟹, 在其死后肌肉的软化速率较快, 并且很快发生空壳现象。
在水产品的肌肉组织和内脏中, 存在许多内源性蛋白酶, 它们直接或间接地加速了水产品在贮藏过程中肌肉软化速率。已有国内外文献报道了远洋梭子蟹()[2]肝胰腺中的胰蛋白酶类酶、罗氏沼虾()[3]肝胰腺中的胰蛋白酶、口虾蛄()[4]肌肉中的丝氨酸蛋白酶和刺参()[5]消化腺中的丝氨酸蛋白酶等, 与其自身肌肉的溶解有关。但是, 对三疣梭子蟹的肌肉软化原因还鲜有报道。本试验拟通过对三疣梭子蟹肝胰腺内源酶基本性质的研究为探究三疣梭子蟹保藏过程中发生的自溶现象提供理论依据。
1 材料与方法
1.1 试验材料
试验所用鲜活三疣梭子蟹()购于青岛市团岛海鲜市场, 平均质量162 g左右, 观察体表健康无病。
1.2 试验方法
1.2.1 三疣梭子蟹肝胰腺干燥脱脂粉末的制备
将鲜活的三疣梭子蟹肝胰腺取出, 称取100 g, 按1︰3(/)加入–20℃的丙酮, 在组织捣碎机中间歇性捣碎3min, 匀浆液在真空下抽滤。将滤渣进行真空干燥, 直至滤渣干燥且无丙酮味[6]。干燥后的肝胰腺粉末在–20℃下保藏待用。
1.2.2 三疣梭子蟹肝胰腺粗酶提取液的制备
将上述脱脂干燥粉末溶解于2倍体积的原肝胰腺湿重的0.05 mol/LTris-HCl缓冲液中(4 ℃, pH7.5), 在4 ℃条件下搅拌提取粗酶。离心15min(4 ℃, 12000 r/min), 上清液即为三疣梭子蟹肝胰腺粗酶提取液。
1.2.3 三疣梭子蟹粗酶提取时间的优化
在0、2、4、6、8、10、12、14 h 分别取20.0 mL1.2.2中的提取液, 同条件下离心, 取上清液。向上清液中缓慢加入经研磨干燥后的硫酸铵固体粉末, 至100%饱和度, 4℃静置过夜。次日离心(4℃, 12000 r/min), 收集沉淀。用0.05 mol/L Tris-HCl缓冲液(4℃, pH 7.5)复溶, 并透析24 h, 期间换液3~4次。透析后所得液体即为粗酶液。将粗酶液离心(4℃, 12000 r/min), 留上清待用。用Tris-HCl缓冲液将各透析后的粗酶液定容至等体积, 测定其蛋白质含量及粗酶活力, 计算酶比活, 最大酶比活对应的提取时间为最佳提取时间, 做三组平行试验。
1.2.4 三疣梭子蟹粗酶酶活最适温度测定
选取上述最佳提取时间下的粗酶液, 在不同温度(4、20、30、40、50、55、60、65、70、80℃)条件下测定其粗酶活力, 以确定最适温度。
1.2.5 三疣梭子蟹粗酶酶活最适pH测定
于最适温度下, 将粗酶液置于不同pH(pH2.0~11.0)条件下测定粗酶活力, 以确定最适pH。中不同pH值缓冲液分别为: 柠檬酸-Na2HPO4缓冲液(pH2.0~ 8.0)、Tris-HCl缓冲液(pH 7.0~9.0)、甘氨酸- NaOH缓冲液(pH 9.0~11.0)。
1.2.6 抑制剂对三疣梭子蟹粗酶活性的影响
参考Klomklao等[7]的方法并稍作修改。将酶液分别加入等体积不同浓度、不同抑制剂溶液中, 使抑制剂的最终浓度达到以下浓度: 0.1和5 mmol/L N-甲苯磺酰-L-赖氨酸-氯甲基酮(TLCK)、0.1和5 mmol/L甲苯磺酰-苯丙氨酸氯甲基酮(TPCK)、0.005和1 g/mL SBTI、0.025和5 mmol/L PMSF、0.1和5 mmol/L乙二胺四乙酸(EDTA)、0.025和0.1 mmol/L胃蛋白酶抑制剂A(PepstatinA)、0.025和0.1 mmol/L E-64蛋白酶抑制剂(E-64)、0.1和5 mmol/L碘乙酸。室温下放置30 min后, 在最适pH值、最适温度下测其粗酶活力。以超纯水作为对照。计算不同蛋白酶抑制剂对粗酶活性的抑制率, 其中, 抑制率最大的设定为100%, 计算其他蛋白酶抑制剂的相对抑制率。蛋白酶活力抑制率的计算公式如下:
抑制率(%)=(C–S)/C×100
其中,C、S分别为对照组蛋白酶活力和试验组蛋白酶活力。
1.2.7 硫酸铵分级沉淀
向30.0 mL未经硫酸铵沉淀的粗酶提取液中, 缓慢加入经研磨干燥的硫酸铵固体粉末, 使硫酸铵溶液的饱和度依次达到20%、30%、40%、50%、60%、70%、80%、100%, 4℃条件下静置过夜, 离心(4℃, 12000 r/min)。盐析沉淀用适量0.05 mol/L Tris-HCl缓冲液(4℃, pH 7.5)复溶、透析并离心(4℃, 12000 r/min)。将各硫酸铵饱和度的粗酶液定容至蛋白质浓度相差小于0.1 mg/mL的粗酶溶液, 分别测其粗酶活力、丝氨酸蛋白酶活力和蛋白质含量, 并计算其相应的酶比活, 做三组平行试验。
1.2.8 可溶性蛋白质浓度测定
参考考马斯亮蓝染色法测定[8]。
1.2.9 蛋白酶粗酶活力测定
参考Jensen等[9]的方法并稍作修改。取1.0 mL粗酶液, 加入到3.0mLTris-HCl缓冲液(0.05 mol/L, pH7.5)中, 混匀, 随后加入1 mL1%酪蛋白溶液, 37℃条件下孵育15 min, 加入1 mL10%TCA溶液终止反应。4℃静置2 h, 5000 r/min离心20 min, 取上清, 在280nm下测吸光值。空白管中先加入1.0 mL粗酶液与1 mL 10%TCA溶液, 混匀, 37℃条件下孵育15 min, 加入1 mL 1%酪蛋白溶液, 其余操作相同。作三组平行试验。该条件下, 定义每分钟水解产生1µmol酪氨酸的酶量为一个蛋白酶活力单位(U)。
1.2.10 丝氨酸蛋白酶活力测定
本试验参考Yoshida等[10]的方法测定, 并稍作修改。取0.1 mL样品, 加入到0.8 mLTris-HCl缓冲液(0.05 mol/L, pH7.5)中, 随后加入0.1 mL 50 µmol/L荧光底物Boc-Phe-Ser-Arg-MCA, 混匀, 55℃条件下反应10 min, 加入1.5 mL荧光终止液(甲醇︰异丙醇︰水=35︰35︰30)终止反应。将混匀后的反应液在激发波长380 nm和发射波长450 nm下测定荧光强度, 作三组平行试验。该条件下, 定义每分钟水解产生1 nmolAMC的酶量为一个蛋白酶活力单位(U)。
1.3 数据分析
试验数据用平均数±标准差(means±SD)表示, 采用SPSS 19.0软件对数据进行ANOVA方差分析, 当差异显著(<0.05)时, 采用Duncan检验进行多重比较分析。
2 结果与分析
2.1 提取时间对三疣梭子蟹肝胰腺粗酶提取的影响
由图1a结果可见, 提取时间对粗酶提取液中蛋白质含量和粗酶总酶活无显著性影响(>0.05), 但是, 从图1b结果可见提取时间对酶比活却有显著性影响(<0.05)。由图1b可看出, 在提取时间为0~2 h间, 酶比活无显著性差异, 但在2 h后酶比活显著升高。当提取时间为4~12 h间, 各时间段粗酶提取液中酶比活无显著性差异, 但在提取时间超过12 h后, 酶比活显著下降。
注: 同一曲线上标中含有不同字母代表组间差异显著(< 0.05), 下同
2.2 温度对三疣梭子蟹肝胰腺粗酶活性的影响
由图2结果可见, 在pH为7.5的条件下, 不同温度条件对三疣梭子蟹肝胰腺粗酶活性有显著性影响(<0.05)。当温度为4~50℃时, 粗酶活力随温度的升高而迅速增加; 当温度为50~65℃时, 粗酶活力上升速度相对平缓, 在温度为65℃时, 粗酶活力达到最大; 但当温度超过65℃后, 粗酶活力迅速降低。
2.3 pH对三疣梭子蟹肝胰腺粗酶活性的影响
由图3结果可见, 当反应温度为65℃时, 不同pH条件对三疣梭子蟹肝胰腺粗酶活性有显著性影响(<0.05)。当pH为2.0~4.0时, 粗酶活力均较小, 而在pH>4时, 粗酶活力随着pH的上升而迅速增加, 且在pH为7.0时达到最大; 在Tris-HCl缓冲液体系中, 当pH分别为7.0和8.0时, 粗酶活力无显著性差异(<0.05); 当pH大于8.0后, 粗酶活力显著降低。此外, 从图中可以看出, Tris-HCl缓冲液体系(pH为7.0~9.0时)中粗酶活力明显高于柠檬酸-Na2HPO4和甘氨酸-NaOH缓冲液体系中的酶活力。因此, 后续的试验采用了Tris-HCl缓冲液体系。
2.4 蛋白酶抑制剂对三疣梭子蟹肝胰腺粗酶活性的影响
由表1可知, 在反应温度为65℃、pH为7.5的条件下, 不同抑制剂的不同浓度对三疣梭子蟹肝胰腺粗酶活力的相对抑制率有显著性差异(<0.05)。当SBTI浓度为1 g/L抑制率最大, 定义此抑制率为100。在各抑制剂浓度为5 mmol/L时, PMSF的平均抑制率最大, 依次往下分别为EDTA、TLCK和碘乙酸; 在各抑制剂浓度为0.1 mmol/L时, TLCK的平均抑制率最大, 依次往下分别为碘乙酸、PeptatinA、EDTA、E-64和TPCK; 在各抑制剂浓度为0.025 mmol/L时, PMSF的平均抑制率最大, 依次往下分别为E-64、PepstainA。
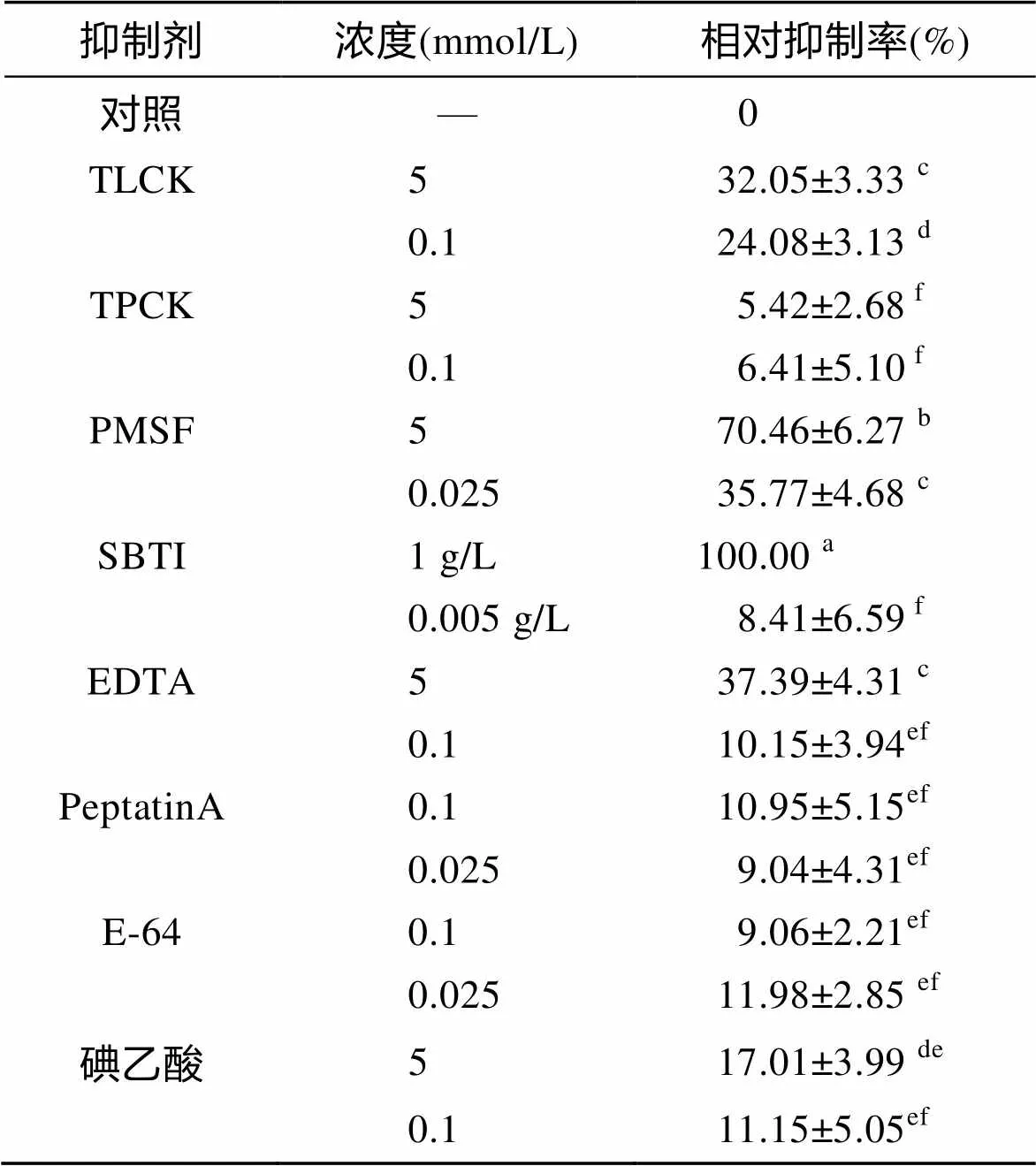
表1 不同抑制剂对三疣梭子蟹肝胰腺粗酶活力的相对抑制率
注: 同列数据右上标中不含有相同字母代表组间差异显著(<0.05)
2.5 硫酸铵分级沉淀
由图4可见, 不同硫酸铵浓度对三疣梭子蟹肝胰腺蛋白质含量、粗酶总酶活、丝氨酸蛋白酶活、粗酶比活和丝氨酸蛋白酶比活均有显著性影响(<0.05)。
由图4a、b、c可见, 当硫酸铵浓度在0~60%区间时, 各指标均随着硫酸铵浓度的升高而升高, 并且在50%~60%区间时达到最大值; 当硫酸铵饱和度大于60%后, 各指标均显著降低。
由图4d中粗酶比活的趋势可见, 当硫酸铵浓度在0~20%时, 粗酶比活相对较低, 硫酸铵浓度大于20%后有上升趋势, 硫酸铵浓度为20%~70%间, 粗酶比活无太大差异, 但是当硫酸铵浓度高于70%后, 粗酶比活急剧下降。由图4d中丝氨酸蛋白酶比活的趋势可见, 当硫酸铵浓度在0~40%时, 丝氨酸蛋白酶比活随着硫酸铵浓度的升高而升高, 硫酸铵浓度为30%~40%和40%~50%区间时无显著性差异, 丝氨酸蛋白酶比活在硫酸铵浓度为50%~60%时达到最大值, 当硫酸铵浓度高于60%后, 显著降低。
3 讨论
3.1 提取时间对三疣梭子蟹肝胰腺粗酶酶活的影响
酶原分子在一定条件下发生特异肽键断裂或去除部分肽段, 酶分子构象就会发生变化, 形成具有活性的三维结构,此为酶原的激活作用。据报道[11-12],在粗酶提取缓冲液中加入钙离子可使酶的结构更稳定[13]或对酶反应有激活作用。但是, 并不是对所有的胰蛋白酶都能被钙离子激活, David等[2]报道了钙离子反而使远洋梭子蟹()肝胰腺中类胰蛋白酶的酶活降低了4%。所以, 本试验没有采用此种方法, 试验采用延长搅拌浸提时间的方法来增加粗酶活力。结果显示, 适量延长浸提时间虽然对蛋白质含量和粗酶总酶活无显著影响, 但却能使粗酶比活显著增加13%, 证明用延长提取时间来增加粗酶活的方法是可行的。
脊椎动物有两种胰蛋白酶原活化的方式, 一是酶原的自我活化, 另一种是肠激酶识别活化肽与活性酶的接点。吴志强[14]推测, 由于甲壳类动物胰蛋白酶氨基酸序列中N-末端IVGG前不存在4个连续Asp,因此其可能为自我活化机制。本试验中, 酶比活在浸提时间为4~12 h达到较高水平并且长时间处于稳定状态, 随后却显著降低。推测可能由于随着搅拌时间的增长, 酶原逐渐被肝胰腺内部某些离子激活, 随后到达稳定状态。然而, 当浸提时间大于12 h, 酶比活却显著降低的原因还不得而知, 尚需要进一步的研究。
3.2 温度对三疣梭子蟹肝胰腺粗酶酶活的影响
本试验中, 三疣梭子蟹肝胰腺粗酶在以酪蛋白为水解底物时, 酶活在反应温度为65℃时最大, 此结果与已报道文献结果相似, 如远洋梭子蟹()类胰蛋白酶的最适温度60℃[2]、南极磷虾自溶酶最适温度50~60℃[15]、两种斑节对虾()胰蛋白酶的反应最适温度为55、65℃[16], 高于海参(Holothurian)体壁粗蛋白酶的最适温度50℃[17]、南美白对虾()虾头内源酸性蛋白酶的30℃[18]和纯化的口虾蛄()丝氨酸蛋白酶的最适温度约37℃[4]。当温度到达70℃, 粗酶酶活与最大酶比活相比, 降低了11%, 推测是由于热失活作用导致的。酶在高温下失活, 可能因为酶结构在高温下会部分伸展, 破坏酶的作用位点, 从而导致酶的活性降低或丧失。
3.3 pH对三疣梭子蟹肝胰腺粗酶酶活的影响
本试验中, 三疣梭子蟹肝胰腺粗酶在pH为7.0~ 8.0间均能保持较高活性, 此pH范围与很多甲壳类动物的胰蛋白酶类似, 如远洋梭子蟹()[2]、太平洋磷虾()[14]等, 也与某些动物的丝氨酸蛋白酶类似, 如罗氏沼虾()[3]、口虾蛄()[4]、狗母鱼、鲤鱼、鲫鱼[19]等, 但是, 低于皇家红虾()[20]胰蛋白酶的9.0。同类型的酶具有不同最适pH, 主要是由于在不同的pH介质中的不同电荷能影响底物以及酶的作用位点, 从而影响底物与酶作用位点结合的紧密度[21]。一般来说, 胰蛋白酶的最适反应pH在7.0~9.0间[22], 所以在此初步推测三疣梭子蟹肝胰腺粗酶中主要为胰蛋白酶。
3.4 抑制剂对三疣梭子蟹肝胰腺粗酶酶活的影响
本试验所采用的蛋白酶抑制剂中, TLCK和TPCK分别是胰蛋白酶特异性抑制剂和糜蛋白酶特异性抑制剂[7], PMSF和SBTI为丝氨酸蛋白酶特异性抑制剂[23], EDTA为金属蛋白酶特异性抑制剂[7], PepstatinA为天冬氨酸蛋白酶特异性抑制剂[24], E-64和碘乙酸为半胱氨酸蛋白酶特异性抑制剂[24, 7]。从试验结果可看出, SBTI在高浓度(1g/L)时对粗酶酶活的抑制作用最大, 其次, 在抑制剂浓度为5、0.1和0.025 mmol/L时, 抑制率最大的分别为PMSF、TLCK和PMSF, 均属于丝氨酸蛋白酶类抑制剂, TPCK、PeptatinA、E-64和碘乙酸对粗酶酶活几乎没有抑制效果。由上述试验结果可推测, 在三疣梭子蟹肝胰腺的粗酶中, 主要蛋白酶为丝氨酸蛋白酶, 有可能是胰蛋白酶, 为糜蛋白酶、天冬氨酸蛋白酶和半胱氨酸蛋白酶的可能性较小。低浓度SBTI(0.005 g/L)对粗酶酶活几乎没有抑制效果, 可能是由于抑制剂浓度太低, 对酶活的抑制效果非常微弱, 以至用此方法不能检测出。
3.5 硫酸铵浓度对三疣梭子蟹肝胰腺粗酶酶活的影响
由试验结果可看出, 随着硫酸铵浓度的增加, 盐析出的蛋白质含量、粗酶酶活呈现出中间高、两端低的趋势, 这与南美白对虾()虾头自溶酶在盐析过程中, 蛋白含量一直上升的趋势[25]有所不同, 与草鱼、鲫鱼、青鱼酶比活先上升后下降[26]的趋势类似。从蛋白质含量的趋势可以看出, 当硫酸铵浓度高于60%后, 盐析出的蛋白质含量就大幅度减少, 这说明大部分蛋白质在低盐浓度下就被盐析出。但是, 从粗酶酶比活的趋势又可看出, 在硫酸铵浓度达到70%前, 粗酶比活都保持在较高水平。该结果表明, 如果以酪蛋白作为粗酶分解底物, 对粗酶进行后续研究, 则可选择盐析浓度0~70%。
通过不同抑制剂对粗酶酶活抑制效果的数据, 可大致推测出, 粗酶中丝氨酸蛋白酶占主导地位, 所以, 本试验对不同盐析浓度下的粗酶也进行了丝氨酸蛋白酶活性的测定。结果显示, 丝氨酸蛋白酶活和酶比活均呈现出中间高、两端低的趋势, 其酶比活在硫酸铵浓度为0~30%和70%~100%间较低。所以, 如果以粗酶中丝氨酸蛋白酶为主要研究对象, 则可选择盐析浓度在30%~70%之间。
4 总结
本试验中, 搅拌浸提时间对三疣梭子蟹肝胰腺粗酶性质有显著影响, 其最佳浸提时间段为4~12h; 通过对粗酶最适反应温度和最适pH的测定, 大致推测粗酶主要成分为类胰蛋白酶, 抑制剂对内源酶酶活的特异性抑制试验进一步验证了此推测; 粗酶在各盐析浓度下蛋白质含量、粗酶总酶活、丝氨酸蛋白酶活、粗酶比活和丝氨酸蛋白酶比活均呈现先上升后下降的趋势; 如果以不同底物为蛋白酶水解对象, 可选择不同的盐析浓度来沉降蛋白。
[1] 董志国. 中国沿海三疣梭子蟹群体形态、生化与分子遗传多样性研究[D]. 上海: 上海海洋大学, 2012. Dong Zhiguo. The study on morphology, biochemistry, molecular phylogeography and genetic dibersity of the swimming crabalong China coast[D]. Shanghai: Shanghai Ocean University, 2012.
[2] Dionysius D A, Hoek K S, Milne J M, et al. Trypsin-like enzyme from sand crab (): purification and characterization[J]. Journal of Food Science, 1993, 58(4): 780-784.
[3] Chodsana S, Soottawat B, Wonnop V, et al. Collagenolytic serine protease in fresh water prawn (): Characteristics and its impact on muscle during ice storage[J]. Food Chemistry, 2011, 124(2011): 29-35.
[4] 蔡秋凤, 林敏, 钟婵, 等. 口虾蛄肌肉中丝氨酸蛋白酶的纯化及性质分析[J]. 中国食品学报, 2013, 13(11): 185-190. Cai Qiufeng, Lin Min, Zhong Chan, et al. Purification and characterization of serine proteinase from mantis shrimp ()[J]. Journal of Chinese Institute of Food Science and Technology, 2013, 13(11): 185-190.
[5] Yan L J, Zhan CH L, Cai Q F, et al. Purification, characterization, cDNA cloning andexpression of a serine proteinase from the intestinal tract of sea cucumber () with collagen degradation activity[J]. Journal of Agricultural and Food Chemistry, 2011, 62(20): 4769-4777.
[6] Klomklao S, Kishimura H, Benjakul S, et al. Cationic trypsin: A predominant proteinase in pacific saury () pyloric ceca[J]. Journal of Food Biochemistry, 2010, 34(5): 1105-1123.
[7] Klomklao S, Benjakul S, Visessanguan W, et al. Purification and characterisation of trypsins from the spleen of skipjack tuna ()[J]. Journal of Food Chemistry, 2007, 100(4): 1580-1589.
[8] 陈毓荃. 生物化学实验方法和技术[M]. 北京: 科学出版社, 2002: 95-97. Chen Yuquan. Biochemical experimental methods and techniques[M]. Beijing: The Science Publishing Company, 2002: 95-97.
[9] Jensen S E, Philipe L, Stemke G W, et al. Purification and characterization of exocellular proteases produced by a clinical isolate and a laboratory strain of[J]. Canadian Journal of Microbiology, 1980, 26: 77-86.
[10] Yoshida A, Bae I, Sonoda H, et al. Characterization of gelatinolytic enzymes in the skeletal muscle of red sea bream[J]. Fisheries Science, 2009, 75(5): 1317-1322.
[11] Chodsana S, Soottawat B, Wonnop V, et al. Low molecular weight trypsin from hepatopancreas of freshwater prawn (). Characteristics and biochemical properties[J]. Food Chemistry, 2012, 134(2012): 351-358.
[12] Misook K, Yoonhwa J. Purification and characterization of a trypsin-like protease from flatfish () intestine[J]. Journal of Food Biochemistry, 2013, 37(2013): 732-741.
[13] Walsh K A. Trypsinogen and trypsins of various species[J]. Methods Enzymology, 1970, 19: 41-63.
[14] 吴志强. 太平洋磷虾(Euphausiapacifica Hansen)胰蛋白酶样酶酶学性质及基因片段研究[D]. 青岛: 中国海洋大学, 2007. Wu Zhiqiang. Enzymatic characteristics and partial gene of trypsin-like enzymes from EuphausiapacificaHansen[D]. Qingdao: Ocean University of China, 2007.
[15] 杭虞杰, 李学英, 杨宪时, 等. 南极磷虾自溶酶性质的初步研究[J]. 食品科学, 2011, 32(13): 198-200. Hang Yujie, Li Xueying, Yang Xianshi, et al. Properties of autolysis enzymes from antarctilkill[J]. Food Science, 2011, 32(13): 198-200.
[16] Jiang S T, Moody M W, Chen H C. Purification and characterization of protease from digestive tract of grass shrimp ()[J]. Journal of Food Science, 1991, 56: 322-326.
[17] 启航, 董秀萍, 高杨, 等. 海参体壁粗蛋白酶的提取及酶学性质研究[J]. 食品研究与开发, 2007, 28(3): 4-8. Qi Hang, Dong Xiuping, Gao Yang, et al.Studies on the extraction and enzymology character of the crude protease from the body wall of holothurians[J]. Food Research and Development, 2007, 28(3): 4-8.
[18] 庄志凯, 吉宏武. 南美白对虾虾头内源酸性蛋白酶的分离纯化及酶学特性研究[J]. 食品工业科技, 2012, 33(18): 116-120. Zhuang Zhikai, Ji Hongwu. Purification and characteristics of endogenous acid protease from shrimp head of[J]. Science and Techonlogy of Food Industry, 2012, 33(18): 116-120.
[19] 杜翠红, 曹敏杰. 鱼类肌原纤维结合型丝氨酸蛋白酶研究进展[J]. 食品科学, 2013, 34(9): 336-339. Du Cuihong, Cao Minjie. Progress in research on myofibril-bound serine proteinase from fish[J]. Food Science, 2013, 34(9): 336-339.
[20] Pornpimol S, Chodsana S. A trypsin from royal red prawn () and its possible application for collagen hydrolysis[J]. Separation Science and Technology, 2015, 50: 1073-1082.
[21] Benjakul S, Visessanguan W, Leelapongwattana K. Purification and characterization of heat-stable alkaline proteinase from bigeyesnapper () muscle[J]. Comparative Biochemistry and Physiology, B: Comparative Biochemistry, 2003, 124: 107-127.
[22] Eggerer J. Hysteretic behaviour of citrate synthase: site-directed limited proteolysis[J]. European Journal of Biochemistry, 1984, 143: 205-212.
[23] Benjakul S, Leelapongwattana K, Visessanguan W. Comparative study on proteolysis of two species of bigeye snapper,and[J]. Journal of the Science of Food and Agriculture, 2003, 83(9): 871-879.
[24] Klomklao S, Benjakul S, Visessanguan W. Comparative studies on proteolytic activity of splenic extract from three tuna species commonly used in Thailand[J]. Journal of Food Biochemistry, 2004, 28(5): 355-372.
[25] 银凤, 周爱梅, 张祥刚, 等. 南美白对虾虾头主要自溶酶的分离纯化及鉴定[J]. 食品工业与发酵, 2011, 37(3): 23-26. Yin Feng, Zhou Aimei, Zhang Xianggang, et al. Purification and identification of major autoenzyme from the head of white shrimp ()[J]. Food and fermentation Industries, 2011, 37(3): 23-26.
[26] 王秋岑. 不同食性鱼类胰蛋白酶的提纯、性质及消化力的比较研究[D]. 南昌: 南昌大学, 2013.Wang Qiucen. Comparative study on proteolytic digestion, purification and characterization of trypins from different feeding fish[D]. Nanchang: Nanchang University, 2013.
Characteristics of endogenous protease from hepatopancreas of swimming crab ()
YANG Li-zhu, ZHANG Li, HUANG Lin, MENG Xiang-hong
(College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China)
Endogenous autolytic enzyme is an important enzyme in. Normally, after the death of swimming crabs, deterioration is very rapid in the muscle, which produces a severe effect on the storage quality of crabs. To investigate few basic properties of this autolytic enzyme, crude samples were extracted from the hepatopancreas ofand the parameters are optimized. Then, a preliminary study on the enzymatic properties of the endogenous enzyme was conducted. The results showed that the optimum extraction time range of endogenous protease was 4–12 h, and the specific activity was significantly higher than that at other time points,, 0–4 h and 12–14 h. The optimal temperature and pH for hydrolysis of casein were 65℃ and 7.0–8.0, respectively. Compared with other protease inhibitors, endogenous protease activity was significantly inhibited by serine protease inhibitors, including soybean trypsin inhibitor (SBTI) and phenylmethylsulfonyl fluoride (PMSF), suggesting that serine protease was the dominant content of this endogenous enzyme. Ammonium sulfate grading precipitation showed that fractions of 0%–70% and 30%–70% could be used to collect the targeted proteases for casein and Boc-Phe-Ser-Arg-MCA hydrolysis, respectively. Their specific activities were significantly higher than those of the samples precipitated by other ammonium sulfate fractions. Moreover, samples collected by ammonium sulfate fractions of 40%–60% had a higher protein content and total activity of crude and serine proteinase than those of the samples precipitated by other ammonium sulfate fractions.
Swimming crab (); Hepatopancreas; Endogenous protease; Characteristic
(本文编辑: 康亦兼)
Dec. 24, 2015
[Province Natural Science Foundation of Shandong, No.ZR2015CM010]
TS254.1
A
1000-3096(2016)10-0097-08
10.11759/hykx20151224003
2015-12-24;
2016-03-29
山东省自然科学基金项目(ZR2015CM010)
杨利珠(1990-), 女, 彝族, 四川攀枝花人, 硕士研究生, 主要从事水产食品化学研究, E-mail: ylz901209@163.com; 张莉, 通信作者, E-mail: qdzhangli@ouc.edu.cn
