水温和盐度对皱纹盘鲍“97”选群第6代变态及变态幼体生长存活的影响
2017-01-18连建武薛艳洁钟兆山
孔 宁, 连建武, 薛艳洁, 钟兆山, 李 鹏, 刘 晓
水温和盐度对皱纹盘鲍“97”选群第6代变态及变态幼体生长存活的影响
孔 宁1, 3, 连建武2, 薛艳洁2, 钟兆山1, 3, 李 鹏2, 刘 晓1
(1. 中国科学院海洋研究所, 山东青岛 266071; 2. 宁波大学, 浙江宁波315211; 3. 中国科学院大学, 北京100049)
采用室内受控方法研究了水温(14、16、18、20、22、24、26和28℃)和盐度(22、24、26、28、30、32、34、36、38和40)对皱纹盘鲍变态及变态幼体生长存活的影响。结果表明, 水温对变态率、变态幼体存活率和生长率的影响极显著(< 0.01)。14~28℃条件下, 随着水温的升高, 幼体变态率、变态幼体存活率和生长率均呈现先升高后降低的趋势。24℃时变态率最高, 为86.05%; 18℃时, 变态幼体存活率最高, 为96.00%; 26℃时, 投苗6 d内的壳长、壳宽生长率最大, 分别为48.49 μm/d和43.81 μm/d; 投苗15 d内的壳长、壳宽生长率最大, 分别为68.06 μm/d和59.69 μm/d。盐度对皱纹盘鲍变态率及变态幼体生长率的影响极显著(< 0.01), 对幼体存活率却无显著影响(> 0.05)。22~40盐度条件下, 幼体变态率先升高后降低, 于32达最大值, 为79.23%; 变态的盐度下限为22, 该盐度下仅有2.21%的个体能够完成变态。26~40条件下, 变态幼体存活率均高达85%以上; 随着盐度的升高, 变态幼体生长率先升高后降低。投苗6 d内壳长、壳宽生长率均于34达最大值, 分别为32.03 μm/d和25.20 μm/d; 投苗15 d内壳长、壳宽生长率分别于34和32达最大值, 为43.03 μm/d和39.00 μm/d。
皱纹盘鲍(Ino); 水温; 盐度; 变态率; 生长存活
皱纹盘鲍(Ino), 隶属于软体动物门, 腹足纲, 前鳃亚纲, 原始腹足目, 鲍科, 鲍属, 为海产八珍之首, 素有海洋“软黄金”之称[1]。皱纹盘鲍自然分布于我国辽东及山东半岛, 是北方重要的传统养殖贝类之一。由于野生资源的日益衰退, 我国于20世纪70年代初开始鲍的人工育苗研究, 经过近40年的发展, 我国成为世界鲍养殖第一大国, 皱纹盘鲍养殖产量得到大幅提升, 养殖区域已由自然分布区南扩至福建沿海、广东东部沿海等地[2]。
随着养殖范围的扩大及“南北调养”模式的发展, 皱纹盘鲍面临环境变化的几率急剧增加。水温和盐度是影响海洋无脊椎动物的重要环境因子[3-4], 它们不仅限制皱纹盘鲍的地理分布及养殖区域, 还影响其孵化率、变态率、存活率、生长率, 甚至导致病害的发生[5]。附着变态是皱纹盘鲍由浮游生活转为底栖生活的关键阶段, 该过程涉及形态变化、器官发生及营养转换等多个生理过程[6], 变态及变态后期更是皱纹盘鲍生产育苗中的死亡高发期, 该时期幼体对水温和盐度变化尤为敏感, 因此合理调控温盐范围对于提高养殖产量具有重要意义。
水温和盐度对腹足类变态及变态幼体的影响已有相关报道。柯才焕等[7]研究表明, 波部东风螺幼体在25~30℃范围内变态率较高, 并且高温可加快幼虫的变态进程。林伟等[8]研究了盐度对九孔鲍附着变态的影响。结果表明, 盐度24时幼体无法完成变态, 在26~34范围内, 随着盐度的升高, 变态率逐渐增大。在皱纹盘鲍方面, 聂宗庆等[9]对匍匐幼体(壳长513~1215 μm)的盐度耐受性进行了评估, 而有关变态期的温盐效应及变态后期的水温效应, 国内仍未见报道。水温和盐度既影响贝类幼体的变态进程, 也影响其变态率和变态幼体的活力, 因此, 确定该阶段幼体的适宜温盐条件对于提高幼体变态率、增加出苗量具有重要意义。本实验系统研究了水温和盐度对皱纹盘鲍变态及变态幼体生长存活的影响, 旨在确定最佳培育条件, 以期为提高生产效益及生态研究提供理论依据。
1 材料与方法
1.1 材料来源
本研究所用亲鲍是由中国科学院海洋研究所培育的皱纹盘鲍第5代“97”快速生长选育群体, 壳长7.5~8.5 cm。鲍的繁育于2014年4月在山东荣成海珍品有限公司进行。亲鲍经阴干刺激后放入催产槽中, 用升温至23℃的紫外线照射海水刺激精卵排放, 受精后按常规工艺孵化, 孵化密度10个/mL。12 h后担轮幼体上浮, 选取上层幼体转移至4 m3水泥池中培育, 幼体密度5个/mL。选取发育至42 h的后期面盘幼体(壳长: 289.55 μm ± 3.05 μm, 壳宽: 213.18 μm ± 4.86 μm)用作本研究的实验材料。
1.2 实验方法
实验分水温和盐度两部分。水温实验设置8个梯度, 分别为14、16、18、20、22、24、26和28℃, 盐度为32。实验采用水浴控温, 每个梯度设3个平行。
盐度实验设置10个梯度, 分别为22、24、26、28、30、32、34、36、38和40, 水温为20℃。实验采用水浴控温, 盐度用砂滤海水、海水素和曝气自来水调配, 并用光学盐度计标定, 每个梯度设3个平行。
实验在1L烧杯中进行, 每个烧杯放入9.0 cm × 7.5 cm的硅藻板供幼体附着变态。为避免因蒸发改变盐度, 烧杯用保鲜膜封口。幼体培育密度为0.2个/mL。温盐实验同步进行, 均持续15 d。实验前6 d不换水不充气, 以免干扰幼体变态。第6天所有烧杯中已无浮游幼体, 此时统计变态率, 并从每个烧杯中随机选取50个变态幼体于相同温盐条件下继续培育, 期间微量充气, 每天换水一次, 并统计死亡个体数。实验期间, 分别于第6天和第15天从每个烧杯中随机选取20个变态幼体, 于显微镜下测量其壳长和壳宽, 并按照下列公式计算生长率: 壳长或壳宽生长率=(结束时壳长或壳宽–初始壳长或壳宽)/实验天数。
1.3 统计分析
用SPSS v 16.0软件对数据进行单因素方差分析(ANOVA), 并进行Student-Newman-Keuls多重比较, 差异显著性水平设为< 0.05。
2 结果
2.1 水温对皱纹盘鲍变态率的影响
14~28℃条件下, 水温对皱纹盘鲍变态率的影响极显著(< 0.01)。由图1可知, 14~24℃条件下, 变态率随水温升高而增加; 24℃时, 变态率最高, 为86.05%; 水温高于24℃时, 变态率开始下降。水温18~26℃条件下, 幼体变态率均高于70%, 且无显著性差异, 故该范围为皱纹盘鲍变态的适温范围。
字母不同表示组间差异显著(下同)
Different letters indicate significant differences (the same below)
2.2 水温对皱纹盘鲍变态幼体存活率的影响
14~28℃内, 水温对变态幼体存活率的影响极显著(< 0.01)。图2显示, 14~28℃内变态幼体存活率均大于70%。14℃时, 存活率最低, 为72.84%; 18℃时, 存活率最高, 为96.00%。方差分析表明, 16~28℃内, 变态幼体存活率无显著性差异, 为81.63%~ 96.00%。
2.3 水温对皱纹盘鲍变态幼体生长率的影响
14~28℃内, 变态幼体于投苗6 d和15 d内呈现相同的生长趋势。14~26℃内, 变态幼体生长率随水温升高而增加; 26℃时, 6 d内的壳长、壳宽生长率最大, 分别为48.49 μm/d和43.81 μm/d; 15 d内的壳长、壳宽生长率最大, 分别为68.06 μm/d和59.69 μm/d; 水温28℃时, 幼体生长率开始下降(表1)。方差分析表明, 水温对皱纹盘鲍变态幼体的生长率具有极显著影响(< 0.01)。

表1 不同水温下皱纹盘鲍变态幼体的生长情况
注: 各水温梯度实验组幼体的初始壳长×壳宽均为289.55 µm×213.18 µm
2.4 盐度对变态率的影响
22~40内, 盐度对皱纹盘鲍变态率的影响极显著(< 0.01)。随着盐度的升高, 幼体变态率先升高后降低, 于盐度为32时达最大值, 为79.23%。盐度为22时, 仅有2.21%的幼体能够完成变态, 故22为幼体变态的盐度下限; 盐度24时, 变态率仍较低, 为10.44%(图3)。盐度26~40内, 幼体变态率较高, 为62.00%~79.23%。
2.5 盐度对变态幼体存活率的影响
盐度22和24处理组因变态幼体数量过少, 于后续实验中剔除。图4显示, 变态幼体在26~40范围内存活率较高, 为87.70%~95.33%。方差分析表明, 26~ 40内, 盐度对变态幼体存活率无显著影响(> 0.05)。
2.6 盐度对变态幼体生长率的影响
表2显示了盐度对变态幼体生长状况的影响。盐度26~40内, 变态幼体于投苗6 d和15 d内呈现相同的生长趋势, 即随盐度的升高, 生长率先升高后降低。6 d内壳长、壳宽生长率均于盐度为34时达到最大值, 分别为32.03 μm/d和25.20 μm/d; 1 5d内壳长、壳宽生长率分别于盐度为34和32时达到最大值, 为43.03 μm/d和39.00 μm/d。方差分析表明, 盐度对皱纹盘鲍变态幼体的生长率具有极显著影响(< 0.01)。
3 讨论
3.1 皱纹盘鲍变态的特点
皱纹盘鲍除短时间营浮游生活外, 均营底栖生活, 变态是其生活方式转变的重要阶段[6]。Pechenik[10]把腹足类幼体的变态定义为游泳器官—面盘的丧失。变态前, 幼体下沉至基质表面, 经过探索、选择和定位后, 用足吸附在基质上, 开始变态。变态期间, 皱纹盘鲍幼体在形态特征和行为习性上均有显著性变化: 形态上表现为面盘的脱落、足的伸出及围口壳的形成[11], 行为上表现为由快速游泳状态转变为缓慢的底栖爬行状态。变态期是鲍生活史中最为薄弱的环节, 不适宜的环境因素(如水温、盐度和附着基质等)会延长幼体浮游期, 推迟变态的发生, 最终影响变态率和变态幼体活力, 因此, 生产操作中应注重理化因子的调控和附着基质的选择。变态完成后, 皱纹盘鲍吻部逐渐发达, 摄食量相应增大, 此时应保证充足的饵料供应, 从而获得高的存活率和生长率。
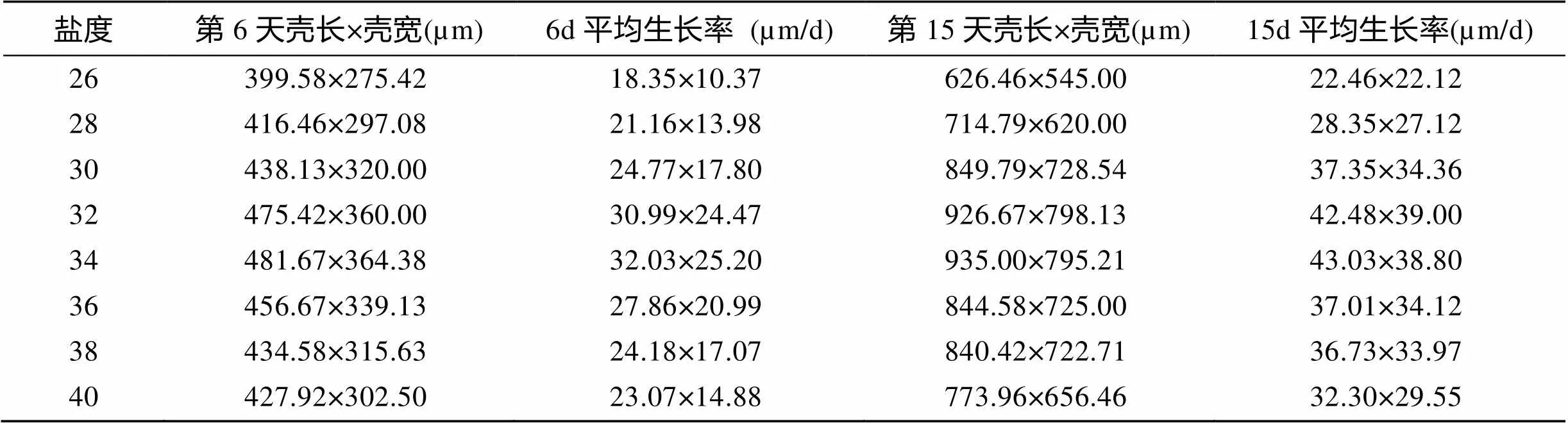
表2 不同盐度下皱纹盘鲍变态幼体的生长情况
注: 各盐度梯度实验组幼体的初始壳长×壳宽均为289.55 µm×213.18 µm
3.2 水温对皱纹盘鲍变态及变态幼体的影响
水温是影响皱纹盘鲍附着变态的重要因素, 它不仅影响幼体变态率, 还与变态进程明显相关。观测表明, 幼体变态时间随水温的升高而缩短, 高温组(26、28℃)和低温组(14℃)的变态进程可相差3~4 d之久。低温降低了皱纹盘鲍幼体的代谢速率, 延缓了变态进程, 最终使得体内卵黄过度消耗而影响变态率。14~28℃内, 随着水温的升高, 变态幼体的生长率先升高后降低。聂宗庆等[12]的研究同样表明, 水温显著影响皱纹盘鲍稚贝的生长, 15~25℃范围内, 水温越高生长越快。低温下, 变态幼体摄食能力弱且不能有效地消化饵料, 导致生长率较低; 随着水温的升高, 代谢水平提高, 生长速率加快; 当水温高于适温范围时, 幼体营养积累不足以维持高的代谢率, 能量收支不平衡, 导致生长率降低[13]。张明等[14]的研究表明, 中国的皱纹盘鲍适温范围为4~26℃, 超过26℃则活力下降、生长停滞, 28℃时大量死亡。然而, 本研究中的皱纹盘鲍变态幼体则表现出较强的高温耐受性, 26℃下生长最快, 28℃下存活率可高达80%以上。不同的水温耐受性可能与发育阶段、种群来源、遗传背景等因素有关。本实验所用亲鲍经历了多代人工选育, 选育引起的遗传结构的变化[15-16]会影响群体的水温耐受性[17]。
参考本研究结果, 在鲍苗生产过程中为缩短浮游期, 进而降低变态风险, 可在适宜范围内适当升温, 以加速变态进程; 然而长时间的海水升温会加大育苗成本, 同时影响硅藻的质量和附板效果, 不利于幼体摄食, 因此变态结束后可适当降低水温, 以期达到较好的育苗效果。
3.3 盐度对皱纹盘鲍变态及变态幼体的影响
盐度是皱纹盘鲍生存环境中的另一个重要影响因子。研究表明, 皱纹盘鲍幼体在盐度22时变态率仅为2.21%, 盐度40时却高达68.09%。可见, 皱纹盘鲍幼体对高盐的适应能力远强于低盐, 这与皱纹盘鲍自然分布仅限于高盐度海区的生态习性有关[2]。聂宗庆和陈文华[9]报道皱纹盘鲍匍匐幼体的适宜盐度在27以上, 且对高盐的适应能力较强, 即使在盐度39.4下仍能正常摄食, 这与本研究的结果基本一致。盐度对变态幼体生长率的影响极显著, 32~34范围内生长率最高, 随着盐度向低盐和高盐的延伸, 生长率逐步降低。这是由于盐度过低或过高会破坏机体渗透压的平衡[18], 为了维持渗透压的稳定, 鲍将消耗大量能量, 导致可用于生长的能量减少, 最终影响生长速率。盐度效应对皱纹盘鲍的人工育苗具有重要的指导意义。育苗季节, 海水盐度常受台风、暴雨、潮汐等影响而处于大幅变化之中, 加之大规模生产中的盐度调控很难实现, 因此在育苗过程中应实时监测海水盐度, 防止盐度骤降, 从而达到提高苗种产量和生产效益的目的。
[1] 于连洋, 刘光谋, 王振华, 等.皱纹盘鲍的遗传育种研究进展[J]. 水产养殖, 2012, 33(1): 48-53. Yu Lianyang, Liu Guangmou, Wang Zhenhua, et al. Advances in genetics and breeding in: a review[J]. Journal of Aquaculture, 2012, 33(1): 48-53.
[2] 聂宗庆, 王素平, 燕敬平, 等. 鲍科学养殖百问百答[M].北京: 中国农业出版社, 2011. Nie Zongqing, Wang Suping, Yan Jingping, et al.The scientific breeding of abalone[M]. Beijing: China Agriculture Press, 2011.
[3] 黄洋, 黄海立, 吕广煊, 等. 温度和盐度分别对尖紫蛤胚胎发育的影响[J]. 海洋科学, 2011, 35(10): 117- 122. Huang Yang, Huang Haili, LU Guangxuan, et al. Respective effects of temperature and salinity on embryonic development ofCai et Zhuang[J]. Marine Sciences, 2011, 35(10): 117-122.
[4] 刘志刚, 刘建勇, 杨博. 温度与盐度对华贵栉孔扇贝幼贝存活与生长的互作效应研究[J]. 海洋科学, 2011, 35(10): 75-80. Liu Zhigang, Liu Jianyong, Yang Bo. Interactions of temperature and salinity to the survival and growth of(Reeve)[J]. Marine Sciences, 2011, 35(10): 75-80.
[5] 房沙沙. 中国南海养殖区分离的两株弧菌对皱纹盘鲍致病性的研究[D].青岛: 中国科学院海洋研究所, 2013. Fang Shasha. Pathogenicity of two vibrio strains in South China Sea toIno[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2013.
[6] 陈木, 卢豪魁, 陈世杰, 等. 皱纹盘鲍人工育苗的初步研究[J]. 动物学报, 1977, 23(1): 35-46. Chen Mu, Lu Haokui, Chen Shijie, et al. A preliminary study on the artificial rearing of the larvae and juveniles ofIno[J]. Acta Zoologica Sinica, 1977, 23(1): 35-46.
[7] 柯才焕, 郑怀平, 周时强, 等. 温度对波部东风螺幼虫存活、生长及变态的影响[C]//中国贝类学会. 贝类学论文集(第Ⅸ辑), 北京: 海洋出版社, 1999: 80-86. Ke Caihuan, Zheng Huaiping, Zhou Shiqiang, et al. Effects of temperature on larval survival, growth and metamorphosis of(Gastropoda: Buccinidae)[C]//Chinese Society of Malacology. Transactions of the Chinese Society of Malacology (Ⅸ), Beijing: China Ocean Press, 1999: 80-86.
[8] 林伟, 杨治国. 盐度对九孔鲍胚胎发育及幼体附着率的影响[J]. 现代渔业信息, 2009, 24 (11): 21-22+27.Lin Wei, Yang Zhiguo. Effects of salinity on embryonic development and larva settlement of[J]. Modern Fisheries Information, 2009, 24(11): 21-22+27.
[9] 聂宗庆, 陈文华. 皱纹盘鲍育苗条件的研究. Ⅱ. 盐度、营养盐类等对胚胎发生与幼体、稚鲍生活的影响[J]. 海洋水产研究, 1984, (6): 41-48. Nie Zongqing, Chen Wenhua. Studies on rearing conditions of abalone,Ino. Ⅱ. the efects of salinity and inorganic nutrients on the development of fertilized eggs and living of larvae[J]. Marine Fisheries Research, 1984, (6): 41-48.
[10] Pechenik J A. Growth and energy balance during the larval lives of three prosobranch gastropods[J]. Journal of Experimental Marine Biology and Ecology, 1980, 44(1): 1-28.
[11] Sawatpeera S, Upatham E S, Kruatrachue M, et al. Larval development inLinnaeus[J]. Journal of Shellfish Research, 2001, 20 (2): 593-601.
[12] 聂宗庆, 陈文华, 季梅芳. 皱纹盘鲍育苗条件的研究. Ⅰ. 不同饵料与温度对幼体、稚鲍的生长影响[J]. 海洋水产研究, 1984, (6): 35-40. Nie Zongqing, Chen Wenhua, Ji Meifang. Studies on rearing conditions of abalone,Ino. Ⅰ. the efects of temperature and food on the growth of larvae and youngs[J]. Marine Fisheries Research, 1984, (6): 35-40.
[13] 林君卓, 许振祖. 温度和盐度对文蛤幼体生长发育的影响[J]. 福建水产, 1997, (1): 27-33. Lin Junzhuo, Xu Zhenzu. The effects of temperature and salinity on the development oflarvae[J]. Journal of Fujian Fisheries, 1997, (1): 27-33.
[14] 张明, 王志松, 高绪生. 不同生长期皱纹盘鲍对水温适应能力的比较[J]. 中国水产科学, 2005, 12(6): 720- 725.Zhang Ming, Wang Zhisong, Gao Xusheng. Comparison on adaptability of abaloneIno to temperatures at different growing stages[J]. Journal of Fishery Sciences of China, 2005, 12(6): 720-725.
[15] Jiang Q, Li Q, Yu H, et al. Genetic and epigenetic variation in mass selection populations of Pacific oyster[J]. Genes & Genomics, 2013, 35: 641-647.
[16] Li Z, Li J, Wang Q, et al. The effects of selective breeding on the genetic structure of shrimppopulations[J]. Aquaculture, 2006, 258: 278- 282.
[17] Liu X, Deng Y W, Zhang G F. Growth of eight Pacific abalone families at three temperatures[J]. Acta Oceanologica Sinica, 2005, 24(3): 148-153.
[18] Cheng W, Yeh S P, Wang C S, et al. Osmotic and ionic changes in Taiwan abaloneat different salinity levels[J]. Aquaculture, 2002, 203(3): 349-357.
Effects of water temperature and salinity on metamorphosis, post-larval survival, and growth of the sixth generation of “97” selective breeding population ofIno
KONG Ning1, 3, LIAN Jian-wu2, XUE Yan-jie2, ZHONG Zhao-shan1, 3, LI Peng2, LIU Xiao1
(1.Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Ningbo University, Ningbo 315211, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China)
The effects of water temperature and salinity on metamorphosis, post-larval survival, and growth ofIno were explored in this study. In the temperature experiment, the animals were reared at eight water temperatures of 14 , 16, 18, 20, 22, 24 , 26, and 28℃. The results illustrated that the water temperature considerably influenced the metamorphosis rate, post-larval survival, and growth ofIno (< 0.01). At 14~28℃, the metamorphosis, post-larval survival, and growth rates were first increased and subsequently decreased. The metamorphosis rate reached its peak at 24℃ with a value of 86.05%. The best post-larval survival was obtained at 18℃ with a value of 96.00%. The optimal water temperature for post-larval growth was 26℃, at which the growth rates of shell length and shell width within 6 days after casting were 48.49 and 43.81 μm/d, respectively, and the two growth rates within 15 days after casting were 68.06 and 59.69 μm/d, respectively. In the salinity experiment, animals were reared at10 salinities of 22, 24, 26, 28, 30, 32, 34, 36, 38, and 40. The salinity considerably affected the metamorphosis rate and post-larval growth (< 0.01); however, it had no impact on post-larval survival (> 0.05). At 22~40, the metamorphosis rate first increased and subsequently decreased, reaching its peak at 32 with a value of 79.23%. The lower salinity limit of metamorphosis was 22, at which only 2.21% of individuals could complete metamorphosis. At 26~40, the post-larval survival rate was above 85%. Within this range, the growth rate first increased and subsequently decreased. Maximum growth rates of shell length and shell width within 6 days after casting were obtained at 34, with values of 32.03 and 25.20 μm/d, respectively. The growth rates of shell length and shell width within 15 days after casting reached their peak at 34 and 32, respectively, with values of 43.03 and 39.00 μm/d.
Ino; water temperature; salinity; metamorphosis rate; survival and growth
(本文编辑: 梁德海)
Jan. 22, 2016
[The National High Technology Research and Development Program, No.2012AA10A412]
S968.3
A
1000-3096(2016)10-0049-06
10.11759/hykx20150107003
2016-01-22;
2016-05-18
国家高技术研究发展计划资助项目(2012AA10A412)
孔宁(1987-), 男, 河北南宫人, 博士研究生, 主要从事贝类遗传育种研究, 电话: 0532-82898721, E-mail: kongkong0223@163.com
