内质网途径在硫酸黏菌素致PC12细胞凋亡中的作用
2017-01-18王宏军李继昌马加峰
黄 鑫,蒋 红⋆,王宏军,李继昌,陈 磊,马加峰
(1.锦州医科大学,辽宁 锦州 121001;2.东北农业大学,黑龙江 哈尔滨 150030;3.辽宁省兴城市药王动物卫生监督所,辽宁 兴城 125100;4.辽宁省锦州市义县留龙沟动物卫生监督所,辽宁 义县 121100)
内质网途径在硫酸黏菌素致PC12细胞凋亡中的作用
黄 鑫1,蒋 红1⋆,王宏军1,李继昌2,陈 磊3,马加峰4
(1.锦州医科大学,辽宁 锦州 121001;2.东北农业大学,黑龙江 哈尔滨 150030;3.辽宁省兴城市药王动物卫生监督所,辽宁 兴城 125100;4.辽宁省锦州市义县留龙沟动物卫生监督所,辽宁 义县 121100)
为了探究内质网途径在硫酸黏菌素诱导PC12细胞凋亡中的作用。取对数生长期PC12细胞,用含0、62.5、125、250 μg/mL硫酸黏菌素的DMEM培养液作用24 h,透射电镜观察PC12细胞凋亡,Western blot法检测GnRP78、caspase-12、Caspase-3蛋白表达量,Fluo-3/AM检测细胞内[Ca2+]i浓度变化,钙测定试剂盒检测细胞外[Ca2+]i浓度变化。与对照组相比,125、250 μg/mL硫酸黏菌素剂量组PC12细胞出现典型凋亡现象,使PC12细胞内[Ca2+]i浓度,GnRP78、caspase-12、Caspase-3蛋白表达量显著升高(P<0.01);细胞外[Ca2+]i浓度显著降低(P<0.01),具有剂量-效应关系。说明通过内质网途径介导的PC12细胞凋亡可引发硫酸黏菌素的神经毒性。
硫酸黏菌素;PC12细胞;细胞凋亡;内质网途径
“超级细菌”是对所有抗生素有抗药性的细菌的统称,包括多重耐药性(MDR)的细菌和“泛耐药性”(pan-drug resistance,PDR)细菌。这些细菌的耐药质粒能轻易地从一种细菌跳到另一种上面,对抗几乎所有的抗生素,一旦“超级细菌”在全球散播,将面临抗生素作废的时代,危害巨大。目前如美国等欧美国家用于治疗多重耐药革兰氏阴性细菌黏菌素感染的有效的抗微生物药物中就有黏菌素[1-3]。硫酸黏菌素(colistin sulfate)为黏菌素的硫酸盐,在20世80年代后期,由于黏菌素对肾脏和神经有一定的毒性作用,因而限制了黏菌素的应用,被其他具有低微的肾毒性和神经毒性的抗生素所取代[4-5]。由于研发新药时间长,所以新型抗生素暂未被研发出来,而黏菌素能切实有效的杀灭多重耐药革兰氏阴性菌,迫使兽医研究人员对黏菌素的临床应用价值进行了再次的认识和重新评价[6-7]。但因神经毒性问题仍然存在,所以明确其毒性机制为寻找新的减毒措施指导临床用药具有重要意义。本文选用被广泛用于神经生物学和神经毒理学研究的体外模型大鼠肾上腺髓质嗜铬细胞(PC12细胞)[8-9]为研究对象,结合前期研究成果,从内质网途径探讨硫酸黏菌素诱导PC12细胞凋亡的神经毒性机制,为硫酸黏菌素的应用提供理论参考,以便于硫酸黏菌素在临床上更好的应用。
1 材料与方法
1.1 材料与仪器
1.1.1 材料 大鼠肾上腺嗜铬骨髓瘤细胞(PC12细胞),DMEM(Gibco),胎牛血清(四季青),蛋白抽提-RIPA裂解液、GnRP78、caspase-12、Caspase-3多抗、β-actin单抗、Fluo-3/AM、BCA试剂盒,钙离子试剂盒(凯基生物),硫酸黏菌素、N',N’-亚甲双丙烯酰胺(Sigma);丙烯酰胺、甘氨酸(Ameresco),其他试剂均为国产分析纯;上述均由博士德生物代购。
1.1.2 仪器 Nikon-1B倒置式生物显微镜(日本Nikon公司);FA2004N型电子天平(上海精密科学仪器有限公司);Bio-Rad iMarkTM型酶标检测仪、Fluoroskan Ascent荧光分光光度计和二氧化碳培养箱(上海一恒公司);Sigma低温高速离心机(美国sigma公司); GEM-1200ES型透射电子显微镜(日本电子公司);Bio-Rad电泳仪(美国BIO-RAD公司);WD-9413C凝胶成像系统(北京六一公司)。
1.2 方法
1.2.1 PC12细胞培养及处理 选择培养瓶内PC12细胞,以覆满瓶底80%~90%,处于对数生长期,细胞形态饱满,光泽好的先悬浮细胞,离心,台盼蓝染色计数,接种于6孔板,细胞密度为1×106个/mL,置于二氧化碳培养箱内培养至细胞贴壁后,分别添加硫酸黏菌素(无血清的DMEM稀释药液),使硫酸黏菌素终浓度为0、62.5、125、250 μg/mL,放入二氧化碳培养箱,继续培养24 h,备用[10]。
1.2.2 透射电镜观察 染毒与分组处理同1.2.1。收集细胞,前固定用2.5%戊二醛2 h,后固定用2%的四氧化锇1.5 h,离心,中间均用冷的PBS缓冲液(pH 7.2)冲洗。用50%、70%、90%酒精依次脱水,100%酒精脱水2次。置换时先用体积比为1∶1的无水乙醇和100%丙酮,时间10 min,再用无水丙酮,时间5 min。包埋时先以1∶1体积比的无水丙酮与环氧树脂812(Epon 812)混合渗透组织,4 000 r/min离心收集细胞。用吹风机挥发无水丙酮1 h,Epon 812包埋,经聚合、修块和超薄切片机切片,染色时,先用4%醋酸双氧铀再用柠檬酸铅,两者染色的时间均为15 min,电镜下观察超微结构。
1.2.3 Western blot法检测胞浆内GnRP78、caspase-12、Caspase-3蛋白表达 染毒与分组处理同1.2.1。处理结束后,收集细胞至离心管,冷PBS漂洗,按照博士德生物有限公司的蛋白抽提-RIPA裂解液操作说明加入裂解液,冰上裂解40 min。冷冻离心机12 000 r/min离心20 min,收集上清,分装后于-80℃保存。BCA法测定蛋白含量,调整每份样品的浓度为30µg/mL,设3个重复,加入加样缓冲液煮样后,进行SDS-PAGE蛋白电泳,100 v,90 min,用Bio-Rad电泳仪采用三明治夹心法湿转,100 v,2 h,转移结束,取硝酸纤维素膜,用TBST略洗,封闭液(5%TBST脱脂奶粉液)封闭1 h,TBST洗膜3次;再分别添加抗体,Gn-RP78、caspase-12、Caspase-3这三种为多克隆抗体,β-actin为单克隆抗体,稀释时多克隆抗体均用5%TBST脱脂奶粉液1∶200稀释,单克隆抗体按照1∶400稀释,4℃孵育过夜,TBST洗3次膜;将对应GnRP78、caspase-12、Caspase-3这三种为多克隆抗体的膜放入以封闭液1∶1 000稀释的山羊抗兔IgG中,对应β-actin抗体的膜放入1∶1 000稀释的山羊抗鼠IgG中,震荡孵育1 h,TBST洗3次膜。ECL显影,胶片曝光,定影并晾干,用WD-9413C凝胶分析仪拍照,Image J软件分析条带灰度值[7]。
1.2.4 硫酸黏菌素对PC12细胞内[Ca2+]i浓度的影响 染毒与分组处理同1.2.1。经过处理的细胞,弃去上面的培养液,加入无血清培养液,轻晃后再弃去,重复2次。在暗室中加入用无血清培养液稀释的5 μmol/L钙荧光指示剂Fluo-3/AM,锡纸包裹,放入二氧化碳培养箱,孵育50 min,使细胞负载Fluo-3。孵育结束后,在暗室中将细胞转移至荧光分光光度计专用96孔黑板,将双波长荧光分光光度计的激发波长和发射波长分别调整为488 nm和525 nm,使用机器读板,所得样品荧光值记为F,加入0.1% Triton X-100后,测得样品荧光值记为Fmax,再加入5 mmol/L EGTA,测得样品荧光值记为Fmin[7],按下面公式求出[Ca2+]i:
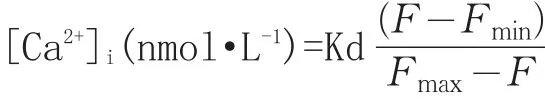
Kd值在37℃为400 nmol/L。每个样本测定后均需减去自发荧光后再进行计算。
1.2.5 硫酸黏菌素对PC12细胞培养液中[Ca2+]i浓度的影响 染毒与分组处理同1.2.1。收集不同浓度硫酸黏菌素处理后的细胞上清液,按照钙试剂盒说明操作,计算培养液中[Ca2+]i:
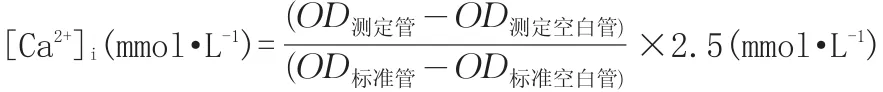
1.2.6 统计分析 统计分析所用的软件是SPSS 17.0软件,选择其中的比较均值中单因素方差分析(AVONA)对数据进行分析。各组数据以均值±标准差表示,角标*表示数据差异显著(P<0.05),角标**表示数据差异极显著(P<0.01)。

图1 电镜下PC12细胞超微结构Fig.1 Ultrastructure of PC12 cells treated with colistin sulfate in electron microscope
2 结果与分析
2.1 电镜观察结果 透射电镜下观察PC12细胞超微结构结果如图1所示。对照组PC12细胞膜及细胞核被膜清晰完整,光滑,细胞核大,细胞核里面的染色质均匀分布。随着剂量的增加,细胞核逐渐变小,并向边缘靠拢,核里面的染色质呈团块状,逐渐浓缩;基质中从62.5 μg/mL硫酸黏菌素剂量组开始出现空泡,到125 μg/mL和250 μg/mL硫酸黏菌素剂量组有片状空腔演化为空泡化;125 μg/mL和250 μg/mL硫酸黏菌素剂量组线粒体嵴逐渐断裂、肿胀、溶解、模糊甚至消失,内质网间隙变宽,大量核糖体释放,凋亡小体逐渐增多。
2.2 Western bblloott法检测胞浆内GGnnRRPP7788、ccaass--ppaassee--1122、casppaassee-- 33蛋白表达结果 由图2~5可知,经125、250 μg/mL硫酸黏菌素处理24 h后的PC12细胞,能促进内质网伴侣蛋白GnRP78、caspase-12、caspase-3表达水平极显著增高(P<0.01),且变化的趋势较为接近,并存在剂量依赖关系,由此说明硫酸黏菌素能通过内质网通路诱导PC12细胞凋亡。
2.3 硫酸黏菌素对PPCC1122细胞内[[CCaa22++]]ii浓度影响 硫酸黏菌素对PC12细胞内[Ca2+]i浓度影响如图6所示。

图2 GnRP78、caspase-12、caspase-3蛋白表达的结果Fig.2 Result of colistin sulfate on the express of GnRP78,caspase-12,caspase-3 in PC 12 cells
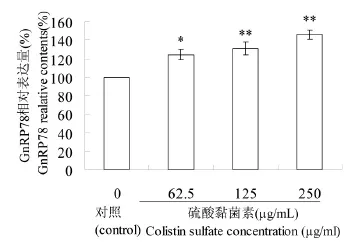
图3 GnRP蛋白表达水平Fig.3 The express level of GnRP78 in PC 12 cells

图4 caspase-12蛋白表达水平Fig.4 The express level of caspase-12 in PC 12 cells

图5 caspase-3蛋白表达水平Fig.5 The express level of caspase-3 in PC 12 cells
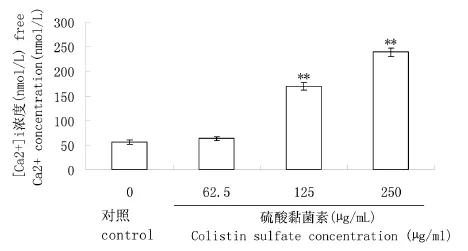
图6 硫酸黏菌素对PC12细胞内[Ca2+]i浓度的影响Fig.6 Effect of colistin on intracellular free Ca2+concentration in PC12
由图6能明确看出,以对照组为参比,随着硫酸黏菌素浓度增加,可使PC12细胞内的[Ca2+]i浓度极显著升高。
2.4 硫酸黏菌素对PPCC1122细胞外[[CCaa22++]]ii浓度影响 硫酸黏菌素对PC12细胞外[Ca2+]i浓度影响如图7所示。与对照组相比,经硫酸黏菌素处理24h后,随着硫酸黏菌素浓度增加,可使PC12细胞外的[Ca2+]i浓度极显著降低。
3 讨论
神经细胞内钙离子不仅能调节神经细胞的损伤、修复和神经元的兴奋性,还能在神经细胞凋亡中起至关重要的作用[7,11]。在静息状态下,神经细胞外钙离子浓度等同于细胞内质网和线粒体的钙离子浓度,比细胞胞浆内钙离子浓度高10 000倍;为了维持细胞内外钙离子环境的稳定状态,需要借助细胞质膜上钙的转运(包括受体门控通道和电压依赖性钙通道)及细胞内钙池的调控,这两方面的协同作用使细胞内的钙离子泵出细胞外,以保持钙稳态。当面临外来刺激或机体病态时,才会出现大量钙离子从胞外流入胞内,钙稳态被破坏,失去原有的平衡,导致钙超载,引发神经毒性。细胞内高浓度的钙离子可激活多种酶和钙依赖蛋白,这些酶和蛋白的激活,可使内质网上caspase-12被释放并激活,从而激活caspase-3,导致caspase依赖性凋亡的发生,因而细胞内Ca2+浓度升高,被认为是凋亡的始动因素[7],目前已经通过试验证实了细胞内钙离子浓度的增加是凋亡的诱发因素之一,Ca2+在神经细胞凋亡中起重要作用[12-14]。本试验可知,250 μg/mL和125 μg/mL硫酸黏菌素处理组的PC12细胞内[Ca2+]i浓度极显著增加,PC12细胞外[Ca2+]i浓度极显著降低,说明硫酸黏菌素能改变细胞内外钙离子平衡关系,使细胞钙稳态失衡。

图7 硫酸黏菌素对PC12细胞外[Ca2+]i含量影响Fig.7 Effect of colistin on extracellular free Ca2+concentration in PC12
在内质网腔中,有HSP70家族分子伴侣即内质网伴侣蛋白GnRP78(Bip),在静息状态下,GnRP78与跨膜蛋白ATF6、Irel和PERK在内质网中以结合状态存在,在电镜观察结果中可见内质网间隙变宽,说明硫酸黏菌素的刺激可以使内质网释放钙离子,导致胞浆内[Ca2+]i浓度升高,由此引发非折叠蛋白反应(UPR),导致GnRP78蛋白的含量升高,余留的GnRP78蛋白与折叠错误蛋白结合,使ATF6、Irel和PERK这三个蛋白解离。于是这三个蛋白将各自或协同启动凋亡信号途径[7,15]。硫酸黏菌素使钙稳态失衡是内质网进入非折叠蛋白反应的诱因,可导致PC12细胞内GnRP78增多。GnRP78变多,促使Bip/ GnRP78-procaspase-12-caspase-7解体,分成三个独立部分,其中caspase-7释放增加,可对caspas-12前体作用,使其促进caspas-12的活化,从而诱发下游的caspase-9活化,caspase-9又可以激活caspase-3,从而诱导细胞凋亡的发生[16-17]。本试验结果表明硫酸黏菌素可使细胞钙稳态失衡,导致GnRP78的表达极显著升高,使caspase-12蛋白表达水平增加,最终使caspase-3被激活而使细胞凋亡发生,说明硫酸黏菌素通过内质网途径诱导PC12细胞凋亡。
4 结论
硫酸黏菌素通过内质网途径诱导PC12细胞凋亡,是其神经毒性的机制之一,该研究为预防和控制硫酸黏菌素的神经毒性提供了基础资料和理论依据。
[1]EVANS M E,FEDA D J,RAPP R P.Polymyxin B sulfate and colistin∶ old antibiotics for emergingmultiresistantgram-negativebacteria[J].Annals of Pharmacotherapy,2009,33∶960-967.
[2]SOFI K K,ARGYRIS M.Combination therapy with intravenous colistin for management of infections due to multidrug-resistant gram-negative bacteria in patients without cystic fibrosis[J]. Antimicroblal Agents and Chemothrapy,2005,49∶3136-3146.
[3]韩振兴,李继昌,蒋国政,等.黏杆菌素对两种诱导多重耐药革兰氏阴性杆菌的体外抗菌活性[J].中国兽医科学,2011,41(11):1202-1205.
[4]FALAGAS ME,KASIAKOU SK.Toxicity of polymyxins∶ a systematic review of the evidence fromold and recent studies[J]. Crit Care, 2006,10∶27.
[5]林巍.硫酸黏菌素致小鼠神经毒性初探及其毒代动力学研究[D].哈尔滨:东北农业大学动物医学院,2012.
[6]SPAPEN H.,JACOBS R.,GORP V.,et al.Renal and neurological side effects of colistin in critically ill patients[J].Annals of inten-sive Care,2011,1∶14-20.
[7]蒋红.硫酸黏菌素诱导PC12细胞凋亡的机制研究[D].哈尔滨:东北农业大学动物医学院,2013.
[8]KALLEL H,BAHLOUL M,HERGAFI L,et al.Colistin as a salvage therapy for nosocomial infections caused by multidrug-resistant bacteria in the ICU[J].Int J Antimicrob Agents, 2006,28∶366-369.
[9]竺飞燕,张雄,王百辰,等.鱼藤酮诱导PC12细胞凋亡及线粒体膜电位变化[J].中国药理学通报,2014,(2):123-126.
[10]蒋红,李继昌,王宏军,等.线粒体凋亡途径在硫酸黏菌素致PC12细胞凋亡中的作用[J].东北农业大学学报,2013,44(6):75-79.
[11]POLOGRUTO T A,YASUDA R,SVOBODA K.Monitoring neural activity and[Ca2+]with genetically encoded Ca2+indicators[J]. J Neurosci, 2004,24(43)∶9572-9579.
[12]Nuttl K,Pataer A,Pahler J,et al.Bax and Bak promote apoptosis by modulating endoplasm creticular and mitochondrial Ca2+stores [J].J Biol Chem,2002,277(11)∶9219-9225.
[13]曲一泓.甲基苯丙胺对大鼠心室肌细胞凋亡及钙离子通道蛋白表达的影响[D].广州:南方医科大学,2014.
[14]侯平,杨丽,刘宁,等.麻黄碱、β-细辛醚和去甲乌药碱对大鼠心肌细胞钙离子浓度和细胞膜钙通道的影响[J].中国医科大学学报,2013,(3):201-203,216.
[15]赵铭,贾航欢,徐曼,等.内质网-细胞膜连接对细胞内钙稳态的影响及其在心血管疾病中的意义[J].生理学报,2016,(4):1-16.
[16]BRECKENRIDGE D G,GERMAIN M,MATHAI J P,et al. Regulation of apoptosis by endoplasmie reticulumpathways[J].Oncogene,2003,22 (53)∶8608-8618.
[17]RAO R V,CASTRO-OBREGON S,FRANKNOWSKI H,et al.Coupling endoplasmic reticulum stress to the cell death program an APaf-1-independent intrinsic pathway[J].J Biol Chem,2002,277 (24)∶21836-21842.
The effect of endoplasmic reticulum pathway of apoptosis induced by colistin sulfate in PC12 cells
Huang Xin1,Jiang Hong1*,Wang Hongjun1,Li Jichang2,Chen Lei3,Ma Jiafeng4
(1.Jinzhou Medical University,Liaoning Jinzhou 121001; 2.Northeast Agricultural University,Heilongjiang Harbin 150030; 3.Xingcheng city Yaowang animal health supervision,Liaoning Xingcheng 125100; 4.Yixian Liulonggou animal health supervision,Liaoning Yixian 121100)
In order to explore the effect of endoplasmic reticulum pathway of colistin sulfate induced apoptosis in PC12 cells.PC12 cells were treated with colistin sulfate dissolved in the DMEM for 24 h,whose final concentrations were 0,62.5,125 and 250µg/mL respectively.The apoptosis was detected by transmission electron microscopy.Expression of GnRP78,caspase-12,Caspase-3 protein was detected by western blotting.Intracellular and extracellular free Ca2+concentration in PC12 cells was detected by Fluo-3/AM and Kit.Compared with control group,125 μg/mL, 250µg/mL colistin sulfate could appear typical characteristics of apoptosis in PC12 cells,significantly increase(P<0.01).Intracellular free Ca2+concentration and the expression of GnRP78, caspase-12,Caspase-3 protein,extracellular free Ca2+concentration significantly reduce(P<0.01). The results showed that the apoptosis induced by endoplasmic reticulum pathway was neurotoxicity mechanisms caused by colistin sulfate.
Colistin sulfate;PC12 cell;Cell apoptosis;Eendoplasmic reticulum pathway
S859.8
B
1672-9692(2016)12-0001-07
2016-11-02
黄鑫(1994-),女,本科在读,动物医学专业。
蒋红(1977-),女,博士,副教授,主要从事兽医药理学和毒理学研究。
辽宁省大学生创新创业项目(项目编号:201410160049);辽宁省科学技术基金自然科学基金项目(项目编号:2014022051)。
