DC-CTL免疫细胞对卵巢上皮癌细胞的靶向性治疗研究
2017-01-18周凌飞胡梦琪魏颖颖
周凌飞,海 娣,胡梦琪,魏颖颖,李 劼
(湖南省人民医院妇科,湖南 长沙 410005)
DC-CTL免疫细胞对卵巢上皮癌细胞的靶向性治疗研究
周凌飞,海 娣,胡梦琪,魏颖颖,李 劼
(湖南省人民医院妇科,湖南 长沙 410005)
目的 探讨经树突状细胞(DC)诱导的细胞毒性T淋巴细胞(CTL)免疫细胞靶向性的抑制卵巢上皮癌细胞的机制,为临床上DC-CTL治疗卵巢癌提供理论基础。方法 无胸腺BALB/C/nu/nu裸小鼠48只,分为4组,每组12只,裸鼠人卵巢癌SKOV3移植瘤模型成功后用未经DC诱导的CTL免疫细胞和经DC诱导的CTL免疫细胞进行治疗,比较各组裸鼠移植瘤体积和重量、抑瘤率、移植瘤miRNAlet-7表达和HMGA2蛋白表达的差异。结果 DC-CTL组和CTL组裸鼠的移植瘤体积和移植瘤重量低于模型对照组(F值分别为8.175、6.823,均P<0.05),DC-CTL组裸鼠的移植瘤体积和移植瘤重量低于CTL组,且差异具有统计学意义(t=13.244,P<0.05);DC-CTL组裸鼠的抑瘤率(69.57±10.81)%高于CTL组(42.35±8.15)%,且差异具有统计学意义(t=6.965,P<0.05);DC-CTL组和CTL组裸鼠的移植瘤miRNAlet-7表达均高于模型对照组(F=7.528,P<0.05),DC-CTL组裸鼠的移植瘤miRNAlet-7表达(1.69±0.40)高于CTL组(1.17±0.39),且差异具有统计学意义(t=2.964,P<0.05);DC-CTL组和CTL组裸鼠的HMGA2蛋白表达的ISH评分均低于模型对照组(F=6.419,P<0.05),DC-CTL组裸鼠的HMGA2蛋白表达的ISH评分(15.31±1.72)低于CTL组(17.18±1.86),且差异具有统计学意义(t=3.143,P<0.05)。结论 经DC诱导的CTL免疫细胞能够明显抑制裸鼠卵巢癌移植瘤的生长,其机制可能为促进let-7表达和抑制HMGA2蛋白表达有关。
裸鼠卵巢癌移植瘤;树突状细胞;胞毒性T淋巴细胞;靶向性研究
卵巢上皮癌(epithelial ovarian cancer,EOC)是一种常见的卵巢恶性肿瘤类型[1]。目前临床上多采用卵巢癌肿瘤细胞减灭术以及紫杉醇和铂类联合化疗的方式治疗卵巢上皮癌,但治疗效果并不理想,而对晚期和复发的患者效果更差[2]。有研究表明,恶性肿瘤局部树突状细胞(dendritic cell,DC)数量及功能状态通常与恶性肿瘤的进展之间存在密切联系[3-4]。为了进一步探讨经DC诱导的CTL免疫细胞靶向性的抑制卵巢上皮癌细胞的机制,本研究制备了卵巢癌冻融抗原负载的树突状细胞诱导细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL),并建立了卵巢癌SKOV3细胞裸鼠移植瘤动物模型,探讨了DC-CTL对卵巢癌裸鼠移植瘤生长的抑制作用以及对HMGA2蛋白表达的影响,为临床上提供了理论依据。
1实验动物与方法
1.1实验动物和材料
无胸腺BALB/C/nu/nu裸小鼠48只,购置于湖南斯莱克景达实验动物有限公司,体重16~22g,平均体重(15.11±1.94)g,周龄4~6周,平均周龄(4.54±0.22)周。
1.2细胞株
人卵巢癌细胞株SKOV3购置于ATCC(中国科学院典型培养物种保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心)。
1.3卵巢癌冻融抗原的制备
将人卵巢癌SKOV3细胞置于含有10%FBS的RPMI-1640培养基中进行培养,并用0.25%胰蛋白酶进行消化并制成细胞悬液,密度大约为1×106个/mL。随后将血细胞放入液氮中10min,取出后迅速放入100℃水浴中,以此反复冻融3次;用台式离心机1 500r/min离心20min,随后收集上清,再用8 000r/min离心1h,将上清用微孔滤膜进行过滤,滤液于-20℃下保存备用,即为卵巢癌冻融抗原。
1.4树突状细胞诱导细胞毒性T细胞的制备方法
将采集的新鲜脐血加入等体积比例的PBS缓冲液(含0.6%枸橼酸钠)进行稀释;随后再加入等体积的淋巴细胞分离液以2 000r/min离心30min,收集单个核细胞层并将细胞进行洗涤和计数。以5倍体积的PBS充分洗涤单个核细胞悬液以获得足月妊娠健康产妇脐血单个核细胞(cord blood mononuclear cells,CBMC),再用含10%FBS的RPMI1640培养基将CBMC重悬后于二氧化碳培养箱内37℃培养2h。向贴壁细胞中加入100ng/mL粒细胞巨噬细胞集落刺激因子(granulocyte- macrophage colony stimulating factor,GM-CSF)和50ng/mL白细胞介素-4(interlukin-4,IL-4)进行DC的诱导培养,每半日更换培养液并补加细胞因子,37℃、5%CO2条件下培养7d。待细胞培养结束则加入卵巢癌冻融抗原致敏DC(抗原加入量以冻融前卵巢癌细胞的量计),并于次日用0.25%胰蛋白酶进行消化以制成细胞悬液,用于后续试验。
1.5裸鼠卵巢癌移植瘤模型方法和裸鼠分组及治疗方法
1.5.1裸鼠卵巢癌移植瘤模型方法
将SKOV3细胞菌株在含10%胎牛血清、1%青链霉素的RPMI1640培养基上于37℃、5%CO2培养箱中培养5~7d,待细胞长满瓶底后用0.1%胰蛋白酶消化成单个细胞,并以10%胎牛血清终止消化。将培养液置离心管中以2 000r/min离心5min,弃去上清液后加入PBS吹散混匀并稀释成2.5×107个/mL的单细胞悬液。按照每只0.2mL的剂量将单细胞悬液接种于裸鼠背侧近后肢处皮下。
1.5.2实验裸鼠分组
将48只裸鼠随机分为4组,每组12只:①空白对照组,不做任何处理做空白对照;②模型对照组,裸鼠移植瘤模型成功后注射生理盐水做模型对照;③CTL组,裸鼠移植瘤模型成功后注射未经DC诱导的CTL免疫细胞;④DC-CTL组,裸鼠移植瘤模型成功后注射经DC诱导的CTL免疫细胞。
1.5.3治疗方法
接种7天后开始治疗,CTL组和DC-CTL组分别腹腔注射未经DC诱导的CTL免疫细胞和经DC诱导的CTL免疫细胞,每次注射10μL,1次/周,连续4周。模型对照组腹腔注射同体积的生理盐水,空白对照组不做任何处理。
1.6裸鼠移植瘤miRNAlet-7表达和HMGA2蛋白表达的方法
将裸鼠移植瘤组织用Trizol试剂盒提取RNA后加反转录反应液进行反转录,所得的反转录产物用灭菌水稀释5~50倍以荧光定量PCR仪进行扩增并检测,荧光定量PCR仪为美国应用生物技术公司生产,型号为FS-7900。
采用酶标免疫法检测HMGA2蛋白表达,酶标仪为德国拜发公司生产,型号为880;免疫试剂盒由武汉博士德生物工程有限公司,检测步骤严格按照试剂盒说明进行。
1.7观察指标及检测方法
比较各组裸鼠在7d、14d、21d时的体重的差异;21d时处死各组裸鼠,比较各组裸鼠移植瘤体积和移植瘤重量的差异;计算抑瘤率(%)=(1-治疗组裸鼠移植瘤重量)/模型组裸鼠移植瘤重量×100%,比较CTL组和DC-CTL组抑瘤率的差异;比较各组裸鼠移植瘤miRNAlet-7表达和HMGA2蛋白表达的差异。
1.8统计学方法
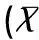
2结果
2.1各组裸鼠不同时间点平均体重的变化比较
各组裸鼠在实验过程中一般情况良好,饮食尚可、大便良好,无精神萎靡和活动迟缓等现象,均未出现死亡;在7d时各组裸鼠的体重均无明显差异(P>0.05);在14d和21d时,移植瘤模型的裸鼠体重均高于空白对照组(P<0.05),免疫细胞治疗组的裸鼠体重均低于模型对照组(P<0.05),而DC-CTL免疫细胞治疗组的裸鼠体重低于CTL组(P<0.05),见表1。


Table 1 Comparison of average body weight at different time points among each group ±S)
注:a与空白对照组比较P<0.05,b与模型对照组比较P<0.05,c与CTL组比较P<0.05。
2.2各组裸鼠21天时移植瘤体积和移植瘤重量比较
模型对照组裸鼠在21d时的移植瘤体积(418.26±53.83)mm3和移植瘤重量(1.35±0.34)g,CTL组裸鼠的移植瘤体积(393.17±41.72)mm3和移植瘤重量(0.92±0.27)g,DC-CTL组裸鼠的移植瘤体积(325.65±38.92)mm3和移植瘤重量(0.72±0.25)g,DC-CTL组和CTL组裸鼠的移植瘤体积和移植瘤重量低于模型对照组,DC-CTL组裸鼠的移植瘤体积和移植瘤重量低于CTL组,且差异具有统计学意义(P<0.05),见表2。
2.3各组裸鼠21d时抑瘤率比较
DC-CTL组裸鼠的抑瘤率(69.57±10.81)%高于CTL组(42.35±8.15)%,且差异具有统计学意义(P<0.05),见表3。


Table 2 Comparison of volume and weight of transplanted tumor at 21st day among each ±S)
注:a与模型对照组比较#P<0.05,b与CTL组比较P<0.05
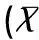
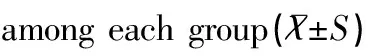

组别例数(n)抑瘤率(%)tP模型对照组12-6.956<0.001CTL组1242.35±8.15DC⁃CTL组1269.57±10.81
2.4各组裸鼠移植瘤miRNAlet-7表达比较
DC-CTL组和CTL组裸鼠的移植瘤miRNAlet-7表达均高于模型对照组,DC-CTL组裸鼠的移植瘤miRNAlet-7表达(1.69±0.40)高于CTL组(1.17±0.39),且差异具有统计学意义(P<0.05),见表4。



组别例数(n)miRNAlet⁃7表达FP模型对照组120.93±0.457.5280.011CTL组121.17±0.39aDC⁃CTL组121.69±0.40ab
注:a与模型对照组比较P<0.05,b与CTL组比较P<0.05。
2.5各组裸鼠移植瘤HMGA2蛋白表达的ISH评分比较
DC-CTL组和CTL组裸鼠的HMGA2蛋白表达的ISH评分均低于模型对照组,DC-CTL组裸鼠的HMGA2蛋白表达的ISH评分(15.31±1.72)低于CTL组(17.18±1.86),且差异具有统计学意义(P<0.05),见表5。


Table 5 Comparison of ISH scores of HMGA2 protein expression among each ±S)
注:a与模型对照组比较P<0.05,b与CTL组比较P<0.05。

图1 21d时裸鼠和移植瘤一般情况图
Fig.1 General picture of nude mice and transplanted tumor at 21st day

图2 模型组移植瘤HMGA2蛋白表达免疫组化图
Fig.2 Immunohistochemistry picture of HMGA2 protein expression of transplanted tumor in model group
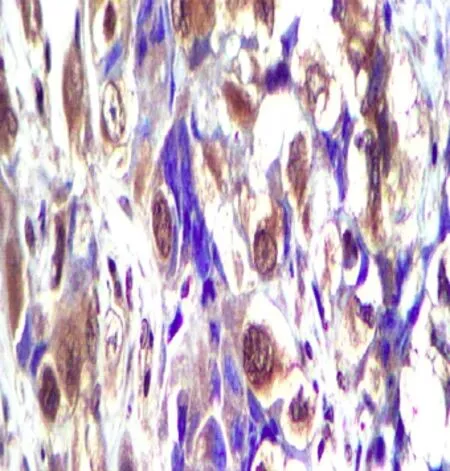
图3 CTL组移植瘤HMGA2蛋白表达免疫组化图
Fig.3 Immunohistochemistry picture of HMGA2 protein expression of transplanted tumor in CTL group

图4 DC-CTL组移植瘤HMGA2蛋白表达免疫组化图
Fig.4 Immunohistochemistry picture of HMGA2 protein expression of transplanted tumor in DC-CTL group
3讨论
3.1卵巢上皮癌现状
卵巢上皮癌是一种常见的妇科恶性肿瘤,其发病率和致死率都较高,患者的五年生存率仅为25%~30%,严重威胁着广大女性的生命安全[5-6]。目前对卵巢癌的治疗方式也较为单一,大部分患者均通过卵巢癌细胞减灭术+术后化疗的方法治疗,但术后的复发率较高,对晚期或后期的治疗效果也较差[7]。因此,探索新的卵巢癌治疗药物并制定个体化治疗方案对提高卵巢癌患者的生存率至关重要。有研究表明,卵巢癌患者的微环境中大量存在肿瘤细胞释放的白细胞介素-10(interlukin-10,IL-10)等免疫抑制分子,而这些免疫抑制分子可降低DC表面CD80以及CD86等共刺激分子的表达,从而减少Th1型细胞因子白细胞介素-12(interlukin-12,IL-12)的分泌并阻断T细胞抗肿瘤活性,导致肿瘤新生血管生成并最终影响卵巢肿瘤的发生和发展[8-10]。而肿瘤细胞与树突状细胞的融合疫苗可表达恶性肿瘤细胞的所有抗原并产生多克隆的细胞毒性T淋巴细胞,从而诱导机体产生肿瘤特异性免疫反应。肿瘤疫苗还能通过表达组织相容性抗原II、共刺激因子以及黏附因子等的方式为肿瘤免疫提供第二信号,最终促使细胞产生抗肿瘤特异性免疫应答[11]。国内外已有大量动物实验表明,肿瘤细胞/DC融合疫苗在消退肿瘤方面作用明显,且对机体无严重毒副作用[12]。
3.2DC-CTL对肿瘤的抑制效果
为了进一步探讨DC-CTL免疫细胞治疗的靶向性研究及其抑制卵巢上皮癌细胞的机制,本研究将裸鼠卵巢癌移植瘤模型成功后分作3组,分别注射生理盐水、未经DC诱导的CTL免疫细胞和经DC诱导的CTL免疫细胞进行治疗,并比较分析了各组裸鼠移植瘤体积和重量、抑瘤率、移植瘤miRNAlet-7表达和HMGA2蛋白表达的差异,从而为DC-CTL应用于卵巢癌的临床治疗及针对患者制定个体化治疗方案提供了理论依据。本研究结果表明,各组裸鼠在实验过程中一般情况良好,饮食尚可、大便良好,无精神萎靡和活动迟缓等现象,CTL组和DC-CTL免疫细胞治疗组的裸鼠体重均低于模型对照组(P<0.05),且DC-CTL免疫细胞治疗组的裸鼠体重更低,说明注射未经DC诱导的CTL免疫细胞和经DC诱导的CTL免疫细胞均能在一定程度上抑制肿瘤的发展,但经DC诱导的CTL免疫细胞的抑制效果更为明显。DC-CTL组和CTL组裸鼠的移植瘤体积和移植瘤重量明显低于模型对照组,而DC-CTL组裸鼠的移植瘤体积和移植瘤重量均低于CTL组,且21d时DC-CTL组裸鼠的抑瘤率明显高于CTL组,更一步证实了经DC诱导的CTL免疫细胞对肿瘤的抑制效果更为明显。
3.3DC-CTL对mi RNA和HMGA2表达的影响作用
Micro RNA(mi RNA)是近年来发现的一种非编码小分子RNA,主要由22个核苷酸组成,其中let-7家族是目前研究较为广泛的miRNA之一,其在卵巢组织中常常高度表达[13]。有研究表明,miRNAlet-7可通过抑制原癌基因RAS、HMGA2、c-Myc 等的表达而抑制肿瘤细胞的生长和侵袭转移,进而抑制肿瘤的发生和发展[14]。本研究通过荧光定量PCR法对各组裸鼠移植瘤中miRNAlet-7进行检测发现,DC-CTL组和CTL组的miRNAlet-7表达量较高,且DC-CTL组的更高,提示DC-CTL能有效的促进miRNAlet-7的表达,进而抑制肿瘤的发展。高迁移率蛋白A2(high mobility group A2,HMGA2)是一种重要的染色体蛋白质,其在生物体内的过度表达与恶性肿瘤的发生和发展过程密切相关,这与本研究的结果基本一致[15]。本研究通过免疫组织化学法对各组裸鼠移植瘤中HMGA2蛋白的表达情况进行检测发现,DC-CTL组和CTL组中HMGA2蛋白的表达量明显低于对照组,且DC-CTL组的更低,说明DC-CTL能有效抑制HMGA2蛋白的表达,进而抑制裸鼠卵巢癌移植瘤的生长。
综上所述,经DC诱导的CTL免疫细胞能够明显促进let-7表达并同时抑制HMGA2蛋白表达,进而抑制裸鼠卵巢癌移植瘤的生长。
[1]郭永梅,黄云海,魏新华,等.3.0 T 动态增强磁共振对卵巢肿瘤的半定量及定量分析研究[J].磁共振成像,2015,6(10):782- 786.
[2]鲁艳明,银铎,王宁,等.miRNA-200c对卵巢癌细胞侵袭能力影响观察[J].中华肿瘤防治杂志,2014,21(10):732-735.
[3]赖一鸣,许娜,陈晓杰,等.五味子多糖抑制卵巢癌SKOV3细胞增殖的研究[J].中华中医药学刊,2014,32(4):856-857.
[4]Amal H, Shi D Y, Ionescu R,etal.Assessment of ovarian cancer conditions from exhaled breath[J].Int J Cancer,2015,136(6):E614-E622.
[5]Raska P, Iversen E, Chen A,etal.European American stratification in ovarian cancer case control data: the utility of genome-wide data for inferring ancestry[J].PLoS One,2012,7(5):e35235.
[6]孙伟娜,杨海青,陈院朝,等.基质金属蛋白酶-9和D-二聚体在卵巢癌诊断中的作用[J].中华实用诊断与治疗杂志,2014,28(5):492-493.
[7]饶明月,吴敬波,林盛,等.深部热疗联合化疗治疗晚期卵巢癌近期疗效临床观察[J/OL].中华临床医师杂志(电子版),2014,8(11):1997-2001[2016-01-05].http://d.wanfangdata.com.cn/Periodical/zhlcyszz201411007.
[8]White E A,Kenny H A,Lengyel E.Three-dimensional modeling of ovarian cancer [J].Adv Drug Deliv Rev,2014,79-80:184-192.
[9]王丽华,张兢,王亮亮,等.Beclin 1、LC3-II及P62蛋白在上皮性卵巢癌中的表达及意义[J].中华解剖与临床杂志,2014,19(1):58-61.
[10]Dubinina V G,Rybin A I,Lysenko M A,等.Genetic features of platinum-resistant ovarian cancer patients[J].中国现代医学杂志,2014,24(15):1-4.
[11]叶萍萍,王豪勋,马军,等.肿瘤患者树突状细胞联合细胞因子诱导杀伤细胞免疫治疗后血清免疫学变化及临床意义[J].中华实验外科杂志,2015,32(10):2539-2541.
[12]王硕,王永华,刘静,等.B7-H1沉默联合肿瘤抗原负载的新型树突状细胞疫苗体外抗膀胱癌免疫效应的研究[J].中华实验外科杂志,2014,31(10):2232-2234.
[13]Fagegaltier D,König A,Gordon A,etal.A genome-wide survey of sexually dimorphic expression of Drosophila miRNAs identifies the steroid hormone-induced miRNA let-7 as a regulator of sexual identity[J].Genetics,2014,198(2):647-668.
[14]Chen W,Liu Z,Li T,etal.Regulation of Drosophila circadian rhythms by miRNA let-7 is mediated by a regulatory cycle[J].Nat Commun,2014,5:5549.
[15]刘变利,郭霞.高迁移率蛋白1(HMGB1)在宫颈癌中表达及其意义[J].现代仪器与医疗,2015,21(6):86-87,103.
[专业责任编辑:韩晓兵]
Targeted therapy of ovarian epithelial cancer by DC-CTL immune cells
ZHOU Ling-fei, HAI Di, HU Meng-qi, WEI Ying-ying,LI Jie
(Department of Gynecology, Hunan People’s Hospital, Hunan Changsha 410005, China)
Objective To investigate the mechanism of targeted inhibiting epithelial ovarian cancer(EOC) by cytotoxic T lymphocyte (CTL) immune cells induced by dendritic cell (DC) so as to provide theoretical basis for clinical treatment of ovarian cancer by DC-CTL. Methods Forty-eight BALB/C/nu/nu nude mice were divided into 4 groups with 12 in each group. After SKOV3 ovarian cancer cells transplanted tumor model was successful, nude mice were treated with CTL immune cells without DC induction and DC induced CTL immune cells. Comparison was made among different groups in volume and weight of transplanted tumor, tumor inhibition rate, miRNAlet-7 expression and HMGA2 protein expression. Results The tumor volume and weight of transplanted tumor in DC-CTL group and CTL group were lower than those in model group (Fvalue was 8.175 and 6.823, respectively, bothP<0.05). Those in DC-CTL group were lower than those in CTL group with statistical differences (t=13.244,P<0.05). The tumor inhibition rate (69.57±10.81%) in DC-CTL group was higher than that in CTL group (42.35±8.15%), and the difference was statistically significant (t=6.965,P<0.05). The expression of miRNAlet-7 in DC-CTL group and CTL group was higher than that in model group (F=7.528,P<0.05), and that in CTL group (1.69±0.40) was significantly higher than that in DC-CTL group (1.17±0.39) with significant difference (t=2.964,P<0.05). The ISH score of HMGA2 protein expression in DC-CTL group and CTL group was lower than that in model group (F=6.419,P<0.05), and that in DC-CTL group (15.31±1.72) was lower than that in CTL group (17.18±1.86) with significant difference (t=3.143,P<0.05). Conclusion CTL immune cells induced by DC can significantly inhibit the growth of ovarian cancer transplanted tumor in nude mice, and the mechanism may be related to the promotion of let-7 expression and inhibition of HMGA2 protein expression.
ovarian cancer transplanted tumor in nude mice; dendritic cell (DC); cytotoxic T lymphocyte (CTL); targeting research
2016-04-12
周凌飞(1990-),女,住院医师,硕士,主要从事妇产科临床工作。
李 劼,主任医师。
10.3969/j.issn.1673-5293.2016.11.016
R711.7
A
1673-5293(2016)11-1339-04
