RNA干扰敲低GSK-3β对瘢痕疙瘩形成影响的体外研究*
2017-01-18蔡玉梅朱世泽杨维群潘明孟王朝阳吴文艺
蔡玉梅, 朱世泽, 杨维群, 潘明孟, 王朝阳, 吴文艺
(1泉州医学高等专科学校病理学教研室, 2福建医科大学附属第二医院整形外科,福建 泉州 362000)
RNA干扰敲低GSK-3β对瘢痕疙瘩形成影响的体外研究*
蔡玉梅1, 朱世泽2△, 杨维群1, 潘明孟2, 王朝阳2, 吴文艺2
(1泉州医学高等专科学校病理学教研室,2福建医科大学附属第二医院整形外科,福建 泉州 362000)
目的: 利用RNA干扰技术探讨糖原合成酶激酶3β(GSK-3β)对人瘢痕疙瘩成纤维细胞(keloid fibroblasts,KFB)的抑制效果。方法: 将针对人GSK-3β基因设计合成的3对特异性小干扰RNA(siRNA)分别转染体外培养的人KFB,通过RT-PCR和Western blot筛选出干扰人KFBGSK-3β基因表达的最佳siRNA,进而转染人KFB,并用RT-PCR和Western blot检测GSK-3β及相关蛋白的mRNA和蛋白表达。结果: 1434序列具有最佳的GSK-3β mRNA和蛋白抑制效率。转染GSK-3βsiRNA后,KFB的β-catenin、细胞周期蛋白D1(cyclin D1)、p-GSK-3β和Wnt2的蛋白水平下降,KFB活力下降,且随着培养时间的延长,细胞生长受抑制程度增大,细胞倍增时间明显延迟。结论: 转染靶向GSK-3β的siRNA可有效降低该基因在KFB内的表达,从而抑制了瘢痕疙瘩生长,具有潜在的治疗前景。
糖原合成酶激酶3β; 瘢痕疙瘩; 成纤维细胞; RNA干扰
瘢痕疙瘩(keloid)是一种具有浸润生长特性的病理性瘢痕,治疗后复发率高,对该病的有效预防和治疗一直是整形外科界迫于解决的难题。瘢痕疙瘩组织学特点为大量成纤维细胞增生,细胞外基质中胶原、蛋白多糖、糖蛋白等过度沉积,以Ⅰ、Ⅲ型胶原过度沉积为主,胶原纤维排列紊乱,从而导致真皮纤维化[1]。成纤维细胞是瘢痕疙瘩形成与增生的效应细胞。
糖原合成酶激酶3β(glycogen synthase kinase-3β,GSK-3β)是一种保守丝氨酸/苏氨酸激酶,存在于所有真核生物组织中[2]。GSK-3β最初被发现是参与糖原代谢的关键酶,但后来发现GSK-3β广泛参与各种细胞功能的调节,包括代谢调节、基因表达调节及细胞骨架完整性的维持,也可促进成纤维细胞的增殖和活化,并增加胶原等细胞外基质的合成[3]。我们在体外研究转染靶向GSK-3β的siRNA对瘢痕疙瘩成纤维细胞生长可能产生的影响,以期为Wnt信号通路中不同基因靶点和高特异性基因药物的开发、瘢痕疙瘩的分子诊断及治疗提供一个新的研究领域。
材 料 和 方 法
1 材料
1.1 标本来源 实验标本来自福建医科大学附属第二医院整形外科,取材部位为面部、胸背部、腹部或四肢等。由于受标本例数限制,瘢痕疙瘩10例,其中男4例,女6例,年龄2~55岁,平均年龄(30.00±18.83)岁,病程6~24月,平均(13.70±6.31)月,病因为外伤4例,手术3例,穿耳孔1例,感染2例。所取标本之患者无合并皮肤疾病、结缔组织病和其它重要脏器器质性疾病,局部皮肤无溃疡及感染;正常皮肤10例(取自瘢痕疙瘩周围的正常皮肤或植皮患者取皮区的正常皮肤),所有取材均获得患者知情同意;所有标本均根据临床和病理(HE染色切片的组织学检查)诊断证实。
1.2 试剂和仪器 改良型1640培养基(HyClone);胎牛血清和胰蛋白酶-EDTA溶液(Gibco);Lipofectamin 2000转染试剂(Invitrogen);siRNA(Gene-pharma);TRIzol 试剂(Invitrogen);抗Wnt2抗体(1∶200)、抗β-catenin抗体(1∶200)、抗p-GSK-3β抗体(1∶200)和抗cyclin D1抗体(1∶200)均购自Santa Cruz;抗GSK-3β抗体(1∶500)(Ptglab);HRP标记的山羊抗兔、小鼠IgG(1∶2 000)(Jackson);增强型化学发光剂和M-PER蛋白提取试剂(Pierce);PVDF膜(Millipore);实时荧光定量通用试剂(上海吉玛公司)。生物安全柜(上海上净净化设备有限公司);荧光显微镜(Motic); MX3000P实时荧光定量 PCR 仪(Stratagene);PowerPacTMHC电泳仪(Bio-Rad);VE-180 垂直电泳槽(上海天能);DY-B1 脱色摇床 (上海沪西仪器)。
2 方法
2.1 细胞培养和实验分组 组织块贴壁法培养人瘢痕疙瘩成纤维细胞,细胞在37 ℃、5% CO2条件下用含10%胎牛血清的改良型1640培养基培养,每隔3~5 d换液1次。实验取第3~6代成纤维细胞。实验分为空白(blank)组、正常皮肤细胞(normal skin cell, normal)组、阴性对照(negative control, NC)组、无义序列siRNA转染(scramble siRNA transfection, scramble)组和siRNA转染组。
2.2 siRNA的设计、合成和筛选 根据Elbashir的设计原则,查找人GSK-3β基因序列(NM_019178)并设计3个siRNA序列(根据靶序列起始位置命名为siRNA1434、siRNA1814和siRNA2012),见表1,由上海吉玛制药有限公司合成,序列经BLAST查询,排除与其它基因同源。并通过RT-qPCR和Western blot检测不同序列具有的GSK-3β mRNA和蛋白抑制效率。

表1 siRNA序列
2.3 siRNA转染及转染率观察 取处于对数生长期的细胞常规消化后,制成单细胞悬液。血球计数板计数,将细胞稀释至1.5×109/L,然后接种 6 孔板,混匀后于37 ℃、5% CO2条件下培养 24 h。 每一A260siRNA用150 μL DEPC-H2O溶解,终浓度约为20 μmol/L。 在1.5 mL EP管中加入250 μL Opti-MEM I,再加入8 μL siRNA,取另一个1.5 mL EP管,加入250 μL Opti-MEM I,加入5 μL Lipofectamine 2000,混匀,室温放置5 min后将两管混合,室温静置25 min。吸去培养液,每孔加入1 mL无血清的改良型1640培养液。 将转染混合物逐滴加入6孔板中,混匀后,在培养箱中温育4~6 h。吸弃转染液,加入1.5 mL含10% FBS 的改良型1640培养液。37 ℃、5% CO2条件下继续培养24 h或48 h后于荧光显微镜下观察转染阳性细胞数,计算细胞转染率。细胞转染率(%)=转染阳性细胞数/细胞总数×100%。
2.4 RT-PCR测定mRNA 的表达 从细胞中提取总RNA,逆转录后,cDNA直接用于PCR扩增,扩增时设计合成的β-catenin、Wnt2、GSK-3β和cyclin D1引物序列见表2。扩增后的PCR产物行琼脂糖凝胶电泳,每个基因每个样品设置3个复孔。

表2 RT-PCR的引物序列
2.5 Western blot检测蛋白 提取细胞总蛋白,SDS-PAGE考马斯亮蓝染色观察蛋白电泳,电转仪将蛋白质转移至PVDF膜上。分别加入相应的I抗和II抗。化学发光检测系统显影、定影后,胶片用凝胶成像分析系统拍照,使用Gel-Pro Analyzer软件分析处理β-catenin、Wnt2、GSK-3β和cyclin D1的蛋白表达情况,每个基因每个样品做3个重复。
2.6 CCK-8检测细胞活力 取处于对数生长期的细胞常规消化后接种于96孔板,每孔3×103个细胞,继续培养12 h,分别于转染前、转染后24 h、48 h、72 h,倾去培养液,加入新鲜的培养基100 μL,每孔避光加入CCK-8试剂 10 μL,避光培养2.5 h,酶标仪450 nm波长测吸光度(A)值,每个基因每个样品3个重复。
3 统计学处理
采用SPSS 12.0软件进行统计分析,所有实验数据用均数±标准差(mean±SD)描述。多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 siRNA转染率测定
转染阳性细胞胞质内可见大量绿色荧光,转染效率为90%,见图1。

Figure 1.siRNA transfection efficiency (×400). The positive cells transfected with green fluorescence.
图1 siRNA转染效率测定
2 不同GSK-3βsiRNA转染后各细胞GSK-3β的mRNA表达水平
与阴性对照组相比,siRNA1434组转染24 h后,GSK-3β的mRNA表达下降(P<0.05),48 h时表达却升高;siRNA1814组于24 h GSK-3β的mRNA表达升高,48 h则下降;而siRNA2012组2个时点均升高,见图2。
3 不同GSK-3βsiRNA转染后各组细胞GSK-3β的蛋白表达水平
siRNA1434组及正常皮肤组与阴性对照组相比,转染24 h及48 h后,GSK-3β的蛋白表达均有下降,差异有统计学显著性(P<0.05); siRNA1814组和siRNA2012组与阴性对照组相比,GSK-3β的蛋白表达均有下降,且48 h各组间差异有统计学显著性(P<0.05);而空白组、无义序列siRNA转染组与阴性对照组相比,差异无统计学显著性,见图3。
4 RT-PCR检测RNA干扰后相关mRNA的表达情况
与阴性对照相比,GSK-3βsiRNA转染组中β-catenin的mRNA表达上调,GSK-3β的mRNA表达下调,差异均有统计学显著性(P<0.05)。Wnt2和cyclin D1的mRNA表达水平差异均无统计学显著性,见图4。
5 Western blot检测RNA干扰后相关蛋白的表达情况
与阴性对照相比,GSK-3βsiRNA转染组β-catenin、GSK-3β、cyclin D1、Wnt2和p-GSK-3β蛋白的表达均下调,差异有统计学显著性(P<0.05),见图5。
6 CCK-8法检测RNA干扰后KFB活力的变化
CCK-8实验显示转染GSK-3βsiRNA导致KFB进入对数生长期后生长减慢,且随着培养时间的延长,细胞生长受抑制程度增大,细胞倍增时间明显延迟,见图6。

Figure 2.After transfection with differentGSK-3βsiRNAs, the mRNA expression of GSK-3β in different groups was detected by RT-PCR. ACTB: β-actin. Mean±SD.n=3.*P<0.05vsNC.
图2 不同GSK-3βsiRNA转染后各组细胞GSK-3β的mRNA表达水平

Figure 3.After transfection with differentGSK-3βsiRNAs, the protein expression of GSK-3β in different groups was detected by Wes-tern blot. Mean±SD.n=3.*P<0.05vsNC.
图3 不同GSK-3βsiRNA转染后各组细胞GSK-3β的蛋白表达水平

Figure 4.After transfection withGSK-3βsiRNA, the mRNA expression of Wnt2, β-catenin, GSK-3β and cyclin D1 in different groups was detected by RT-PCR. Mean±SD.n=3.*P<0.05vsNC.
图4 转染GSK-3βsiRNA后不同细胞组中相关mRNA的表达水平
讨 论
GSK-3β是细胞内主要的丝氨酸/苏氨酸家族激酶。GSK-3β基因的编码产物是含433个氨基酸残基和3个结构域的多功能激酶,ATP绑定在其肽链 N端,由7个反向平行的β折叠构成的桶状结构和α螺旋之间,而 Arg96、Arg180 和 Lys205 3个带正电的氨基酸组成的口袋结构为底物结合的核心位点,通过调控多种底物,成为众多信号转导通路的汇聚点,参与胚胎发育、细胞周期的调控、细胞分化与凋亡、细胞的运动与黏附及炎症反应等多种生理过程,其活性异常与多种疾病的发生发展密切相关[4]。
本研究通过针对人GSK-3β基因设计合成特异性siRNA片段1434序列,此序列具有最佳GSK-3β的mRNA和蛋白抑制效率,同时设置含无关序列的随机片段作为对照。转染GSK-3βsiRNA后,CCK-8实验显示KFB进入对数生长期后细胞活力下降,且随着培养时间的延长,细胞生长受抑制程度增大,细胞倍增时间明显延迟。目前发现GSK-3β参与调节的信号通路主要有2条。(1)PI3K-AKT-GSK3β 信号通路:正常情况下,磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)被激活后,进而活化蛋白激酶B(protein kinase B,PKB;又称AKT),活化的 AKT 与GSK-3β结合后,诱导GSK-3β向细胞膜转位,使GSK-3β失活,进而影响GSK-3β下游底物,最终发挥其参与细胞增殖与分化及调节炎症和免疫反应的作用[5]。同时,也有研究表明当GSK-3β上游的信号转导分子受到抑制导致GSK-3β激活时,就会促进caspase家族的蛋白酶激活,降低核蛋白的分解与DNA链的剪裂,而造成细胞凋亡[6]。(2)Wnt 信号通路:Wnt信号通路参与并影响人体的胚胎发育和肿瘤发生、发展关键的生理、病理过程,而且在出生后机体的损伤与修复方面也起着重要作用[7],GSK-3β是Wnt经典通路的关键成员。创伤等诱因激活Wnt蛋白表达分泌,活化了胞质内的散乱蛋白(Dishevelled,DSH or DVL),使β-catenin不被GSK-3β磷酸化从而避免了泛素蛋白酶体对其识别和降解,进而在细胞质内积聚,当β-catenin在细胞质内积聚到一定浓度时,就移向胞核并与胞核内的T细胞因子/淋巴细胞增强子(T-cell factor/lymphoid enhancer factor,TCF/LEF)相结合,激活下游cyclin D1、c-myc、c-fos等靶基因转录而导致细胞异常增殖[8-9]。有研究表明在临床肿瘤样本中普遍检测出GSK-3β的过度表达与活化,无论是化学性抑制剂介导的GSK-3β活性下调,还是RNA干扰介导的表达沉默均导致肿瘤明显的生长抑制[10-11]。瘢痕疙瘩具有肿瘤的某些生物学特性,在细胞学上以细胞增生为主,刘欢等[12]也证实在瘢痕疙瘩中GSK-3β高表达,所以通过GSK-3βsiRNA片段抑制扮演“促瘤因子”角色的GSK-3β,使得PI3K-AKT-GSK3β 信号通路受阻,最终阻碍其发挥参与细胞增殖的作用。另一方面GSK-3β在 Wnt 信号通路中充当了“肿瘤抑制因子”的功能,胞质中的GSK-3β作为β-catenin 降解复合物中的开关分子,通过磷酸化β-catenin及泛素连接酶β-TrCP介导的泛素蛋白酶体通路,使其稳定性下降[13],所以GSK-3β的失活将在核内外启动 Wnt 信号途径,Wnt2表达上升,但我们实验结果又显示KFB的p-GSK-3β和Wnt2蛋白表达下降,β-catenin和cyclin D1的mRNA和蛋白表达下降,这可能是p-GSK-3β的水平明显降低,增强了GSK-3β及其复合体对β-catenin的磷酸化,促进了β-catenin的降解,导致游离β-catenin的表达下调,从而导致KFB从G1期向S期的阻滞,KFB生长受抑,倍增时间延长。相反的发现在其它研究中也有报道,在体内乳腺组织高表达无激酶活性GSK-3β的转基因小鼠可诱发乳腺癌并伴有β-catenin和cyclin D1的高表达[14],这是否提示有其它途径影响了Wnt2的蛋白表达,抑制了Wnt 信号通路,有待于以后的实验进一步研究。总之,本研究结果表明,通过RNA干扰敲低GSK-3β,能抑制成纤维细胞的生长及活化,从而抑制了瘢痕疙瘩生成。这为 Wnt信号通路不同基因靶点和高特异性基因药物的开发、瘢痕疙瘩的分子诊断及治疗提供一个新的研究领域。

Figure 5.After transfection withGSK-3βsiRNA, the protein expression of GSK-3β, Wnt2, p-GSK-3β, β-catenin and cyclin D1 in different groups. Mean±SD.n=3.*P<0.05vsNC.
图5 转染GSK-3βsiRNA后不同细胞组中相关蛋白的表达水平
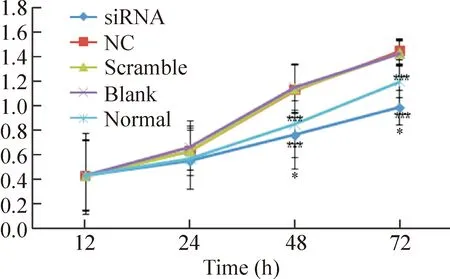
Figure 6.The changes of cell viability after transfection withGSK-3βsiRNA in different groups. Mean±SD.n=3.*P<0.05vsNC.
图6 转染GSK-3βsiRNA后各组细胞活力的变化
[1] Wolfram D, Tzankov AP, Piza-Katzer H, et al. Hypertrophic scars and keloids: a review of their pathophysiology, risk factors, and therapeutic management[J]. Permatol Surg, 2009, 35(2):171-181.
[2] 张 斌, 李法琦. 糖原合酶激酶3β信号分子在心肌肥厚中的作用[J]. 中国病理生理杂志, 2010, 26(3):601-604.
[3] Doble BW, Woodgett JR. GSK-3: tricks of the trade for a multi-tasking kinase[J]. J Cell Sci, 2003, 116(Pt 7):1175-1186.
[4] Kim WY, Wang XY. GSK-3 is a master regulator of neural progenitor homeostasis[J]. Nat Neurosci, 2009, 12(11):1390-1397.
[5] 熊 涛, 屈 艺, 母得志. AKT-GSK3信号通路与缺血缺氧性脑损伤[J]. 医学综述, 2010, 16(23):3521-3524.
[6] De Laurenzi V, Melino G. Apoptosis: the little devil of death[J]. Nature, 2000, 406(6792): 135-136.
[7] Tanaka SS, Koji Y, Yamagnchi YL, et al. Impact of WNT signaling on tissue lineage differentiation in the early mouse embryo[J]. Dev Growth Differ, 2011, 53(7):843-856.
[8] Piao S, Lee SH, Kim H, et al. Direct inhibition of GSK-3β by the phosphorylated cytoplasmic domain of LRP6 in Wnt/β-catenin signaling [J]. PLoS One, 2008, 3(12):1754-1755.
[9] Wu G, Huang H, Garcia Abreu J, et al. Inhibition of GSK3 phosphorylation of β-catenin via phosphorylated PPPSPXS motifs of Wnt coreceptor LRP6[J]. PLoS One, 2009, 4(3):e4926.
[10]Watanabe M, Abe N, Oshikiri Y, et al. Selective growth inhibition by glycogen synthase kinase-3 inhibitors in tumorigenic HeLa hybrid cells is mediated through NF-κB-dependentGLUT3 expression[J]. Oncogenesis, 2012, 1:e21.
[11]Zhou W, Wang L, Gou SM, et al. ShRNA silencing glycogen synthase kinase-3 beta inhibits tumor growth and angiogenesis in pancreatic cancer[J]. Cancer Lett, 2012, 316 (2):178-186.
[12]刘 欢, 郭 澍, 唐明睿, 等. GSK-3β在病理性瘢痕中的表达和意义[J]. 中国美容整形外科杂志, 2012, 5(23):318-320.
[13]Jacobs KM, Bhave SR, Frraro DJ, et al. GSK-3β: a bifunctional role in cell death pathways[J]. Int J Cell Biol, 2012, 2012:930710.
[14]Farago M, Dominguez I, Landesman-Bollag E, et al. Kinase-inactive glycogen synthase kinase 3β promotes Wnt signaling and mammary tumorigenesis[J]. Cancer Res, 2005, 65(13):5792-5801.
(责任编辑: 林白霜, 罗 森)
Effects of GSK-3β knockdown by RNA interference on formation of keloid in vitro
CAI Yu-mei1, ZHU Shi-ze2, YANG Wei-qun1, PAN Ming-meng2, WANG Chao-yang2, WU Wen-yi2
(1DepartmentofPathology,QuanzhouMedicalCollege,2DepartmentofOrthopedics,TheSecondAffiliatedHospitalofFujianMedicalUniversity,Quanzhou362000,China.E-mail:zhusz@fjmu.edu.cn)
AIM: To study the suppressive effect of glycogen synthase kinase-3β (GSK-3β) knockdown by RNA interference on the formation of keloid. METHODS: Human keloid fibroblasts (KFB)invitrowere transfected with 3 pairs of specificGSK-3βsmall interfering RNA (siRNA). The best siRNA to inhibit the GSK-3β expression in human KFB was screen by RT-PCR and Western blot. The expression of GSK-3β and related proteins at mRNA and protein levels in the KFB was determined by RT-PCR and Western blot.RESULTS: TheGSK-3βsiRNA1434 remarkably inhibited the expression of GSK-3β at mRNA and proteins levels in the human KFB. After transfection withGSK-3βsiRNA, the protein levels of β-catenin, p-GSK-3β, Wnt2 and cyclin D1 were all decreased. KFB growth became slow. With the extension of time, the inhibition of cell growth increased, and the cell doubling time was significantly delayed. CONCLUSION: siRNA targetingGSK-3βefficiently knocks down the expression ofGSK-3βin the human KFB, and inhibits the activation of Wnt signaling pathway, thus inhibiting the growth of keloid. GSK-3β may be a potential therapeutic target for keloid.
Glycogen synthase kinase-3β; Keloid; Fibroblasts; RNA interference
1000- 4718(2017)01- 0154- 07
2015- 11- 05
2016- 10- 14
福建省泉州市科技局重点资助科技项目(No. 2012Z70); 福建省医学创新课题(No. 2009-CX-21)
R363; R751
A
10.3969/j.issn.1000- 4718.2017.01.026
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0591-22862863; E-mail: zhusz@fjmu.edu.cn
