花生AhPLDα基因植物过表达载体构建及对拟南芥的遗传转化
2017-01-17刘义杰陈四龙程增书宋亚辉郝军会张朋娟李玉荣
刘义杰,陈四龙,程增书,王 瑾,宋亚辉,郝军会,张朋娟,李玉荣
(河北省农林科学院 粮油作物研究所,河北省作物遗传育种实验室,河北 石家庄 050035)
花生AhPLDα基因植物过表达载体构建
及对拟南芥的遗传转化
刘义杰,陈四龙,程增书,王 瑾,宋亚辉,郝军会,张朋娟,李玉荣
(河北省农林科学院 粮油作物研究所,河北省作物遗传育种实验室,河北 石家庄 050035)
为了明确花生AhPLDα基因在响应干旱胁迫信号传导中的功能和作用机制,以ABA处理的冀花4号花生叶片cDNA为模板,用RT-PCR方法扩增AhPLDα1和AhPLDα2的全长CDS片段,采用酶切-连接的方法分别将这2个基因定向克隆到植物表达载体pBar-F3上,冻融法将重组子转入根癌农杆菌GV3101,利用改良Floral-dip法将过表达质粒转入拟南芥。菌落PCR和酶切结果表明,CaMV35S启动子驱动的过表达载体重组质粒pBar-AhPLDα构建正确。通过RT-PCR和qRT-PCR验证,表明AhPLDα1和AhPLDα2基因整合到拟南芥基因组中并能过量表达,获得了阳性转基因纯合株系。干旱胁迫试验表明,转基因植株的耐旱性较野生型明显增强。可见,AhPLDα基因参与了干旱胁迫应答过程,是转基因途径提高作物耐旱性的潜在候选基因。
花生;AhPLDα基因;植物表达载体;转基因;干旱胁迫信号
花生(ArachishypogaeaL.)是一种重要的油料作物和经济作物,我国花生年均种植面积450万hm2以上,总产居世界首位,花生油年产量占国产植物油总量的23%[1-2]。目前国内食用油过度依赖进口,油脂供给安全问题凸显,花生在保障我国食用油供给安全、稳定国内油源方面,具有较大的潜力和优势。然而,在我国花生主产区,干旱[3]、盐渍、低温、病害等已成为花生产量和品质进一步提高的重要制约因素,严重阻碍了花生生产水平进一步提高和种植面积进一步扩大。我国花生集中种植在干旱半干旱的内陆及丘陵地区,70%以上受干旱威胁,每年因干旱减产达30%~50%,并导致花生品质劣变,油脂含量和品质下降,黄曲霉毒素污染加重[4-5],给消费者的健康带来巨大威胁。因此,花生品种抗旱改良已成为我国花生育种的重要目标之一。常规育种技术在培育、创制耐旱性花生品种和种质方面发挥了重要作用,但是,近年来随着作物功能基因组学的发展,基因工程技术定向培育抗性优良的新品种成为提高作物抗旱耐逆性的新途径。经过多年努力,目前研究者克隆了几个花生抗旱相关的功能基因,但是具有明显生物学功能的关键基因数量仍显不足,且缺乏有效的植物表达载体,限制了转基因技术在提高花生抗旱性中的快速应用。所以,克隆花生抗旱相关基因并构建植物表达载体实现对植物受体的遗传转化,将对增强花生品种抗旱能力、提高花生产量和品质、保障国家食用植物油安全等具有重要意义。
磷脂酶D(Phospholipase D,PLD)是一类重要的跨膜信号转导酶,可水解磷脂,产生磷脂酸、三磷酸肌醇、胆碱、乙醇胺和二酰基甘油等信号分子,参与细胞的信号转导过程,因此PLD是一种既具有水解作用又具有信号传递作用的双重功能酶[6]。PLD编码基因属于多基因家族,拟南芥中已经确认12个PLD家族成员,其中包含已鉴定的3个含C2结构域的PLDα基因[7-8],相对于其他PLD成员,PLDα在植物中存在最为广泛[9],并在植物生长与发育、抗逆及激素反应等生理过程中起重要作用,此外PLDα基因表达与逆境胁迫信号转导过程密切相关。植物在逆境环境中,PLDα可导致脱落酸(ABA)、茉莉酸(JA)、乙烯(ETH)等与胁迫有关的植物激素的产生,从而引起植物对各种生物或非生物胁迫做出一系列生理生化反应[10]。大量研究已表明,PLDα参与了ABA诱导的拟南芥植株衰老过程、ABA诱导的气孔关闭过程[11-12]。Welti等[13]研究发现,PLDα基因被反义抑制后,转基因植株的耐低温能力较野生型明显提高。曾正兵等[14]也指出PLDα基因参与拟南芥的低温驯化过程,不参与ABA诱导的抗冻性过程。Sang等[15]发现拟南芥PLDα基因抑制突变体的抗旱性比野生型显著降低,且离体叶片失水速率明显提高,指出PLDα被抑制后,气孔对ABA的敏感性降低,所以蒸腾失水速率增加,抗旱性下降。水稻受到白叶枯病原菌侵染时,在病菌与植物接触的部位聚集了大量且有活性的PLDα蛋白,抗病品种尤为显著[16]。拟南芥PLD基因家族在响应生物和非生物胁迫中的生物学功能被揭示以来,为作物PLD基因功能研究与利用提供了借鉴。PLDα在植物响应生物胁迫和非生物胁迫中发挥重要作用,是分子育种提高植物抗性的潜在候选基因。近年来,国内外学者对大豆[17-18]、蓖麻[19]、豇豆[20]、谷子[21]、小麦[22]、油菜[23]、水稻[24]等作物的PLD基因家族的生物学功能已开展了大量研究。
花生是一种耐旱性强的作物,花生来源的干旱胁迫相关基因的克隆和功能研究鲜见报道,对于花生PLD基因的生物学功能更知之甚少。Nakazawa等[25]于2006年从花生中克隆到AhPLD1和AhPLD2的全长cDNA。之后,Guo等[26]和Dramé等[27]分别对这2个基因的序列和干旱诱导差异表达做了一定的分析,并未明确它们的生物学功能。本研究依据已获得的AhPLD1和AhPLD2全长cDNA[25],设计带有酶切位点的特异引物,克隆了这2个基因的全长cDNA序列,构建了由CaMV35S启动子驱动的植物过表达载体,遗传转化拟南芥,获得了阳性转基因植株,并进行了初步抗旱性鉴定,为进一步揭示基因的生物学功能奠定基础,为分子育种途径利用AhPLDα基因提高花生等作物的抗旱性提供技术支撑。
1 材料和方法
1.1 试验材料
哥伦比亚型拟南芥(Arabidopsisthaliana)、花生品种冀花4号由河北省作物遗传育种实验室保存。
pEASY-T1克隆试剂盒和Trans1-T1感受态细胞购自北京全式金生物技术有限公司。农杆菌空菌株GV3101和植物过表达载体pBar-F3为本实验室保存。
植物总RNA提取试剂盒、反转录试剂盒、质粒DNA提取试剂盒和DNA凝胶回收试剂盒等购自天根生化科技有限公司。TaqDNA聚合酶购自北京康为世纪生物科技有限公司。T4连接酶、限制性内切酶EcoR Ⅰ和XbaⅠ购自TaKaRa公司。其他化学药品为国产分析纯。
1.2 花生处理及取样
选取大小一致的冀花4号花生种子,75%酒精消毒5 min,灭菌水冲洗3次,于灭菌滤纸上晾干。将干种子播种于营养土∶蛭石=1∶1的混合基质中,在人工气候室中25 ℃,12 h光照,60%湿度培养。待幼苗出土20 d后,用100 μmol/L的ABA溶液进行喷雾直至叶片全部湿润,并分别于0,24,48,72 h采集叶片,液氮速冻,-80 ℃保存备用。
1.3 拟南芥培养及处理
将拟南芥种子均匀播撒在营养土∶蛭石=1∶1的混合基质中,用保鲜膜覆盖,4 ℃黑暗层积处理2~4 d,转移到人工气候室中(光周期昼/夜为17 h/7 h,22 ℃恒温,65%恒湿)培养。待幼苗出土后(5 d左右)去掉保鲜膜,继续培养14 d后移苗。
移苗用基质(生长基质)也为营养土∶蛭石=1∶1的混合基质,将基质分装入花盆,再将花盆放入有水的塑料盘中,水通过花盆底部的小孔渗入,待花盆中基质湿透后即可移苗。轻轻用镊子从育苗基质中拉出小苗,再将根轻压入花盆中,塑料薄膜覆盖,黑暗培养3 d,之后正常培养。取生长28 d的幼苗,干旱处理前5 d停止浇水,之后分开放置,干旱处理21 d,观察幼苗生长情况。
1.4 DNA及RNA提取
在拟南芥开花前,取拟南芥莲座幼叶组织,在液氮中速冻,-80 ℃保存。采用CTAB法提取叶片DNA,总RNA的提取参照天根生化公司的植物总RNA提取试剂盒说明书。
1.5 基因片段克隆
提取ABA处理的不同时间段花生叶片的总RNA,参照天根生化公司反转录试剂盒说明书合成cDNA第一条链。以得到的cDNA为模板,根据Nakazawa等[25]从花生中克隆到的AhPLD1和AhPLD2的全长cDNA序列设计带有不同酶切位点的特异引物(表1),分别扩增出AhPLDα1和AhPLDα2基因的cDNA全长。所用反应程序为:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸2 min 30 s,共30个循环;72 ℃延伸10 min。20 μL反应体系:2×PCR Mix 10 μL,上下游引物各1 μL,模板1 μL,其余用ddH2O补足。
利用琼脂糖凝胶电泳回收试剂盒回收PCR产物,连接至pEASY-T1载体,热激法转化大肠杆菌感受态细胞,经蓝白斑筛选,挑取阳性克隆送北京六合华大基因科技股份有限公司测序。测序结果用Blast在线工具与已知序列比对分析。

表1 引物名称与序列Tab.1 List of primers and sequences
注:上游引物的划线部分为EcoR Ⅰ酶切位点;下游引物的划线部分为XbaⅠ酶切位点。
Note:The underline of upstream primers isEcoR Ⅰ cutting site;The underline of downstream primers isXbaⅠ cutting site.
1.6 过表达载体构建及鉴定
以EcoR Ⅰ和XbaⅠ分别双酶切AhPLDα1和AhPLDα2基因,回收酶切产物后分别与相同酶切的pBar-F3用T4连接酶连接,转化大肠杆菌感受态细胞,提取质粒,酶切鉴定阳性克隆,并送北京六合华大基因科技股份有限公司测序,阳性重组子分别命名为pBar-AhPLDα1和pBar-AhPLDα2。
1.7 拟南芥遗传转化
采用冻融法将植物过表达重组子导入农杆菌菌株GV3101,挑选验证得阳性重组农杆菌单菌落,保存。在200 mL LB培养基中(含100 mg/L卡那霉素和50 mg/L利福平)加200 μL保存菌液,28 ℃,200 r/min培养2 d,取活化菌液1 mL加入200 mL新鲜LB培养基中摇培过夜,至OD600为1.0~1.5。室温4 000 r/min离心15 min,弃上清。加入农杆菌浸染法培养液重悬,至其OD600≈0.8。浸染法培养液配制为5%蔗糖加0.05% Silwet L77。采用改良的Floral-dip方法转化拟南芥,收获T0种子,37 ℃干燥,于4 ℃保存备用。
1.8 转基因拟南芥筛选与鉴定
将转基因拟南芥和野生型拟南芥种子分别均匀播撒在营养土∶蛭石=1∶1的混合基质中育苗。待幼苗出土约21 d后喷洒30 mg/L草胺膦除草剂Basta,使拟南芥幼苗叶片全部润湿,隔6~7 d后再喷一次筛选,野生型的拟南芥作对照。选择绿色的、健壮的幼苗移栽。采集不同转基因苗的叶片和野生型拟南芥的叶片提取DNA,PCR检测(所用引物、程序等与基因扩增时一致)再次筛选,单株收获阳性幼苗的种子。T1转基因拟南芥经进一步抗性筛选,选择抗感分离比例符合3∶1的株系,单株移苗,单株收种,种子记为T2。T2抗性筛选不再分离的株系即为纯合转基因株系,可用于后续试验。
采集纯合转基因株系和野生型株系的叶片,提取总RNA,反转录获得cDNA。以AtActin7为内标基因,获得的cDNA为模板,设计基因特异引物(表1),利用BIO-RAD IQ5.0实时定量PCR仪检测AhPLDα1和AhPLDα2基因的相对表达量,每个生物学样品重复3次。按照SuperReal PreMix Plus(SYBR Green)试剂盒说明书操作,反应体系为20 μL,热启动程序为95 ℃ 15 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,40个循环;72 ℃ 10 min。采用2-ΔΔCt方法计算目标基因的相对表达量。
2 结果与分析
2.1 花生和拟南芥总RNA提取与检测
本试验采用天根生化公司的植物总RNA提取试剂盒提取花生叶片和拟南芥叶片的总RNA,其中28S rRNA条带的亮度大约为18S rRNA的2倍,说明总RNA具有良好的完整性。经NARODROP-2000的分光检测,OD260/280约为2.0,说明RNA的纯度满足后续试验要求。
2.2 目的基因片段的克隆与分析
以ABA处理的花生叶片总RNA反转录的混合cDNA为模板,分别以带有酶切位点EcoR Ⅰ和XbaⅠ的AhPLDα1和AhPLDα2的特异引物(表1)扩增基因片段,获得AhPLDα1和AhPLDα2的目的片段(图1)。将目的片段分别回收后克隆到pEASY-T1载体进行测序验证。测序结果表明,AhPLDα1和AhPLDα2基因序列的编码区与NCBI公布的序列一致,AhPLDα1的cDNA序列全长为2 385 bp,编码795个氨基酸;AhPLDα2的cDNA全长序列为2 424 bp,编码808个氨基酸(图2)。分析结果表明克隆的片段正确,可用于下一步试验。
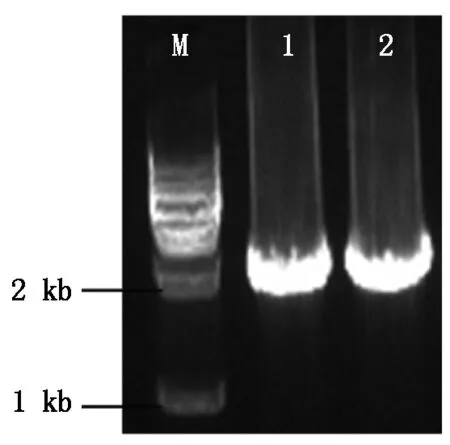
M.1 kb Marker;1.AhPLDα1的扩增产物;2.AhPLDα2的扩增产物。M.1 kb Marker;1.Product of AhPLDα1;2.Product of AhPLDα2.

图2 AhPLDα1和AhPLDα2的cDNA序列图谱Fig.2 cDNA sequences of AhPLDα1 and AhPLDα2
2.3 植物过表达载体的构建与验证
用EcoR Ⅰ和XbaⅠ分别双酶切AhPLDα1和AhPLDα2基因,以及植物过表达载体pBar-F3,回收产物用T4连接酶连接转化,获得融合质粒,转化大肠杆菌感受态细胞,挑选单菌落进行PCR验证和质粒酶切验证(图3),能获得预期的约2 400 bp的目的片段。质粒测序结果表明,AhPLDα1和AhPLDα2均正向插入到CaMV35S启动子的下游,且不存在移码突变,证明植物过表达载体构建成功,分别命名为pBar-AhPLDα1和pBar-AhPLDα2(图4)。

M.1 kb DNA Ladder;1~4依次为pBar-AhPLDα1菌落PCR、质粒PCR、酶切、质粒;5~8依次为pBar-AhPLDα2菌落PCR、质粒PCR、酶切、质粒。
M.1 kb DNA Ladder;1-4.Colony PCR,plasmid PCR,restriction endonucleases digestion,plasmid of recombinant plasmid pBar-AhPLDα1;5-8.Colony PCR,plasmid PCR,restriction endonucleases digestion,plasmid of recombinant plasmid,pBar-AhPLDα2.
图3 pBar-AhPLDα菌落PCR验证和质粒酶切验证
Fig.3 Identification of recombinant plasmid pBar-AhPLDα1 and pBar-AhPLDα2 by colony PCR and restriction endonucleases digestion

图4 重组植物过表达载体结构示意图Fig.4 Schematic diagram of recombinant plant expression vector construct
2.4 纯合转基因拟南芥株系的获得及检测
利用改良的Floral-dip法遗传转化野生型拟南芥,获得T0转基因种子。Basta除草剂筛选获得T1阳性植株(图5),移栽后开花前取拟南芥叶片提取DNA进行PCR检测(图6),由凝胶电泳图可看出,图6-A、C在2 000 bp以上均获得了目的基因片段大小的特异条带,表明2个目的基因已成功整合到拟南芥基因组中。图6-B、D在500bp的位置能扩增出Bar基因的特异条带,进一步说明重组植物过表达载体成功转化拟南芥。
2.5 转基因植株qRT-PCR检测
为了进一步证实花生AhPLDα1和AhPLDα2基因在拟南芥中是否过量表达,提取T2转基因纯合株系和野生型拟南芥的叶片总RNA,采用qRT-PCR方法从转录水平进行验证。图7-A、B分别为AhPLDα1和AhPLDα2基因在拟南芥叶片中的表达情况,结果表明目标基因在野生型对照中均无表达,而转基因植株中目的基因均高水平表达,但不同转基因株系在表达水平上存在差异。

WT.喷除草剂7 d后的野生型幼苗;1.AhPLDα1转基因植株;2.AhPLDα2转基因植株。WT.Wild type of herbicide spraying after 7 days; 1.AhPLDα1 transformants;2.AhPLDα2 transformants.

A、C图中M.1 kb DNA Ladder;B、D图中M.DL2000 DNA Ladder;A、B中1~10.AhPLDα1转基因植株;11.阳性对照;12.阴性对照;C、D中1~4.AhPLDα2转基因植株;5.阳性对照;6.阴性对照。
M in A and C.1 kb DNA Ladder;M in B and D.DL2000 DNA Ladder;1-10 in A and B.T1transformants of pBar-AhPLDα1;11.Positive control;12.Negative control;1-4 in C and D.T1transformants of pBar-AhPLDα2;5.Positive control;6.Negative control.
图6 T1拟南芥抗性植株转化子的PCR鉴定Fig.6 PCR identification of T1transformants inArabidopsis

图7 AhPLDα转基因植株的实时定量表达分析Fig.7 Detection of gene expression in transgenic AhPLDα lines and wild-type Arabidopsis
2.6 转基因植株抗旱性增强
为了解AhPLDα1和AhPLDα2基因过表达对植物抗旱能力的影响,对正常生长28 d的拟南芥幼苗进行干旱处理,停止浇水21 d后野生型植株叶片干枯,全部萎蔫死亡,而转基因株系生长正常,受干旱胁迫的影响较小,叶片仍然保持绿色(图8),说明AhPLDα1和AhPLDα2基因过表达提高了转基因植株的抗旱性。

A.干旱处理的AhPLDα1转基因植株和野生型植株(WT);B.干旱处理的AhPLDα2转基因植株和野生型植株(WT)。A.AhPLDα1 transgenic plants and wild-type plants;B.AhPLDα2 transgenic plants and wild-type plants.
3 讨论与结论
有活性的植物PLD酶最早由Hanahan和Chaikoff从胡萝卜和白菜叶的提取物中发现[28]。Kansas州立大学的王学敏教授首次从蓖麻种子中克隆得到PLD基因的cDNA[28],此后相继从拟南芥[29]、水稻[30-31]、玉米[30]、烟草[32]、番茄[33]等8种作物中分离克隆到15个不同的PLD基因。在花生中,Heller等[34]首次发现和提取了种子中的PLD酶。Nakazawa等[25]于2006年从花生中克隆到AhPLD1和AhPLD2的全长cDNA。之后,Guo等[26]和Dramé等[27]分别对这2个基因做了一定的研究,但并未明确它们的生物学功能。因此,本试验在克隆获得的AhPLDα1和AhPLDα2基因的基础上,构建植物过表达载体,遗传转化拟南芥,为后续基因功能验证提供了良好的材料和技术支撑。
在众多的PLD基因中,PLDα在植物中分布最为广泛,并广泛参与植物响应生物胁迫和非生物胁迫过程。拟南芥AtPLDα1的缺失体表现为ABA诱导的气孔关闭不敏感,抗旱性弱[11-12]。在拟南芥中过表达小麦TaPLDα[22]和谷子SiPLDα[21]均能提高转基因植株的抗旱性,干旱条件下转基因植株叶片的相对含水量增加,离子电导率降低,复水后成活率提高,种子萌发阶段对选择压的敏感性增强,而且植物干旱胁迫响应信号转导通路上的关键基因转录水平被不同程度地上调。本试验中,拟南芥中过表达AhPLDα1和AhPLDα2基因,转基因植株的耐旱性明显增强,充分表明花生来源的PLDα同源基因在提高植物抗旱性方面发挥着重要作用。转基因植株抗旱性反应与体内干旱胁迫响应相关的生理生化代谢过程密切相关,如叶片失水速率、气孔开闭、丙二醛含量、脯氨酸含量等;也与干旱信号转导通路上的关键基因受AhPLDα1和AhPLDα2调节有直接关系,如RDs、CORs、HISs、RAB18、DREBs、P5CS1、ABIs等胁迫效应基因。以上两方面指标需要在本试验基础上进行深入研究,以进一步揭示AhPLDα1和AhPLDα2基因的作用机制。花生AhPLDα1和AhPLDα2基因在干旱胁迫响应中的功能和作用机制的阐明,将为提高逆境胁迫下花生等油料作物的产量和品质奠定坚实的基础,具有重要的理论意义和应用价值。
本试验使用的植物过表达载体pBar-F3以Binary vector pCAMBIA-1301为骨架,用Bar基因替换原骨架上的潮霉素抗性基因HYG(Hygromycin phosphotransferase),可使转基因植株获得对除草剂的抗性,以此作为转基因植株的筛选标记,方便筛选转基因后代阳性植株;在pBar-F3载体上保留有卡那霉素抗性基因Kan,可在细菌寄主中进行抗性筛选;多克隆位点前有CaMV35S启动子。已有的研究结果表明,拟南芥AtPLDα1缺失会使植物应答干旱胁迫过程中的气孔闭合受阻,导致植株抗干旱能力明显低于野生型[11]。烟草组成型过表达AtPLDα1仅在干旱胁迫初期表现较强的耐旱性,后期的抗旱性较野生型明显降低[19]。本试验构建的植物过表达载体,pBar-F3的启动子是组成型强启动子CaMV35S,在该启动子的控制下,外源基因可不受植株的发育阶段和器官差异的影响,在任何阶段和器官中都可稳定表达[35]。本试验T2纯合转基因拟南芥的AhPLDα1和AhPLDα2基因均能在叶片中转录,但是表达水平上存在一定差异,推测这可能是由于目标基因插入拟南芥基因组的位点不同造成的。有研究指出,CaMV35S启动子可能会抑制受体植株该类型启动子基因的表达,对转基因植株的生长发育产生不利影响[36-37]。因此,在后续试验中还要观察转基因植株的生长发育过程。pBar-F3载体含有Kan和Bar筛选基因,转化受体植物后可获得具有双重筛选标记的转基因材料,为后期筛选提供了方便。
克隆获得了花生AhPLDα1和AhPLDα2的全长CDS片段,成功构建了过表达载体重组质粒pBar-AhPLDα1和pBar-AhPLDα2,遗传转化拟南芥,获得AhPLDα1和AhPLDα2基因过表达的纯合转基因株系。转基因植株的耐旱性较野生型明显增强,推测AhPLDα1和AhPLDα2基因与植物的干旱胁迫信号转导有密切关系。
[1] 廖伯寿,雷 永,王圣玉,等.花生重组近交系群体的遗传变异与高油种质的创新[J].作物学报,2008,34(6):999-1004.
[2] 许 燕,张绍龙.我国高油酸花生育种研究进展[J].广东农业科学,2011,38(1):43-45.
[3] Jacqueline Wanessa de Lima Pereira,Manoel Bandeira Albuquerque,Péricles Albuquerque Melo Fiho,et al.Assessment of drought tolerance of peanut cultivars based on physiological and yield traits in a semiarid environment [J].Agricultural Water Management,2016,166(4):70-76.
[4] Singer S D,Zou J T,Weselake R J.Abiotic factors influence plant storage lipid accumulation and composition[J].Plant Science,2016,243:1-9.
[5] Guo Y,Abernathy B,Zeng Y,et al.TILLING by sequencing to identify induced mutations in stress resistance genes of peanut(Arachishypogaea) [J].BMC Genomics,2015,16(1):1-13.
[6] Johansson O N,Fahlberg P,Karimi E,et al.Redundancy among phospholipase D isoforms in resistance triggered by recognition of thePseudomonassyringaeeffector AvrRpm1 inArabidopsisthaliana[J].Frontiers in Plant Science,2014,5:639.
[7] Li S Z,Huang M L,Di Q H,et al.The functions of a cucumberphospholipaseDalphagene (CsPLDα) in growth and tolerance to hyperosmotic stress[J].Plant Physiology and Biochemistry,2015,97:175-186.
[8] Distéfano A M,Valias M A,Scuffi D,et al.Phospholipase D δ knock-out mutants are tolerant to severe drought stress[J].Plant Signaling & Behavior,2015,10(11):e1089371.
[9] Anastasia K,Ilias K,Athanasios T,et al.Cold acclimation and low temperature resistance in cotton:Gossypiumhirsutumphoapholipase Dα isoforms are differentially regulated by temperature and light [J].Journal of Experimental Botany,2010,61(11):2991-3002.
[10] Song Y P,Du D L,Chu M,et al.Cloning and characterization of a cucumber phospholipase D gene in response to excess nitrate and otherabiotic stresses [J].Scientia Horticulturae,2012,135:128-136.
[11] Sang Y,Zheng S,Li W,et al.Regulation of plant water loss by manipulating the expression of phospholipase Dα[J].The Plant Journal:for Cell and Molecular Biology,2001,28(2):135-144.
[12] Zhang W H,Qin C B,Zhao J,et al.Phospholipase Dα 1-derived phosphatidic acid interacts with ABI1 phosphatase 2C and regulates abscisic acid signaling[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(25):9508-9513.
[13] Welti R,Li W,Li M,et al.Profiling membrane lipids in plant stress responses.Role of phospholipase Dα in freezing-induced lipid changes inArabidopsis[J].The Journal of Biological Chemistry,2002,277(35):31994-32002.
[14] 曾正兵,梅旭荣,钟秀丽,等.磷脂酶Dα在拟南芥低温驯化过程中的作用途径分析[J].基因组学与应用生物学,2009,28(4):703-708.
[15] Sang Y,Cui D,Wang X.Phospholipase D and phosphatidic acid-mediated generation of superoxide inArabidopsis[J].Plant Physiology,2001,126(4):1449-1458.
[16] Young S A,Wang X,Leach J E.Changes in the plasma membrane distribution of rice phospholipase D during resistant interactions withXanthomonasoryzaepvoryzae[J].The Plant Cell,1996,8(6):1079-1090.
[17] Lee J,Welti R,Schapaugh W T,et al.Phospholipid and triacylglycerol profiles modified byPLDsuppression in soybean seed[J].Plant Biotechnology Journal,2011,9(3):359-372.
[18] Lee J,Welti R,Roth M,et al.Enhanced seed viability and lipid compositional changes during natural ageing by suppressing phospholipase Dα in soybean seed[J].Plant Biotechnology Journal,2012,10(2):164-173.
[19] Hong Y,Zheng S,Wang X.Dual functions of phospholipase Dα1 in plant response to drought[J].Molecular Plant,2008,1(2):262-269.
[20] El Maarouf H,Zuily-Fodil Y,Gareil M,et al.Enzymatic activity and gene expression under water stress of phospholipase D in two cultivars ofVignaunguiculataL.Walp.differing in drought tolerance[J].Plant Molecular Biology,1999,39(6):1257-1265.
[21] Peng Y,Zhang J,Cao G,et al.Overexpression of aPLDα1 gene fromSetariaitalicaenhances the sensitivity ofArabidopsisto abscisic acid and improves its drought tolerance[J].Plant Cell Reports,2010,29(7):793-802.
[22] Wang J,Ding B,Guo Y,et al.Overexpression of a wheat phospholipase D gene,TaPLDα,enhances tolerance to drought and osmotic stress inArabidopsisthaliana[J].Planta,2014,240(1):103-115.
[23] Lu S,Bahn S C,Qu G,et al.Increased expression of phospholipase Dα1 in guard cells decreases water loss with improved seed production under drought inBrassicanapus[J].Plant Biotechnology Journal,2013,11(3):380-389.
[24] Shen P,Wang R,Jing W,et al.Rice phospholipase Dα is involved in salt tolerance by the mediation of H(+)-ATPase activity and transcription[J].Journal of Integrative Plant Biology,2011,53(4):289-299.
[25] Nakazawa Y,Sato H,Uchino M,et al.Purification,characterization and cloning of phospholipase D from peanut seeds[J].The Protein Journal,2006,25(3):212-223.
[26] Guo B Z,Xu G,Cao Y G,et al.Identification and characterization of phospholipase D and its association with drought susceptibilities in peanut(Arachishypogaea) [J].Planta,2006,223(3):512-520.
[27] Dramé K N,Clavel D,Repellin A,et al.Water deficit induces variation in expression of stress-responsive genes in two peanut(ArachishypogaeaL.) cultivars with different tolerance to drought[J].Plant Physiology and Biochemistry,2007,45(3/4):236-243.
[28] Wang X,Guo L,Wang G,et al.PLD:phospholipase Ds in plant signaling[J].Phospholipases in Plant Signaling,2014,20:3-26.
[29] Qin W,Pappan K,Wang X.Molecular heterogeneity of phospholipase D(PLD).Cloning of PLD grmma and regulation of plant PLD γ,β and α by polyphosphoinositides and calcium[J].The Journal of Biological Chemistry,1997,272(45):28267-28273.
[30] Ueki J,Morioka S,Komari T,et al.Purification and characterization of phospholipase D(PLD) from rice(OryzasativaL.) and cloning of cDNA for PLD from rice and maize(ZeamaysL.) [J].Plant & Cell Physiology,1995,36(5):903-914.
[31] Morioka S,Ueki J,Komari T.Characterization of two distinctive genomic clones(accession nos.AB001919 and AB001920) for phospholipase D from rice(PGR 97-076) [J].Plant Physiology,1997,114:396.
[32] Lein W,Saalbach G.Cloning and direct G-protein regulation of phospholipase D from tobacco[J].Biochimica et Biophysica Acta,2001,1530(2/3):172-183.
[33] Whitaker B D,Smith D L,Green K C.Cloning,characterization and functional expression of a phospholipase Dα cDNA from tomato fruit[J].Physiologia Plantarum,2001,112(1):87-94.
[34] Heller M,Arad R.Properties of the phospholipase D from peanut seeds[J].Biochimica et Biophysica Acta,1970,210(2):276-286.
[35] Singh N P,Mccoy M T,Tice R R,et al.A simple technique for quantitation of low levels of DNA damage in individual cells[J].Experimental Cell Research,1988,175(1):184-191.
[36] 刘正杰,张 园,王彦霞,等.陆地棉异质性ACCase基因的种子特异表达载体构建与遗传转化[J].分子植株育种,2011,9(3):270-277.
[37] 赵欢欢,吴 兴,张 锋,等.拟南芥AtLACS9基因的克隆及其植物表达载体构建[J].大豆科学,2011,30(2):190-193.
Vector Construction to Overexpress AhPLDα Genes from Peanut and Genetic Transformation into Arabidopsis thaliana
LIU Yijie,CHEN Silong,CHENG Zengshu,WANG Jin,SONG Yahui,HAO Junhui,ZHANG Pengjuan,LI Yurong
(Cereal and Oil Crops Institute,Hebei Academy of Agriculture and Forestry Sciences, Hebei Provincial Laboratory of Crop Genetics and Breeding,Shijiazhuang 050035,China)
This study provides a good foundation for further elucidating the function and mechanism ofAhPLDα1 andAhPLDα2 in responding to drought stress in peanut.The full-length CDS sequences ofAhPLDα1 andAhPLDα2 were cloned from Jihua 4 peanut leaf with ABA treatment using RT-PCR.TheAhPLDα1 andAhPLDα2 gene fragments were inserted into the expression vector pBar-F3 by forward ways.These constructs were transformed intoAgrobacteriumtumefaciensGV3101 by freeze-thawing method and then introduced into wild-typeArabidopsisthalianausing modified floral-dip method.Under the condition of drought,the authors observed phenotypic changes of wild type and transgenic plants.Colony PCR and enzyme digestion results showed that,the plant overexpressing recombinant plasmid pBar-AhPLDαdriven by CaMV35S promoter was successfully constructed.Glyphosate resistance screening,PCR detection and gene expression analysis showed that the positive transgenic plants were obtained.Under water deprivation,overexpression ofAhPLDα1 andAhPLDα2 in transgenicArabidopsisplants resulted in significantly enhanced tolerance to drought stress.In conclusion,AhPLDα1 andAhPLDα2 have a certain relation with drought stress signal transduction in transgenicArabidopsisplants,and are potential candidate genes on the way to modified crop drought resistance.
Peanut;AhPLDαgene;Plant expression vector;Transgene;Drought stress signaling
2016-07-13
国家自然科学基金项目(31201239;31301354);河北省重点基础研究项目(10960122D);河北省博士基金项目(F14E055610);现代农业产业技术体系建设专项资金(CARS-14)
刘义杰(1988-),女,河北石家庄人,硕士,主要从事花生分子生物学研究。
陈四龙(1978-),男,河北定州人,副研究员,博士,主要从事花生遗传育种和栽培研究。 李玉荣(1956-),女,河北涞水人,研究员,主要从事花生遗传育种和栽培研究。
S332.4;Q78
A
1000-7091(2016)06-0031-08
10.7668/hbnxb.2016.06.006
