甘蓝型油菜异三聚体G蛋白原生质体瞬时表达体系的建立
2017-01-17于一帆潘淑芬葛会敏刘立军
陈 云,于一帆,潘淑芬,周 研,葛会敏,刘立军
(扬州大学 江苏省作物遗传生理重点实验室,江苏 扬州 225009)
甘蓝型油菜异三聚体G蛋白原生质体瞬时表达体系的建立
陈 云,于一帆,潘淑芬,周 研,葛会敏,刘立军
(扬州大学 江苏省作物遗传生理重点实验室,江苏 扬州 225009)
为建立甘蓝型油菜异三聚体G蛋白各组分原生质体瞬时表达体系,以油菜叶片为试材,从试材选取、平摇时间和聚乙二醇浓度方面优化了油菜原生质体制备条件和转化条件。结果表明,选取30 d苗龄叶片、平摇10 min时原生质体游离状态最佳,产量为10.73×106/mL,活力可达96.4%。采用30% PEG转化原生质体时,目的蛋白表达量最高。 Western Bolt的检测分析表明,异三聚体G蛋白各组分均参与了甘蓝型油菜对ABA的应答反应,当ABA浓度分别为100,150,100,50 mmol/L时,BnGA1、BnGB1、BnGG2和BnRGS1蛋白的表达量最高。
油菜;原生质体瞬时表达;异三聚体G蛋白
异三聚体G蛋白(简称G蛋白)介导的信号转导途径是真核生物最为保守的信号转导途径之一。G蛋白包括3个亚基(Gα、Gβ和Gγ)以及1个G蛋白调节蛋白(RGS蛋白)。目前,已经在拟南芥、水稻、玉米、大豆、油菜等十几种植物中发现了G蛋白。在模式植物拟南芥和水稻中的研究表明,G蛋白参与了植物生长发育的诸多过程,包括种子萌发、侧根和顶端钩形成、下胚轴生长、叶片伸展,在植物响应生物和非生胁迫中起着十分重要的调节作用[1-2]。Gao等[3-5]于2010年先后在甘蓝型油菜中分离和鉴定出了G蛋白的α亚基、β亚基和γ亚基,江苏省作物遗传生理重点实验室于2013年鉴定出了BnRGS1蛋白[6]。通过分析G蛋白组分在不同生长时期的表达特征,以及外源激素处理后G蛋白表达的变化,发现G蛋白在不同组织器官和不同生长时期表达均有差异,各个亚基在响应激素信号时其表达水平有差异,但有关G蛋白参与这些途径的作用机制缺乏深入研究。本试验在前期已经克隆得到G蛋白相关基因及获得相应抗体的工作基础上,优化了油菜原生质体分离方法,建立了G蛋白组分的原生质体瞬时表达体系,并应用以上体系,采用Western Blot检测方法,初步分析了G蛋白对脱落酸(ABA)的响应。以期为进一步深入阐明G蛋白在油菜中的生理功能提供理论和实践依据。
1 材料和方法
1.1 试验材料
供试植物材料为甘蓝型油菜(Brassicanapus)扬油6号,种子经4 ℃春化48 h后,播种于土壤中,置于恒温23 ℃、光照/黑暗 16 h/8 h的培养箱中生长,选取生长一定叶龄的油菜叶片作为提取原生质体的外植体材料。转化用G蛋白组分基因(BnGA1、BnGB1、BnGG2和BnRGS1)重组质粒为江苏省作物遗传生理重点实验室构建留存。
1.2 试验方法
1.2.1 油菜原生质体的提取和转化 取40~50株植株,将其完全展开的叶片切成0.5~1.0 mm的小段,置于预处理液中,预培养20 min后,置于30 mL酶解液(0.25%纤维素酶,0.05%离析酶,0.6 mol/L甘露醇)中,25 ℃黑暗培养16 h,在水平摇床上40 r/min平摇以释放原生质体。收集原生质体,用10 mL Wash溶液(0.154 mol/L NaCl,0.125 mol/L CaCl2·2H2O,0.005 mol/L KCl,0.005 mol/L葡萄糖,pH值 5.8)洗涤,1 000 r/min离心5 min沉淀原生质体。用10 mL预冷的Wash溶液重悬原生质体,冰浴30 min,1 000 r/min离心5 min。最后用500 μL MMG溶液(10.93% 甘露醇,0.304% MgCl2,4% MES)重悬原生质体。使用血球计数板进行计数。
将20 μg DNA,200 μL原生质体,200 μL PEG/Ca2+溶液(9.1% 甘露醇,10% CaCl2,30% PEG 4000)轻轻混匀,室温放置15 min。用W5溶液(154 mmol/L NaCl,125 mmol/L CaCl2,5 mmol/L KCl,2 mmol/L MES,pH值5.7)洗过后重悬于预先用5%牛血清白蛋白包被过的含200 μL WI溶液(0.5 mol/L 甘露醇,4 mmol/L MES-KOH,pH值5.7,20 mmol/L KCl)的12孔板中,室温温育2 h以使质粒转化。
1.2.2 原生质体产量和活力测定 用W5溶液将纯化的原生质悬浮液稀释至一定倍数,取10 μL滴在0.1 mm 血球计数板上,在10倍物镜下观察和统计原生质体的数量,重复3次。每毫升原生质体数量=4个大方格中细胞数之和×2 500×稀释倍数。
取10 μL纯化的原生质体与10 μL 0.02% FDA(荧光素双醋酸)慢慢混匀,室温静置10 min,在ZEISS倒置荧光显微镜下检查原生质体活力。制备良好,具有活力的原生质体呈圆形,发黄绿色荧光。统计每一视野中原生质体总数和具有活性的原生质体数,重复观察20个视野。原生质体活力=发黄绿色荧光的原生质体数/总原生质体数×100%。
1.2.3 Western Blot 检测蛋白表达量 收集原生质体加入蛋白提取液(1 mL PBS,20 μL广谱蛋白酶抑制剂,10 μL PMSF,1 μL DTT),4 ℃涡旋振荡30 min,用BCA法测定蛋白质浓度。SDS-PAGE分离后,经转膜、封闭、洗膜、杂交、洗膜、显色后观察条带。油菜异三聚体G蛋白各组分蛋白抗体为本实验室留存(制备方法:克隆目的基因的全长序列,转入大肠杆菌DH5α,培养后提取质粒,交由北京华大蛋白质研发中心有限公司制备抗体)。
2 结果与分析
2.1 油菜原生质体制备体系的优化
根据已经报道的拟南芥[7-8]和油菜[9-11]原生质体分离方法,制备获得了活力为70%的原生质体。为了进一步提高原生质体活力和产量。本试验探讨了材料选取和平摇时间对原生质体提取的影响。
2.1.1 不同苗龄油菜叶片对原生质体产量的影响 原生质体的产量和活力受很多因素的影响,其中苗龄很重要。选取的材料从7 d的幼苗或下胚轴到30 d的叶片都有过报道,相对应的依据也不尽相同,有的认为选取幼嫩的组织细胞更容易破碎,原生质体更易释放,有的则认为以苗龄更大一些的叶片为试材提取原生质体不易破碎[12-14]。本试验就试材选取的时期做了如下对比:
在保持酶解条件一致的前提下,选取土培20 d的扇形叶片(图1-A)作为材料提取原生质体,原生质体释放不完全,大量原生质体仍然积聚在叶条中,且释放出来的原生质体较小(图1-B)。当选取土培30 d的锯齿形叶片时,原生质体可以很好地释放出来,光镜下可以清晰看到分离良好并完整的原生质体,大小合适,产量可达10.22×106/mL(图1-C)。因此,本试验采用土培30 d的锯齿形叶片为试材。
2.1.2 酶解后平摇时间对原生质体产量和活力的影响 酶解后平摇是原生质体提取中的一项重要操作,通过低转速(40 r/min)的平摇可以将原生质体从破碎的细胞中更好地释放出来。

A.不同苗龄油菜叶片;B.原生质体形态;C.原生质体产量。A.Leaves of different seedling age;B.Morphology of protoplasts;C.Yield of protoplasts.
选取每5 min为1个时间间隔进行镜检,关注分离的原生质体数量及活力,结果显示5 min时原生质体完整度高,但释放不完全,产量只有1.64×106/mL;10 min时原生质体的数量最多(10.73×106/mL),活力最高(96.4%);20 min时原生质体数量没有明显增多,但是可以观察到部分原生质体的圆度开始受到影响,甚至已经有部分原生质体开始破裂(图2),活力下降至69.7%。因此,10 min是制备原生质体较佳的平摇时间。

A.原生质体形态;B.原生质体产量;C.原生质体活力。A.Morphology of protoplasts;B.Yield of protoplasts;C.Viability of protoplasts.
2.2 PEG浓度对油菜原生质体转化的影响
本试验采用PEG/Ca2+法将质粒转化进油菜原生质体,设置PEG浓度分别为10%,20%,30%,40%和50%,原生质体转化后提取蛋白质(BnRGS1蛋白)经Western Blot检测转化效率。由图3-A可以看到:随着PEG浓度的增加,蛋白表达量先上升后下降,PEG浓度为30%时蛋白表达量最高。观察浓度分别为30%,40%和50% PEG处理后的原生质体的形态,可以发现30% PEG处理后原生质体形态基本可以保持完整,少量发生破裂;40%浓度处理后原生质体发生皱缩,部分发生破裂;50%浓度处理后原生质体大量破裂,内容物流出(图3-B)。因此,选取30% PEG浓度转化效率最高。
采用30% PEG浓度,分别将含有BnGA1、BnGB1、BnGG2和BnRGS1的重组质粒转化油菜原生质体,用Western Blot检测其蛋白表达量。由图4可以看出:内参Actin均可稳定表达,转化原生质体中对应蛋白的表达量均高于野生型,说明质粒已成功转入原生质体。

A.蛋白表达量;B.原生质形态。A.Expression of protein;B.Morphology of protoplasts.
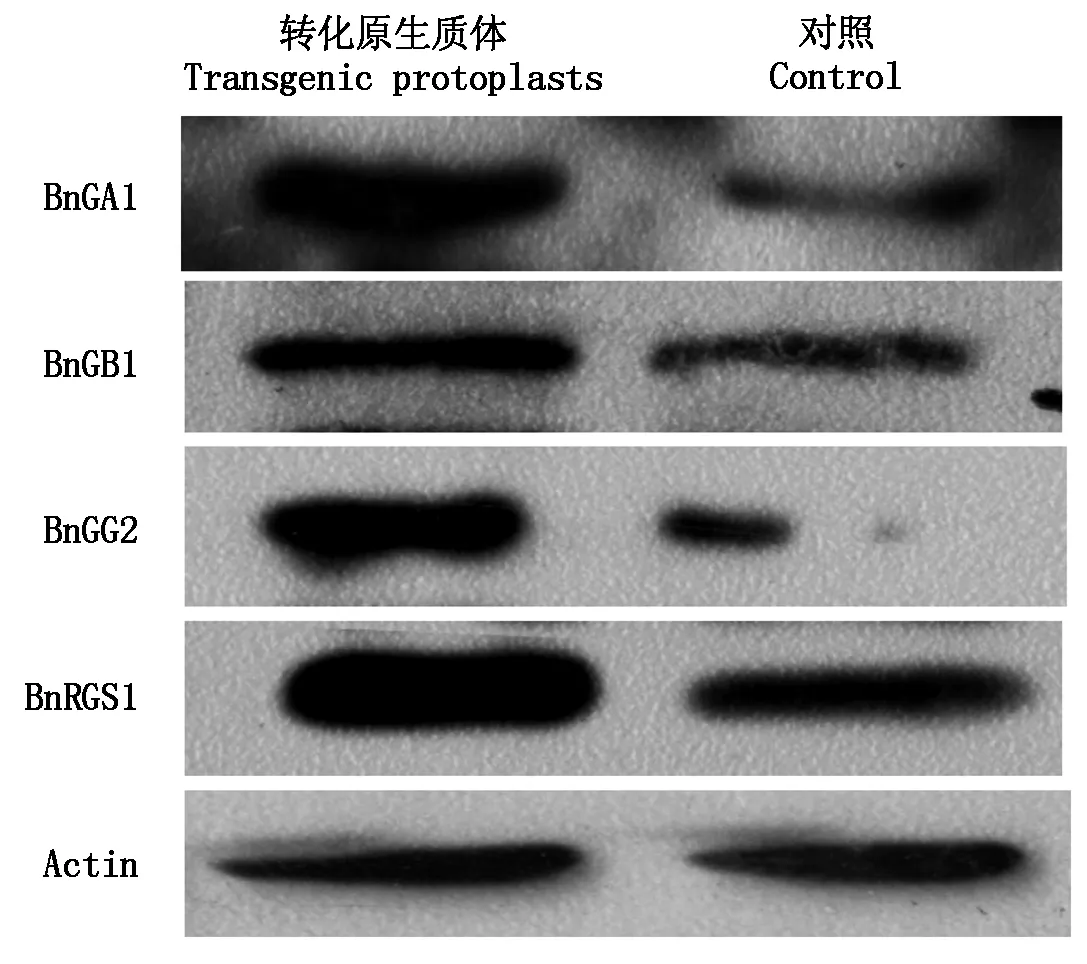
图4 Western Blot检测转基因原生质体中BnGA1、BnGB1、BnGG2和BnRGS1表达量Fig.4 Expression of BnGA1,BnGB1,BnGG2 and BnRGS1 proteins in transgenic protoplasts
2.3 BnGA1、BnGB1、BnGG2和BnRGS1对外源ABA的响应
ABA可以显著促进BnGA1、BnGB1、BnGG2和BnRGS1基因的表达[3-6],表明G蛋白组分参与了油菜对ABA信号的响应。本试验用不同浓度的ABA处理转基因原生质体24 h,用Western Blot检测原生质体中G蛋白的表达情况。结果表明:BnGA1蛋白的表达量随着ABA浓度增加而增加,在100 mmol/L ABA时达到最高,之后下降。BnGB1蛋白的表达量在ABA浓度为150 mmol/L时达到最高。低浓度的ABA(50~100 mmol/L) 时,BnGG2蛋白的表达量增加,在高浓度的ABA处理(150~200 mmol/L)下表达水平下降,在100 mmol/L ABA处理时表达量最高。BnRGS1蛋白表达量在ABA浓度为50 mmol/L时最大(图5)。以上结果表明,G蛋白的各组分均参与了甘蓝型油菜对植物激素的应答反应。

图5 ABA处理对转基因原生质体G蛋白组分表达的影响Fig.5 Effects of ABA on expression of components of G protein in transgenic protoplasts
3 结论与讨论
本试验目的是构建甘蓝型油菜原生质体瞬时表达系统,为油菜异三聚体G蛋白功能研究提供研究载体。试验采用酶解法提取油菜原生质体,PEG-Ca2+介导转化原生质体。但是直接进行试验操作时遇到了原生质体释放不充分、原生质体大量严重破裂、转化效率低等一系列问题。因此,在前人的基础上,从试材的选取、酶解后平摇的时间和PEG浓度这几个方面进行了条件优化。
无菌培养的幼苗子叶、下胚轴、黄化苗及生长不同时间的真叶都可以作为原生质体游离的外殖体[12-14]。利用下胚轴或黄化苗作为外殖体,当报告基因为GFP或荧光素基因时,可以有效避免叶绿素自发荧光的干扰。本试验采用Western Blot检测目标蛋白的表达量,不需考虑叶绿素自发荧光的干扰。
苗龄越大,叶片表面角质层和细胞壁发育越充分,叶片组织结构越紧密,不利于酶与细胞结构的接触,而使酶解效率降低,原生质体产量较低。相反苗龄越小,细胞组织结构较疏松,酶解较充分,但产生的原生质体容易破裂,导致原生质体活力下降[15-17]。在拟南芥中,生长21~28 d的第5~7片真叶是提取原生质体最佳材料[8]。本试验选取土培30 d左右的锯齿形叶片进行原生质体提取,原生质体可以很好地释放出来,产量可达10.22×106/mL。较幼嫩(20 d)叶片的原生质体释放不完全,产量不高,且酶解释放出的原生质体易破碎,活力低。
酶解后低速平摇可以促进原生质体的释放[18],由于没有细胞壁的保护,机械摇晃对释放出的原生质体可能造成损伤,致使破裂或活力下降。因此,合理控制平摇时间对原生质体的产量和活力有重要影响。在本试验条件下,平摇10 min原生质体的产量和活力最高,是较佳的平摇时间。
PEG/Ca2+介导的原生质体转化是原生质体瞬时表达最常用的方法。PEG浓度对转化效率的影响因不同植物试材和不同外源DNA而异,浓度自20%~50%均有报道[19-21]。本试验对甘蓝型油菜研究的结果表明,PEG浓度为30%时转化蛋白质的表达量最高,转化后原生质体形态可以基本保持完整。因此,采用以上优化的条件进行试验可以提取出完整度好、数量多的原生质体,转化后在不破坏原生质体形态的情况下可以达到较高的转化效率。
采用以上优化的条件,有效地分离了甘蓝型油菜原生质体,成功转化得到了油菜异三聚体G蛋白各组分的原生质体瞬时表达体系,经Western Blot检测功能蛋白均有效表达,G蛋白各组分对ABA信号的响应存在剂量效应。上述测试结果为深入研究油菜G蛋白功能提供了良好的试材依据。
[1] Urano D,Chen J G,Botella J R,et al.Heterotrimeric G protein signalling in the plant kingdom[J].Open Biology,2013,3(3):120186.
[2] Urano D,Jones A M.Heterotrimeric G protein-coupled signaling in plants[J].Annual Review in Plant Biology,2014,65(4):365-384.
[3] Gao Y,Li T T,Liu Y,et al.Isolation and characterization of gene encoding G protein alpha subunit protein responsive to plant hormones and abiotic stresses inBrassicanapus[J].Molecular Biology Reports,2010,37(8):3957-3965.
[4] Gao Y,Zhao Y,Li T T,et al.Cloning and characterization of a G protein beta subunit gene responsive to plant hormones and abiotic stresses inBrassicanapus[J].Plant Molecular Biology Reporter,2010,28(3):450-459.
[5] Gao Y,Li T T,Zhao Y,et al.Isolation and characterization of a G protein gamma subunit gene responsive to plant hormones and abiotic stresses inBrassicanapusL.[J].Acta Physiologiae Plantarum,2011,33(2):391-399.
[6] Chen Y,Zhu X,Zhu X B,et al.Identification of the regulator of G-Protein signaling protein responsive to plant hormones and abiotic stresses inBrassicanapus[J].Journal of Integrative Agriculture,2014,13(12):2634-2644.
[7] Chen Y,Ji F,Xie H,et al.Overexpression of the regulator of G-protein signalling protein enhances ABA-mediated inhibition of root elongation and drought tolerance inArabidopsis[J].Journal of Experimental Botany,2006,57(9):2101-2110.
[8] Sheen J.Signal transduction in maize andArabidopsismesophyll protoplasts[J].Plant Physiology,2001,127(4):1466-1475.
[9] 周邢扬,佘建明,陆维忠,等.甘蓝型油菜原生质体培养获得再生植株的研究[J].作物学报,1991,17(5):340-346.
[10] 程振东,卫志明,许智宏.用PEG法把外源基因导入甘蓝型油菜原生质体再生转基因植株[J].实验生物学报,1994,27(3):341-348.
[11] 田志宏,孟金陵.甘蓝型油菜原生质体培养及植株再生的研究[J].中国油料作物学报,2002,24(2):10-13.
[12] 李 贵,李必元,王五宏,等.结球甘蓝下胚轴原生质体培养再生植株体系的优化研究[J].西北植物学报,2012,32(12):2438-2443.
[13] 谢 礼,宗 娜,赵 军.玉米生长条件对玉米原生质体转化的影响研究[J].中国农业科技导报,2014,16(5):147-153.
[14] 李妮娜,丁林云,张志远,等.棉花叶肉原生质体分离及目标基因瞬时表达体系的建立[J].作物学报,2014,40(2):231-239.
[15] 舒小娟,温腾建,邢佳毅,等.葡萄原生质体分离及瞬时转化体系的建立[J].西北植物学报,2015,35(6):1262-1268.
[16] 杜晓敏,王 均,安子玄,等.小麦叶肉细胞原生质体制备参数解析及在基因瞬时表达上的应用[J].华北农学报,2015,30(6):52-60.
[17] 孙慧慧,闫晓红,叶永忠,等.甘蓝型油菜子叶原生质体培养及植株再生研究[J].河南农业科学,2010,39(6):35-39.
[18] 孙 鹤,郎志宏,朱 莉,等.玉米、小麦、水稻原生质体制备条件优化[J].生物工程学报,2013,29(2):224-234.
[19] 霍 鹏,言 普,沈文涛,等.PEG介导番木瓜叶肉原生质体瞬时表达体系的建立[J].分子植物育种,2015,13(4):808-815.
[20] 席海秀,艾可筠,佟少明.普通小麦幼苗叶肉细胞原生质体分离方法的优化[J].生物技术通报,2016,32(4):68-73.
[21] Yoo S D,Cho Y H,Sheen J.Arabidopsismesophyll protoplasts:a versatile cell system for transient gene expression analysis[J].Nature Protocols,2007,2(7):1565-1572.
Establishment of Heterotrimeric G Protein Gene Protoplast Transient Expression System in Brassica napus
CHEN Yun,YU Yifan,PAN Shufen,ZHOU Yan,GE Huimin,LIU Lijun
(Key Laboratory of Crop Genetics and Physiology of Jiangsu Province,Yangzhou University,Yangzhou 225009,China)
To establish the protoplast transient expression system of the components of heterotrimeric G protein inBrassicanapus,the key factors in protoplast preparation and transformation including explant,flat rolling time and polyethylene glycol(PEG) concentration were optimized.The results showed that the best yield and viability of protoplasts were 10.73×106/mL and 96.4% respectively,with the optimum conditions as 30 days seedling age and 10 min rolling time.The expression of target proteins reached the maximum with 30% PEG.The responses of G protein to ABA were investigated using the protoplast transient system by Western Blot detection.The highest expression levels of BnGA1,BnGB1,BnGG2 and BnRGS1 were observed when the ABA concentration was 100,150,100,50 mmol/L,respectively.
Brassicanapus;Protoplast transient expression;Heterotrimeric G protein
2016-07-22
国家自然科学基金项目(31371562;30970249)
陈 云(1973-),女,江苏东台人,副教授,博士,主要从事植物生理与生化研究。
刘立军(1973-),男,江苏泗阳人,教授,博士,主要从事作物栽培生理研究。
S565.03;Q819
A
1000-7091(2016)06-0021-05
10.7668/hbnxb.2016.06.004
