5个板栗品种对干旱胁迫的生理响应及抗旱性评价1)
2017-01-17武燕奇郭素娟
武燕奇 郭素娟
(省部共建森林培育与保护教育部重点实验室(北京林业大学),北京,100083)
5个板栗品种对干旱胁迫的生理响应及抗旱性评价1)
武燕奇 郭素娟
(省部共建森林培育与保护教育部重点实验室(北京林业大学),北京,100083)
以迁西地区5个板栗品种‘紫珀’‘燕山早丰’‘迁西早红’‘迁西晚红’‘迁西壮栗’实生苗为试验材料,对土壤干旱胁迫0、10、20、30、40 d以及复水14 d后叶片中MDA质量摩尔浓度及SOD、POD活性,可溶性糖质量分数,叶片水势的变化进行了分析,并采用隶属函数法对5个品种的抗旱性进行综合评价。结果表明:随干旱时间的延长,5个板栗品种叶片MDA质量摩尔浓度呈增加趋势;干旱胁迫40 d,各品种叶片MDA质量摩尔浓度显著高于各自的对照。5个板栗品种叶片SOD活性呈降低-升高-降低的趋势,均在干旱胁迫30 d时达到最大值,且均高于各自的对照;干旱胁迫40 d,各品种叶片SOD活性显著低于各自的对照。5个板栗品种叶片POD活性呈升高-降低的趋势;叶片POD活性均在干旱胁迫10 d时达到最大值,除‘燕山早丰’显著高于对照外,其余4个品种均与对照差异不显著;干旱胁迫40 d,各品种叶片POD活性显著低于各自的对照。5个板栗品种叶片可溶性糖质量分数总体呈升高趋势;干旱胁迫40 d,5个板栗品种叶片可溶性糖质量分数均达到最大值,但与各自的对照差异不显著。5个板栗品种叶片水势均呈降低的趋势;干旱胁迫40 d,各品种叶片水势显著低于各自的对照。复水14 d后,5个板栗品种叶片MDA质量摩尔浓度、可溶性糖质量分数均有所降低。各品种板栗叶片SOD、POD活性,水势较干旱胁迫40 d时有所升高。经隶属函数法分析得出,5种板栗的抗旱性由大到小的顺序为‘燕山早丰’(0.52)、‘紫珀’(0.46)、‘迁西晚红’(0.42)、‘迁西早红’(0.36)、‘迁西壮栗’(0.34)。
板栗;干旱胁迫;生理指标;抗旱性;隶属函数法
Taking five Chinese chestnut varieties ‘ZP’, ‘YSZF’, ‘QXZH’, ‘QXWH’ and ‘QXZL’, we studied the changes of leaf MDA molality, SOD activities, POD activities, soluble sugar contents and water potentials after drought stress for 0, 10, 20, 30 and 40 d and rewatering for 14 d, and comprehensively evaluated drought resistance of five Chinese chestnut varieties by subordinate function method. The development of drought stress, leaf MDA molality of the five Chinese chestnut varieties raised constantly. Treated for 40 d, leaf MDA molality are significantly higher than that of their respective controls. Leaf SOD activities of the five Chinese chestnut varieties showed a trend of descending-rising-descending, the maximum of the five kinds appear after treated for 30 d, and higher than that of their respective controls. Treated for 40 d, the leaf SOD activities were significantly lower than that of their respective controls. Leaf POD activities of the five Chinese chestnut varieties showed a trend of rising-descending, the maximum of the five kinds appeared after treated for 10 d, ‘YSZF’ was higher than its controls, the other four varieties with no significant difference in comparison with that of their controls. Treated for 40 d, leaf POD activities were significantly lower than that of their respective controls. The leaf soluble sugar content of the five Chinese chestnut varieties increased. The maximum of the five kinds appear after treated for 40 d, but with no significant difference in comparison with that of their control. The five Chinese chestnut varieties leaf water potentials showed a trend of decrease. Treated for 40 d, leaf water potentials were significantly lower than that of their respective controls. After rewatering for 14 d, leaf MDA molality, soluble sugar contents of the five Chinese chestnut varieties descended. Leaf SOD activities, POD activities and water potentials of the five Chinese chestnut varieties increased more than drought stress for 40 d. A subordinate function was used to rank their drought resistance, with the descending order of YSZF (0.52), ZP (0.46), QXWH (0.42), QXZH (0.36), and QXZL(0.34).
板栗(CastaneamollissimaBl.),壳斗科(Fagaceae),其果实富含脂肪、蛋白质、淀粉等多种营养成分,是我国主要的木本粮食树种之一,被誉为“铁杆庄稼”。在国际市场上占有重要地位。干旱是一个长期存在的世界性难题,严重制约着植物的生长发育,限制世界各国农林业发展[1-3]。众多学者对干旱胁迫下植物体内抗氧化系统、渗透调节物质、水势等进行了大量研究[4-10]。嫁接是板栗繁殖的主要方式,砧木抗旱性对于嫁接成活与否及嫁接后苗木生长状况极其重要。因此,研究不同品种板栗砧木的抗旱能力对于板栗成活及稳定发展具有重要意义。以往有关板栗抗旱性研究较少,对于干旱胁迫下板栗的生理生化指标变化、不同品种抗旱性比较鲜有报道。
文中以5个板栗品种容器苗为试验材料,采用盆栽控水法,研究了土壤干旱胁迫0、10、20、30、40 d及复水14 d后叶片中MDA质量摩尔浓度,SOD、POD活性,可溶性糖质量分数及叶片水势的变化,并据上述生理指标,运用隶属函数法对5种板栗抗旱性进行综合评价,进而为筛选抗旱板栗砧木提供初步依据。
1 材料与方法
试验于北京林业大学迁西试验基地温室内进行。供试材料为5个板栗品种容器苗(‘紫珀’‘燕山早丰’‘迁西早红’‘迁西晚红’‘迁西壮栗’)。
2014年9月份采集以上5个板栗品种种子置于低温冷藏柜中进行贮藏。于2015年3月中旬将以上5个板栗品种种子用0.4%的NaClO消毒30 min,蒸馏水冲洗干净,之后进行层积催芽。每种催芽100粒。待胚根伸长至5 cm时截根后栽种至上口径21 cm、下口径16 cm、高21 cm的营养钵中,每盆栽1株。栽培基质为迁西板栗园土,土壤类型为沙壤土,pH=6.44,有机质质量分数为2.89 g·kg-1,每盆装土量为5.20 kg。
于2015年5月份,选择生长良好、长势一致的板栗容器苗(平均苗高33.2 cm,地径4.72 mm),在温室内进行自然干旱胁迫处理。温室与外界进行通风。试验设对照(CK)和自然干旱(GH)两个处理,为了避免试验过程中植株死亡影响取样,每个处理准备40盆:干旱胁迫开始前先给苗木浇清水至饱和,之后40 d停止浇水(此时板栗叶片出现萎蔫,土壤相对含水量为29.67%~31.98%,达到重度干旱胁迫);40 d后解除胁迫并浇水至饱和,随后正常养护。对照组土壤相对含水量保持在75%左右。
分别在干旱胁迫0、10、20、30、40 d以及复水14 d后的当日08:00采集对照组及处理组植株枝条顶端向下第3至第5个叶片,置于冰盒中立即带回实验室进行指标测定。每次采样设3次重复,随机选取5盆植株采集,以保证材料充足和一致,采样后的植株不再重复采样。
去除新鲜样叶的叶脉,取0.5 g样叶置于预冷的研钵中,加2 mL预冷的0.05 mol·L-1磷酸缓冲液(含10 g·L-1PVP,pH值7.0),以及少量石英砂,研磨至匀浆;用3 mL上述磷酸缓冲液冲洗研钵,合并提取液,于离心机4 ℃、10 000 r·min-1下离心20 min;沉淀用上述方法重复提取1次;合并上清液定容至5 mL;样液于4 ℃条件下保存,用于MDA质量摩尔浓度及SOD、POD活性测定[11]。
采用硫代巴比妥酸比色法测定MDA质量摩尔浓度[12];采用氮蓝四唑光还原法测定SOD活性[13];采用愈创木酚比色法测定POD活性[13];采用蒽酮比色法测定可溶性糖质量分数[12];利用WP4-T露点水势仪测定叶片水势。
通过EXCEL2007和SPSS17.0统计分析软件进行数据处理及统计分析。差异显著性运用Duncan’s检验法进行多重比较。
采用隶属函数法[11,14]对板栗的抗旱能力进行综合评价。为避免不同品种间对照值的差异影响试验结果,依据公式Ii=I/I0(其中,I为干旱组值;i为品种;I0为对照组值)计算各指标在不同时间的变化系数,之后再计算各指标与抗旱性的相关隶属函数值。各指标与抗旱性隶属函数值的计算公式为:指标与抗旱性呈正相关时,计算结果表示为R(i,j)=(Xi,j-Xmin)/(Xmax-Xmin);指标与抗旱性呈负相关时,计算结果表示为R(Xi,j)=1-(Xi,j-Xmin)/(Xmax-Xmin),式中,R(Xi,j)为i品种j指标的抗旱性隶属函数值;Xi,j为i品种j指标的测定值;Xmax及Xmin分别为j指标的最大值和最小值。分别计算各品种所有测定指标隶属函数值的平均值,平均值越大,则抗旱性越强[11]。
2 结果与分析
2.1 土壤干旱胁迫及复水后5个板栗品种叶片部分生理指标的变化
土壤干旱胁迫0、10、20、30、40 d及复水14 d后5个板栗品种叶片丙二醛(MDA)质量摩尔浓度、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、可溶性糖质量分数、叶片水势的变化见表1。
2.1.1 丙二醛(MDA)质量摩尔浓度的变化
由表1可知,试验期间,对照组5个板栗品种叶片的MDA质量摩尔浓度呈小幅波动趋势,但整体变化幅度不大;持续干旱胁迫条件下,5个品种干旱组叶片的MDA质量摩尔浓度总体呈不断增加的趋势,各时段的MDA质量摩尔浓度均显著(P<0.05)高于各自的对照组。干旱胁迫40 d,5个品种干旱组叶片的MDA质量摩尔浓度达到最大值。‘紫珀’‘燕山早丰’‘迁西早红’‘迁西晚红’‘迁西壮栗’叶片的MDA质量摩尔浓度分别较各自的对照组升高161.36%、145.04%、171.00%、163.11%、167.74%;复水14 d后,各品种叶片MDA质量摩尔浓度均较干旱胁迫40 d时有所降低,5个叶片MDA质量摩尔浓度均显著高于各自对照组(P<0.05);‘迁西壮栗’叶片MDA质量摩尔浓度平均值显著高于‘紫珀’‘燕山早丰’‘迁西早红’,前3者又显著高于‘迁西晚红’(P<0.05)。

表1 土壤干旱胁迫及复水后5个板栗品种叶片各生理指标的变化
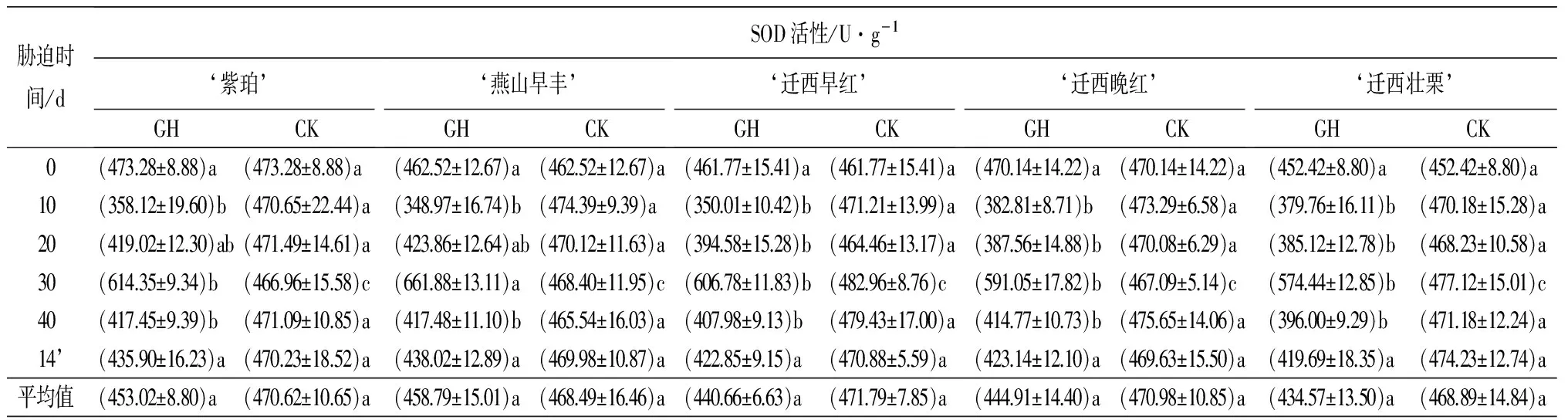
胁迫时间/dSOD活性/U·g-1‘紫珀’GHCK‘燕山早丰’GHCK‘迁西早红’GHCK‘迁西晚红’GHCK‘迁西壮栗’GHCK0(473.28±8.88)a (473.28±8.88)a (462.52±12.67)a(462.52±12.67)a(461.77±15.41)a(461.77±15.41)a(470.14±14.22)a(470.14±14.22)a(452.42±8.80)a(452.42±8.80)a10(358.12±19.60)b(470.65±22.44)a(348.97±16.74)b(474.39±9.39)a(350.01±10.42)b(471.21±13.99)a(382.81±8.71)b(473.29±6.58)a(379.76±16.11)b(470.18±15.28)a20(419.02±12.30)ab(471.49±14.61)a(423.86±12.64)ab(470.12±11.63)a(394.58±15.28)b(464.46±13.17)a(387.56±14.88)b(470.08±6.29)a(385.12±12.78)b(468.23±10.58)a30(614.35±9.34)b(466.96±15.58)c(661.88±13.11)a(468.40±11.95)c(606.78±11.83)b(482.96±8.76)c(591.05±17.82)b(467.09±5.14)c(574.44±12.85)b(477.12±15.01)c40(417.45±9.39)b(471.09±10.85)a(417.48±11.10)b(465.54±16.03)a(407.98±9.13)b(479.43±17.00)a(414.77±10.73)b(475.65±14.06)a(396.00±9.29)b(471.18±12.24)a14’(435.90±16.23)a(470.23±18.52)a(438.02±12.89)a(469.98±10.87)a(422.85±9.15)a(470.88±5.59)a(423.14±12.10)a(469.63±15.50)a(419.69±18.35)a(474.23±12.74)a平均值(453.02±8.80)a(470.62±10.65)a(458.79±15.01)a(468.49±16.46)a(440.66±6.63)a(471.79±7.85)a(444.91±14.40)a(470.98±10.85)a(434.57±13.50)a(468.89±14.84)a
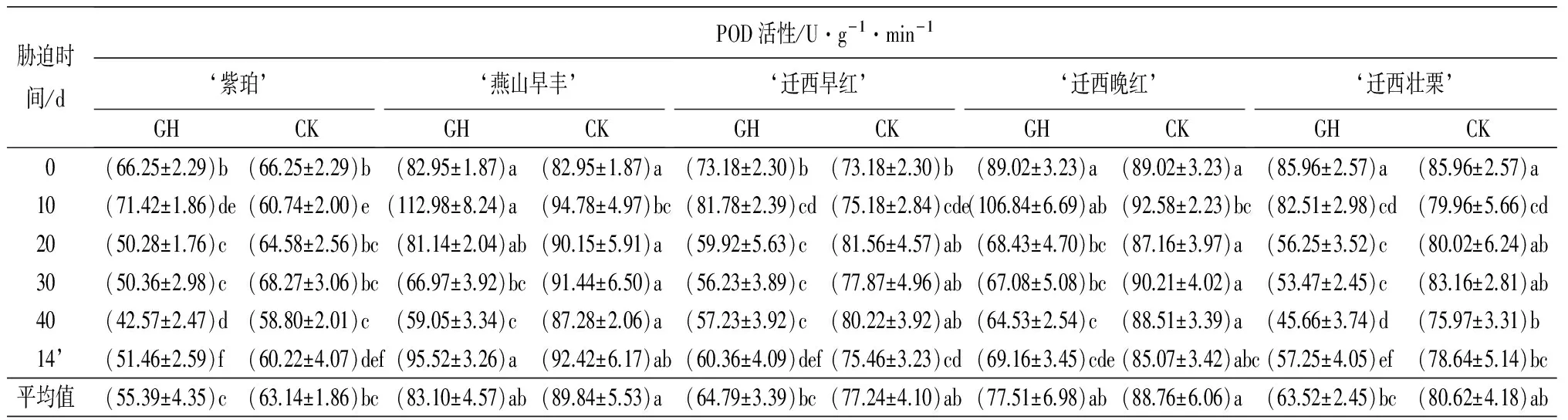
胁迫时间/dPOD活性/U·g-1·min-1‘紫珀’GHCK‘燕山早丰’GHCK‘迁西早红’GHCK‘迁西晚红’GHCK‘迁西壮栗’GHCK0(66.25±2.29)b(66.25±2.29)b(82.95±1.87)a(82.95±1.87)a(73.18±2.30)b(73.18±2.30)b(89.02±3.23)a(89.02±3.23)a(85.96±2.57)a(85.96±2.57)a10(71.42±1.86)de(60.74±2.00)e(112.98±8.24)a(94.78±4.97)bc(81.78±2.39)cd(75.18±2.84)cde(106.84±6.69)ab(92.58±2.23)bc(82.51±2.98)cd(79.96±5.66)cd20(50.28±1.76)c(64.58±2.56)bc(81.14±2.04)ab(90.15±5.91)a(59.92±5.63)c(81.56±4.57)ab(68.43±4.70)bc(87.16±3.97)a(56.25±3.52)c(80.02±6.24)ab30(50.36±2.98)c(68.27±3.06)bc(66.97±3.92)bc(91.44±6.50)a(56.23±3.89)c(77.87±4.96)ab(67.08±5.08)bc(90.21±4.02)a(53.47±2.45)c(83.16±2.81)ab40(42.57±2.47)d(58.80±2.01)c(59.05±3.34)c(87.28±2.06)a(57.23±3.92)c(80.22±3.92)ab(64.53±2.54)c(88.51±3.39)a(45.66±3.74)d(75.97±3.31)b14’(51.46±2.59)f(60.22±4.07)def(95.52±3.26)a(92.42±6.17)ab(60.36±4.09)def(75.46±3.23)cd(69.16±3.45)cde(85.07±3.42)abc(57.25±4.05)ef(78.64±5.14)bc平均值(55.39±4.35)c(63.14±1.86)bc(83.10±4.57)ab(89.84±5.53)a(64.79±3.39)bc(77.24±4.10)ab(77.51±6.98)ab(88.76±6.06)a(63.52±2.45)bc(80.62±4.18)ab
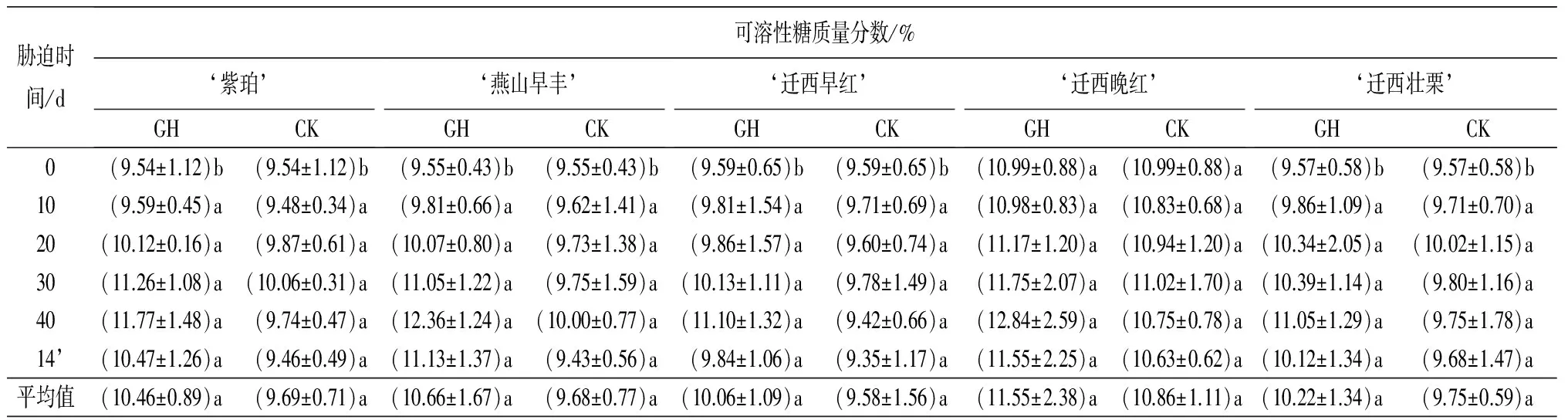
胁迫时间/d可溶性糖质量分数/%‘紫珀’GHCK‘燕山早丰’GHCK‘迁西早红’GHCK‘迁西晚红’GHCK‘迁西壮栗’GHCK0(9.54±1.12)b(9.54±1.12)b(9.55±0.43)b(9.55±0.43)b(9.59±0.65)b(9.59±0.65)b(10.99±0.88)a(10.99±0.88)a(9.57±0.58)b(9.57±0.58)b10(9.59±0.45)a(9.48±0.34)a(9.81±0.66)a(9.62±1.41)a(9.81±1.54)a(9.71±0.69)a(10.98±0.83)a(10.83±0.68)a(9.86±1.09)a(9.71±0.70)a20(10.12±0.16)a(9.87±0.61)a(10.07±0.80)a(9.73±1.38)a(9.86±1.57)a(9.60±0.74)a(11.17±1.20)a(10.94±1.20)a(10.34±2.05)a(10.02±1.15)a30(11.26±1.08)a(10.06±0.31)a(11.05±1.22)a(9.75±1.59)a(10.13±1.11)a(9.78±1.49)a(11.75±2.07)a(11.02±1.70)a(10.39±1.14)a(9.80±1.16)a40(11.77±1.48)a(9.74±0.47)a(12.36±1.24)a(10.00±0.77)a(11.10±1.32)a(9.42±0.66)a(12.84±2.59)a(10.75±0.78)a(11.05±1.29)a(9.75±1.78)a14’(10.47±1.26)a(9.46±0.49)a(11.13±1.37)a(9.43±0.56)a(9.84±1.06)a(9.35±1.17)a(11.55±2.25)a(10.63±0.62)a(10.12±1.34)a(9.68±1.47)a平均值(10.46±0.89)a(9.69±0.71)a(10.66±1.67)a(9.68±0.77)a(10.06±1.09)a(9.58±1.56)a(11.55±2.38)a(10.86±1.11)a(10.22±1.34)a(9.75±0.59)a
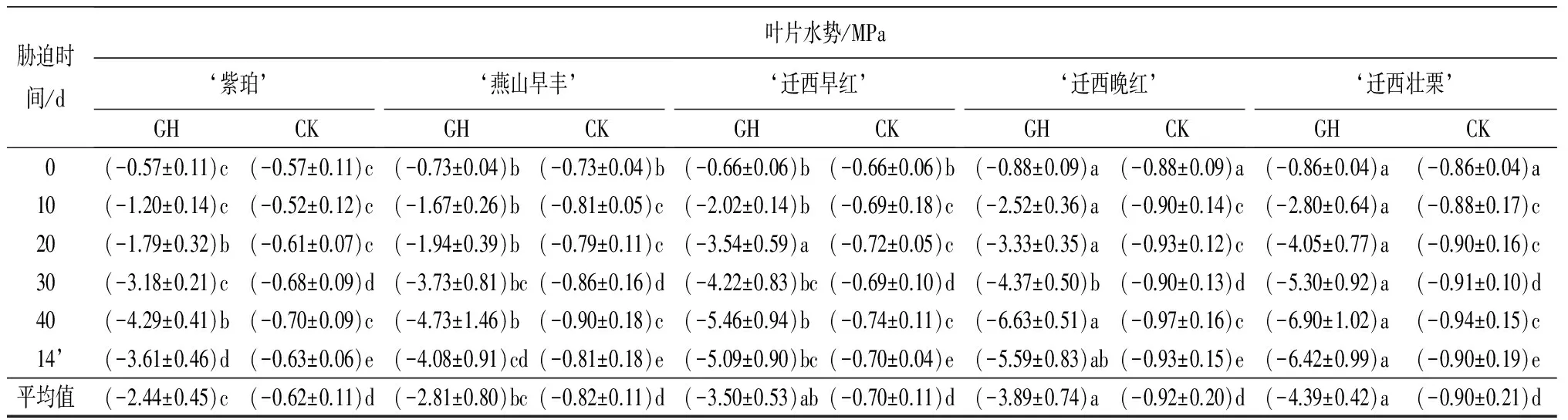
胁迫时间/d叶片水势/MPa‘紫珀’GHCK‘燕山早丰’GHCK‘迁西早红’GHCK‘迁西晚红’GHCK‘迁西壮栗’GHCK0(-0.57±0.11)c(-0.57±0.11)c(-0.73±0.04)b(-0.73±0.04)b(-0.66±0.06)b(-0.66±0.06)b(-0.88±0.09)a(-0.88±0.09)a(-0.86±0.04)a(-0.86±0.04)a10(-1.20±0.14)c(-0.52±0.12)c(-1.67±0.26)b(-0.81±0.05)c(-2.02±0.14)b(-0.69±0.18)c(-2.52±0.36)a(-0.90±0.14)c(-2.80±0.64)a(-0.88±0.17)c20(-1.79±0.32)b(-0.61±0.07)c(-1.94±0.39)b(-0.79±0.11)c(-3.54±0.59)a(-0.72±0.05)c(-3.33±0.35)a(-0.93±0.12)c(-4.05±0.77)a(-0.90±0.16)c30(-3.18±0.21)c(-0.68±0.09)d(-3.73±0.81)bc(-0.86±0.16)d(-4.22±0.83)bc(-0.69±0.10)d(-4.37±0.50)b(-0.90±0.13)d(-5.30±0.92)a(-0.91±0.10)d40(-4.29±0.41)b(-0.70±0.09)c(-4.73±1.46)b(-0.90±0.18)c(-5.46±0.94)b(-0.74±0.11)c(-6.63±0.51)a(-0.97±0.16)c(-6.90±1.02)a(-0.94±0.15)c14’(-3.61±0.46)d(-0.63±0.06)e(-4.08±0.91)cd(-0.81±0.18)e(-5.09±0.90)bc(-0.70±0.04)e(-5.59±0.83)ab(-0.93±0.15)e(-6.42±0.99)a(-0.90±0.19)e平均值(-2.44±0.45)c(-0.62±0.11)d(-2.81±0.80)bc(-0.82±0.11)d(-3.50±0.53)ab(-0.70±0.11)d(-3.89±0.74)a(-0.92±0.20)d(-4.39±0.42)a(-0.90±0.21)d
注:表中数据为平均值±标准差;14’d表示复水14 d;同行不同小写字母表示差异显著(P<0.05)。
2.1.2 超氧化物歧化酶(SOD)活性的变化
由表1可知,5个板栗品种干旱组、对照组之间叶片SOD活性平均值差异不显著(P>0.05);持续干旱胁迫及复水过程中,5个板栗品种叶片SOD活性呈降低-升高-降低-升高的趋势。5个板栗品种叶片SOD活性均在干旱胁迫30 d时达到最大值。‘紫珀’‘燕山早丰’‘迁西早红’‘迁西晚红’‘迁西壮栗’分别较各自的对照组增加31.56%、41.31%、25.64%、26.54%、20.40%。且均与各自对照组差异显著(P<0.05);干旱胁迫40 d 5个板栗品种叶片SOD活性开始下降,干旱组板栗叶片SOD活性均显著低于各自的对照组(P<0.05);复水14 d,各品种板栗叶片SOD活性较干旱胁迫40 d时有所升高。但5个品种干旱组、处理组之间差异均不显著(P>0.05)。
2.1.3 过氧化物酶(POD)活性的变化
由表1可知,持续干旱胁迫及复水过程中,5个品种板栗叶片POD活性总体呈升高-降低-升高的趋势。均在干旱胁迫10 d时达到最大值。‘紫珀’‘燕山早丰’‘迁西早红’‘迁西晚红’‘迁西壮栗’分别较各自的对照组增加17.58%、19.21%、8.78%、15.40%、3.19%。除‘燕山早丰’显著高于对照组(P<0.05),其余均与对照组差异不显著(P>0.05);干旱胁迫40 d,5个品种叶片POD活性达到最低值,分别低于各自对照的26.23%、26.76%、27.79%、25.65%、35.70%。且均与对照差异显著(P<0.05);复水14 d,5种叶片POD活性较干旱胁迫40 d时有所升高。除‘燕山早丰’高于对照组外,其余均低于各自的对照,但均差异不显著(P>0.05);‘燕山早丰’‘迁西晚红’叶片POD活性平均值显著高于‘紫珀’。‘燕山早丰’‘迁西早红’‘迁西晚红’‘迁西壮栗’之间差异不显著。‘紫珀’‘迁西早红’‘迁西壮栗’之间差异不显著。
2.1.4 可溶性糖质量分数的变化
由表1可知,5个板栗品种干旱组、对照组之间,叶片可溶性糖质量分数平均值差异不显著(P>0.05);持续干旱胁迫及复水过程中,5个板栗品种叶片可溶性糖质量分数总体呈升高-降低趋势。干旱胁迫40 d,5个板栗品种叶片可溶性糖质量分数均达到最大值,‘紫珀’‘燕山早丰’‘迁西早红’‘迁西晚红’‘迁西壮栗’分别高于对照的20.82%、23.59%、17.88%、19.46%、13.33%。但互相之间差异不显著(P>0.05);复水14 d后5个板栗品种叶片可溶性糖质量分数有所降低,但各品种干旱组、对照组之间差异不显著(P>0.05)。
2.1.5 叶片水势的变化
由表1可知,持续干旱胁迫及复水过程中,5个板栗品种叶片水势呈降低-升高的趋势。干旱胁迫40 d,5个板栗品种叶片水势均达到最小值。‘迁西晚红’‘迁西壮栗’显著低于‘紫珀’‘燕山早丰’‘迁西早红’(P<0.05)。‘紫珀’‘燕山早丰’‘迁西早红’‘迁西晚红’‘迁西壮栗’均显著低于各自的对照(P<0.05),分别较对照降低510.74%、427.17%、640.67%、581.77%、636.53%;复水14 d,5个板栗品种叶片水势均有所升高,但仍显著低于各自的对照(P<0.05)。‘紫珀’‘燕山早丰’干旱组之间差异不显著(P>0.05),‘燕山早丰’‘迁西早红’干旱组之间差异不显著(P>0.05),‘迁西晚红’‘迁西壮栗’之间差异不显著(P>0.05)。‘紫珀’‘燕山早丰’叶片水势最低,‘迁西晚红’‘迁西壮栗’叶片水势最高;‘迁西早红’‘迁西晚红’‘迁西壮栗’叶片水势平均值显著高于‘紫珀’(P<0.05)。‘紫珀’‘燕山早丰’之间差异不显著(P>0.05)。‘燕山早丰’‘迁西早红’之间差异不显著(P>0.05)。‘迁西早红’‘迁西晚红’‘迁西壮栗’之间差异不显著(P>0.05)。
2.2 5个板栗品种抗旱性的综合评价
植物抗旱性是一个复合性状,采用模糊数学的隶属函数法对板栗抗旱性进行综合评价,用每种板栗各项指标隶属函数值的平均值作为其抗旱性综合评价标准,隶属函数平均值越大,抗旱性越强[14]。因此,基于板栗叶片MDA质量摩尔浓度,可溶性糖质量分数,SOD、POD活性,叶片水势的变化,对5个板栗品种抗旱性进行综合评价(表2)。由表2可知,‘紫珀’‘燕山早丰’‘迁西早红’‘迁西晚红’‘迁西壮栗’叶片5个生理指标的平均隶属函数值分别为0.46、0.52、0.36、0.42、0.34。据此对5个板栗品种的抗旱性进行排序,抗旱性由高到低依次为‘燕山早丰’‘紫珀’‘迁西晚红’‘迁西早红’‘迁西壮栗’。
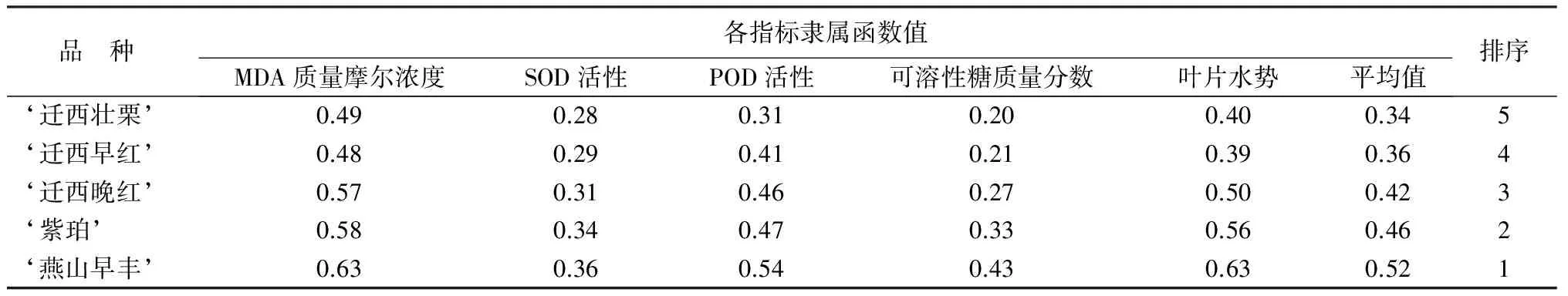
表2 基于叶片5个生理指标的5个品种板栗抗旱性隶属函数分析
3 结论与讨论
植物遭受逆境时,脂膜过氧化导致MDA积累,蛋白质和核酸变性失活,进而导致膜流动性降低,透性增加,MDA可以作为植物遭受逆境伤害的指标。本研究结果表明:持续干旱时,5个板栗品种叶片中MDA质量摩尔浓度不断增加。这与李钧[15]、时忠杰等[16]、苏寒之等[17]、李嫱等[18]的研究结果相一致。干旱胁迫条件下5个板栗品种叶片MDA质量摩尔浓度平均值较对照显著升高(P<0.05)。干旱胁迫后期,‘燕山早丰’叶片MDA质量摩尔浓度最低,且MDA质量摩尔浓度平均值较低,说明‘燕山早丰’对干旱胁迫的抗性较强,叶片细胞受到的膜脂过氧化伤害程度最小,MDA积累最少。
植物遭受逆境时,产生有害的活性氧,SOD、POD是生物体内清除自由基的重要保护酶。相关研究表明[19],干旱胁迫下,SOD、POD的活性与抗氧化能力呈正相关。本研究结果表明,干旱胁迫过程中,板栗SOD活性呈降低-升高-降低的趋势。这与时忠杰等[16]的研究结果一致。5个板栗品种均在干旱胁迫30 d达到最高值,说明此时SOD的作用达到最大值。之后开始降低,说明干旱胁迫导致细胞内产生大量的自由基,超过了防御系统的清除能力;此外,还可能与植物对逆境的补偿和超补偿效应有关,是植物对长期干旱胁迫的应激动力学反应,叶片膜脂过氧化程度加重导致细胞代谢紊乱和细胞活力降低[11];干旱胁迫及复水过程中,5个板栗品种叶片POD活性基本呈升高-降低-升高的趋势。这与张鹏等[20]对板栗的研究结果一致。5个板栗品种均在干旱胁迫10 d达到最高值,‘燕山早丰’‘迁西晚红’的叶片POD活性最高值较高,说明其具有较强的抗氧化能力。复水之后,酶活性升高,说明植株的抗氧化系统有所恢复。SOD、POD的共同作用,使活性氧的含量降低,从而植物体可以进行正常的生命活动。
可溶性糖是植物体内重要渗透调节物质。研究表明[21],当植物受到干旱胁迫时,可溶性糖逐渐积累,从而进行渗透调节,阻止细胞膜解离,增强细胞保水能力,稳定细胞结构,防止细胞脱水。本研究结果表明,随着干旱胁迫时间的延长,5个板栗品种叶片中可溶性糖质量分数不断积累,进而维持细胞膨压,使植物能够维持正常的生命活动。这与柯世省等[22]、徐莲珍等[23]的研究结果相一致。
水势是表示植物水分亏缺或水分状况的一个直接指标[24]。本研究表明,随着干旱胁迫时间的延长,5个板栗品种叶片水势均表现出下降趋势。复水后,叶片水势有所增加。这与大多数学者的研究基本一致[25-30]。抗旱性强的品种,干旱胁迫下水势下降幅度较小,复水之后恢复较快。干旱胁迫40 d时,‘燕山早丰’叶片水势相对对照下降幅度最小,且复水后水势较高。说明其自身调节能力最强,在干旱胁迫环境下,保持较高的水势,防止细胞失水,保持细胞内环境的稳态。
植物抗旱性是一个复合性状,单一指标并不能说明抗旱性强弱。因此,根据隶属函数法对5个板栗品种抗旱性进行综合评价。结果表明,5个板栗品种抗旱性由强到弱的顺序为‘燕山早丰’‘紫珀’‘迁西晚红’‘迁西早红’‘迁西壮栗’。
[1] CRAMER G R, URANO K, DELROT S, et al. Effects of abiotic stress on plants: a systems biology perspective[J]. BMC Plant Biology,2011,11:163.
[2] 韩文萍,丁贵杰,鲍斌.不同钟源马尾松对干旱胁迫的生理生态响应[J].中南林业科技大学学报,2012,32(5):25-29.
[3] 沈国舫,王礼先.中国生态环境建设与水资源保护利用[M].北京:中国水利水电出版社,2001.
[4] 王凯红,刘向平,张乐华,等.5种杜鹃幼苗对高温胁迫的生理生化响应及耐热性综合评价[J].植物资源与环境学报,2011,20(3):29-35.
[5] 令狐昱慰,李汝娟,李思锋,等.干旱胁迫对九头狮子草和圆苞金足草幼苗形态和生理特性的影响[J].植物资源与环境学报,2013,22(3):25-32.
[6] 姜英淑,陈书明,王秋玉,等.干旱胁迫对2个欧李种源生理特征的影响[J].林业科学,2009,45(6):6-10.
[7] NUCCIO M L, RHODES D, McNEIL S D, et al. Metabolic engineering of plants for osmotic stress resistance[J]. Curr Opin Plant Biol,1999,2(2):128-134.
[8] SMIRNOFF N. Plan tresistance to environmental stress[J]. Curr Opin Biotechnol,1998,9(2):214-219.
[9] TURNER N C. Techniques and experimental approaches for the measurement of plant water status[J]. Plant Soil,1981,58(1):339-366.
[10] LEVITT J. Responses of plants to environmental stress[J]. Water Relation, Salt and Other Stresses,1980,2(2):606.
[11] 杨淑红,宋德才,刘艳萍,等.土壤干旱胁迫和复水后3个杨树品种叶片部分生理指标变化及抗旱性评价[J].植物资源与环境学报,2014,23(3):65-73.
[12] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[13] 张蜀秋.植物生理学实验技术教程[M].北京:科学出版社,2011.
[14] 黄承玲,陈训,高贵龙.3种高山杜鹃对持续干旱的生理响应及抗旱性评价[J].林业科学,2011,47(6):48-55.
[15] 李钧.华北地区板栗主栽品种抗旱生理研究[D].北京:北京林业大学,2006.
[16] 时忠杰,杜阿朋,胡哲森,等.水分胁迫对板栗幼苗叶片活性氧代谢的影响[J].林业科学研究,2007,20(5):683-687.
[17] 苏寒之,金建邦,祝遵凌.干旱胁迫对北美红栎幼苗生理特性的影响[J].东北林业大学学报,2014,42(8):35-39.
[18] 李嫱,王佳,崔虎亮,等.干旱胁迫对翠菊苗期生理生化特性的影响[J].东北林业大学学报,2012,40(11):35-37.
[19] 王建华,刘鸿先,徐同.超氧化物歧化酶(SOD)在植物逆境和衰老生理中的作用[J].植物生理学通讯,1989,25(1):1-5.
[20] 张鹏,孙明高,宋尚文,等.干旱胁迫对板栗幼苗保护酶活性的影响[J].山东农业大学学报(自然科学版),2010,41(1):6-10.
[21] 吴强盛,夏仁学,张琼华.果树对水分胁迫反应研究进展[J].亚热带植物科学,2003,32(2):72-76.[22] 柯世省,杨敏文.水分胁迫对云锦杜鹃抗氧化系统和脂类过氧化的影响[J].园艺学报,2007,34(5):1217-1222.
[23] 徐莲珍,蔡靖,姜在民,等.水分胁迫对3种苗木叶片渗透调节物质与保护酶活性的影响[J].西北林学院学报,2008,23(2):12-14.
[24] 单长卷,梁宗锁.土壤干旱对刺槐幼苗水分生理特征的影响[J].山东农业大学学报(自然科学版),2006,37(4):598-602.
[25] 李继文,王进鑫,张慕黎,等.干旱及复水对刺槐叶水势的影响[J].西北林学院学报,2009,24(3):33-36.
[26] 赵燕,李吉跃,刘海燕,等.水分胁迫对5个沙柳种源苗木水势和蒸腾耗水的影响[J].北京林业大学学报,2008,30(5):19-25.
[27] 王海珍,韩路,李志军,等.塔里木河上游胡杨与灰杨光合水分生理特性[J].生态学报,2009,29(11):5843-5850.
[28] 招礼军,李吉跃,于界芬,等.干旱胁迫对苗木蒸腾耗水日变化的影响[J].北京林业大学学报,2003,25(3):42-47.
[29] 王丁,姚健,杨雪,等.干旱胁迫条件下6种喀斯特主要造林树种苗木叶片水势及吸水潜能变化[J].生态学报,2011,31(8):2216-2226.
[30] 谭雪红.5种灌木的生理特性及抗旱性的综合评价[J].东北林业大学学报,2013,41(2):29-34.
Physiological Response of Five Chinese Chestnut Varieties of Drought Stress and Evaluation of Drought Resistance//
Wu Yanqi, Guo Sujuan
(Key Laboratory for Silviculture and Conservation, Ministry of Education, Beijing Forestry University, Beijing 100083, P. R. China)//Journal of Northeast Forestry University,2017,45(1):20-24,29.
Chinese chestnut varieties; Drought stress; Physiological indexes; Drought resistance; Subordinate function method
1)国家林业公益性行业科研专项重大项目(201204401)、“十二五”科技支撑专题(2013BAD14B0402)。
武燕奇,女,1992年7月生,省部共建森林培育与保护教育部重点实验室(北京林业大学),硕士研究生。E-mail:YQ15525@163.com。
郭素娟,省部共建森林培育与保护教育部重点实验室(北京林业大学),教授。E-mail:gwangzs@263.net。
2016年8月18日。
S792.18;Q945.78
责任编辑:任 俐。
