间接酶联免疫吸附测定河豚鱼中河豚毒素*
2017-01-16严忠雍顾蓓乔张小军李佩佩高学慧
严忠雍, 顾蓓乔, 张小军, 方 益, 李佩佩, 龙 举, 高学慧
(1浙江省海洋水产研究所,浙江 舟山 316021;2 浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江 舟山 316021;3 浙江海洋大学水产学院,浙江 舟山 316021)
间接酶联免疫吸附测定河豚鱼中河豚毒素*
严忠雍1,2, 顾蓓乔1,2, 张小军1,2, 方 益1,2, 李佩佩1,2, 龙 举1,2, 高学慧3
(1浙江省海洋水产研究所,浙江 舟山 316021;2 浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江 舟山 316021;3 浙江海洋大学水产学院,浙江 舟山 316021)
为有效确保食用河豚鱼的安全性,进一步监测河豚鱼中河豚毒素,本方法应用间接酶联免疫吸附测定河豚鱼中河豚毒素的含量,评估河豚鱼的安全风险程度。实验结果表明,间接酶联免疫吸附法测定河豚毒素灵敏度高,方法的在线性范围为2~135 μg/L内有良好的线性关系,且方法的回收率达到82.4%~92.5%,检出限能达到2 μg/kg。本方法快速、简单,完全满足实际工作的需要。
间接酶联免疫吸附;河豚鱼;河豚毒素
河豚毒素(TTX)是一种天然海洋生物神经毒素,分布广泛,主要存在于河豚鱼中,在蟾蜍、蓝环章鱼、螺类等其他动物体内也有存在。河豚毒素毒性极强,食用0.5 mg就可致人死亡,河豚毒素可通过对细胞纳离子通道的阻断作用而抑制神经冲动的传导,使感觉神经麻痹,四肢瘫痪,呼吸困难,最后因呼吸抑制而死亡[1-3]。因此每年都有因食河豚鱼而导致中毒的事件发生。鉴于河豚中毒的严重危害,我国严禁河豚鲜售鲜食。但由于人们嗜食习惯和河豚的昂贵的价格,我国鲜河豚非法制售活动屡禁不止。因此建立快速、有效的检测和控制河豚毒素的方法显得非常必要。
目前,河豚毒素的检测方法有生物测定法、高效液相色谱法、气相色谱质谱法及免疫化学测定法等[4]。其中生物测定法[5-7]一般需要专门动物,适用性差,且操作繁琐,费时费力重复性差;物理化学检测法[8-10]虽灵敏度较高,但检测成本高,仪器昂贵且检测周期长。酶联免疫吸附剂测定法[11]灵敏度高、特异性强、检测成本低,其中国家标准GB/T 5009.206-2007《鲜河豚鱼中河豚毒素的测定酶联免疫》[12]是目前我国检测河豚鱼中河豚毒素时普遍使用的方法。但是该方法前处理非常复杂,且酶联免疫反应耗时长,操作难度较大。因此,有必要建立一种快速、高效、简便、灵敏的检测方法。本研究建立一种以单克隆抗体为基础的免疫学检测方法,具有特异性强,灵敏度高快速、操作简便、经济快捷的特点,满足河豚毒素快速筛检的需要,适合实际检测工作。
1 实 验
1.1 仪器和试剂
MK3微孔板酶标仪,美国Thermo Labsystems公司;MS2漩涡混合器,德国IKA公司;Centrifuge5810高速离心机,德国Eppendorf公司;T18匀浆机,德国IKA公司;恒温孵育箱,上海一恒科技有限公司;纯度≥98%的河豚毒素标准品,德国Dr公司;河豚毒素试剂盒,购自江苏美正生物有限公司。实验所用其他试剂均为分析纯。
1.2 溶液系统
TTX标准溶液:将河豚毒素标准品溶于0.2 mol/L pH:4.0乙酸盐缓冲液中,配制成浓度为1.0 mg/mL标准储备液,4 ℃避光保存,保存期为6个月。
1.3 样品采集与制备
1.3.1 样品采集
于我国东南沿海11月间野捕河豚鱼,采集后低温冷藏处理,保存在冷冻状态中运输至实验室。
1.3.2 样品制备
对冷藏样品解冻后,用蒸馏水清洗鱼体表面污物,滤纸吸干,将鱼分解成肌肉、肝脏、卵巢(雄性为精囊)等部分,各部分组织分别用蒸馏水洗去血污,滤纸吸干水分后充分均质称重。
1.4 样品提取
称取上述均质样品(1.00±0.02)g于50 mL聚苯乙烯离心管中,加入样品提取液1 mL,涡旋振荡3 min,4000 r/min离心10 min,取50 μL供分析。
1.5 样品测定
将试剂盒回温至室温,加样品50 μL每孔到微孔中,加河豚毒素抗体试剂每孔50 μL,轻轻振荡混匀,用盖板膜盖板后置孵育箱25 ℃避光反应30 min。揭开盖板膜,将孔内液体甩干,加洗板液250 μL每孔到微孔中。充分洗涤4次(每次间隔10 s)后,加河豚毒素酶标物溶液100 μL每孔到微孔中,用盖板膜盖板25 ℃避光反应30 min,洗涤4次。加入底物液A每孔50 μL,再加入底物液B每孔50 μL,用盖板膜盖板置孵育箱25 ℃避光反应15 min。加入终止液50 μL每孔到微孔中,于双波长450/630 nm测定吸光值。
2 结果与讨论
2.1 线性范围及检出限
用TTX毒素储备液分别配制浓度为2,5,15,45,135 μg/L 的标准溶液,用间接ELISA法测定制作校准曲线,如图1所示。该方法的线性范围为2~135 μg/L,对TTX的最低检出限为2 μg/L。
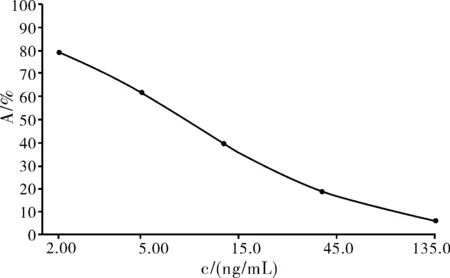
图1 TTX标准曲线
2.2 加标回收与精密度
在1.00 g阴性河豚鱼肉中添加10、40、70、100 μg/kg的TTX标准溶液,每个添加水平平行测定3次,计算其回收率和精密度,见表1。结果表明,方法在10~100 μg/kg之间的添加水平的回收率为82.4%~92.5%,完全符合TTX的检测要求。

表1 TTX的回收率和相对标准偏差
注:n=3。
2.3 ELISA检测方法与液相串联质谱法的比较
用本方法和液相串联质谱法(采用文献报道[13]方法)对6份河豚鱼肉样品分别进行TTX检测,并比对两种方法的检测结果,结果如表2所示。由表2可知,两种检测方法的测定结果基本符合,并无明显差异,表明本方法的灵敏度和准确度完全满足TTX的检测要求。

表2 ELISA法与液质联用法的检测结果
*ND为未检出。
2.4 实际样品测定
用本方法对我国东南沿海野捕的10河豚鱼样品进行检测,检测发现6个阳性样品。6个阳性样品对应的TTX浓度分别为8.92、20.31、82.56、15.84、25.27和37.72 μg/kg,表明野生河豚鱼多数带毒。因此,有必要对河豚鱼进行常规监测和严格控制。
3 结 论
本方法在原有的检测标准上进行条件优化,简化实验步骤,缩短检测时间,提高工作效率。本方法的灵敏度和准确度完全满足日常TTX的检测需要,适宜推广于实际工作使用。
[1] 计融,王健伟,罗雪云,等.河豚鱼类中河豚毒素直接竞争抑制性酶联免疫吸附试验测定方法的研究[J].中国食品卫生杂志,2005,14(5):7-10.
[2] 李世平,焦新安,黄金林,等.河豚毒素两种定量检测方法的比较研究[J].扬州大学学报, 2004,25(2):58-60.
[3] 纪元,刘岩,宫庆礼.小鼠生物法和酶联免疫法(ELISA)定量监测沿海5省养殖河豚鱼中的河豚毒素(TTX)[J].水产学报,2010,34(4):589-597.
[4] 周晓翠,谢光洪,刘国文,等.河豚毒素检测方法的研究进展[J].中国畜牧兽医,2008,35(7):43-45.
[5] 张理,谢克勤,赵金山,等.用昆明小鼠定量测试河豚毒素的研究[J].中国食品卫生杂志,2004,16(6):497-500.
[6] 段发淼,谢心磊,朱宝平.用小鼠单位法检测河豚毒素[J].中国卫生检验杂志,2000,10(4):463-464.
[7] 林蔚,林健,黄宗锈.用ICR小鼠生物法测定烤鱼片河豚毒素的研究[J].海峡预防医学杂志,2008,14(4):49-50.
[8] 陈唯真,朱伟华,俞如英.HPLC法测定河豚毒素的含量及稳定性[J].药物分析杂志,2004,24(1):41-43.
[9] Margaret A O’leary, Jennifer J Schneider, Geoffrey K Isbister. Use of high performance liquid chromatography to measure tetrodotoxin in serum and urine of poisoned patitents[J].Toxicon,2004(44):549-553.
[10]张虹,柳正良,黄蓓琳,等.反向离子对-高效液相色谱法测定河豚毒素[J].中国现代应用药学杂志,2001,18(3):197-198.
[11]宫慧芝,计融,江涛,等.河豚毒素单抗ELISA检测试剂盒的研制[J].中国公共卫生,2005,21(12):1423-1424.
[12]国家标准GB/T 5009.206-2007鲜河豚鱼中河豚毒素的测定酶联免疫[S].2007.
[13]李爱峰,于仁成,周名江.液相色谱-电喷雾离子阱质谱联用分析河豚毒素[J].分析化学,2007,35(3):397-400.
Determination of Tetrodotoxin in Puffer by Indirect Enzyme-linked Immunosorbent Assay*
YANZhong-yong1,2,GUBei-qiao1,2,ZHANGXiao-jun1,2,FANGYi1,2,LIPei-pei1,2,LONGJu1,2,GAOXue-hui3
(1 Marine Fisheries Research Institute of Zhejiang, Zhejiang Zhoushan 316021; 2 Key Lab of Sustainable Utilization of Technology Research for Fishery Resource of Zhejiang, Zhejiang Zhoushan 316021; 3 Zhejiang Ocean University,Zhejiang Zhoushan 316021, China)
An indirect ELISA method was developed to monitor tetrodotoxin in puffer and assess the security risk level of the puffer. The indirect ELISA method ensured the safety of puffer fish consumption and monitoring of tetrodotoxin in puffer fish. The indirect ELISA method was sensitive, the quantification limit of the method was 2 μg/kg with satisfactory sensitive. The recovery of tetrodotoxin was 82.4%~92.5% in the range of 2~135 μg/L. The method was rapid and simple, met the needs of practical work.
indirect enzyme-linked immunosorbent assay; puffer; tetrodotoxin
浙江省科研院所公共科技服务项目(2016F30020);舟山市科技计划项目(2015C31011)。
严忠雍(1990-),男,助理工程师,学士,主要从事渔业环境监测和水产品质量安全研究。
O656.31
B
1001-9677(2016)023-0098-03
