胃黏膜组织中肿瘤坏死因子α及iNOS表达水平与胃炎发病的关系研究
2017-01-16鲍文漪
鲍文漪
(天津市第一中心医院消化科,天津 300192)
胃黏膜组织中肿瘤坏死因子α及iNOS表达水平与胃炎发病的关系研究
鲍文漪
(天津市第一中心医院消化科,天津 300192)
目的 研究胃炎发病与肿瘤坏死因子α(TNF-α)及诱导型一氧化氮合酶(iNOS)表达水平的相关性研究。方法 选取114例慢性胃炎患者为研究对象,根据胃镜与组织学检查结果进行分析,包括Hp阳性54例,Hp阴性60例,以放射免疫法检测TNF-α,免疫组织化学法检测iNOS表达水平,以分析上述两项指标与胃炎发病的相关性,并研究胃黏膜炎症程度在两组中的分布。结果 Hp阳性组TNF-α为(1.41±0.33)ng/mg VS(0.64±0.22)ng/mg,显著高于对照组(P<0.05);观察组iNOS(69.34±6.10)% VS(21.94±3.87)%显著高于对照组(P<0.05)。Hp阳性组轻、中、重度占66.67%,显著高于Hp阴性组的11.67%(P<0.05)。结论 胃黏膜组织TNF-α及iNOS水平上升与胃炎发生发展有关。
胃黏膜组织; 肿瘤坏死因子α; iNOS; 胃炎
慢性胃炎多由幽门螺杆菌(Hp)感染引发,发达国家为30%~50%,发展中国家高达80%以上[1,2]。Hp为慢性胃炎的关键诱因,其与慢性胃炎活动有密切联系,同时细胞毒素、黏附分子、细胞因子/炎症递质均参与Hp感染的炎症反应,细胞因子对中性粒细胞有趋化、激活作用,可导致机体出现非特异性炎症反应,进而导致胃黏膜受损。同时肿瘤坏死因子α(TNF-α)和白介素1β(IL-1β)还被发现参与了慢性胃炎的病理过程,而Hp感染时可刺激一氧化氮合成酶(iNOS)产生大量的一氧化氮(NO)同为病发的重要机制。本文探讨TNF-α、iNOS水平与Hp胃炎相关性,现报告如下。
1 资料与方法
1.1 一般资料 选取我院2011年2月至2014年1月114例慢性胃炎患者为研究对象,均符合2012年中国慢性胃炎共识意见中诊断标准,根据胃镜与组织学检查结果分为Hp阳性组(54例)与Hp阴性组(60例),Hp阳性组男25例,女29例,年龄22~67岁,平均(41.32±7.45)岁;Hp阴性组男28例,女32例,年龄21~66岁,平均(40.90±7.35)岁,两组的年龄、性别等基线资料差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 病理组织学检测 完成石蜡包埋、切片、HE染色,于显微镜下对胃黏膜病理学组织学改变进行观察,组织切片HE染色完成后盲选一名不了解患者情况、研究目的的医生进行病理组织学诊断。
1.2.2 TNF-α表达水平检测 收集患者清晨空腹血,离心,4 ℃ 3 000 r/min,离心 15 min,提取上清,稀释度3倍,严格按TNF-α试剂盒要求,采用酶联免疫吸附法测定 TNF-α。
1.2.3 iNOS表达水平检测 以免疫组织化学法检测进行测定,先切片常规脱蜡至水,尿素消化30 min,10 mL/L过氧化氢封闭内源酶0.5 h,正常羊血清在37 ℃下放置0.5 h,后滴加一抗4 ℃放至隔天,将生物素羊抗兔IgG(1∶100)37 ℃ 40 min,滴入ABC复合物(1∶100)37 ℃ 40 min,DAB显色后苏木精衬染,脱水透明封片,分为PBS置换一抗(阴性对照组)与明确5-HT染色阳性小鼠小肠切片(阳性对照组)。光镜辅助下400视野观察每片中相对染色强、阳性细胞多的部位,得出阳性细胞所占比重,将400视野内阳性细胞占有面积比例进行综合。最终免疫组化结果判定为染色阳性信号处于细胞值,且颜色为棕黄到黄色。
1.3 观察指标 (1)对比Hp阳性组与Hp阴性组TNF-α和iNOS水平;(2)慢性胃炎严重程度,根据胃黏膜的炎症细胞密度,将患者分为3个等级,轻度:炎症细胞轻度浸润,占胃黏膜全层1/3;中度:炎症细胞浸润处于1/3~2/3之间;重度:炎症细胞浸润面积基本达全黏膜层,同时伴胃小凹、黏膜上皮坏死等。
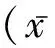
2 结 果
2.1 Hp阳性组与Hp阴性组TNF-α和iNOS比较 Hp阳性组TNF-α水平及iNOS表达均高于Hp阴性组,差异有统计学意义(P<0.05),见表1。

表1 Hp阳性组与Hp阴性组TNF-α和iNOS比较
2.2 两组慢性胃炎严重程度对比 Hp阳性组重度胃炎占66.67%,显著高于Hp阴性组的11.67%比较差异有统计学意义(χ2=36.6,P<0.01)。
3 讨 论
Hp为革兰阴性细菌,对单核细胞有刺激作用,外膜成分中含有脂多糖,可使单核细胞、巨噬细胞分泌促炎症递质分泌,同时鞭毛蛋白也发挥协同作用。另外Hp在为乳液与胃黏膜上皮的中性微氧环境中定殖,可立即释放出VacA、CagA等毒素,最终可加重炎症反应。
TNF-α为单核细胞、巨噬细胞受到致炎因子影响后所释放的细胞因子,为促炎症蛋白,可使中性粒细胞出现移动,具体机制为调控内皮细胞上黏附分子和中性粒细胞表达,还可诱导中性粒细胞黏附、白细胞穿出血管壁,导致胃黏膜内细胞损伤,进而减少血流量。胃黏膜血流是胃黏膜整体防御机制的重点,因此出血可直接导致胃黏膜损伤。同时TNF-α能够作用于靶细胞膜的磷脂代谢,进而导致氧自由基出现,引发溶酶体破裂,使组织出现损伤和死亡。
NO主要由iNOS催化形成,iNOS活性变化可使NO生成量与正常的生物效应受到影响。其具有广泛生物效应,具有正反两面性,一方面有生理功能,同时又是炎症递质。正常生理状态下,胃黏膜血管内皮细胞与神经元产生的NO含量较低,主要作用为调节闭黏液与胃黏膜微循环与黏液的分泌,是胃黏膜的重要保护物质。在炎症的病理状态下,NO过量产生会导致羟自由基和过氧硝基阴离子的毒性上升,或可引发正常基因突变。有研究显示Hp感染可提高NO水平,而炎症细胞分泌以及大量细胞因子的释放可提高iNOS表达[10]。本次研究结果显示Hp阳性组TNF-α及iNOS显著高于对照组(P<0.05)。Hp阳性组重度胃炎占66.67%,显著高于Hp阴性,可说明TNF-α与iNOS表达水平上升与胃炎发生发展密切相关,应引起临床关注。
[1]赵敏,吕宾,黄宣,等.胃复春对肿瘤坏死因子诱导人胃上皮GES-1细胞炎症和肠化的影响.中国中西医结合消化杂志,2012,20(9):394-397.
[2]中华医学会消化病学分会.中国慢性胃炎共识意见(2012年,上海).中华消化杂志,2013,33(1):5-16.
[3]伍红英,方慧祺,邓燕,等.尾型同源异型盒基因2、肿瘤坏死因子α蛋白表达及幽门螺杆菌感染与慢性胃病伴肠上皮化生关系研究.中国医师进修杂志,2014,37(4):20-23.
[4]中华医学会消化内镜学分会.慢性胃炎的内镜分型分级标准及治疗的试行意见.中华消化内镜杂志,2004,21(2):77-78.
[5]Kao CY, Sheu BS, Wu JJ.CsrA regulates Helicobacter pylori J99 motility and adhesion by controlling flagella?formation.Helicobacter. 2014,19(6):443-454.
[6]Noche CD, Njajou O, Etoa FX.No Association between CagA-and VacA-Positive Strains of Helicobacter pylori and Primary Open-Angle Glaucoma: A Case-Control Study.Ophthalmol Eye Dis,2016,2:1-4.
[7]Qu B, Han X, Ren G,et al.Influence of H.pylori CagA Coupled with Alcohol Consumption on Cytokine Profiles in Men. Medicine (Baltimore),2016 ,95(5):e2721.
[8]Zhang X, Jiang A, Qi B,et al.Resveratrol Protects against Helicobacter pylori-Associated Gastritis by Combating Oxidative Stress. Int J Mol Sci,2015,16(11):27757-27769.
[9]Lee SH, Park JW, Go DM,et al.Ablation of osteopontin suppresses N-methyl-N-nitrosourea and Helicobacter pylori-induced gastric cancer development in mice.Carcinogenesis,2015 ,36(12):1550-1560.
[10]Zhang H, Ding C, Suo Z, et al.Effect of “Helicobacter pylori” on cyclooxygenase-2 and inducible nitric oxide synthase in patients with gastric precancerous lesions and its clinical significance.Exp Ther Med. 2015,9(6):2364-2368.
R735.2
B
1000-744X(2016)07-0701-02
2016-01-06)
