鸡肠道内乳酸菌的分离鉴定及体外抑菌试验
2017-01-14
(石河子大学动物科技学院,新疆石河子 832003)
鸡肠道内乳酸菌的分离鉴定及体外抑菌试验
刘 鸽,刘绒欢,刘升兰,张培生,于会举,张 倩,屈勇刚
(石河子大学动物科技学院,新疆石河子 832003)
为获得鸡肠道内抑菌效果好、适应性强的乳酸菌,从健康鸡小肠内容物中分离乳酸杆菌,并对其进行生化鉴定。结果成功从鸡小肠中分离出6株细菌。通过革兰氏染色和生化鉴定,发现这6株细菌分别是微小乳酸菌(L.minor)、约氏乳杆菌(L.johnsonii)、弯曲乳杆菌(L.curvatus)、肠乳杆菌(L.intestinalis)、嗜酸乳杆菌(L.acidlophilus)、植物乳杆菌(L.plantarum)。对分离到的6 株乳酸菌进行体外抑菌试验,结果表明肠乳杆菌(L.intestinalis)对大肠杆菌有一定的抑菌作用。该研究为后期开发益生菌制剂奠定了一定的基础。
鸡;乳酸杆菌;分离鉴定;体外抑菌试验
益生菌在1965年首次被定义为一种微生物分泌的,可以刺激另一种微生物生长的物质。1989年Fuller[1]把益生菌定义为在一定程度上可对宿主起到有益作用的活微生物制剂。1992年Fuller[2]又详细描述了益生菌制剂应符合以下标准:要有存活能力,达到工业化生产的标准;活性稳定,便于控制;在肠内或其他生存环境内,具有存活能力(不一定繁殖);必须对宿主产生有益作用;无毒、无害、安全、无副作用。
乳酸菌是一种研究较多的益生菌,其应用早、制剂多。乳酸菌产生的特殊抗生素(酸菌素)可抑制沙门氏菌和大肠杆菌的生长。乳酸菌类益生菌的应用在近十年发展很快,是动物营养学研究中的一个热点。鸡大肠杆菌病是影响养禽业的主要细菌病之一,常给养殖企业带来巨大的经济损失。由于长期饲喂抗生素,导致了耐药菌株的生成以及畜禽产品中严重的药物残留,从而威胁人类健康。乳酸菌类益生菌制剂避免了抗生素长期使用而出现的毒副作用及耐药性或抗药性问题,可防治微生态平衡失调,同时可促进畜禽生长发育,提高饲料消化、吸收和转化的效率,增加肉蛋产率,而且产品中无残留污染,符合绿色食品要求。目前,关于乳酸菌类益生菌的研究已成为国内外热点。基于上述情况,本试验拟分离并驯化鸡肠道益生菌,为生物防治鸡细菌性疾病奠定基础,为养禽业和科学研究提供一定的参考。
1 材料与方法
1.1 试验材料
1.1.1 样品来源。健康鸡的肠道内容物,从石河子市金马市场购买。
1.1.2 培养基和试剂盒。营养肉汤;营养琼脂;分离培养基(MRS培养基,北京索莱宝科技,加0.75% CaCO3和营养琼脂);菌种保藏及传代培养基(MRS 固体培养基,配法和分离培养基配法相同,不加CaCO3);生化鉴定培养基;乳酸菌成套生化鉴定管;快速革兰氏染色液。
1.1.3 指示菌来源。鸡致病性大肠杆菌由石河子大学动物科技学院传染病实验室提供。指示菌放于超低温冰箱中,且保存完好,没有被污染。
1.1.4 主要仪器。电子天平(北京赛多丽斯仪器厂);调温电热套(山东省邺城永兴仪器厂);电热恒温培养箱(上海精宏实验设备厂);电热恒温水浴锅(北京市永光明医疗仪器厂);光学显微镜(CX21FS1,日本);净化工作台(上海鸿都电子科技有限公司);恒温振荡培养箱(上海智城);移液器(德国 Eppendorf);厌氧罐。
1.2 方法
1.2.1 样品采集。从石河子市金马屠宰市场采集鸡的肠道,在实验室立即用无菌生理盐水冲洗至无肉眼可见的食糜后,刮取肠道粘膜1 g,放于无菌生理盐水中,依次用无菌生理盐水进行10倍梯度稀释,静置5 min后,取上清液,用以分离乳酸杆菌。
1.2.2 菌种分离。各取102、107、108、109、1010、1011稀释度的上清液,分别滴加到加0.75% CaCO3的MRS固体选择培养基上,且涂布均匀。把培养基小心装入厌氧罐(可以采用烛缸法),放入37 ℃的恒温箱中连续培养48 h左右。认真观察待检菌落的形成、发育和溶钙环的大小。挑取有明显溶钙环的单个菌,在MRS选择培养基上进行厌氧培养。在37 ℃恒温箱中培养24 h,观察细菌生长情况。再次接种培养,直到形成形态均一、分布均匀的单一菌落为止。
1.2.3 乳酸菌的鉴定
1.2.3.1 革兰氏染色[3]。挑选加入0.75% CaCO3的MRS培养基上的溶钙单个菌落,进行革兰氏染色试验,在镜下观察分离菌的形态。染色为红色的菌体为阴性,染色为蓝色的菌体为阳性。选择阳性菌,以及染色深浅不一、形态各异的杆菌进行纯化和革兰氏染色,选出阳性菌株做进一步鉴定。
1.2.3.2 生化试验[4-5]
1.2.3.2.1 接触酶试验。挑选MRS加钙培养基上的单个菌落于无菌的载玻片上,在每个单个菌上滴加一滴3%的H2O2溶液,混合均匀。如果发现有气泡,则判为阳性,无气泡则为阴性。
1.2.3.2.2 糖发酵试验。从琼脂的纯培养物上取少量菌,接种于糖发酵管培养基,在37 ℃恒温箱中连续培养48 h,及时观察培养液的颜色。如培养液仍为蓝色为“-”,变黄色为“+”;不产气为“-”,产气为“+”。
1.2.3.2.3 液化明胶试验。试验菌接种后放到适温培养环境下培养,其中两支管作空白对照。明胶培养基在20℃以下时凝固,24℃以上时能自行液化。而试验菌株通常在高于20℃的适温中培养,因此结果观察需在低温环境下。可把试验管和对照管放到冷水或冰箱中,等到对照管凝固后,及时准确记录试验结果。反复对比,多次观察。若对照管凝固时,接种管液化或明胶表面出现凹陷小窝,则判为阳性反应;凝固,则判为阴性反应。
1.2.3.2.4 硫化氢试验。将普通滤纸裁剪成0.5~1cm 宽的纸条,长度可根据实际需要适当调整。把纸条用5%~10%的醋酸铅溶液浸透,烘干,在培养皿中灭菌后备用。接种后加醋酸铅纸条,并用棉塞塞紧,使其悬于试管中,不能接触到管中的液面,放置于37℃恒温箱中培养。纸条若变黑,则为阳性,否则为阴性。
1.2.3.3 用生化鉴定管鉴定
1.2.3.3.1 准备实验。用力折开安瓿瓶,放到安瓿试管架中。操作过程中注意安全,不要伤及自己和他人。如果染菌或变色,则需换用新的。
1.2.3.3.2 接种方法。直接接种法:用接种针挑取已纯化的同一菌落,分别接种到相应试验的生化管中。菌悬液法:取1个内盛无菌水的试管,从纯化培养的平板上挑取单个菌落,放入无菌水中仔细研磨,制成0.5麦氏浊度的均一细菌悬液,滴入相应试管中,每管3滴。其中对固体和半固体生化管,采用穿刺接种。
1.2.3.3.3 接种后,放到(36±1)℃的恒温箱中培养。使用封口膜将试管封口;封口膜在使用前可用75%酒精擦拭灭菌。
1.2.4 活菌液对致病菌的抑菌试验。采用琼脂扩散法[6-7]。把致病菌悬液均匀涂布在厚度约为4 mm的营养琼脂平板上,室温下静置30 min,使菌液得到充分吸收。然后在琼脂上打孔径约5 mm的孔,封底。用制备的各菌株菌液加满孔,置适宜温度下培养24 h,测量抑菌圈直径。本试验做3个平行实验,取平均值。判断标准[9]:φ≤5 mm,不敏感;φ5~10 mm,低度敏感;φ10~15 mm,中度敏感;φ≥15 mm,高度敏感。
2 结果与分析
2.1 细菌分离与染色形态特征
从鸡肠道中分离了6株细菌(分别标记为1号、3号、5号、6号、7号、8号)。这6株菌在0.75%CaCO3的MRS培养基上长出乳白色菌落,染色镜检为G+杆菌,结果见表1、图1、图2。
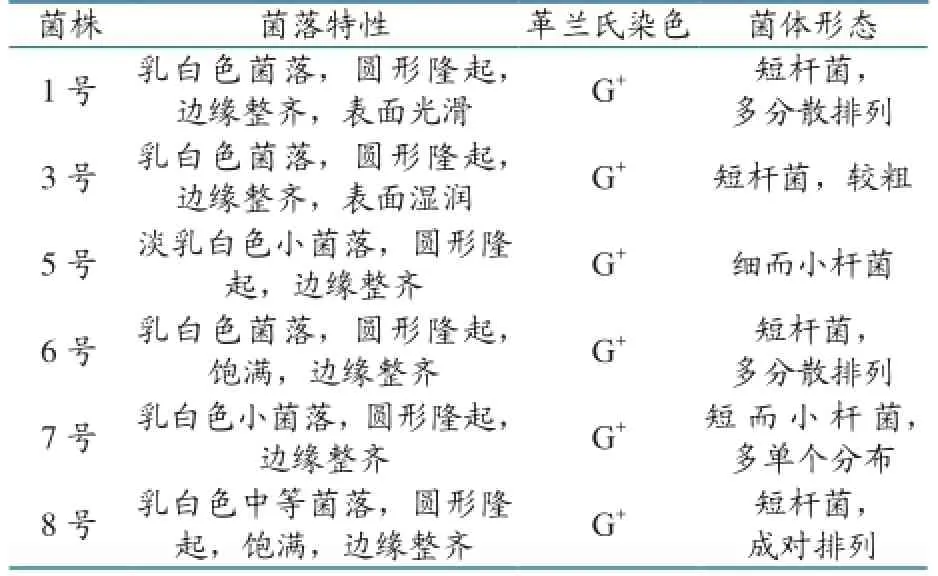
表1 分离菌的染色及形态特性
2.2 生化鉴定结果
对分离得到的6株菌分别进行过氧化氢酶试验、明胶液化试验、硫化氢试验、各种糖发酵试验及乳酸菌微管鉴定试验,结果见表2、表3。

图1 纯化分离菌的试验结果

图2 分离菌(6号)的形态及染色特征

表2 分离菌株的生化试验结果
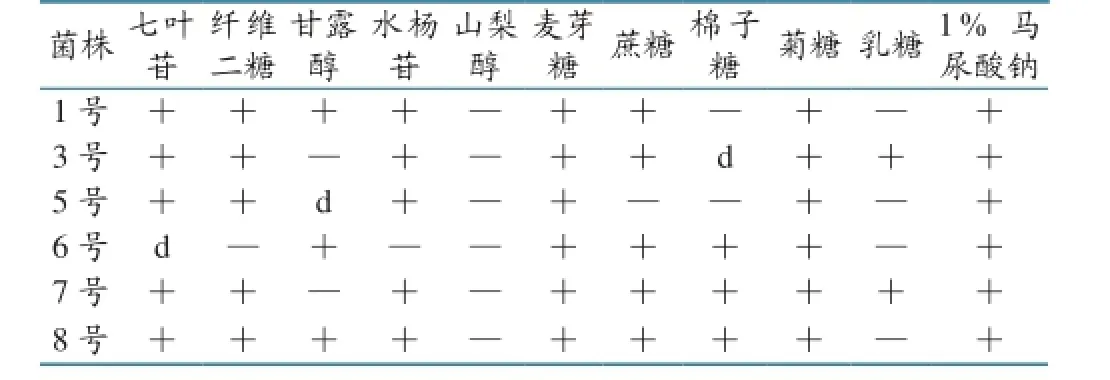
表3 细菌微量生化鉴定管(乳酸菌)鉴定结果
根据菌落形状大小、革兰氏染色镜检特性,以及各生化反应结果,参考《乳酸菌分类鉴定及实验方法》[8]和《常见细菌系统鉴定手册》[9]进行综合判定,确定得到的纯化菌株种属。乳酸菌种的鉴定结果:1号为微小乳酸菌(L.minor),3号为约氏乳杆菌(L.johnsonii),5号为弯曲乳杆菌(L.curvatus),6号为肠乳杆菌(L.intestinalis),7号为嗜酸乳杆菌(L.acidlophilus),8号为植物乳杆菌(L.plantarum)。
2.3 体外抑菌试验结果
6株乳酸杆菌的体外抑菌试验结果见表4。微小乳酸菌不敏感,约氏乳杆菌、嗜酸乳杆菌、植物乳杆菌为低度敏感,弯曲乳杆菌、肠乳杆菌为中度敏感。相对来说抑菌效果最佳的是肠乳杆菌。

表4 不同乳酸菌对大肠杆菌产生的抑菌圈大小
3 结论与讨论
本试验材料是小鸡的肠道粘膜。乳酸菌在动物的不同种属、不同年龄、不同消化道部位的含量不同。鸡日龄越大,肠道中的乳酸菌含量越少;鸡胃和小肠中的乳酸菌含量比大肠和粪便中的多。冲洗食糜,从粘膜上分离乳酸菌就是为了避免从饲料中带入细菌造成的影响。小鸡价格便宜,体型较小,因此小鸡肠道粘膜作为试验材料是比较理想的。
本次试验共从小肠粘膜中分离出6株乳酸菌。对其纯化时,在37 ℃温箱中培养24~36 h。如果时间过长,菌落就容易长成一片,不容易长出单个菌落;时间太短,菌落形态就不理想。因此,在培养时要特别注意对时间的把控。
应注意保存分离得到的乳酸菌。如果接种在MRS斜面培养基上,则需保存于4 ℃冰箱中。乳酸菌在MRS斜面培养基上可以存活一周左右,所以接种一周后要重新接种保存。也可以使用MRS甘油冷冻保存,至少可保存8个月以上。
乳酸菌平板划线时,应尽量划细并逐步灼烧以减少含量,这样比较容易得到单个菌落。
在鸡肠道内的多种细菌中,最具代表性的有益菌是乳酸杆菌[10]。临床试验和实验室研究表明,乳酸菌对肠道内的细菌,如大肠杆菌、沙门氏菌等所引起的肠道感染有较为明显的拮抗作用[11]。乳酸菌分离后的抑菌试验也对此有所证实,尤其是对致病性大肠杆菌有一定的抑制作用,可以作为益生素的备用菌株。本研究为开发应用乳酸菌提供了参考依据和菌种保证。
[1] FULLER R. Probiotics in man and animals[J]. J.Appl. Bacteriol,1989,66:365-378.
[2]王焕.鸡源益生菌BL-Y-1菌株分离鉴定、发酵条件及其耐受性研究[D].保定:河北农业大学,2009.
[3] 胡桂学.兽医微生物学实验教程[M].北京:中国农业大学出版社,2006:32-46.
[4] 谷子林.断奶仔兔腹泻发生机制及生物活性物质的调控研究[D].哈尔滨:东北农业大学,2004.
[5] 凌代文,东秀珠.乳酸菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:6-124.
[6] 田召芳.治疗性乳酸杆菌的筛选、应用及生物学特性研究[D].泰安:山东农业大学,2003.
[7] 蒋建军,肖红冉.仔猪胃肠道优良性状乳酸杆菌的分离和鉴定[J].石河子大学学报(自然科学版),2012,30:44.
[8] 张文鑫,龚伟.四种活菌剂对仔猪黄痢病原菌的体外抑菌试验[J].云南农业大学学报,1997(2):133-136.
[9] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:289-294.
[10] FULLER R.益生素的作用及其在生产中的应用[J].国外畜牧科技,1992,19:38-39.
[11] 王蔚淼,潘玲.青贮饲料中乳酸菌的体外抑菌试验及其细菌素的提取[J].饲料博览,2006(4):1-3.
(责任编辑:朱迪国)
Isolation and Identification of Lactobacillus in Intestinal Tract of the Chickens and Its Antibacterial Test in Vitro
Liu Ge,Liu Ronghuan,Liu Shenglan,Zhang Peisheng,Yu Huiju,Zhang Qian,Qu Yonggang
(College of Animal Science and Technology,Shihezi University,Shihezi,Xinjiang 832003)
In order to obtain Lactobacillus with good antimicrobial activity and strong adaptability in intestinal tract of chickens,the strains were isolated from small intestine of healthy chickens and identifed by biochemical test. As a result,6 strains were successfully isolated. Through Gram staining and biochemical test,it was identifed that these 6 strains were Lactobacillus minor(L.minor),L. johnsonii,L. curvatus,L. intestinalis,L. acidlophilus and L. plantarum. In vitro,the antibacterial tests were conducted,and the results showed that the L. intestinalis had a certain antibacterial activity against E.Coli,which would provide theoretical foundation for the development of probiotics.
chicken;Lactobacillus;isolation and identifcation;antibacterial test in vitro
book=86,ebook=92
S858.31
B
1005-944X(2017)01-0086-04
10.3969/j.issn.1005-944X.2017.01.024
新疆生产建设兵团重点领域科技攻关(2013BA002)
屈勇刚
