苦水玫瑰糖浆的研制及其抗氧化与抑菌作用研究
2017-01-13陈继华张宇霞胡妍芸
陈继华,王 波,张宇霞,胡妍芸,周 围,,*
(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;2.甘肃出入境检验检疫局综合技术中心,甘肃兰州 730000)
苦水玫瑰糖浆的研制及其抗氧化与抑菌作用研究
陈继华1,王 波2,张宇霞2,胡妍芸1,周 围1,2,*
(1.甘肃农业大学食品科学与工程学院,甘肃兰州 730070;2.甘肃出入境检验检疫局综合技术中心,甘肃兰州 730000)
以苦水玫瑰为原料研制玫瑰糖浆,在单因素实验的基础上选取料液比、提取时间、提取次数为实验因素进行L9(34)正交实验设计优化苦水玫瑰糖浆的制备工艺。通过研究玫瑰糖浆对2,2′-联氨-双(3-乙基苯+并噻唑啉-6-磺酸)二胺盐(ABTS)的清除作用,探讨其体外抗氧化活性;并采用滤纸片法研究其抑菌效果。结果表明:苦水玫瑰糖浆的最佳制备工艺参数为:料液比1∶40,提取时间2 h,提取次数4次,蔗糖添加量45%,柠檬酸添加量0.15%,在此工艺条件下制得的苦水玫瑰糖浆酸甜适中,有浓郁的玫瑰花香,口感清爽,葡萄糖当量(DE值)14.94%,水分54.27%,相对甜度4,粘度500 mPa·s,pH3.43,总黄酮含量1.95 g/L,密度1.15 g/mL,且具有较强的体外抗氧化活性和抑菌效果:对ABTS+·的半数抑制浓度(IC50)为186.1 μL/L;对金黄色葡萄球菌和大肠杆菌的抑菌圈直径分别为(1.37±0.09) cm和(1.67±0.14) cm。
玫瑰糖浆,研制,抗氧化,抑菌
苦水玫瑰(R.Setate×R.Rugosa)属于重瓣玫瑰花,是我国传统玫瑰与钝齿蔷薇的杂交品种,有着200多年的栽培历史[1-2]。玫瑰花含有挥发油、酯类、苯乙醇、香茅醇、有机酸、花青素、蜡质、胡萝卜素等几十种对人体有益的成分,具有缓减疲劳、镇静安神,给人以愉悦之感[3-7]。其中,玫瑰花中的花青素是安全的天然食用色素,多酚类物质则是一种重要的抗氧化物质,其酚羟基具有很强的还原性,具有抗氧化活性,能有效清除自由基成分,具有美容养颜等功效[8-9]。玫瑰提取物对艾滋病、白血病有明显的抗病毒作用[10]。
近年来,甘肃省苦水玫瑰种植面积逐年增长,仅苦水镇种植面积就高达4.9万亩,每年6~8月份,大量苦水玫瑰花上市,但其主要加工方式仅限于鲜花饼、烘干花蕾、玫瑰花露及玫瑰精油等。对苦水玫瑰的研究也主要集中在玫瑰精油的提取及应用上;而苦水玫瑰糖浆的研制、功效及相关研究国内外未见文献报道。目前,对糖浆的研究主要集中在具有一定疗效的药用糖浆。肖泽琼[11]确定了健脾补肺糖浆的生产工艺;刘志明等[12]以优质枸杞为原料制作枸杞糖浆,为解决糖浆市场产品单一的问题做了一定贡献,但对于玫瑰糖浆的研究匮乏。
本文以苦水玫瑰为原料,在单因素实验的基础上通过正交实验优化了制备具有最佳抗氧化活性苦水玫瑰糖浆的工艺参数,2,2′-联氨-双(3-乙基苯+并噻唑啉-6-磺酸)二胺盐(ABTS)法研究苦水玫瑰糖浆体外抗氧化活性,滤纸片法测定了玫瑰糖浆的抑菌作用,旨在获得最佳的制备工艺,为苦水玫瑰产业的发展开创新的空间,促进苦水玫瑰在食品、药品及医疗保健等领域的应用,提高苦水玫瑰的附加值,为其工业化生产提供参考。
1 材料与方法
1.1 材料与仪器
苦水玫瑰花 采自甘肃省苦水玫瑰工程技术研究中心苦水玫瑰基地(永登县);培养基 胰酪胨大豆肉汤(胰胨17 g/L、多价胨3 g/L、氯化钠5 g/L、磷酸氢二钾2.5 g/L、葡萄糖2.5 g/L、蒸馏水1000 mL,pH7.3±0.2),营养肉汤(蛋白胨10 g/L、牛肉膏3 g/L、氯化钠5 g/L、蒸馏水1000 mL,pH7.4);供试菌种 金黄色葡萄球菌(Staphylococcusaureus,ATCC 29213)、大肠杆菌(Escherichiacoli,ATCC 8739) 甘肃省检科院食品微生物实验室保存;1号定性滤纸 上海飞岭化工科技有限公司;芦丁、2,2′-联氨-双(3-乙基苯+并噻唑啉-6-磺酸)二胺盐(ABTS) 上海源叶生物科技有限公司,色谱纯;过(二)硫酸钾 天津市科密欧化学试剂有限公司,优级纯;柠檬酸、无水乙醇、氢氧化钠、亚硝酸钠、硝酸铝 天津市登丰化学品有限公司,分析纯;蒸馏水 广州屈臣氏;白砂糖。
Lambda 25UV型紫外分光光度计 美国珀金埃尔默公司;3K30型冷冻离心机 德国Sigma公司;AG204型电子天平 瑞士METTLER TOLEDO公司;SLR型电磁加热搅拌器 德国SCHOTT公司;Memmert IN160 恒温培养箱 德国Memmert公司。
1.2 实验方法
1.2.1 工艺流程 新鲜玫瑰花→低温烘干(60 ℃)→粗粉碎→加水煎煮(提取)→过滤→2、3、4次煎煮过滤→滤液浓缩定量→加糖熬制→加柠檬酸→成品
1.2.2 单因素实验条件的选择 设计料液比1∶40(g/mL)、提取时间2 h、提取次数1次、蔗糖添加量40%、柠檬酸添加量0.1%,固定其他条件,分别考察料液比(1∶30、1∶40、1∶50、1∶60、1∶70、1∶80)、提取时间(0.5、1、2、3、4、5 h)、提取次数(1、2、3、4、5、6次)、蔗糖添加量(40%、45%、50%、55%、60%)、柠檬酸添加量(0.05%、0.1%、0.15%、0.20%、0.25%)对ABTS+·清除能力的影响。此外根据文献[13]中玫瑰花酱感官评分标准,对不同蔗糖和柠檬酸添加量所制得的玫瑰糖浆进行感官评价,确定最佳添加量。
1.2.3 正交实验设计 以单因素实验结果为依据,选取对抗氧化能力有明显影响的3个因素:料液比、提取时间、提取次数,以对ABTS+·清除能力为评价指标,进行正交实验设计,共9个实验点,每个实验点做3个平行,取其平均值。因素水平设计如表1所示。

表1 正交实验设计因素水平
1.2.4 总黄酮含量测定
1.2.4.1 芦丁标准曲线的绘制 采用亚硝酸钠-硝酸铝比色法,参照李绚等[14]的方法略加修改,制作芦丁标准曲线,利用分光光度计在波长510 nm处、以1 cm比色皿、试剂空白为参比,测定吸光度A值。以芦丁标准品质量浓度为横坐标,吸光度A为纵坐标,其线性回归方程为:y=0.0167x-0.0256,R2=0.9996,标准曲线的线性范围为10.0~80.0 mg/L。
1.2.4.2 样品总黄酮含量测定 准确量取苦水玫瑰糖浆1.0 mL用蒸馏水定容至50 mL,每个样品分别取4.0 mL按照制作标准曲线的方法加入试剂,测吸光度值,代入回归方程,计算玫瑰糖浆中总黄酮的含量,计算公式为:
式中:C为从回归方程求得的芦丁含量(g/L);V1为样液总体积(mL);V为测定取样体积(mL)。
1.2.5 ABTS+·清除能力的测定 准确配制浓度为7 mmol/L的ABTS和42.5 mmol/L的K2S2O8溶液,将两种溶液等体积混合,避光,室温反应12 h使其反应生成稳定的ABTS+·,用乙醇稀释一定倍数,使其吸光度值A734 nm=0.7±0.02,即得ABTS工作液[15]。
准确移取苦水玫瑰糖浆8.0 mL置50 mL的离心管中,加入32.0 mL的无水乙醇,振荡提取,在10000 r/min的转速下冷冻离心10 min。取上清液2.0 mL于50 mL容量瓶定容至40 mL,再分别用移液枪移取60 μL于4.0 mL的ABTS工作液中,摇匀,测吸光度,按照以下公式计算该浓度下的清除率:

式中:A0为ABTS+·溶液的吸光度;A为加玫瑰糖浆处理样液后的吸光度。
半数抑制浓度的计算:准确移取4.0 mL的ABTS工作液,分别加入20、40、60、80、100 μL的处理样液,摇匀,测吸光度值,以苦水玫瑰糖浆浓度为横坐标,吸光度为纵坐标绘制标准曲线,代入回归方程求解半数抑制浓度,以此评价苦水玫瑰糖浆抗氧化能力的强度。
1.2.6 理化指标、感官分析和微生物指标 理化指标选取葡萄糖当量(DE值)、水分、甜度、粘度、pH、总黄酮含量和密度为评价标准,测定方法分别采用斐林试剂热滴定法[16]、卡尔费休法[17]、蔗糖甜度比对法[18]、旋转粘度计法[19]、pH酸度计法、分光光度比色法和天平量筒测量法。感官评价小组由5人组成,感官评价标准参照张冰晶等[13]对玫瑰花酱的感官评分标准,感官指标包括:色泽、口感、气味、稠度和典型性,对最佳工艺条件下研制的玫瑰糖浆进行理化指标和感官方面的评价[20]。
微生物指标:选取菌落总数、大肠菌群和致病菌(沙门氏菌、志贺氏菌、金黄色葡萄球菌)3个通用微生物指标进行玫瑰糖浆的安全性室验。分别按照GB4789.2-2010《食品安全国家标准 食品微生物学检验 菌落总数测定》、GB4789.3-2010《食品安全国家标准 食品微生物学检验 大肠菌群计数》、GB4789.4-2010《食品安全国家标准 食品微生物学检验 沙门氏菌检验》、GB4789.5-2012《食品安全国家标准 食品微生物学检验 志贺氏菌检验》和GB4789.10-2010《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验》的方法检测菌落总数、大肠菌群、沙门氏菌、志贺氏菌和金黄色葡萄球菌[21]。
1.2.7 抑菌实验 抑菌实验参照胡静丽[22]的方法并进行了相应的改进。选用吸水性强的定性滤纸,用打孔器打成若干直径为6 mm的圆形滤纸片,置于洁净干燥的小培养皿中,160 ℃干热灭菌1~2 h,备用。用移液器分别准确移取经复壮后的大肠杆菌和金黄色葡萄球菌两种新鲜隔夜肉汤培养物各200 μL(1×106CFU/mL),均匀涂布于预先制备好的营养琼脂平板和TSA琼脂平板,水平正置培养皿15 min待菌液彻底吸收后,用无菌镊子镊取滤纸片贴在含菌平板上,每只含菌平板间隔一定距离贴2片,分别吸取15 μL玫瑰糖浆样液和相同蔗糖、柠檬酸添加量的蔗糖柠檬酸溶液(对照)于灭菌滤纸片上,每菌做3次重复,并用浸有无菌水的滤纸片作对照,置37 ℃下恒温培养24 h,测定抑菌圈直径,计算平均值。同时,将玫瑰糖浆原液稀释2、4、8、16、32倍做抑菌实验,计算最低抑菌浓度。
1.2.8 数据分析 每个实验组设三个平行,数据采用Microsoft Office Excel 2007(Microsoft Office 2007,Microsoft Co.,Redmond,USA)进行处理,正交设计助手专业版v3.1破解绿色版对数据进行分析。
2 结果与分析
2.1 单因素实验结果
2.1.1 料液比的选择 实验结果如图1所示,在料液比1∶30~1∶50时,自由基清除率逐渐增加,这是因为在提取过程中随着溶剂量的增加,溶液中抗氧化活性成分浓度逐渐稀释,加快了传质速度,当料液比达到1∶50时,清除率最大,但料液比在1∶50后又出现下降趋势,可能是因为其他杂质的溶出抑制了抗氧化活性成分的溶出,也有可能是因为随着料液比的继续增大,溶液体积变大,在后期煮沸浓缩过程中时间过长,从而影响自由基清除率。因此料液比以1∶50为宜,能在节约成本和时间的前提下,保证良好的抗氧化活性。
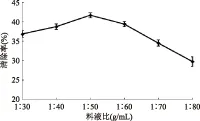
图1 料液比对ABTS+·清除率的影响Fig.1 Effect of solid-to-liquid ratio on the radical scavenging rate
2.1.2 提取时间的优化 实验结果如图2所示,在0.5~2 h时,自由基清除率随时间的增加而明显提高,2 h时提取率最高,随着时间的继续延长,清除率呈明显下降趋势,这可能是因为随着时间的增加,玫瑰细胞破碎度逐渐增大,抗氧化活性成分溶出量逐渐增加,清除率提高;时间过长,细胞进一步破碎,杂质的溶出相应增多,影响抗氧化活性成分的继续溶出和自由基的清除效果,因此提取时间以2 h为宜。

图2 提取时间对ABTS+·清除率的影响Fig.2 Effect of extraction timeon the radical scavenging rate
2.1.3 提取次数的优化 实验结果如图3所示,在1~3次时,自由基清除率随次数的增多逐渐提高,3次时达到最大,之后随着次数的增多又呈现较为平缓的下降趋势,这可能是因为随着次数的增多需要煮沸浓缩的溶剂体积增大,浓缩时间过长,导致一些抗氧化活性成分的分解,从而影响自由基清除率。因此提取次数以3次为宜。

图3 提取次数对ABTS+·清除率的影响Fig.3 Effect of extraction times on the radical scavenging rate
2.1.4 蔗糖、柠檬酸添加量的优化 实验结果如图4、图5所示,在苦水玫瑰糖浆中加入不同量的蔗糖和柠檬酸对玫瑰糖浆的体外抗氧化能力并无明显影响。但由感官评价结果发现:不同的蔗糖和柠檬酸添加量使糖浆的感官特性发生很大变化,当蔗糖的添加量为45%,柠檬酸为0.15%时,口味、甜度、酸度、黏度适中;蔗糖添加量大于45%,且不断增大时,其粘度过大,而且比较腻;当柠檬酸添加量过大于0.15%时,酸味和涩味明显增强,影响口感。综合考虑选择蔗糖添加量为45%,柠檬酸为0.15%。

图4 蔗糖添加量对ABTS+·清除率的影响Fig.4 Effect of sucrose amount on the radical scavenging rate

图5 柠檬酸添加量对ABTS+·清除率的影响Fig.5 Effect of Citric acid amount on the radical scavenging rate
2.2 正交实验结果
从表2实验结果可以看出:极差分析结果为A>C>B,使玫瑰糖浆具有最佳抗氧化能力的工艺条件为A1B2C3,结合对感官有明显影响的因素(蔗糖、柠檬酸),即料液比为1∶40、提取时间2 h、提取次数4次、蔗糖45%,柠檬酸0.15%为最佳工艺条件参数。验证实验结果表明:在该实验条件下,玫瑰糖浆对ABTS+·的清除率可达42.96%,半数抑制浓度为186.1 μL/L,总黄酮含量为1.95 g/L。
2.3 理化、感官和微生物指标评价结果
对2.2所述最佳工艺参数条件下制得的苦水玫瑰糖浆进行理化、微生物和感官指标评价。理化指标测定结果为:DE值14.94%,水分54.27%,相对甜度4,粘度500 mPa·s,pH3.43,总黄酮含量1.95 g/L,密度1.15 g/mL。微生物指标:在选取的菌落总数、大肠菌群和致病菌(沙门氏菌、志贺氏菌、金黄色葡萄球菌)3个通用微生物指标中,菌落总数CFU/mL(g)<10,大肠杆菌MPN/mL(g)<3.0,3种致病菌均未检出。感官评价结果如表3所示。

表2 L9(34)正交实验结果

表3 苦水玫瑰糖浆感官评价
2.4 抑菌实验结果
苦水玫瑰糖浆的抑菌圈大小检测结果见表4。

表4 苦水玫瑰糖浆的抑菌实验结果
表4结果表明:消除蔗糖和柠檬酸的影响后[23],苦水玫瑰糖浆原液对大肠杆菌的抑菌圈直径为1.67 cm,对金黄色葡萄球菌的抑菌圈直径为1.37 cm;一般认为抑菌圈小于1.3 cm为低度抑菌、1.3~1.9 cm为中度抑菌、大于1.9 cm为高度抑菌[24]。当稀释倍数为8时,玫瑰糖浆对大肠杆菌仍有抑菌效果,其抑菌圈直径为0.78 cm,但对金黄色葡萄球菌已无明显的抑菌效果,其最低抑菌浓度分别为:大肠杆菌12.5%,金黄色葡萄球菌25%。
3 结论
本文对玫瑰糖浆的最佳制备工艺进行了探讨,得出最佳工艺条件参数为料液比为1∶40、提取时间2 h、提取次数4次、蔗糖45%,柠檬酸0.15%。在此条件下制得的苦水玫瑰糖浆DE值14.94%,水分54.27%,相对甜度4,粘度500 mPa·s,pH3.43,总黄酮含量1.95 g/L,密度1.15 g/mL,且具有较好的感官特性,对ABTS+·的半数抑制浓度为186.1 μL/L,清除率42.96%,总黄酮含量1.95 g/L,说明此条件下制备的玫瑰糖浆具有一定的体外抗氧化活性。通过滤纸片法做抑菌实验,发现玫瑰糖浆对大肠杆菌和金黄色葡萄球菌的抑菌圈直径分别为1.67 cm和1.37 cm,最低抑菌浓度分别为12.5%和25%,说明其对大肠杆菌的抑制效果优于金黄色葡萄球菌,但是不是玫瑰糖浆对大多数革兰氏阴性菌的抑制作用都优于革兰氏阳性菌,还有待于进一步研究。
[1]周围,周小平,赵国宏,等. 中国苦水玫瑰油香气成分的研究[J]. 色谱,2002,20(6):560-564.
[2]于长青,赵煜,徐琼,等. 对苦水玫瑰产业发展的思考[J]. 甘肃科技,2012,28(20):14-15.
[3]张雪喜,孙迪,田鑫,等. 玫瑰花渣的再利用研究进展[J]. 农产品加工,2016(2):64-66.
[4]洪稹. 玫瑰花营养成分分析及花青素稳定性研究[J]. 中国食物与营养,2011,17(10):74-77.
[5]FRANCO D,PINELO M,SINEIRO J,et al. Processing of Rosa rubiginosa:extraction of oil and antioxidant substances[J]. Bioresource Technol,2007,98(18):3506-3512.
[6]王多宁. 玫瑰花的综合利用及开发前景[J]. 黑龙江农业科学,2010(1):117-120.
[7]SOOD S,NAGAR PK. Changes in abscisic acid and phenols during flower development in two diverse species of rose[J]. Acta Physiologiae Plantarum,2005(4):411-416.
[8]Harborne JB,Heywood VH,SalehNAM. Chemosystematics of the com-posiate:flavonoid patlerns in the chrysanthemum complex of the tribe anthemideaa[J]. Phytochemistry,1970,9:2011-2017.
[9]NG T B,HE J S,NIU S M,et al. A gallic acid derivative and polysaccharides with antioxidative activity from rose(Rose rugosa)flowers[J]. Journal of Pharmacy and Pharmacology,2004,56(4):537-545.
[10]Eun Ju Cho,Takako Yokozawa,Hyun Young Kim,et al. Rosa rugosa attenuates diabetic oxidative stress in rats with streptozotocin-induced diabetes[J]. American Journal of Chinese Medicine,2004,32(4):487-496.
[11]肖泽琼. 健脾补肺糖浆制备工艺的研究[J]. 中国民族民间医药,2008,17(8):34.
[12]刘志明,陶古,韩小兰,等. 枸杞保健糖浆研制工艺[J]. 保鲜与加工,2006,6(6):33-35.
[13]张冰晶,蒋玉梅,米兰,等. 发酵型苦水玫瑰花酱的制作工艺参数优化[J]. 中国酿造,2014,33(6):147-152.
[14]李绚,龙敏仪. 紫外分光光度法测定食用玫瑰花中类黄酮的含量[J]. 食品研究与开发,2015,36(23):142-144.
[15]李华,李勇,吴莹,等. ABTS+·法测定葡萄酒抗氧化活性的研究[J]. 西北农林科技大学学报,2009(11):90-96.
[16]姚刚. 从紫甘薯中提取纯化花青素、花青素的抗氧化活性以及利用剩余物制备麦芽糊精的研究[D]. 杭州:浙江大学,2015.
[17]陈秀明. 卡尔费休法测定葡萄糖浆中的水分[J]. 现代测量与实验室管理,2012,20(4):13-14.
[18]来鹏飞,盛云燕,袁丽伟. 甜瓜感官检验与主要风味物质的相关关系[J]. 蔬菜,2015(5):23-25.
[19]余小娜,盛淑玲. 转化糖浆制备工艺研究[J]. 许昌学院学报,2016,35(2):107-111.
[20]赵镭,刘文,汪厚银. 食品感官评价指标体系建立的一般原则与方法[J]. 中国食品学报,2008,8(3):121-124.
[21]中华人民共和国卫生部. GB/T 4789系列—2010 食品安全国家标准 食品微生物学检验标准汇编[S]. 北京:中国标准出版社,2010.
[22]胡静丽. 杨梅叶提取物抑菌作用的研究[D]. 杭州:浙江大学,2002.
[23]周小琦,方敏,宫智勇. 玫瑰花中总黄酮提取工艺及其抗氧化与抑菌作用的研究[J]. 食品科学,2010,31(20):102-105.
[24]LARRAURI J A,SANCHEZ-MOR ENO C,SAURA-CALIXTO F. Effect of temperature on the free radical scavenging capacity of extracts from red and white grape pomace peels[J]. Agric Food Chem,1998,46(7):2694-2697.
The development of the rosa rugosa syrup and its antioxidant and bacteriostatic activity
CHEN Ji-hua1,WANG Bo2,ZHANG Yu-xia2,HU Yan-yun1,ZHOU Wei1,2,*
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China; 2.Central Laboratory of Technical Center of Gansu Entry-Exit Inspection and Quarantine Bureau,Lanzhou 730000,China)
Rosa rugosa was used to produce rose syrup. On the basis of single factor experiment,using material-liquid ratio,extraction time and extraction times as experimental factor,the optimum process parameters were determined by L9(34)orthogonal experiment. Scavenging effects of 2,2′-Azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid)diammonium(ABTS)radicals of rose syrup was investigated to study its anti-oxidation activityinvitro,and filter-paper method was used to study the bacteriostatic activity. The results showed that the optimum process parameters of rose syrup was determined as follows:material-liquid ratio 1∶40,extraction time 2 h,extraction times 4,white granulated sugar 45%,citric acid 0.15%. Under this condition,the rose syrup tasted moderate sour and sweet with rose aroma and fresh palate,the DE was 14.94%,moisture was 54.27%,relative sweetness was 4,viscosity was 500 mPa·s,pH was 3.43,flavonoids content was 1.95 g/L and density was 1.15 g/mL. It also had stronger antioxidantinvitroand bacteriostatic activity:the half inhibitory concentration(IC50)on ABTS+· was 186.1 μL/L,and the rose syrup had good antibacterial activity onStaphylococcusaureusandEscherichiacoli,the diameters of antibacterial circle were(1.37±0.09) cm and (1.67±0.14) cm.
rose syrup;development;antioxidant;bacteriostatic
2016-06-15
陈继华(1991-),女,在读硕士研究生,研究方向:食品安全与检测,E-mail:791525516@qq.com。
*通讯作者:周围(1957-),男,博士,研究员,研究方向:食品营养及食品安全分析,E-mail:zhouwei845@163.com。
干制苦水玫瑰保色保香关键技术及产业化研究(1604NKCA079)。
TS201.1
B
1002-0306(2016)22-0269-05
10.13386/j.issn1002-0306.2016.22.044
