耐受重金属铅乳酸菌的分离筛选及鉴定
2017-01-13贾原博赵晓峰贺银凤
贾原博,赵晓峰,贺 敏,顾 悦,贺银凤,*
(1.内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特 010018;2.内蒙古包头市疾病控制中心,内蒙古包头 014030)
耐受重金属铅乳酸菌的分离筛选及鉴定
贾原博1,赵晓峰1,贺 敏2,顾 悦1,贺银凤1,*
(1.内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特 010018;2.内蒙古包头市疾病控制中心,内蒙古包头 014030)
通过对包头尾矿库区、白云鄂博采矿区重金属污染严重区域土壤样品中的乳酸菌进行分离、筛选,共得到62株乳酸菌,并对分离得到的乳酸菌进行耐受铅离子的测定,62株乳酸菌对铅离子均有一定的耐受能力,不同菌株对铅离子的耐受能力有所不同;铅离子浓度为1200~9600 mg/L时,随着培养时间的增长,菌株对耐受铅离子的修复能力逐渐增强;30 ℃下分离得到的菌株对铅离子的修复能力明显优于37 ℃下分离得到的菌株;菌株BY-Fa4、BG-5b3、BG-8b2等13株菌可在铅离子浓度为7200 mg/L的环境下生长,菌株BY-Fa1、BY-Fc2、BG-6b1可在铅离子浓度为8400 mg/L的环境下生长。实验结果得出筛选得到的13株乳酸菌对铅离子不仅具有较强的耐受能力,而且还具有较强的修复能力。对筛选出13株高耐受铅离子的菌株进行16S rRNA序列分析,鉴定结果为戊糖片球菌2株、清酒乳杆菌1株、食窦魏斯氏菌5株、戊糖乳杆菌2株、植物乳杆菌3株。
尾矿区,乳酸菌,耐受重金属铅,筛选与鉴定
生物修复作为近年来研究投入关注度较多的新兴修复、治理重金属污染的方法,由于其原材料广泛、修复效果好、成本低廉、操作简单、对环境不会产生次生危害等特点,成为现阶段研究的热点。水生生物如部分鱼类、贝壳类、藻类,陆生生物如部分植物、大型真菌[1-3],以及很多的微生物如霉菌[4]、酵母菌[5]、芽孢杆菌[6]等均可用来作为修复重金属污染。微生物具有个体小、数量庞大、繁殖速度快、吸附效率高等特点,作为生物吸附剂修复重金属污染具有很大的潜力。随着研究的不断深入,有研究发现一些乳酸菌对重金属有着良好的抗性和吸附性能,并且乳酸菌作为人体肠道内的有益菌群,对人体健康也有很好的保健作用[7-8]。国内外对将乳酸菌作为生物吸附剂的研究还是比较少的,这些研究报道为本研究开发应用于人体、动物体的新型生物吸附剂提供了思路。
内蒙古地区矿产资源丰富,在矿产资源开采和利用的过程中会对环境造成一定的污染,据资料显示包头尾矿库区、白云鄂博采矿区重金属污染指数比背景值高出9倍,人们的健康安全受到了极大的威胁。本研究通过对包头尾矿库区、白云鄂博采矿区重金属污染严重区域的土壤样品中的乳酸菌进行分离、筛选,对其分离特性、耐受程度进行探讨,并对能够耐受较高铅离子浓度菌株进行鉴定,从而为后期对吸附机理、开发新型生物吸附剂,以及将优良菌种应用到饲料或食品中奠定基础。
1 材料与方法
1.1 材料及仪器
实验样品 采集自内蒙古包头市包头钢铁厂尾矿库区(BG1~BG10)、白云鄂博稀土矿矿区(BY-A~BY-F)周边土壤及污水处理厂淤泥,共计17个样品;铅储备液[9];MRS 固体培养基(DifcoTM Lactobacilli MRS Agar) 用于培养乳酸菌;MRS半固体培养基 用于保藏乳酸菌;MRS(Man Rogosa Sharpe broth)液体培养基 用于种子发酵培养[10-11];细菌基因组DNA提取试剂盒 天根生化科技有限公司;2×Easy Taq Super Mix TRANS公司;溶菌酶-306A046 Solarbio公司;PrimeSTAR HS DNA Polymerase、DL2000 DNA Marker、6×Loading buffer 宝生物工程有限公司;琼脂糖 Sigma公司;核酸染料 TaKaRa公司;生理生化鉴定培养管 广东环凯微生物科技有限公司。
OHAUS型电子天平 上海OHAUS有限公司;SX-500型高压灭菌锅 日本TOMY公司;FLC-3型超净工作台 哈尔滨市东联公司;HPS-250型生化培养箱 哈尔滨市东明医疗仪器厂;OLYMPOS BX50型光学显微镜 OLYMPOS公司;pHS-25 型数显酸度计 雷磁分析仪器厂;HH.S-Ni电热恒温水浴锅 北京长安科学仪器厂;BG-Power3500电泳仪 北京百晶生物技术有限公司;Veriti 96孔PCR仪 美国应用生物系统公司。
1.2 实验方法
1.2.1 样品采集 实验选取重金属污染相对严重的包头钢铁厂、包头尾矿库和白云鄂博稀土矿区土壤及污水处理厂淤泥进行实验。选择地势平坦的区域,去掉土壤表层杂物和浮土,在距离地表5~20 cm深处使用土壤采集器取样,采用梅花五点法进行打孔采样,将五点样品(每五点为一个样)混合均匀后装入塑料封口袋,封好袋口,在封口袋上做好标记,置于-20 ℃冰箱保存备用。
1.2.2 耐受铅离子乳酸菌的分离纯化 将保存的土壤样品取出适量,恢复至室温,混合均匀后,称取1 g溶解于生理盐水中,使菌群均匀分布,接种至MRS液体培养基中,分别置于30 ℃有氧、30 ℃厌氧和37 ℃有氧、37 ℃厌氧环境静置培养7 d以富集LAB菌群[12]。将富集培养基划线至含100 mg/L铅离子浓度和CaCO3的MRS固体平板培养基上,分别置于30 ℃有氧、30 ℃厌氧和37 ℃有氧、37 ℃厌氧环境培养24 h。
挑取有透明圈的、具有金属抗性的LAB菌落,接种至MRS液体培养基中,观察记录菌落形态,观察各菌株的形态及革兰氏染色,对革兰氏阳性菌株进行过氧化氢酶实验,用3%过氧化氢溶液滴加一滴至单个菌落,如果有气泡产生表明细菌中存在过氧化氢酶,弃掉过氧化氢酶阳性的菌落。将分离筛选得到的革兰氏染色阳性、过氧化氢酶实验阴性的杆菌和球菌暂定为乳酸菌。将分离得到的乳酸菌在MRS固体平板培养基上再划线两次以更进一步得到纯培养物。
1.2.3 乳酸菌对铅离子最大耐受浓度的测定 将分离得到的乳酸菌活化至三代,分别划线至铅离子浓度为0、1200、2400、3600、4800、6000、7200、8400、9600 mg/L的MRS固体培养基上,置于37 ℃和30 ℃恒温培养箱中培养,每隔24 h观察菌株生长情况直到96 h,记录乳酸菌对铅离子的耐受及其修复能力。
1.2.4 高耐受铅乳酸菌的鉴定
1.2.4.1 实验菌株总DNA的提取及16S rRNA序列PCR扩增及凝胶电泳 将实验菌株活化培养至三代,3000 r/min离心10 min,用生理盐水洗涤3次后,按照细菌基因组DNA提取试剂盒说明书中步骤进行基因组DNA的提取。
实验菌株16S rRNA序列PCR扩增引物F:5′-AGAGTTTGATCCTGGCTCAG-3′ R:5′-CCGTCAA TTCCTTTGAGTTT-3′,参照文献[13]所给引物。PCR扩增体系:上下游引物各2 μL、模板DNA 2 μL、Dream Tap Green PCR Master Mix 25 μL、加无菌水补齐至50 μL。PCR条件参数为:预变性94 ℃ 3 min,变性94 ℃ 30 s,退火57.4 ℃ 30 s,延伸72 ℃ 90 s,循环35次,最后末端延伸72 ℃ 5 min。取5 μL实验菌株PCR扩增产物与1 μL 6×Loading buffer混合均匀上样后,用1%琼脂糖凝胶电泳检测(110 V、30 min),使用凝胶成像系统观察条带。
1.2.4.2 实验菌株16S rRNA序列分析 将PCR扩增产物委托上海生工生物工程股份有限公司测序及双向拼接后,在NCBI上用BLAST进行同源性比较,最后使用DNAStar软件中Megalign程序绘制系统发育树。
2 结果与分析
2.1 耐受铅离子乳酸菌分离
对所采样品进行分离后共得到62株乳酸菌,其中包钢所采10个样品中分离得到24株乳酸菌菌株,白云稀土矿区所采7个样中分离得到38株乳酸菌菌株。白云稀土矿样品分离得到的菌株较包钢样品分离得到的菌株多。
由表1可知,在不同的样品中,分离得到的菌株个数也有所差异,BY-B、BY-C、BY-D三个样品中分离得到的乳酸菌均来自37 ℃,可能是这三个样品中的乳酸菌较适宜在37 ℃下生长;BG-7、BG-8两个样品中分离得到的乳酸菌均来自于30 ℃,可能是这两个样品中的乳酸菌更适宜在30 ℃条件下生长,其余样品中在30 ℃和37 ℃下均分离到了不同数量的乳酸菌。在37 ℃分离条件下白云鄂博稀土矿区所采样品分离得到20株菌,包钢所采样品只分离得到10株菌,37 ℃对两个不同采样区域的分离结果影响比较明显;30 ℃分离条件下两个不同的采样区域分离得到的乳酸菌株数比较接近,说明30 ℃对两个不同采样区域的影响不大。但从分离总数可以看出,在30 ℃分离得到32株乳酸菌,37 ℃分离得到30株乳酸菌,分离温度对分离结果影响不大。在有氧条件下分离得到33株乳酸菌,厌氧条件下分离得到29株乳酸菌,厌氧条件下分离得到的菌株数较有氧条件略多,可能由于乳酸菌生长土壤中氧气含量较低所致。
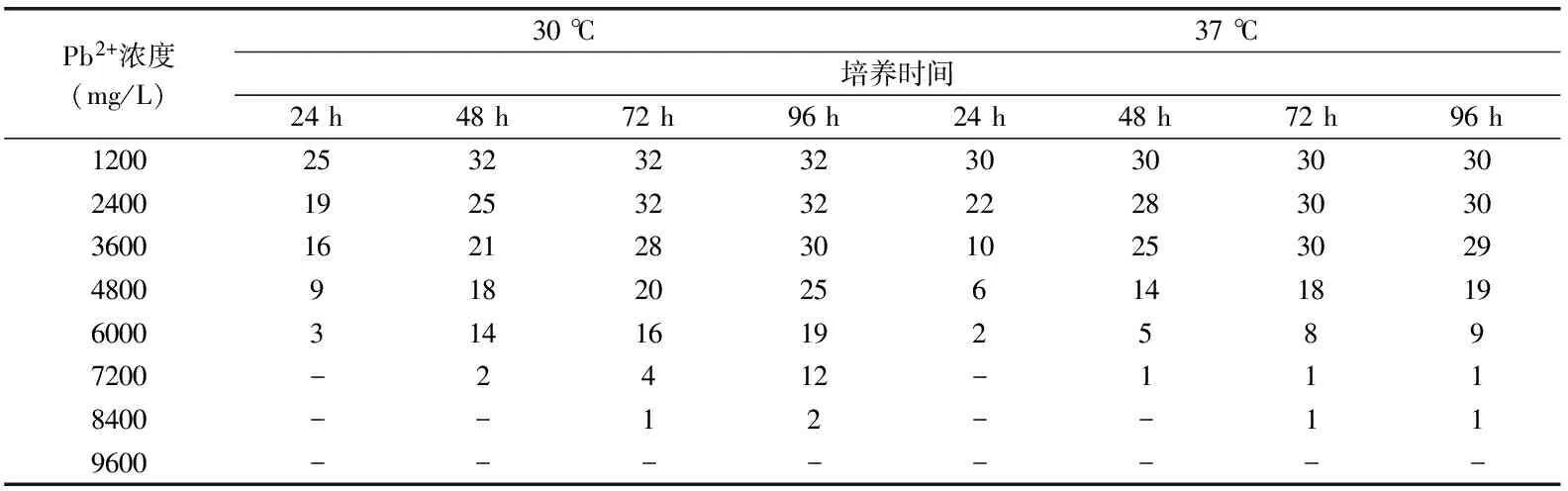
表2 分离温度对菌株耐受能力的影响结果
注:“-”表示该浓度没有可生长的菌株。

表1 各样品不同温度条件分离结果
注:“-”表示该条件下没有可生长的菌株。
2.2 分离菌株耐受铅离子筛选
2.2.1 分离菌株耐受不同铅离子浓度的能力 培养基中设置铅离子浓度分别为1200、2400、3600、4800、6000、7200、8400、9600 mg/L八个梯度,将分离得到的乳酸菌分别划线至上述含不同铅离子浓度的MRS固体培养基中,培养24、48、72、96 h观察分离菌株的生长情况,结果见图1。
从图1可以看出,菌株对铅离子均有一定的耐受能力,不同菌株对铅离子的耐受能力有所不同,随着铅离子浓度的增大,可耐受铅离子浓度的菌株减少。随着培养时间的增长,分离菌株对耐受铅离子的修复能力逐渐增强,如在铅离子浓度为3600 mg/L,培养时间为24 h时,62株分离菌株中只有26株可生长,培养至48 h,有46株乳酸菌可生长,培养至72 h时,可生长菌株增加到57株,当培养到96 h时,共有59株乳酸菌可生长,仅有3株分离菌株未生长。
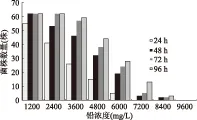
图1 不同铅离子浓度下菌株生长情况Fig.1 Growth of various strains in different lead concentrations
2.2.2 分离温度对菌株耐受能力的影响 实验设置的分离温度为30 ℃和37 ℃,对分离菌株在不同铅离子浓度下的耐受情况结果如表2所示。从表2可以看出,在30 ℃和37 ℃下分离得到的菌株对铅离子均有较强的耐受能力。当铅离子浓度大于4800 mg/L时,30 ℃下分离得到的菌株对铅离子的修复能力明显优于37 ℃下分离得到的菌株。如可耐受铅离子浓度为6000 mg/L的菌株中,培养24 h时,有3株来自30 ℃,2株来自37 ℃,培养至48 h时,来自30 ℃的菌株增长至14株,37 ℃的菌株只有5株,培养至72 h,来自30 ℃的菌株为16株,37 ℃菌株为8株,培养至96 h,来自30 ℃下的菌株为19株,37 ℃的菌株为9株;再如,可耐受铅离子浓度为7200 mg/L的菌株中,培养48 h时,有2株来自30 ℃,1株来自37 ℃,培养至72 h时,来自30 ℃的菌株增长至4株,37 ℃的菌株没有变化,还是1株,培养至96 h,来自30 ℃下的菌株增加到12株,37 ℃的菌株无变化。
2.2.3 不同培养时间乳酸菌最大耐受铅离子浓度的测定结果 通过在不同的培养时间下测得的乳酸菌最大耐受铅离子浓度,随着培养时间的延长,菌株逐步对铅离子的抑制作用进行修复,表现出较好的耐受能力。实验中有13株乳酸菌对铅离子表现出较强的耐受能力,由表3可知,培养96 h,菌株耐受铅离子浓度均可达到7200 mg/L以上,这13株对铅离子浓度耐受能力较强的菌株在培养48 h时就表现出较强的耐受能力。其中,BY-Fa1、BY-Fc2、BY-Fa4这3株乳酸菌在培养48 h最大耐受铅离子浓度与培养至96 h时的最大耐受铅离子浓度一致,说明这3株乳酸菌对铅离子有较强的耐受能力,其余10株乳酸菌随着培养时间的延长对铅离子的耐受能力均有提高,说明这10株乳酸菌除了对铅离子有较强的耐受能力外,还对铅离子有较强的修复能力。
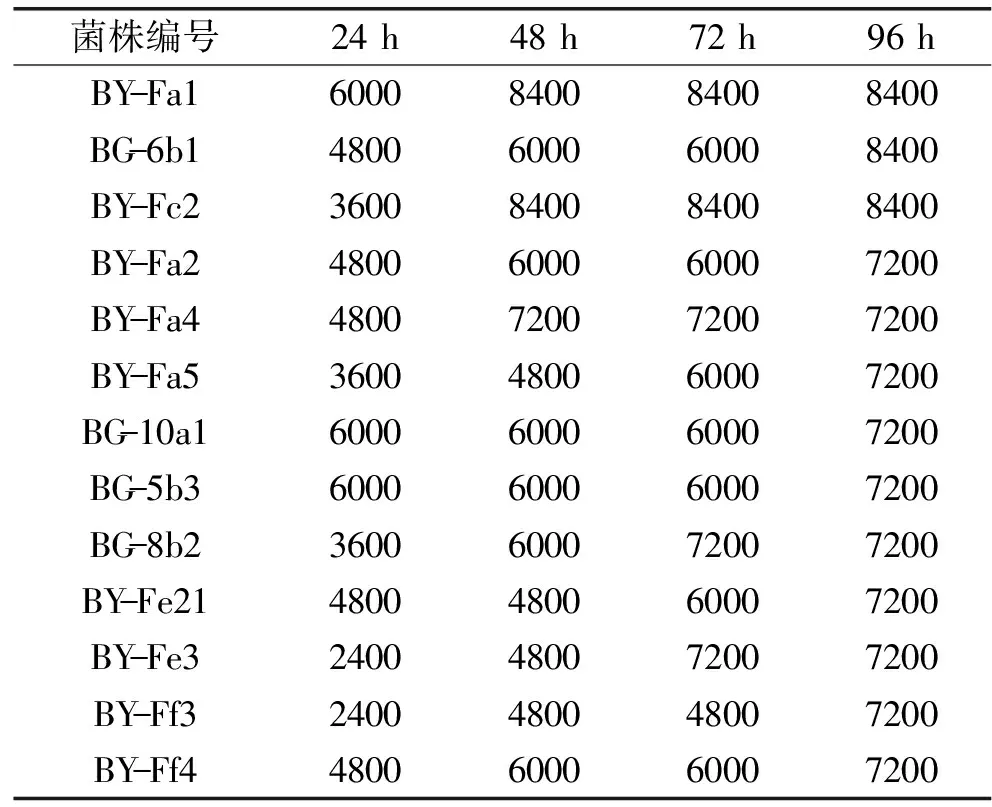
表3 不同培养时间菌株耐受铅离子最大浓度值(mg/L)
2.3 高耐受铅离子乳酸菌的鉴定
13株实验菌株和标准菌株的测序序列与GeneBank中菌株16S rRNA基因序列进行同源性比较,同源性比较结果见图2,系统发育树结果见图3。

图2 实验菌株与其他乳酸菌的同源性Fig.2 The homology between the test strains and other lactic acid bacteria
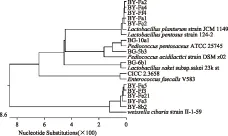
图3 实验菌株与其他乳酸菌的系统发育树Fig.3 Phylogentic tree of strains and other lactic acid bacteria
由图2、图3可知,实验菌株BG-10a1、BG-5b3与戊糖片球菌(Pediococcuspentosaceus)同源性为100%、96.3%,并且在系统发育树中属于同一分支,进化距离很相近,所以可以判定BG-10a1、BG-5b3为戊糖片球菌;BG-6b1与清酒乳杆菌(Lactobacillussakei)的同源性为99.5%,在系统发育树中位置最近,并属于同一分支,可以判定BG-6a1为清酒乳杆菌;BY-Fa5、BY-Ff3、BY-Fe3、BY-Fe21、BG-8b2与食窦魏斯氏菌(Weissellacibaria)的同源性分别为99.4%、99.6%、100.0%、99.7%、95.9%,在系统发育树中属于同一分支,由此可鉴定为食窦魏斯氏菌;BY-Fa2、BY-Fa4与戊糖乳杆菌(Lactobacilluspentosus)的同源性分别为99.9%、97.2%,由此可鉴定为戊糖乳杆菌;BY-Fa1、BY-Fc2、BY-Ff4与植物乳杆菌(Lactobacillusplantarum)的同源性分别为99.2%、100.0%、99.9%,由此可鉴定为植物乳杆菌,标准菌株CICC23658为屎肠球菌,与鉴定结果一致,说明测序结果可信。
3 结论
实验对包头尾矿库和白云鄂博稀土矿区17个样品的分离,共得到62株乳酸菌。其中不同的温度条件、不同的氧气培养条件对分离菌株的总数结果影响不大;分离得到的62株乳酸菌对铅离子均有一定的耐受能力,不同菌株对铅离子的耐受能力有所不同。随着培养时间的增长,菌株对耐受铅离子的修复能力逐渐增强;30 ℃下分离得到的菌株对铅离子的修复能力明显优于37 ℃下分离得到的菌株;筛选得到13株对铅离子不仅具有较强耐受能力而且具有较强修复能力的菌株;对筛选出13株高耐受铅的菌株进行16S rRNA序列分析,结果得出,菌株BG-10a1、BG-5b3为戊糖片球菌,菌株BG-6b1为清酒乳杆菌,菌株BY-Fa5、BY-Ff3、BY-Fe21、BY-Fe3、BG-8b2为食窦魏斯氏菌,菌株BY-Fa1、BY-Fa2、BY-Fa4、BY-Fc2、BY-Ff4为植物乳杆菌。
[1]Cocchi L,Vescovi L,Petrini L E,et al. Heavy metals in edible mushrooms in Italy[J]. Food Chemistry,2006(2):277-284.
[2]Xiangliang P,Jianlong W,Daoyong Z. Biosorption of Pb(II)byPleurotus ostreatus immobilized in calcium alginate gel[J]. Process Biochemistry,2005(8):2799-2803.
[3]Melgar M J,Alonso J,García M A. Removal of toxic metals from aqueous solutions by fungal biomass of Agaricus macrosporus.[J]. Science of the Total Environment,2007,385(1-3):12-19.
[4]闫建芳,刘秋,赵柏霞,等. 龟裂链霉菌GQ-17对Pb2+吸附性的初步研究[J]. 大连民族大学学报,2016,18(1):19-22.
[5]李明春,姜恒,侯文强,等. 酵母菌对重金属离子吸附的研究[J]. 菌物系统,1998(4):80-86.
[6]刘月英,傅锦坤,陈平,等. 巨大芽孢杆菌D01吸附金Au3+的研究[J]. 微生物学报,2000,40(4):425-429.
[8]Avalljääskeläinen S,Lindholm A,Palva A. Surface display of the receptor-binding region of the Lactobacillus brevis S-layer protein in Lactococcus lactis provides nonadhesive lactococci with the ability to adhere to intestinal epithelial cells[J]. Applied & Environmental Microbiology,2003,69(4):2230-2236.
[9]倪奕弘. 耐受重金属铜的乳酸菌的筛选及其铜结合性能的研究[D]. 广州:暨南大学,2014.
[10]陈天寿. 微生物培养基的制造及应用[M]. 北京:中国农业出版社,1995.
[11]内村泰,岗田草苗. 乳酸菌实验手册[M]. 日文版.东京:朝仓书店,1992.
[12]Bhakta J N,Munekage Y,Ohnishi K,et al. Isolation and identification of cadmium-and lead-resistant lactic acid bacteria for application as metal removing probiotic[J]. International Journal of Environmental Science & Technology,2012,9(3):433-440.
[13]李少英. 奶牛源性双歧杆菌和乳杆菌的分离鉴定及耐药性研究[D]. 呼和浩特:内蒙古农业大学,2008.
Isolation,screening and identification of lactic acid bacteria tolerance to heavy metal lead
JIA Yuan-bo1,ZHAO Xiao-feng1,HE Min2,GU Yue1,HE Yin-feng1,*
(1.College of Food Sciences and Engineering,Inner Mongolia Agricultural University,Huhhot 010018,China; 2.Baotou Center Disease Control and Prevention,Baotou 014030,China)
A total of 62 strains of lactic acid bacteria was isolated from the soil sample which was polluted by heavy metal collected at Baotou and Baiyun Ebo mine. And by the test of the tolerance of lead ions,the 62 strains of lactic acid bacteria all had the tolerance of lead ions,but different stains had different tolerance capability. With the increasing of culturing time,the capability of strains to repair the lead ions had increased gradually when the concentration of lead ions was 1200~9600 mg/L. The strains which were isolated at 30 ℃ had better repair capability of lead ions than the strains isolated at 37 ℃. There were 13 strains could survive under the condition of 7200 mg/L concentration of lead ions,and the strains of BY-Fa4、BG-5b3、BG-8b2 could survive under the condition of 8400 mg/L concentration of lead ions. It indicated that there were 13 stains of all the lactic acid bacteria which isolated had better capability of both tolerance and repair to lead ions. The 16S rRNA gene of 13 strains was amplified by PCR and were identified as 2 strains ofPediococcuspentosaceus,1 strain ofLactobacillussake,5 strains ofWeissellacibaria,2 strains ofLactobacilluspentosus,3 strains ofLactobacillusplantarum.
tailings;lactic acid bacteria;tolerance to heavy metal lead;screening and identification
2016-05-27
贾原博(1989-),男,硕士研究生,研究方向:食品生物技术,E-mail:jiayb2016@163.com。
*通讯作者:贺银凤(1960-),女,教授,研究方向:食品生物技术,E-mail:heyinf6468@163.com。
内蒙古自然科学基金资助项目(2015MS0345)。
TS201.3
A
1002-0306(2016)22-0244-05
10.13386/j.issn1002-0306.2016.22.039
