发芽糙米乳中双株复合乳酸菌的发酵特性研究
2017-01-13朱力杰方怡元陈妍婕刘秀英何余堂
朱力杰,方怡元,陈妍婕,刘秀英,王 勃,刘 贺,何余堂,马 涛
(渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013)
发芽糙米乳中双株复合乳酸菌的发酵特性研究
朱力杰,方怡元,陈妍婕,刘秀英,王 勃,刘 贺,何余堂,马 涛*
(渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州 121013)
以发芽糙米为基质,将植物乳杆菌(Lactobacillusplantarum)、鼠李糖乳杆菌(L.rhamnosus)、嗜酸乳杆菌(L.acidophilus)、干酪乳杆菌(L.casei)4种乳酸菌经两两组合后,对发芽糙米乳进行发酵。通过对酸度、活菌数、脱水收缩作用敏感性、蛋白分解力、流变学性质等指标的测定来进行发酵特性评价,最终筛选出适合发酵发芽糙米乳的最佳菌株组合。实验结果表明:各组合在发芽糙米乳中的发酵特性不尽相同,其中嗜酸乳杆菌和干酪乳杆菌对各自组合贮藏过程中酸度的变化起主导作用,每组产品的活菌数均达8 lg cfu/mL以上,发酵特性的组间差异较为明显。综合考虑鼠李糖乳杆菌和干酪乳杆菌以1∶1的体积比组合所得产品品质较好,该发酵乳在4 ℃贮藏21 d后酸化程度较弱,pH下降了0.65个单位;乳清析出较少,7 d以后低于20%;活菌数变化小且冷藏期间数量一直高于8.5 lg cfu/mL,游离氨基酸增加0.08 mmol/L,流变学性质显示其黏稠度较高,相对易于储运。
乳酸菌,混合发酵,发芽糙米乳,特性
发芽糙米是以去掉外壳的稻谷米粒为原料,经适当的浸泡与发芽过程后,得到芽长在0.5~1 mm左右[1],由幼芽、糠层和胚乳组成的糙米制品[2]。在发芽过程中,糙米既有物质含量发生改变,同时又产生了新的营养成分,其中γ-氨基丁酸、赖氨酸、维生素E、维生素B、膳食纤维、镁及烟酸等的含量增加较多[3-4],而糖类和热量较糙米、精白米均有所减少[5]。发芽改变了稻谷种子中部分营养物质的结合状态,使维生素、矿物质、有机酸等组分更容易消化和吸收[6-8]。研究表明,常食发芽糙米有利于预防头痛、结肠癌、心脏病,缓解便秘、调节血糖水平等[9]。基于此,食品从业者以发芽糙米为基质,研发了发芽糙米黑豆复合饮料、发芽糙米面包、速食发芽糙米等多种新型糙米食品[10-12]。
为丰富发芽糙米食品的品种,本研究以发芽糙米为基质,利用乳酸菌的发酵作用制作发芽糙米发酵乳,发芽糙米乳综合了谷物与乳酸菌的优点,是一种蛋白质和膳食纤维含量丰富、高活菌数的发酵乳品。产品既保留了糙米中的主要营养物质,又改进了适口性和风味。前期实验中已获得了不同乳酸菌在全谷物糙米乳中的发酵特性,但单一菌种的使用往往不能实现稳定的产品品质并同时兼顾良好的风味和口感。因此本研究从实际生产应用的角度出发,将不同种类的乳酸菌菌株进行两两组合,通过探究双株复合乳酸菌在发芽糙米乳中的发酵特性,筛选出性能优良、适合推广应用的菌株组合。
1 材料与方法
1.1 材料与仪器
植物乳杆菌(L.plantarum,Lp)、鼠李糖乳杆菌(L.rhamnosus,Lr)、嗜酸乳杆菌(L.acidophilus,La)和干酪乳杆菌(L.casei,Lc) 由四川高福记生物科技有限公司提供;发芽糙米粉、中温α-淀粉酶(酶活为3000 u/g)、大豆分离蛋白、蔗糖 由本溪寨香生态农业有限公司提供;液体、固体MRS培养基 分别用于菌种活化和活菌计数;所采用化学试剂 均为分析纯,购自国药集团化学试剂有限公司。
雷磁PHS-3C酸度计 上海雷磁仪器厂;UV-2550紫外可见分光光度计 杭州英斯特科技有限公司;SIS60-70均质机 上海申鹿均质机有限公司;Czone5F抑菌圈测量及菌落计数仪 杭州讯数科技有限公司;DHR-1流变仪 美国TA公司。
1.2 实验方法
1.2.1 菌种的活化与母发酵剂的制备 将4株乳酸菌的菌粉按0.1%的质量体积比分别接种于三角瓶MRS液体培养基中,37 ℃恒温培养12 h,再以3%体积比接种于试管MRS液体培养基中37 ℃恒温培养12 h,经过2次活化,活菌数达到9 lg cfu/mL以上。按3%总接种量以1∶1的体积比将2种不同的菌株接种于三角瓶无菌发芽糙米乳中,37 ℃恒温培养5 h,凝乳后即为母发酵剂,放入4 ℃冰箱中备用。发芽糙米乳按技术路线中涉及方法进行制备。
1.2.2 技术路线 发芽糙米粉→中温α-淀粉酶酶解(0.05%质量比,65 ℃,40 min)→煮沸(100 ℃,10 min,终止酶解)→过滤(200目滤布)→添加大豆分离蛋白→均质(20 MPa,10 min)→蔗糖调配(质量体积比70 g/L)→灭菌(90 ℃,10 min)→冷却室温→接种母发酵剂(5%体积比)→发酵(37 ℃,24 h)→冷藏后熟(4 ℃,12 h)→成品发芽糙米乳。
在发酵乳制成后的第0、1、7、14、21 d取样检测相关各项指标。
1.2.3 pH测定 4 ℃条件下冷藏的样品置于室温,待恢复到室温用玻璃棒搅拌均匀。PHS-3C酸度计直接测定,测3次取平均值。
1.2.4 滴定酸度 参照GB5413.34-2010所列方法,简述如下:称取10 g(精确到0.001 g)搅拌均匀的发酵糙米乳于150 mL锥形瓶中,加入20 mL新煮沸冷却至室温的蒸馏水和2 mL 0.5%酚酞乙醇指示液于试样中,混合均匀后用0.1 mol/L氢氧化钠标准溶液滴定至微红色,并在30 s内不褪色。记录NaOH标准溶液消耗的体积,通过计算得滴定酸度(吉尔涅尔度°T)。
式中:X为试样的酸度(°T);C为氢氧化钠标准溶液的摩尔浓度(mol/L);V为滴定时消耗氢氧化钠标准溶液体积(mL);m为试样的质量(g);0.1为酸度理论定义氢氧化钠的摩尔浓度(mol/L)。在重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留三位有效数字。
1.2.5 活菌数 将发酵乳用无菌生理盐水梯度稀释,选择3个合适梯度(10-3、10-4和10-5),采用MRS琼脂培养基平板倾注法37 ℃培养48 h进行活菌计数,测3次取平均值[13]。
1.2.6 脱水收缩作用敏感性 称量20 g发酵乳样品,置于带有滤纸的漏斗中,4 ℃放置2 h,收集滤液并称重。测3次取平均值[14],随后计算脱水收缩作用敏感性(susceptibility to syneresis,STS)。脱水收缩作用敏感性(%)=滤液重量/样品重量×100。
1.2.7 蛋白分解力 蛋白分解力的测定采用邻苯二甲醛比色法[15-16],在340 nm波长下测定样品吸光度,确定蛋白分解力,测3次取平均值。
1.2.8 流变学性质分析 先将发酵乳搅拌均匀,选用直径40 mm的不锈钢平板探头,平板与底面的间隙为0.5 mm,测试温度控制在25 ℃。剪切速率从0.01 s-1增大到150 s-1,在150 s-1保持120 s,然后从150 s-1减小至0.01 s-1。
1.2.9 数据处理 实验数据采用SPSS13.0软件和OriginPro 8.6软件进行数据分析并作图。
2 结果与分析
2.1 pH测定
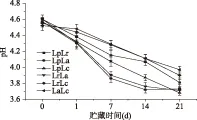
图1 发酵乳pH变化Fig.1 Changes of pH of fermented milk by co-culture
发酵乳从发酵结束到4 ℃贮藏21 d pH变化如图1所示。6组发酵乳的pH都随着冷藏时间的延长而下降(p<0.05)。其中同时含有La的LpLa和LrLa组合的两条曲线基本重合,而同时含有Lc的LrLc和LaLc组合也如此,可能在各组合中La和Lc分别对pH降低起主导作用。前期单菌株实验发现,La耐酸性较强,pH下降较多,而Lc后酸化能力较弱,因而LpLa和LrLa两组pH变化大,至21 d时下降到3.7;而LrLc和LaLc两组是pH变化最小的复合菌株。但是LpLc也含有Lc,其pH变化却是6组复合菌株中最大的,可能是因为这两种乳酸菌之间存在协同共生作用;也可能与Lp具有较强的淀粉水解能力有关[17]。乌仁图雅[18]以后酸化能力强的保加利亚乳杆菌发酵牛乳,贮藏21 d pH从4.5下降到3.65,影响发酵乳质量。本研究中LpLc、LpLa和LrLa 21 d时pH降至4以下,同样不利于产品质量控制[19]。
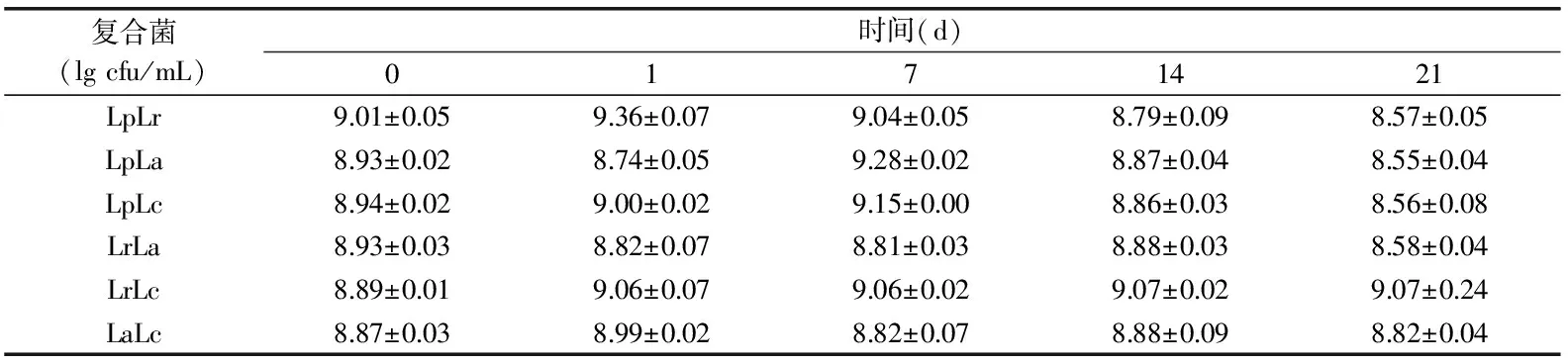
表1 贮藏期间活菌数变化
2.2 滴定酸度
如图2所示贮藏期内滴定酸度显著升高(p<0.05),发酵乳在发酵结束时的滴定酸度<40 °T偏低,未能达到《GB19302-2010食品安全国家标准 发酵乳》中滴定酸度≥70 °T的要求。王水泉[20]将植物乳杆菌和嗜热链球菌混合发酵豆乳42 ℃条件下,发酵结束时发酵豆乳滴定酸度为38.7 °T,与本研究所得结论一致;而发酵牛乳为78 °T。这可能与发酵基质有关,发酵过程中乳酸菌在牛乳中能够产生较多酸性物质,而豆乳、糙米乳中较少。1 d内滴定酸度上升较快,包艳[21]等以LpLa混合发酵豆乳,贮藏1 d增加了8 °T,变化较大。朱秋劲[22]报道了发酵乳后熟12 h内是乳酸菌产酸的主要阶段。到第7 d,组合LpLa、LpLc和LrLa发酵乳的滴定酸度显著高于另外3组(p<0.05),21 d时达到75 °T。冷藏期间LpLc后酸化最严重,21 d内上升了40.3 °T;LaLc最弱为23.59 °T;其次为LrLc滴定酸度上升了28.14 °T。发酵乳品在贮藏过程中伴随着后酸化作用,但是滴定酸度变化太大不利于产品质量控制,对产品的风味、口感,质地都会产生一定的影响。可以通过改变菌种组合来降低发酵产品的后酸化作用,从而改善产品质量。贮藏期间乳酸菌继续产生酸性物质,随着时间的延长滴定酸度增大,一直保持着上升趋势,这与pH持续下降是对应的,滴定酸度与pH显著相关(p<0.05)。并且pH降低的越多,滴定酸度升高的越多。

图2 发酵乳滴定酸度变化Fig.2 The graph of titratable acidity of fermented milk by co-culture
2.3 活菌数
发酵产品在贮藏期内保持高含量的乳酸菌是非常重要的。很多研究提出了提高乳酸菌含量的方法,如降低发酵温度至37 ℃,添加乳清蛋白、益生元如菊粉、低聚糖,降低贮藏温度至3~4 ℃等[23-24]。乳酸菌在体内发挥益生特性必须能够存活于肠道,耐受胃酸和肠胆盐并且在发酵产品货架期内具有活力。由表1可得6组产品的乳酸菌数量在贮藏期内均超过8 lg cfu/g,远远超过国标GB19302-2010中对发酵乳制品货架期内活菌数的要求(≥6 lg cfu/mL),可能是低温条件下延长了乳酸菌的稳定期。前4组产品在前14 d活菌数较高,21 d活菌数降至8.5 lg cfu/mL,与后2组差异显著(p<0.05),可能是营养物质消耗、乳酸菌的代谢活动终止,从而引起活菌数量下降[25]。LrLc和LaLc贮藏期内活菌数基本稳定(p>0.05),活菌数高达8.8 lg cfu/mL以上,pH等环境的改变对乳酸菌的生长繁殖影响较小。王佳[26]以LrLc混合发酵豆乳,4 ℃贮藏21 d活菌数仍然达到8 lg cfu/mL,该实验与其结果一致。吴均[27]测定了牦牛酸乳20 d内活菌数的变化,发现活菌数先增大后减小,与本实验结果基本一致。而李岩岩[28]等将瑞士乳杆菌和干酪乳杆菌复配发酵绿豆乳4 ℃贮藏21 d活菌数一直在降低。这可能与发酵基质,菌种不同有关。乳酸菌复配后发酵产品中乳酸菌活菌数均较高,有利于乳酸菌发酵制品的开发。
2.4 STS值的变化
STS值与发酵乳的微观结构紧密相关,体现了凝胶对体系中各种乳成分特别是水分的结合能力,STS值越小,则发酵乳在特定时间内失去的乳清越少,产品质量越好。各组发酵乳的STS值随着贮藏时间的延长而下降,持水性增强。LpLr、LpLa和LrLa在发酵结束时STS值较小在26%左右,随后的时间里STS维持在20%左右;LrLc在发酵结束时高于上述3组约为30%,但贮藏期内STS值持续下降且在同一时间点与其他组合相比处于较低水平,末期下降到14.53%,与上述3组差异显著(p<0.05);LpLc、LaLc在21 d时STS值较低,但前14 d持水性较差,其中LaLc最差。王水泉[20]以植物乳杆菌与两种嗜热链球菌分别复配发酵豆乳,发酵结束时STS在30%左右,后熟24 h后降至25%左右,与本实验结果一致。包艳[21]以LpLa复合发酵豆乳贮藏1 d后STS较发酵结束时降低,有助于豆乳的贮藏和保形。冷藏期间各组发酵乳STS值相对较小,这可能是因为大豆蛋白分子量大,分子之间能够形成良好的网络结构,从而具有较好的持水性;而且对“毛细管水”的束缚力较强,可以束缚更多的自由水分子,使其本身“变稠”[29]。
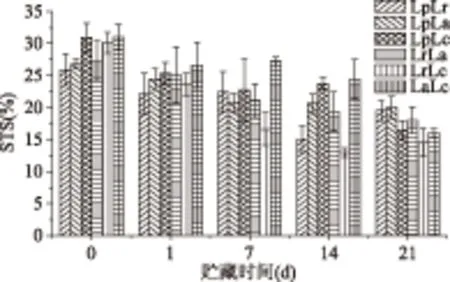
图3 发酵乳STS值的变化Fig.3 Changes of STS of fermented milk by co-culture
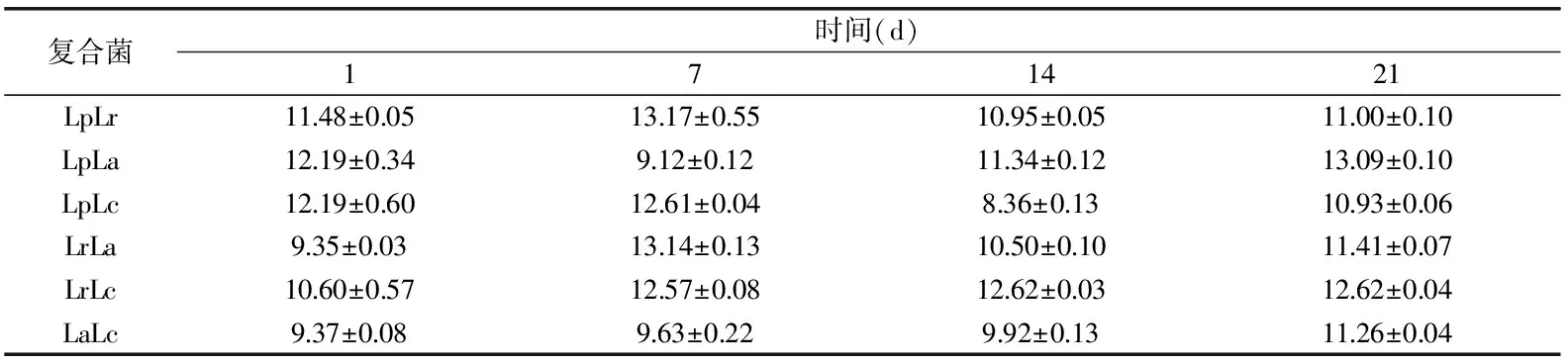
表2 发酵乳稠度系数K的变化
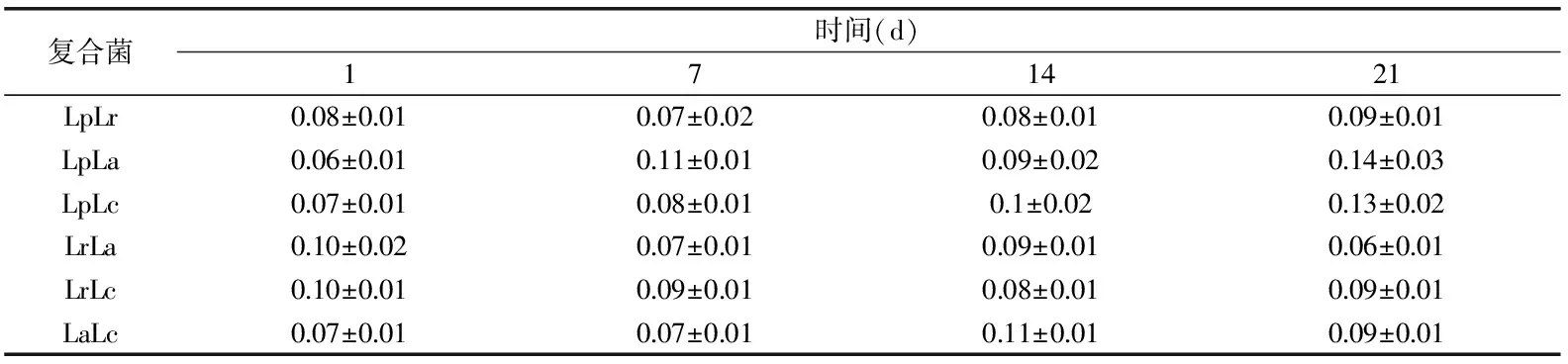
表3 发酵乳流动行为指数n的变化
2.5 蛋白质分解力
蛋白质分解力测定的是蛋白质降解成的小分子的短肽类和氨基酸,改善产品的酸度、风味,并提供保健功能。冷藏期间6组乳酸菌组合的蛋白质分解力都较低,游离氨基酸较初期有不同程度的增加,对产品的酸度及口感产生一定的影响。发酵结束时差异不显著(p>0.05);后熟1 d游离氨基酸变化较小。从7 d开始蛋白质分解力发生较为明显的变化,其中LpLa在14 d升高,随后在21 d降至第7 d时相近水平;LrLa开始下降直至21 d;其他4组先下降后升高。LpLr和LrLc贮藏期内蛋白质分解力差异不显著(p>0.05)。Thomas等[30]研究表明:乳酸菌中La的蛋白质水解力较强,游离氨基酸的含量随发酵酸度及菌体生物量的增加而呈上升的趋势,本研究也发现含有La复合菌其贮藏期间蛋白分解力相对较高。杨媚[31]采用SDS-PAGE分析了组合乳酸菌发酵豆乳在贮藏期间的蛋白质降解情况,蛋白分子量处于44.3及29.0 ku的条带出现微弱的降解,且小分子量条带表达稍有增加。表明组合菌对发酵乳具有一定的蛋白水解活性,与本文研究结果一致。又由于游离氨基酸变化不大,因而发酵乳的三维网络结构并未受到太大影响,持水性较强。
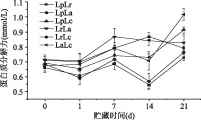
图4 发酵乳蛋白质分解力变化Fig.4 The curve of proteolytic activity of co-culture in fermented milk
2.6 流变性质
对6组样品进行剪切速率0~150 s-1扫描研究其流变性质。根据改进的Ostwald-de Waele模型:η=K·γn-1对流变性质进行拟合,η是黏度(Pa·s),γ是剪切速率(s-1),K是稠度系数(Pa·sn),n是流动行为指数。其拟合系数可达0.99,说明此方程适合分析发酵乳的流变参数。在7 d时同一组合K值呈增加的趋势,说明在贮藏初期样品的黏度在增大。LaLc冷藏期间K较小,则其黏度较低,脱水收缩敏感性差,凝胶容易收缩,乳清较易析出。而LrLc的K值保持在较高水平,黏度大,抗剪切能力强,乳清析出较少;此外LpLr、LpLa和LrLa黏度也较大。
相对于稠度系数K,各组发酵糙米乳的流动行为指数n变化较小。冷藏期间n<1,所有样品的n值均在0.06~0.14范围内,属于典型的非牛顿流体,当受到剪切或外力作用时容易变形,具有剪切稀化特性。发酵发芽糙米乳是由紧密连接的多肽链形成的三维结构,当剪切速率增大时,链状的胶体粒子之间相互钩挂减少从而表现出剪切稀化的现象。n越小对外力作用越敏感,组织结构越容易遭到破坏。LpLa和LrLc的n值较大,相对受外界作用力影响较小,在贮运中较方便,而n值较小的发酵糙米乳则需要在贮运时注意。
Nguyen等[31]研究了2种发酵牛乳的流变学性质,发现28 d贮藏期内随着贮藏时间的延长K增大,n减小。对发酵牛乳进行0.01~100 s-1剪切扫描,K变化范围为49~63 Pa·sn,n为0.08~0.05。这一方面可能与发酵基质有关;另一方面可能是因为剪切速率不一样,Bezerra[32]对发酵牛乳从10~1100 s-1进行剪切扫描,发现其K值为4.9 Pa·sn。
3 结论
将4种乳酸菌两两组合发酵发芽糙米乳,4 ℃贮藏21 d LrLc和LaLc pH变化较小,对应的滴定酸度增加较少,分别为28.14 °T和23.59 °T,后酸化程度相对较弱,有利于产品质量的稳定与保持。贮藏期间各组发酵乳活菌数都大于8 lg cfu/mL,远远高于国家标准。其中LrLc和LaLc活菌数较稳定,尤其是LrLc活菌数含量一直较高。发酵乳脱水收缩敏感性冷藏期间≤30%,但不同组合之间存在差异性,LrLc STS值较小,持水力较强,21 d时降到14.53%。6组发酵乳蛋白质分解力均较低,可能因为是乳酸杆菌。但是较发酵结束时蛋白质分解力都有所提高。实验中发现含有La的组合蛋白质分解力相对较高。对其流变学特性进行分析得出在贮藏期发酵乳属于典型的非牛顿流体,贮藏期间黏度呈增加的趋势,乳清析出逐渐减少,与脱水收缩敏感性结果一致。结果显示LpLa和LrLc流变学性质较好。综合考虑LrLc较适合发酵发芽糙米乳。
[1]张泓,刘玉芳,许杨. 发芽糙米的开发价值[J]. 食品工业科技,2009,30(6):368-370.
[2]王文高,陈正行. 发芽糙米——21世纪主食[J]. 粮食与油脂,2001(12):6-7.
[3]Kayahara H. Functional components of pre-germinated brown rice and their health promotion and disease prevention and improvement[J]. Weekly Agriculture Forest,2001,1791:4-6.
[4]Patil S B,Khan M K. Germinated brown rice as a value added rice product:A review[J]. Journal of Food Science and Technology,2011,48(6):661-667.
[5]Nathanon T,Chantelle B,Anuchita M,et al. Effect of germinated rough rice media on growth of selected probiotic bactaria[J]. Pakistan Journal of Biological Sciences,2006,9(14):2657-2661.
[6]Hunt J R,Johnson L A K,Juliano B O. Bioavailability of zinc from cooked Philippine milled,undermilled,and brown rice,as assessed in rats by using growth,bone zinc,and zinc-65 retention[J]. Journal of Agricultural and Food Chemistry,2002,50(18):5229-5235.
[7]Su T,Kozo N,Hiroshi K. Analysis of phenolic compounds in white rice,brown rice,and germinated brown rice[J]. Journal of Agricultural and Food Chemistry,2004,52(15):4808-4813.
[8]Chung H J,Cho D W,Park J D,et al.Invitrostarch digestibility and pasting properties of germinated brown rice after hydrothermal treatments[J]. Journal of Cereal Science,2012,56(2):451-456.
[9]Ito Y,Shen M,Kise M,et al. Effect of pre-germinated brown rice on postprandial blood glucose and insulin level in subjects with hyperglycemia[J]. Japanese Journal of Food Chemistry,2005(12):80-84.
[10]孙月娥,王卫东,李曼曼. 发芽糙米黑豆复合饮料的生产工艺[J]. 食品科学,2010,31(18):476-478.
[11]Cornejo F,Caceres P J,Rosell C M,et al. Effects of germination on the nutritive value and bioactive compounds of brown rice breads[J]. Food Chemistry,2015,173:298-304.
[12]李次力. 速食发芽糙米的研究[J]. 食品工业科技,2010,23(1):304-306.
[13]苏芳. 六株植物乳杆菌在豆乳中发酵特性的研究[D]. 内蒙古:内蒙古农业大学,2011:8.
[14]曾凤泽. 具有优良发酵特性的德氏乳杆菌保加利亚亚种的筛选[D]. 内蒙古:内蒙古农业大学,2013:12.
[15]Abu-taraboush H M,Al-dagal M M,Al-royli M A. Growth viability and proteolytic activity of Bifidobacteria in whole camel milk[J]. Journal of Dairy Science,1998,81(2):354-361.
[16]Nielsen P M,Petersen D,Dambmann C. Improved method for determining food protein degree of hydrolysis[J]. Food Chemistry and Toxicology,2001(5):642-646.
[17]李丽微. 新型益生乳酸菌发酵山药酸奶的研究[D]. 保定:河北农业大学,2014.
[18]乌仁图雅,德亮亮,扎木苏,等. 分离自传统发酵乳制品中具有优良发酵特性的保加利亚乳杆菌的筛选[J]. 食品与发酵工业,2014,40(6):60-64.
[19]王晴,王宇,韩建荣,等. 开菲尔发酵乳发酵参数变化趋势[J]. 食品与发酵工业,2009,35(11):189-192.
[20]王水泉. 益生植物乳杆菌P8在豆乳及牛乳中发酵特性的研究[D]. 内蒙古:内蒙古农业大学,2011:15.
[21]包艳,苏芳,董喜梅,等. 益生菌豆乳发酵剂的筛选[J]. 中国乳品工业,2011,39(8):11-15.
[22]朱秋劲,王电,陈廷昌. 酸奶加工的全程物理性质变化的研究[J].食品科学,2003,24(2):44-48.
[23]Prasanna P H P,Grandison A S,Charalampopoulos D. Bifidobacteria in milk products:An overview of physiological and biochemical properties,exopolysaccharide production,selection criteria of milk products and health benefits[J]. Food Research International,2014,55(2):247-262.
[24]Ranadheera C S,Baines S K,Adams M C. Importance of food in probiotic efficacy[J]. Food Research International,2010,43(1):1-7.
[25]Mani-López E,Palou E,López-Malo A. Probiotic viability and storage stability of yogurts and fermented milks prepared with several mixtures of lactic acid bacteria[J]. Journal of Dairy Science,2014,97(5):2578-2590.
[26]王佳. 鼠李糖乳杆菌和干酪乳杆菌发酵大豆乳工艺研究[D]. 保定:河北农业大学,2009:22.
[27]吴均. 牦牛酸乳中优良乳酸菌的筛选鉴定及发酵酸乳抗氧化特性研究[D]. 重庆:西南大学,2014:23.
[28]李岩岩,谷新晰,杨雪聪,等. 瑞士乳杆菌和干酪乳杆菌混种发酵绿豆乳产品稳定性研究[J]. 中国食品学报,2013,13(7):14-18.
[29]杨媚. 应用萌发大豆生产益生菌发酵豆乳的研究[J]. 食品工业科技,2010,31(11):206-209.
[30]Thomas T D. Role of lactic acid bacteria and their improvement for production of better fermented animal products[J]. Journal of Dairy Science and Technology,1985,2(1):1-10.
[31]Nguyen H T H,Ong L,Lefevre C,et al. The microstructure and physicochemical properties of probiotic buffalo yoghurt during fermentation and storage:a comparison with bovine yoghurt[J]. Food and Bioprocess Technology,2014,7(4):937-953.
[32]Bezerra M F,Souza D F S,Correia R T P. Acidification kinetics,physiochemical properties,and sensory attributes of yoghurts prepared from mixtures of goat and buffalo milks[J]. International Journal of Dairy Technology,2012,65(3):437-443.
Study on characters of fermented germinated brown rice milk prepared with combination of two lactic acid bacteria
ZHU Li-jie,FANG Yi-yuan,CHEN Yan-jie,LIU Xiu-ying,WANG Bo,LIU He,HE Yu-tang,MA Tao*
(College of Food Science and Technology,Bohai University,National & Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products,Jinzhou 121013,China)
Lactobacillusplantarum,L.rhamnosus,L.acidophilusandL.caseiwere used for germinated brown rice milk fermentation on pairwise combination. The best group was selected by evaluating their properties including acidity,viable count,susceptibility to syneresis,proteolytic activity and rheological property. Results showed that fermentation characteristics of these combinations in germinated brown rice milk were different,while L. acidophilus and L. casei dominated the acidity trend of each combination at 4 ℃ during a 21 d storage. Viable count of each groups were more than 8 lg cfu/mL,and the differences of processing properties were obvious between the two groups. The product fermented withL.rhamnosusandL.caseidisplayed weak post acidification which reduced 0.65 units pH and lower amount of whey was separated out. The viable count of the product was more than 8.5 lg cfu/mL and the free amino acid increased 0.08 mmol/L. Rheological measurement indicated that its viscosity was better.
Lactobacillus;co-culture;germinated brown rice milk;properties
2016-06-13
朱力杰(1986-),男,博士,讲师,研究方向:农产品深加工与功能性食品,E-mail:charleswestwood@163.com。
*通讯作者:马涛(1962-),男,博士,教授,研究方向:粮油与植物蛋白工程,E-mail:matao-09@163.com。
辽宁省农业领域青年科技创新人才培养计划(2015001)。
TS210.1
A
1002-0306(2016)22-0195-06
10.13386/j.issn1002-0306.2016.22.030
