曼式无针乌贼肌肉的低温相变区热特性及蛋白热稳定性研究
2017-01-13李和生宋正规毛天立
李 密,李和生,金 洋,郑 丽,宋正规,毛天立
(宁波大学海洋学院,浙江宁波 315211)
曼式无针乌贼肌肉的低温相变区热特性及蛋白热稳定性研究
李 密,李和生*,金 洋,郑 丽,宋正规,毛天立
(宁波大学海洋学院,浙江宁波 315211)
以曼式无针乌贼肌肉为原料,采用差式扫描量热仪(DSC)研究乌贼肌肉的热特性。本文一方面测定新鲜乌贼肌肉低温相变区(-40~10 ℃)的热特性,另一方面比较4 ℃贮藏(冷藏)和4 ℃下冰块包埋贮藏(冰藏)乌贼肌肉在贮藏期间的热特性差异。结果分析表明:乌贼肌肉冰点是-3.3 ℃,冻结焓170.75 J/g,冻结温度-15.1 ℃,不可冻结含水率为22.98%;表观比热首先缓慢增加,然后快速增加达到峰值28.242 J/(g· ℃),随后迅速减小,并且表观比热和温度拟合良好,拟合度R2=0.9879;乌贼肉的热焓值在升温过程中明显增大;冰藏组(4 ℃冰块包埋)和冷藏组(4 ℃)对比,肌球蛋白和肌动蛋白贮藏稳定性更高。本实验研究曼式无针乌贼肌肉的热特性,为乌贼肉的加工提供理论依据。
曼式无针乌贼肌肉,差式扫描量热,表观比热,热焓
曼式无针乌贼(SepiellamaindronideRochebrune),属于头足纲乌贼科动物,是我国东海海域的重要海产品之一。新鲜的曼氏无针乌贼,肉质洁白、有光泽且味道鲜美、营养丰富。其中蛋白质含量在13%左右,脂肪含量在0.8%以下,同时还含有丰富的磷、维生素B2、钙、铁、镁、功能性糖类等,是符合人们健康需求的滋补海产珍品,研究曼式无针乌贼的热特性对于乌贼资源的产业化加工具有重要意义。
目前市场上乌贼主要以新鲜和冻藏两种方式销售,深加工产品所占比例较低。水产品深加工能创造巨大经济价值,是未来水产品行业发展的方向之一。但是水产品深加工首先要熟悉原料的基本特性,尤其是众多加工流程都要涉及的热特性,比如水产品的保鲜、杀菌、干燥、烹调等过程[1]。Dominique等[2]利用差式扫描量热仪(DSC)研究高压对于蛋白质热稳定性的影响;艾志录等[3]分析棕榈酸、油酸对于淀粉糊化温度的影响;钱旻等[4]研究真空渗盐对冷藏藕片热特性的影响。综上,目前国内外文献热特性研究主要集中在淀粉、油脂,蛋白质等方面,对于乌贼等水产品原料热特性的研究报道较少,本文主要研究曼式无针乌贼肌肉的热特性。
本文以曼氏无针乌贼肌肉为研究对象,本文主要应用差式扫描量热仪对乌贼肉进行三个温度段(10~-40,-40~10,5~90 ℃)的扫描,来测定乌贼肌肉的冰点、不可冻结含水率、表观比热、热焓等热特性参数和冷藏(4 ℃)和冰藏(4 ℃冰块包埋)过程中蛋白稳定性的变化,为乌贼的深加工与利用提供理论基础。
1 材料与方法
1.1 材料与仪器
曼氏无针乌贼 选取象山港海捕曼氏无针乌贼,质量在300~500 g之间;碳酸钾、阿拉伯胶、甘油、硼酸、盐酸、磷酸、氯化钾、高氯酸、氢氧化钠、硫酸铜、碘化钾、甲基红、亚甲基蓝 均购于国药集团,分析纯。
5mL微量滴定管 杭州市凯英仪器公司;康威式微量扩散皿 临沂正恒化玻璃仪器公司;UV-1700型紫外可见分光光度计 日本岛津公司;DSC204F1型差示扫描量热仪(DSC) 德国耐驰公司,该设备用铟校正温度和热焓,冷却方式为液氮,样品吹扫气和保护气(氮气,纯度99%以上)分别为20 mL/min和50 mL/min;TG16-WS型高速离心机 湖南湘仪实验室仪器有限公司。
1.2 实验方法
1.2.1 乌贼的处理 新鲜乌贼解剖,取得胴体肌肉,平均分为两组,分别编号放入PE袋中。一组冷藏处理(温度(4±1) ℃,放入样品盒内,4 ℃冰箱放置),另一组冰藏处理(底部镂空盒子,样品表面覆盖碎冰块,4 ℃冰箱放置),贮藏时间为两周。首先选取新鲜乌贼样品运用DSC测定冰点、不可冻结含水率、表观比热(标准物为氯化钾)、热焓;同时对两种贮藏方式的样品,在0、2、4、6、8、10、12 d测定理化指标和蛋白吸热值,每个指标做三次平行。
1.2.2 理化指标的测定 参照沈月新[5]的方法和国家最新标准测定其中的水分(GB 5009.3-2010),粗蛋白(GB 5009.5-2010),粗脂肪(GB/T 14772-2008),灰分含量(GB 5009.4-2010)。每组样品做3个平行。
1.2.3 低温相变区热特性参数测定 参照鲁长新[6]的方法,在标准铝坩埚中准确称取(5±0.1)~(10±0.1) mg样品,液压密封,每个样品五次平行。设置初温扫描程序为:初温为10 ℃,恒温5 min,以5 ℃/min的速率降温至-45 ℃,恒温5 min,再以5 ℃/min的速率升温至10 ℃。参比物选择氯化钾。在降温曲线上,取降温曲线上外推起始温度为冻结温度;升温曲线上,理论上冰点为结晶刚刚熔解完成的温度,但由于试样熔化完后,热流曲线回归基线是个渐变的过程,且受到升温速率和样品量的影响,出现不同程度的滞后现象,因此把相变峰值温度作为乌贼肉的冰点。
1.2.4 表观比热和热焓的测定 采用刘振海[7]的方法,并加以改进,测定乌贼肉的表观比热,按下式计算:
式(1)
式中Capp-样品的表观比热,J/g· ℃;mstd-标准物的质量,mg;ms-样品的质量,mg;DSCs-样品的热流信号,mW;DSCb-空盘的热流信号,mW;DSCstd-标准物的热流信号,mW;Cp·std-标准物的比热,J/g· ℃。
参考Gauss公式并进行改进,表观比热(f)和温度(x)的拟合公式为:
f=a/(1+((x-x0)/b)2
式(2)
其中a,b,x0为常数。
热焓和表观比热的关系可用下式表示,本实验参考温度为-40 ℃,即-40 ℃的热焓H=0:
式(3)
式中H-样品热焓,J/g;T-温度, ℃;Capp(T)-温度T时的表观比热,J/g· ℃。
1.2.5 不可冻结含水率的测定 不可冻结含水率是通过测量样品中的可冻结水的结晶焓(或熔融焓),参考刘春泉[8]等人的方法,修改为下式计算:
式(4)
式中:α-不可冻结含水率,%(湿基);ω-水分含量,%(湿基);Tf=样品冻结温度, ℃;ΔHTf-样品在冻结温度下的冻结焓,J/g;L-纯水在冻结温度下的冻结焓,J/g。
1.2.6 蛋白质热稳定性的分析方法 参考刘振海[6]等建立的方法,并加以改进。在标准铝坩埚中准确称取(5±0.1)~(10±0.1) mg样品,液压密封,每个样品做五次平行。设置初温扫描程序为:初始温度为5 ℃,以5 ℃/min的速率升温至90 ℃。
1.3 数据处理与统计分析
所有数据至少重复三次,数据以平均值及方差表示。所有的热信号都从DSC曲线上读出,数据分析采用热分析软件Proteus(德国耐驰公司),统计分析使用SPSS 13.0软件,IBM公司,采用单因素方差分析(one-Way ANOVA),p<0.05表示具有显著性差异;表观比热使用Gauss公式拟合,绘图使用Origin 8.5.1版本,Origin LAB公司。
2 结果与讨论
2.1 曼氏无针乌贼肌肉主要成分分析
由表1可知乌贼肌肉水分含量为80%左右,蛋白含量高且脂肪含量低,是理想的蛋白质来源。乌贼肌肉可以看做由水和非水两部分组成,非水部分包括蛋白质、脂肪、糖类、金属离子、水溶性小分子化合物等[9]。乌贼肉的加工过程就是水分和非水部分相互作用的过程,

表1 曼氏无针乌贼肌肉的基本成分分析

表2 乌贼肌肉相变温度和不可冻结含水率
了解乌贼肌肉的主要成分含量有助于肌肉热特性的分析。
2.2 乌贼肌肉冻结和熔融过程DSC曲线分析
由图1可知,样品在-10.8~-15.1 ℃之间出现放热峰,且在-12.0 ℃出现峰值,峰值为-4.326 mW/mg,之后没有放热峰出现。这可能因为乌贼肉在降温过程中温度先过冷到-12 ℃附近,出现稳定的晶核,立即向冰晶体转化并释放出潜热,因此有放热峰出现,完全冻结后放热过程结束,不再出现放热峰。在纯水冻结的过程中,由于缺少形成冰晶体的物质,冻结温度很低,超纯水的冻结温度大约为-39 ℃[10]。由于乌贼肉中富含小分子化合物和部分金属离子,有利于晶核的形成,因此乌贼肉的冻结温度远高于纯水。
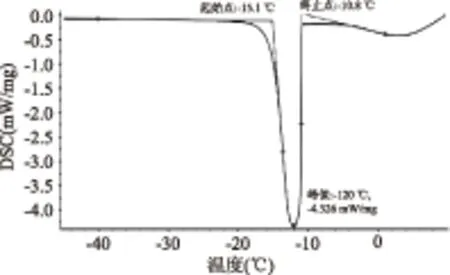
图1 乌贼肉降温的DSC曲线Fig.1 DSC melting curve for squid muscle
由图2可知,样品在-3.3~6.6 ℃之间出现明显的吸热峰,峰值为2.478 mW/mg,表明冻结样品在此温度区间内逐渐融化。对比图1可知升温曲线并不是降温曲线的逆过程,其峰形比降温过程中的峰形要宽,在4.1 ℃附近出现峰值;降温曲线上-12 ℃出现峰值,峰相对较高,但峰面积相当,表明吸热值和放热值近似。这可能是因为两个过程能量守恒的原因。
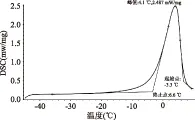
图2 乌贼肉升温的DSC曲线Fig.2 DSC freezing curve for squid muscle
由表2可知乌贼冻结相变温度区间为-15.1~-10.8 ℃,熔融相变温度为-3.3~6.6 ℃,冻结温度为-15.1 ℃,冰点温度为-3.3 ℃,不可冻结含水率为22.98% 。水产品组织的冰点和组织纹理、水分含量、可溶性小分子含量等有关,相关文献[11]报道了部分海产品组织的冰点,基本集中在-1~-2.2 ℃之间。乌贼肌肉冰点为-3.3 ℃,远低于其他海产品,可能与乌贼肌肉特殊的纹理和较高的可溶物质有关,较低的冰点便于利用冰点贮藏更好的保存乌贼肉的新鲜度、风味和口感;不可冻结水主要是结合水,可以方便估计自由水的含量,冻结相变温度范围为-15.1~-10.8 ℃,为乌贼肉的冻藏保鲜提供基础。
2.3 低温条件下表观比热的变化
在低温相变过程中,乌贼肉的表观比热随温度的变化而变化,两者之间存在定量关系。在Gauss公式的基础上,对表观比热(f)和温度(x)进行数学拟合,其拟合公式为f=a/(1+((x-x0)/b)2,其中,R2=0.9879;a=30.2703,b=2.6028,x0=3.1660;SD=1.3852。其拟合曲线如图3所示。
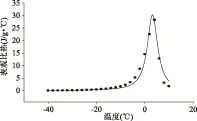
图3 乌贼相变区表观比热变化Fig.3 Apparent specific heat of squid muscle during phase transition
由图3可知,在低温区(-40~-10 ℃)随着温度升高,乌贼的表观比热变化不显著(p>0.05;在相变区(-10~6 ℃),表观比热显著增大(p<0.05)且在冰点附近达到峰值28.242 J/g· ℃;相变结束后乌贼的表观比热降低,与文献[12]中报道的12种海产品在该温度范围内的表观比热(3.33~3.71 J/g· ℃)接近。在水产品加工的理论运算,包括冷冻设备、低温保鲜和生产工艺的设计过程中,往往要计算原料的热负荷,它与原料的质量和表观比热有关,探索表观比热与温度的函数关系可以对计算提供帮助[13]。表观比热主要取决于相变潜热的大小:在相变区随温度的升高,乌贼肉中的冰晶吸热融化转变为液态水,表观比热快速增加;当冰晶完整存在或冰晶完全转换为液态水时,相变潜热变化很小,表观比热变化不大。
2.4 低温条件下热焓的变化
乌贼的热焓表示了肉中含有的热量,它有显热和潜热两部分组成,包括了肉中固形物,未结冻水,结冻水的显热和肉中水分结晶与熔融的潜热。通过相变潜热的测量,可以得到有关物质结构,相变机理等重要信息。图4反应了相变前后的热焓变化情况,确定-40 ℃的焓值为0点,随着温度的升高,热焓逐渐增大,冰点过后热焓值迅速增加,可能是由于相变的进行使得相变潜热被快速的释放出来。冷雪等[14]研究了不同种类小米淀粉热力学特性,发现淀粉颗粒在相变开始后热焓值快速增加,热焓值和糊化终止温度相关。
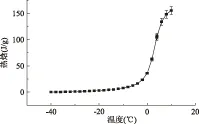
图4 乌贼相变区的热焓变化Fig.4 The enthalpy of squid muscle during phase transition
2.5 低温贮藏过程中乌贼肌肉热特性分析
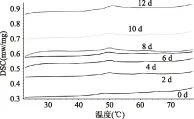
图5 不同贮藏时间冷藏组DSC扫描曲线Fig.5 DSC scanning curves during refrigeration
图5和图6显示了冰藏组和冷藏组乌贼肉DSC扫描曲线的变化,由图可知,两组新鲜乌贼肉(0 d)在扫描曲线上出现了三个峰:从左往右,峰1在40~60 ℃有最大吸收值,已经证实由肌球蛋白引起;峰2在60~70 ℃有最大吸收值,由胶原蛋白和肌浆蛋白引起;峰3在75~85 ℃间有最大吸收值,由肌动蛋白引起[15-18]。对比图5和图6我们可知,肌球蛋白和肌动蛋白对应吸收峰变化明显,冷藏组中胶原蛋白和肌浆蛋白对应吸热峰变化不明显,通过分析峰的变化进而分析肌球蛋白和肌动蛋白的变化情况。肌球蛋白的肌动蛋白是乌贼肉中的重要蛋白质,和肉的持水力相关,进而影响肉的品质。肌球蛋白对应峰1和肌动蛋白对应峰3的具体变化情况如图7和图8所示,其中温度表示蛋白热变性过程峰值温度,峰值面积表示蛋白质变性吸收的热量的多少。温度、峰的形状、峰面积的变化都反映出蛋白质三级结构、四级结构等发生了变化。
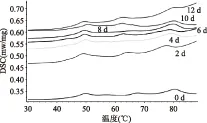
图6 不同贮藏时间冰藏组乌贼DSC扫描曲线Fig.6 DSC scanning curves during ice store
吸热峰的出现表明蛋白质在对应温度范围内结构发生了改变。已知图5中DSC曲线,对峰1在冷藏期间对应峰值温度和吸热值进行分析,结果如图7所示。
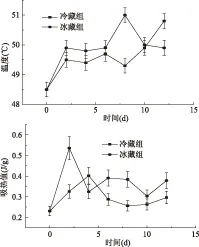
图7 峰1贮藏过程中峰值温度和吸热值的变化Fig.7 Changes in peak area and temperature during storage of peak 1
由图7可知,在两种贮藏条件下肌球蛋白对应的吸收峰变化趋势显著(p<0.05)不同:冷藏组和冰藏组吸收峰对应温度均升高,贮藏期间相同天数冰藏组对应温度高于冷藏组,对应吸热值冰藏组也高于冷藏组。这表明冰藏组肌球蛋白的贮藏稳定性高于冷藏组。肌球蛋白吸收热量结构发生改变,变性过程中吸收的热量越多表明蛋白质结构越稳定,贮藏期间冰藏组对应温度和吸热值高于冷藏组,因此冷藏组对应肌球蛋白稳定性更高,即冷藏组乌贼肉的品质降低更为缓慢。
对图6 DSC曲线积分,并对峰3在冷藏期间对应峰值温度和吸热值进行分析得到如图8所示。
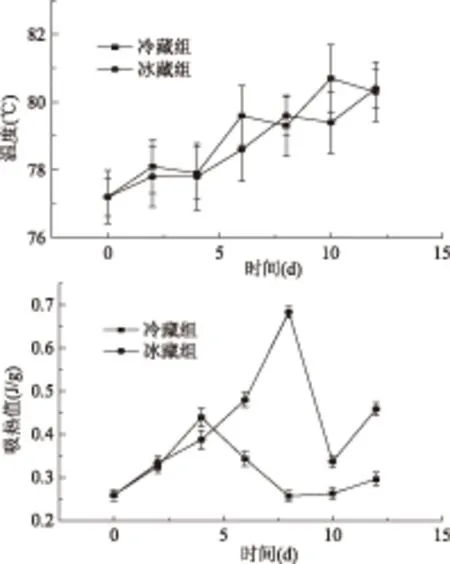
图8 峰3贮藏过程中变性温度和吸热值的变化Fig.8 Changes in peak area and temperature during storage of peak 3
由图8可知,两种贮藏条件下肌动蛋白对应的吸收峰变化同样不同。其中对应温度都呈现增加的趋势,从77 ℃附近增大到80 ℃附近;贮藏的前5 d吸热峰面积无明显差异,5 d后吸热峰面积有较大的差异(p<0.05),特别是第8 d冰藏组吸热值远大于冷藏组,冰藏条件下的峰面积大于冷藏条件下的峰面积。这表明两种贮藏条件下,肌动蛋白的结构也发生了变化,但是冷藏组稳定性高于冰藏组。Tironi等研究发现黑鲈鱼分别经鼓风冻结(-30 ℃)和压力辅助解冻(20 ℃)、以及压力切换冻结(-18 ℃)和鼓风解冻(4 ℃)之后,肌球蛋白所对应的吸热峰的形状和面积都发生了变化,表明不同温度条件下肌球蛋白的结构确实发生了变化[19]。
3 结论
经过分析,曼式无针乌贼肌肉样品的冰点是-3.3 ℃,冻结焓是170.75 J/g,冻结温度是-15.1 ℃,不可冻结含水率为22.98%;乌贼肉的表观比热随着温度的升高呈现先升高后降低的变化趋势,且同温度之间存在极高的拟合度;乌贼的热焓值随着温度的升高快速增加;冰藏组和冷藏组对比,肌球蛋白和肌动蛋白贮藏稳定性更高。为乌贼肉的低温贮藏和加工提供理论基础。
[1]李永武,刁静静,赵泽龙,等.绿豆清蛋白功能特性及热特性研究[J]. 食品工业科技,2014,35(20):128-133.
[2]Dominique L,Gipsy T,Luis M. Protein Changes Caused by High Hydrostatic Pressure(HHP):A Study Using Differential
Scanning Calorimetry(DSC)and Fourier Transform Infrared(FTIR)Spectroscopy[J]. Food Engineering Reviews,2017,2(7):220-227.
[3]艾志录,陈迪,谢新华,等.棕搁酸、油酸对糯米淀粉热特性的影响[J]. 食品科学,2013,34(21):20-24.
[4]钱旻,宋江峰,李大婧. 真空渗盐对冷冻莲藕片品质及热特性的影响[J]. 食品科学,2014,35(17):114-118.
[5]沈月新,章超桦,薛长湖,等. 水产食品学[M].北京:中国农业出版社,2001.
[6]鲁长新,赵思明,熊善柏. 鲢鱼肉相变区间的热特性研究[J]. 农业工程学报,2007,23(6):39-43.
[7]刘振海. 分析化学手册(热分析)[M]. 北京:化学工业出版社,2000.
[8]刘春泉,卓成龙,宋江峰,等. 外源添加物对毛豆仁熔融相变区热特性的影响[J].江苏农业学报,2012,28(3):652-656.
[9]马荣朝,秦文,薛文通. 马铃薯糊化过程中介电特性和热特性的研究[J]. 农业工程学报,2008,24(10):248-253.
[10]顾园华,宋春芳,崔政伟.基于温度和水分的紫薯热物理特性与介电特性的分析[J]. 浙江农业学报,2015,27(1):97-103.
[11]Lacey R E,Payne F A. A model to estimate thermodynamic properties of biological materials during freezing[J]. Transactions of the ASAE,1991,34:1836-1841.
[12]Schwartzberg H G. Effective heat capacities for the freezing and thawing of food[J].Journal of Food Science,1976,41:152-156.
[13]马红静,谢新华,贺平,等. 蔗糖和海藻糖对糯米淀粉黏滞性和热特性的影响[J]. 粮食与饲料工业,2015,7(1):36-40.
[14]冷雪,曹龙奎. 利用差示扫描量热仪研究小米淀粉及小米粉的糊化特性[J]. 食品科学,2015,36(19):60-67.
[15]Bertolan C,Bevilacqua AE,Zaritzky N E.Heat treatment effect on texture changes and thermal denaturation of proteins in beef muscle[J]. Journal of Food Processing and Preservation,1994,18(1):31-46.
[16]Wright D. Differential scanning calorimetry-Its application to the study of meat proteins[J]. Journal of the Science of Food and Agriculture,1978,29(12):42-45.
[17]FrYsteineskf T. Myosin denaturation in pale soft and exudative(PSE)porcine muscle tissue asstudied by differential scanning calorimetry[J]. Journal of the Science of Food and Agriculture,1984,35(2):240-244.
[18]Martens H. Thermal denaturation of proteins in post rigor muscle tissue as studied by differential scanning calorimetry[J]. Journal of the Science of Food and Agriculture,1980,31(10):1034-1042.
[19]Tironi V A,Tomas M C,Anon M C. Lipid and protein deterioration during the chilled storage of minced Sea salmon(Pseudopercissemifasciata)[J].Journal of Science Food Agriculture,2007,87(12):2239-2246.
Thermal characteristics in low-temperature-phase transition and thermal stability of the protein of squid(SepiellamaindronideRochebrune)muscle
LI Mi,LI He-sheng*,JIN Yang,ZHENG Li,SONG Zheng-gui,MAO Tian-li
(College of Marine,Ningbo University,Ningbo 315211,China)
The thermal characteristics of Mannesmann maindroni muscles as raw material was studied by using differential scanning calorimetry(DSC). On the one hand,the freezing point,freezing enthalpy,freezing temperature and non-freezing water content of fresh squid meat were measured in low temperature phase transition region(-40~10 ℃).On the other hand,thermal characteristics of squid muscle was compared between the refrigerator storage and the ice-embedded storage of 4 ℃.The results showed that freezing point,freezing enthalpy,freezing temperature and non-freezing water content was respectively -3.3 ℃,170.75 J/g,-15.1 ℃ and 22.98%. Squid meat apparent specific heat increased at first and peaked 28.242 J/(g· ℃),but it decreased rapidly at last. Apparent specific heat and temperature fitted well,and theR2was 0.9879.Compared with refrigerated group of 4 ℃,myosin and actin protein in iced group had higher storage stability. The study aimed to research thermal characteristics of Mannesmann maindroni muscle and provide a theoretical basis for the squid meat processing.
squid muscle;DSC;apparent specific heat;enthalpy
2016-05-27
李密(1992-),男,在读硕士研究生,研究方向:水产品加工与贮藏,E-mail:limi_0115@163.com。
*通讯作者:李和生(1960-),男,教授,研究方向:食品资源利用,E-mail:lihesheng@nbu.edu.cn。
浙江省重大科技专项(2009C03017-3);“水产”浙江省重中之重学科开放基金(xkzsc1426,xkzsc1523);宁波市自然科学基金(013A610156)。
TS254
A
1002-0306(2016)22-0168-05
10.13386/j.issn1002-0306.2016.22.025
