肿瘤异常蛋白在乳腺癌患者中的表达及其与化疗效果相关性
2017-01-12史英柳志宝赵瑾高敬华刘纪红郭廷
史英 柳志宝 赵瑾 高敬华 刘纪红 郭廷廷
[摘 要] 目的:分析肿瘤异常蛋白(Tumor abnormal protein,TAP)在乳腺癌患者中的表达及其与化疗效果的相关性,为患者预后的早期评估提供参考。方法:选取我院2014年1月—2015年3月符合标准的156例乳腺癌患者,对其化疗前末梢血涂片TAP凝聚物面积进行检测,比较不同病理特征、不同近期疗效患者TAP表达的差异,分析TAP评估患者新辅助化疗近期疗效的临床价值。结果:化疗前TAP正常者36例,TAP异常(凝聚物较小)者76例,TAP异常(凝聚物较大)者44例,TAP异常率为76.92%。不同肿瘤直径、病理分级、淋巴结状态、ER状态、PR状态及三阴性乳腺癌患者化疗前TAP表达情况比较,差异有统计学意义(P<0.05)。156例患者均完成2周期化疗,疗程结束后PR89例,SD 40例,PD 27例。PR者化疗前TAP凝聚物面积低于SD/PD患者,差异有统计学意义(P<0.05)。结论:TAP在乳腺癌预后评估及疗效监测等方面具有一定临床应用价值,值得进一步研究。
[关键词] 肿瘤异常蛋白;乳腺癌;化疗;相关性
中图分类号:R737.9 文献标识码:A 文章编号:2095-5200(2016)06-097-03
DOI:10.11876/mimt201606036
乳腺癌被认为是化疗最有效的实体肿瘤之一,部分患者对化疗不敏感,如何早期评估患者化疗效果并寻求其他治疗策略十分重要[1]。肿瘤异常蛋白(Tumor abnormal protein,TAP)又称异常糖链糖蛋白,是一类细胞癌变初期致癌因子促发原癌基因和抑癌基因突变后产生的异常糖蛋白及钙-组蛋白复合物,癌细胞异常增生的发生发展往往伴随着TAP表达的显著增加[2]。作为一种病理学、影像学、肿瘤标志物检测的补充诊断手段,近年来TAP检测在子宫内膜癌、胃肠肿瘤的早期筛查与疗效评估中得到了关注 [3]。本研究就乳腺癌患者TAP表达及其与化疗效果的相关性进行了分析,旨在弥补关于TAP与乳腺癌研究的空白。
1 资料与方法
1.1 一般资料
自我院2014年1月—2015年3月收治的确诊乳腺癌[4]患者中进行筛选,选取标准:1)卡氏功能状态评分(KPS)≥70分,预计生存期≥6个月;2)接受新辅助化疗。排除标准:1)合并其他良恶性肿瘤;2)合并TAP检测阳性干扰因素,包括糖尿病、自身免疫性疾病、风湿和类风湿进行期、骨折未愈、异常增生等;3)妊娠或哺乳期女性。共选取符合条件的患者156例,将其纳入此次研究。本研究经我院医学伦理委员会批准,患者及家属均知情同意并签署书面协议。
1.2 检测方法
对患者化疗前后TAP表达进行检测[5]:末梢血 25μL涂血片2张。晾干后,每张血片间隔均匀滴加3滴TAP试剂,共6个液斑,2 h后使用TAP检测图文系统,选取面积测量功能,对TAP凝聚颗粒面积进行测量。TAP检测仪和TAP凝聚助剂均购自浙江瑞生医疗科技有限公司。凝聚颗粒面积测量方法[6]:单颗典型凝聚颗粒面积≥81μm2为有效凝聚颗粒;若有效凝聚颗粒仅为1颗,则报告面积为该有效凝聚颗粒的实测面积;若有效凝聚颗粒≥2颗,报告面积为所有有效凝聚颗粒的实测面积之和×0.62;若最大凝聚颗粒面积<81μm2,报告面积为最大最典型凝聚颗粒的面积。
1.3 分析方法
比较不同临床病理特征患者化疗前TAP表达情况,分析TAP表达与肿瘤直径、肿瘤分级、雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体(HER-2)等特征的关系。TAP表达情况包括:TAP正常(无明显凝聚物):凝聚物面积<121μm2;TAP异常(凝聚物较小):121≤凝聚物面积<225 μm2;TAP异常(凝聚物较大):凝聚物面积≥225μm2。
参照世界卫生组织(WHO)实体瘤疗效评价标准[7],
对其化疗2周期后近期疗效进行评价。比较疗效为PR、SD、PD患者化疗前后TAP值变化。
1.4 统计学分析
数据采用SPSS18.0进行分析,计数资料以(n/%)表示,并采用χ2检验,计量资料以(x±s)表示,满足方差齐性则采用独立样本t检验,若方差不齐,则采用校正t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同临床病理特征患者化疗前TAP表达情况
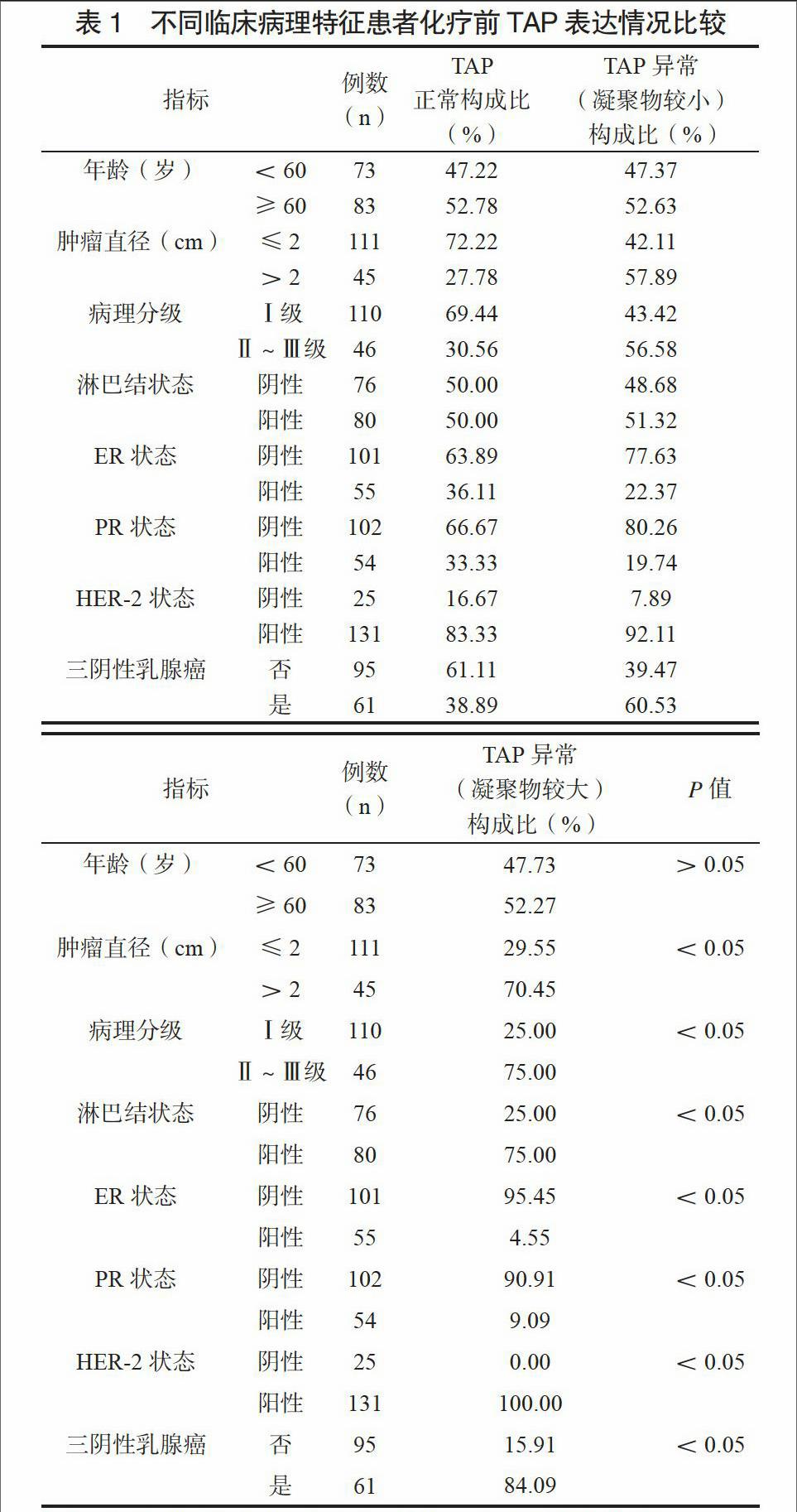
化疗前TAP正常者36例,TAP异常(凝聚物较小)者76例,TAP异常(凝聚物较大)者44例,TAP异常率为76.92%。不同肿瘤直径、病理分级、淋巴结状态、ER状态、PR状态及三阴性乳腺癌患者化疗前TAP表达情况比较,差异有统计学意义(P<0.05)。见表1。
2.2 不同临床疗效患者化疗前后TAP表达情况
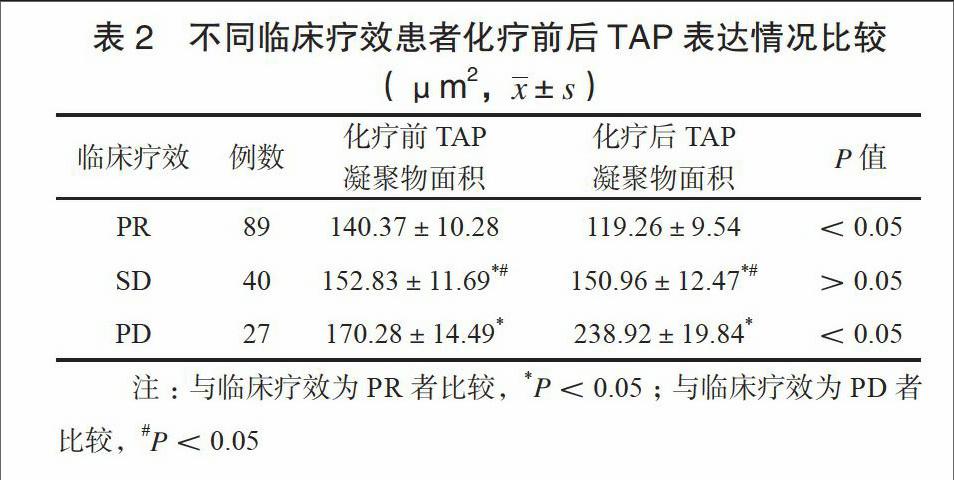
156例患者均完成2周期化疗,疗程结束后CR 0例,PR 89例,SD 40例,PD 27例。不同临床疗效患者化疗前后TAP表达情况比较,差异有统计学意义(P<0.05):临床疗效为PR者,其化疗前TAP凝聚物面积低于SD/PD患者,化疗后TAP凝聚物面积减小;临床疗效为SD者,其化疗前TAP凝聚物面积低于PD者,但化疗后TAP凝聚物面积无明显;临床疗效为PD者,其化疗后TAP凝聚物面积增加。见表2。
3 讨论
既往关于乳腺癌生物学行为的研究表明,多数患者对化疗具有较高的敏感性[8],但仍有部分患者化疗疗效受限,且目前临床尚缺乏一种可早期判定化疗敏感性、预测临床疗效的有效指标[9]。
糖基化作用是蛋白质翻译后修饰过程中的主要方式,故TAP与恶性肿瘤发生、发展、转移及预后均存在一定关联,自国外学者率先将TAP检测系统用于恶性肿瘤的诊断以来,近年来已有大量研究证实TAP在食管、胃、大肠癌癌前病变早期筛查中较高的灵敏度与特异性[10-12]。本研究就TAP与乳腺癌患者临床病理特征的关联性进行了观察,结果表明,随着患者肿瘤直径、病理的上升与淋巴结阳性、ER阴性、PR阴性的出现,其TAP异常率及凝聚物面积均呈现上升趋势,提示TAP在乳腺癌进展过程中扮演了重要角色,其可能机制为:1)乳腺癌细胞恶变早期,糖基转移酶、糖苷酶等糖基化修饰酶失活,某些胚胎成熟时期静止的酶类激活,可能导致细胞表面糖类结构变化,其中,聚糖结构的变化即可造成异常糖链蛋白合成增加,并表现为体液TAP表达上升[13];2)某些糖链蛋白在肿瘤细胞的转移中亦发挥了重要作用,如β1,6分支糖链蛋白表达上升可造成肿瘤细胞粘附纤连蛋白能力下降,导致肿瘤迁移能力上升[14],而唾液酸水平的降低往往导致肿瘤细胞连接紧密性下降,转移能力增强[15]。
恶性肿瘤治疗的有效性不仅仅反应为肿瘤体积的缩小,故单纯应用影像学手段无法明确肿瘤功能或活性变化,其有限的时效性可能造成延迟治疗或过度治疗,影响患者预后质量[16]。新型的TAP试剂弥补了判断结果仅为阴性、阳性的局限性 [17]。为验证其价值,本研究对不同临床疗效患者化疗前后TAP表达进行了比较,结果表明,临床疗效较佳者,其治疗前TAP表达水平较低且化疗后TAP表达水平进一步下降,而TAP表达水平的上升往往伴随着疾病的进展,且TAP检测具有操作方便、采血量少、结果可靠等多种优势[18]。
总之,乳腺癌患者末梢血TAP呈异常表达,TAP可能在病情进展演变的过程中扮演了重要角色,且TAP高表达者化疗效果较差。
参 考 文 献
[1] Lan F, Zhu M, Qi Q, et al. Prognostic value of serum tumor abnormal protein in gastric cancer patients[J]. Differentiation, 2016, 4(34): 81.0.
[2] Liu J, Huang X E. Clinical application of serum tumor abnormal protein from patients with gastric cancer[J]. Asian Pac J Cancer Prev, 2014, 16(9): 4041-4044.
[3] 魏昕, 杨举伦. Ki-67 和 PCNA 表达与乳腺癌及乳腺癌化疗敏感性的关系[J]. 中国免疫学杂志, 2014, 30(11): 1549-1551.
[4] Wu X Y, Huang X E. Clinical Application of Serum Tumor Abnormal Protein (TAP) in Colorectal Cancer Patients[J]. Asian Pac J Cancer Prev, 2014, 16(8): 3425-3428.
[5] 李志华, 雷秋模, 熊建萍. 乳腺癌组织p53表达与新辅助化疗疗效相关性Meta分析[J]. 中华肿瘤防治杂志, 2015, 22(3): 221-226.
[6] Zhang L, Guo X, Min Y, et al. Tumor abnormal protein (TAP) examination contributes to primary diagnosis of bladder cancer[J]. Int J Clin Exp Med, 2015, 8(10): 18528.
[7] Xiao Y, Liu J, Huang X E, et al. A Clinical Study on Juheli (Recombinant Human Interleukin-11) in the Second Prevention of Chemotherapy Induced Thrombocytopenia[J]. Asian Pac J Cancer Prev, 2016, 17(2): 485-489.
[8] 屈洪波, 范原铭, 韩明利, 等. 化疗后残存乳腺癌组织中乳腺癌耐药蛋白, P-糖蛋白的表达及其与癌干细胞的相关性[J]. 中国医学科学院学报, 2013, 35(2): 171-176.
[9] Wang L, Huang X E, Ji Z Q, et al. Safety and Efficacy of a Mouth-Rinse with Granulocyte Colony Stimulating Factor in Patients with Chemotherapy-Induced Oral Mucositis[J]. Asian Pac J Cancer Prev, 2016, 17(1): 413-418.
[10] Zhai X, Zhu H, Wang W, et al. Abnormal expression of EMT-related proteins, S100A4, vimentin and E-cadherin, is correlated with clinicopathological features and prognosis in HCC[J]. Med Oncol, 2014, 31(6): 1-9.
[11] 邱志远, 陶曙, 雷珍, 等. 肿瘤异常蛋白在胃肠肿瘤中的临床价值[J]. 癌症进展, 2016, 14(4): 340-342.
[12] Behrens C, Solis L M, Lin H, et al. EZH2 protein expression associates with the early pathogenesis, tumor progression, and prognosis of non–small cell lung carcinoma[J]. Clin Cancer Res, 2013, 19(23): 6556-6565.
[13] Zhao Y J, Ju Q, Li G C. Tumor markers for hepatocellular carcinoma (Review)[J]. Mol Clin Oncol, 2013, 1(4): 593-598.
[14] 王义霞, 胡涛, 徐尊花, 等. 肿瘤异常蛋白检测系统在早期妇科恶性肿瘤筛查中的应用价值[J]. 中国实验诊断学, 2016, 20(5): 745-747.
[15] Xue X, Hall M D, Zhang Q, et al. Nanoscale drug delivery platforms overcome platinum-based resistance in cancer cells due to abnormal membrane protein trafficking[J]. ACS Nano, 2013, 7(12): 10452-10464.
[16] Nilsson M I, Dobson J P, Greene N P, et al. Abnormal protein turnover and anabolic resistance to exercise in sarcopenic obesity[J]. FASEB J, 2013, 27(10): 3905-3916.
[17] Easwaran H, Tsai H C, Baylin S B. Cancer epigenetics: tumor heterogeneity, plasticity of stem-like states, and drug resistance[J]. Mol Cell, 2014, 54(5): 716-727.
[18] Miettinen M, Killian J K, Wang Z F, et al. Immunohistochemical loss of succinate dehydrogenase subunit A (SDHA) in gastrointestinal stromal tumors (GISTs) signals SDHA germline mutation[J]. Am J Surg Pathol, 2013, 37(2): 234.