紫云英苷在黄顶菊适生土壤中的迁移及降解
2017-01-10张瑞海宋振付卫东张婷黄成成朱昌雄张国良
张瑞海,宋振,付卫东,张婷,黄成成,朱昌雄,张国良
中国农业科学院农业环境与可持续发展研究所,北京 100081
紫云英苷在黄顶菊适生土壤中的迁移及降解
张瑞海,宋振,付卫东,张婷,黄成成,朱昌雄,张国良*
中国农业科学院农业环境与可持续发展研究所,北京 100081
近年来植物黄酮类次生代谢物质已成为外来植物入侵机制研究的热点。黄顶菊(Flaveria bidentis)自2001年入侵我国以来,已对自然生态系统及农业生产造成了严重危害。紫云英苷是黄顶菊植株体内含量最高的黄酮类次生代谢物质,可抑制种子萌发,影响植物生长,目前对其被分泌到土壤后,在土壤中的迁移性及降解等行为尚不清楚。本文研究了紫云英苷在不同土壤中的迁移及降解规律,并以潮土为例,通过土壤酶活性测定与高通量测序技术,试图揭示紫云英苷在土壤中的降解机制。结果表明:紫云英苷在不同土壤中的迁移值Rf为0.14~0.51,呈现弱至中等移动特性;紫云英苷在不同土壤中的降解符合一级动力学方程,降解半衰期为2.68~18.55 h,在灭菌潮土中的半衰期为111.8 h;紫云英苷加入土壤后土壤脱氢酶、多酚氧化酶及β-葡萄糖苷酶活性均表现出一定程度的升高;高通量测序结果表明,紫云英苷改变了土壤细菌群落结构,其中诺卡氏菌属(Nocardioides)、鞘氨醇单胞菌属(Sohingomonas)、新鞘氨醇杆菌属(Novosphingobium)、脂肪杆菌属(Pimelobacter)、Aeromicrobium属、Pedobacter属、溶杆菌属(Lysobacter)、热单胞菌属(Thermomonas)、枝动菌属(Mycoplana)、类芽孢杆菌属(Paenibacillus)、红球菌属(Rhodococcus)、支原体属(Mycoplasma)等菌群在紫云英苷加入土壤后表现出较高的丰度,可能在紫云英苷降解过程中起重要作用。
黄顶菊;紫云英苷;次生代谢物质;土壤迁移;微生物降解;高通量测序
植物在长期进化过程中,逐渐形成了一些适应环境的生理生态功能,其根据自身初生生长的需要产生各种类型的次生代谢物质,释放到土壤中后与土壤中的生物与非生物互作,从而影响植物的生长与发育(Bais et al.,2006;Jones et al.,2012)。黄酮类化合物(flavonoids)是一种被研究得较多的植物次生代谢物质,在植物体内具有重要生理作用,目前已知的生理作用包括控制生长素的运输(Peer et al.,2004;Buer et al.,2007)、种子萌发(周小理等,2012)、植物抗氧化(Agati et al.,2012)、紫外线损伤保护和抵御胁迫等(Eichholz et al.,2012;何永美等,2013;Hideg et al.,2013)等。黄酮类化合物经植物根系分泌到根际土壤后,可以影响土壤氮循环(Cesco et al.,2012),保护植物免受病虫害侵害(Gahukar,2012;Gurjar et al.,2012),影响植物根系生长与发育(Samanta et al.,2011),产生化感作用(Huang et al.,2013;Schulz et al.,2013)以及影响根际土壤微生物(Hassan et al.,2012)等。
近年来植物黄酮类次生代谢物质已成为外来植物入侵机制研究的热点(Weng et al.,2012;Wang et al.,2012;Salles et al.,2014),研究发现入侵植物斑点矢车菊(Centaurea maculosa)分泌的黄酮类物质儿茶素(catechin)可对其他植物及土壤中的微生物等产生化感作用(Pollock et al.,2009);何首乌属(Fallopia)植物释放的黄酮类植物抑制了根际土壤中细菌的代谢活动,从而有利于其成功入侵(Dassonville et al.,2011;Bardon et al.,2014)。
自2001年外来入侵植物黄顶菊(Flaveria bidentis)在天津南开及河北衡水湖被发现以来,已在我国华北地区大面积蔓延,严重破坏了入侵地的生态环境,在入侵农田后造成农作物减产,导致严重的经济损失(高贤明等,2004;刘全儒,2005;张国良等,2014119-125)。黄顶菊入侵机制已成为现阶段的研究热点之一(任艳萍等,2008)。黄顶菊可分泌化感物质到土壤中,影响周围植物种子萌发及幼苗生长(冯建永等,2009;彭军等,2011),并改变根际微生物群落结构(纪巧凤等,2014;Huangfu et al.,2015;宋振等,2016)。已有研究表明,黄酮类物质是其植株体内主要的次生代谢物质,全株中最大总量可达5.78%,紫云英苷(astragalin)是其中相对含量最高的黄酮类物质,其在不同植株部位中的质量分数为0.79~16.36 mg∙g-1(Agnese et al.,1999;Xie et al.,2010;Wei et al.,2011),在一些研究中,紫云英苷也被认为是一些植物的化感物质,可抑制萝卜种子胚根及胚芽的生长(黄洪武,2008;戴灵超,2011;张凯,2011)。然而,紫云英苷被释放到根际土壤后,其迁移、降解过程和滞留动态以及土壤微生物在紫云英苷降解过程中所发挥的作用尚缺乏系统研究,解析这些信息对了解黄顶菊成功入侵的机理具有重要理论指导意义。
黄顶菊是一种入侵性极高的杂草,其入侵范围有不断扩大的趋势,有学者分别用不同的软件模型模拟了黄顶菊在中国的潜在适生分布区域(白艺珍等,2009;曹向锋等,2010),但由于建模的环境因素多与气候相关,而土壤类型等因素并未包含其中,故研究结果较为片面。本文选取了分别来自黄顶菊入侵区(潮土、碱土)、黄顶菊入侵风险区(紫色土、红壤及风沙土)的不同类型土壤,通过模拟黄顶菊在土壤中释放紫云英苷的行为,研究紫云英苷在不同土壤中的迁移、降解特性,并利用高通量测序技术进一步揭示土壤细菌对紫云英苷降解的影响,以期为黄顶菊在不同类型土壤中的扩散风险差异研究提供理论参考。

表1 各土壤的土壤理化性质Table 1 Physical and chemical characteristics of soil
1 材料与方法
1.1 供试土壤及紫云英苷标准品
所用土壤分别为潮土(采自河北省沧州市,记作CT)、紫色土(采自云南,记作ZST)、红壤(采自湖南,记作HR)、碱土(采自天津,记作JT)、风沙土(采自辽宁,记作FST),以上土壤均未生长过黄顶菊,采样深度均为0~20 cm,剔除土壤中的砂石和动植物残体等非土壤组分,混匀后过40目筛,备用。参照鲍士旦(2000)的方法测定土壤pH(电极法)、有机质含量(重铬酸钾容量法)、铁含量(比色法)、锰含量(KMnO4比色法)、阳离子交换量(CEC)(氯化钡-硫酸法)(张彦雄等,2010),土壤粒径分析利用激光粒度分析仪(HELOS/RODOS)测定,测得土壤基本理化性质如表1所示。紫云英苷标准品购于上海纯优生物科技有限公司(纯度大于98.9%),用甲醇配置1 mg∙mL-1母液置于-20 ℃保存、备用。
1.2 土壤中紫云英苷的提取及检测
称取5 g土壤,用15 mL甲醇-2% EDTA(V/V,1∶1)在25 ℃下超声提取30 min,然后2800 g离心5 min,收集上清液,提取2次。将收集的上清液置于旋转蒸发仪中浓缩去除有机溶剂。采用固相萃取方法(solid phase extraction)(Hennion,1999)分离紫云英苷。预先平衡固相萃取SPE柱(购于上海安谱实验科技股份有限公司):依次加入5 mL甲醇、5 mL去离子水,将样品上清液全部通过柱子后,用20 mL甲醇冲洗,收集;然后用旋转蒸发仪浓缩蒸干,用2 mL甲醇定容,用0.22 μm滤膜过滤;HPLC测定紫云英苷含量,每个处理重复3次。通过该方法测得紫云英苷回收率为67.1%~78.4%。
利用超高效液相色谱仪(Waters)测定土壤中紫云英苷含量。色谱条件如下,(1)色谱柱:CAPCELL PAK MG C18色谱柱(250 mm×4.6 mm I.D.,5 μm);(2)流动相:A:乙腈,B:1‰乙酸水溶液;(3)梯度洗脱条件:0~10 min,A:10%,B:90%;10~15 min,A:15%,B:85%;15~18 min,A:25%,B:75%;18~22 min,A:35%,B:65%;22~23 min,A:45%,B:55%;23~25 min,A:10%,B:90%;(4)柱温:35 ℃;(5)检测波长:360 nm;(6)流速:1.0 mL∙min-1。
配制不同质量浓度的紫云英苷甲醇溶液,得紫云英苷标准曲线为Y=0.1951X+0.0001,在0.025~50 mg∙L-1具有良好的线性关系,其相关系数R=0.9999,RSD=0.7344%。
1.3 紫云英苷在土壤中的迁移
采用土壤薄层层析法(soil TLC)(Ravanel et al.,1999)研究紫云英苷在土壤中的迁移。取20 g供试土壤用蒸馏水调成流动的泥浆,倒在玻璃板(10 cm×10 cm)上,用玻璃棒涂布成厚度约1 mm的均匀平板,室温自然晾干后备用。以玻璃板板基部1.0 cm处为基线,将紫云英苷溶液用微型注射器在基线处点样,点样量分别为1 μg∙g-1(低水平,L)和10 μg∙g-1(高水平,H)。玻璃板水平放置于装有水的密闭容器中,用滤纸条引展开剂到达玻璃板的基部,使之保持相对均匀的流动。待展开剂迁移到9.5 cm(R0)后停止层析。进行不等距取样,取样时用小刀将每个取样距离段的土壤全部刮下,然后按照1.2的方法提取、土壤中的紫云英苷并测定其含量,确定紫云英苷迁移距离。利用紫云英苷在薄层板上的迁移距离(R1)和溶剂水迁移位置(R0)的比值计算出比移值:

Rf的大小直接反映紫云英苷在土壤中的迁移性,每个处理重复3次。
1.4 紫云英苷在土壤中的降解
准确称取5 g供试土壤于试管中,加入一定量的紫云英苷甲醇标液,使土壤中的紫云英苷质量分数达到10 μg∙g-1,为避免甲醇对土壤微生物活性产生影响,将试管置于通风橱中进行,并搅拌至甲醇完全蒸发。加入去离子水,使样品含水量达到饱和持水量60%,保持试管内气体和外界流通以保持微生物活性。将试管置于25 ℃恒温箱中进行避光培养,及时补充水分,使其含水量保持稳定。分别于0、6、12、24、72、120、168 h取样,测定土壤中的紫云英苷含量,每个处理3个重复。
利用一级动力学公式(Martins et al.,1998)描述紫云英苷降解规律:

其中,Ct为t时土壤中滞留的紫云英苷质量分数,μg∙g-1;C0为紫云英苷加入土壤中的起始质量分数,μg∙g-1;t为培养时间,h;k为降解速率常数,h-1;t1/2为紫云英苷的降解半衰期,h。
1.5 土壤酶活性及土壤细菌测定
以潮土(CT)为例,观察土壤酶及土壤细菌对紫云英苷在土壤中滞留所产生的影响,具体方法为:
(1)土壤酶活性测定:分别称取灭菌潮土(120 ℃湿热灭菌50 min,灭菌3次)与未灭菌潮土5 g于玻璃试管中,加入一定量紫云英苷标准溶液,使紫云英苷质量分数达到10 μg∙g-1,其余操作同1.4,分别于0、6、12、24、72、120、168 h进行取样,用1.2的方法提取灭菌土壤中紫云英苷并测定其含量(未灭菌土壤中紫云英苷含量已在1.4中检测),每个处理3个重复。并利用土壤酶试剂盒(购于北京索莱宝科技有限公司)测定土壤中多酚氧化酶(s-PPO)、土壤脱氢酶(s-DHA)以及β-葡萄糖苷酶(s-β-GC)活性,土壤酶活性参照试剂盒说明书进行测定。
(2)土壤高通量测定:称取50 g潮土于小烧杯中,加入一定量紫云英苷甲醇溶液,使土壤中的紫云英苷质量分数达到10 μg∙g-1(记作T),同时设添加等量的甲醇为对照(CK),操作过程同1.4。分别于24、72、120、168 h进行取样,分别记作T1、T3、T5、T7及CK1、CK3、CK5、CK7,空白潮土记作CK0,每个处理3个重复。
利用PowerSoil® DNA Isolation Kit(MoBio, Carlsbad,CA,USA)提取各土壤样品中的总DNA。以纯化后的DNA为模板,以细菌16S rDNA V3-V4区通用引物(V3F:5’-TACGGRAGGCAGCAG-3’,V4R:5’-AGGGTATCTAATCCT-3’),PCR扩增16S rDNA V3-V4区片段。PCR反应体系为30 μL,DNA模版10 μL,Phusion® High-Fidelity PCR Master Mix with GC Buffer(New England Biolabs,USA)15 μL,上、下游引物(0.2 μM)各0.5 μL,补充ddH2O至30 μL。PCR扩增程序为:98 ℃预变性1 min,98 ℃变性10 s,50 ℃退火30 s,72 ℃延伸60 s,30个循环,最后于72 ℃延伸5 min。使用TruSeq® DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和QPCR定量,文库合格后,使用Illumina MiSeq测序平台(由北京诺禾致源生物信息科技有限公司提供)进行上机测序。
1.6 数据处理
采用Uparse软件(v7.0.1001)(Li et al.,2013)对所有样品的全部Effective Tags进行聚类,默认以97%的一致性(Identity)将序列聚类成为OTUs(Operational Taxonomic Units),根据所有样品的物种注释结果和OTUs丰度信息,将相同分类的OTUs信息合并处理得到物种丰度信息表(Profiling Table);同时采用MUSCLE软件构建OTUs之间的系统发生关系,采用Qiime软件(Version 1.7.0)计算Unifrac距离(Unweighted Unifrac)、构建样品聚类树(Caporaso et al.,2010)。采用SPSS 19.0进行多重方差分析(ANOVA)及相关分析。

表2 紫云英苷在不同土壤中的Rf值Table 2 The Rf value of astragalin in the soil

表3 紫云英苷在不同土壤中的Rf值与半衰期(t1/2)与土壤理化性质相关分析Table 3 The correlation between Rf value, t1/2and soil physical and chemical properties

表4 紫云英苷在土壤中的降解动态方程及其特征值Table 4 The kinetics equation and characteristic value of astragalin
2 结果与分析
2.1 紫云英苷在不同土壤中的迁移
两种浓度紫云英苷在不同土壤中的迁移值存在较大差异,且紫云英苷浓度越高,在不同土壤中的迁移距离越远,与之相对应的Rf越高,迁移性越好。两种浓度紫云英苷在不同土壤中均呈现不同的迁移规律,但均以紫色土迁移最远,红壤迁移最近。(表2),其中,低浓度紫云英苷在土壤中的迁移值Rf为0.14~0.25,迁移性高低顺序为:紫色土>风沙土>碱土>潮土>红壤;高浓度紫云英苷在土壤中的迁移值为0.36~0.51,迁移性高低顺序为:紫色土>碱土>潮土>风沙土>红壤。由此可知,紫云英苷在各种土壤中都呈现弱至中等移动特性(Helling et al.,1968)。
相关分析结果表明(表3),紫云英苷在土壤中的迁移性与土壤有机质、土壤pH及土壤砂粒含量呈正相关,而与土壤粘粒含量、粉粒含量、土壤中金属离子含量(Fe、Mn)呈负相关。其中,低浓度紫云英苷迁移性与土壤粘粒组成相关性达到显著水平,同样高浓度紫云英苷在土壤中的迁移性与土壤中Fe离子含量相关性也达到显著水平;低浓度紫云英苷迁移性与阳离子交换量呈负相关,而高浓度紫云英苷迁移性与阳离子交换量呈正相关,由此说明紫云英苷在土壤中的迁移较复杂。
2.2 紫云英苷在不同土壤中的降解动态
紫云英苷加入土壤后,在土壤胶体和土壤微生物的作用下发生生物或非生物降解反应,故其在土壤中的滞留量逐渐减少,利用一级动力学方程可较好地模拟其降解动态,决定系数均在0.95以上(表4)。此外,经过公式(3)计算的紫云英苷在不同土壤中的降解时间及速率均有所不同,其在风沙土中的半衰期最短,仅有2.68 h,而在紫色土中的半衰期最长,为28.55 h,降解半衰期长短顺序为风沙土<碱土<潮土<红壤<紫色土。就降解速率而言,紫云英苷在紫色土中的降解速率常数最小,为0.0243,而在风沙土中的降解速率常数最大,为0.2591,紫云英苷在土壤中的降解速率常数大小顺序为紫色土<红壤<潮土<碱土<风沙土,说明紫云英苷在紫色土中的降解相对较难,而在风沙土中降解较易。通过相关分析发现(表3),紫云英苷在土壤中的降解半衰期与土壤有机质、土壤粘粒含量、土壤砂粒含量及土壤阳离子交换量、土壤中金属离子含量(Fe、Mn)呈正相关,而与土壤pH及土壤粉粒含量呈负相关,但仅与土壤有机质相关性达到显著水平。紫云英苷在经过灭菌后的潮土中降解缓慢,半衰期达111.8 h,降解速率常数仅为0.0062,可见经过灭菌后,大部分土壤酶及微生物失去活性,紫云英苷的降解受到较大的影响。
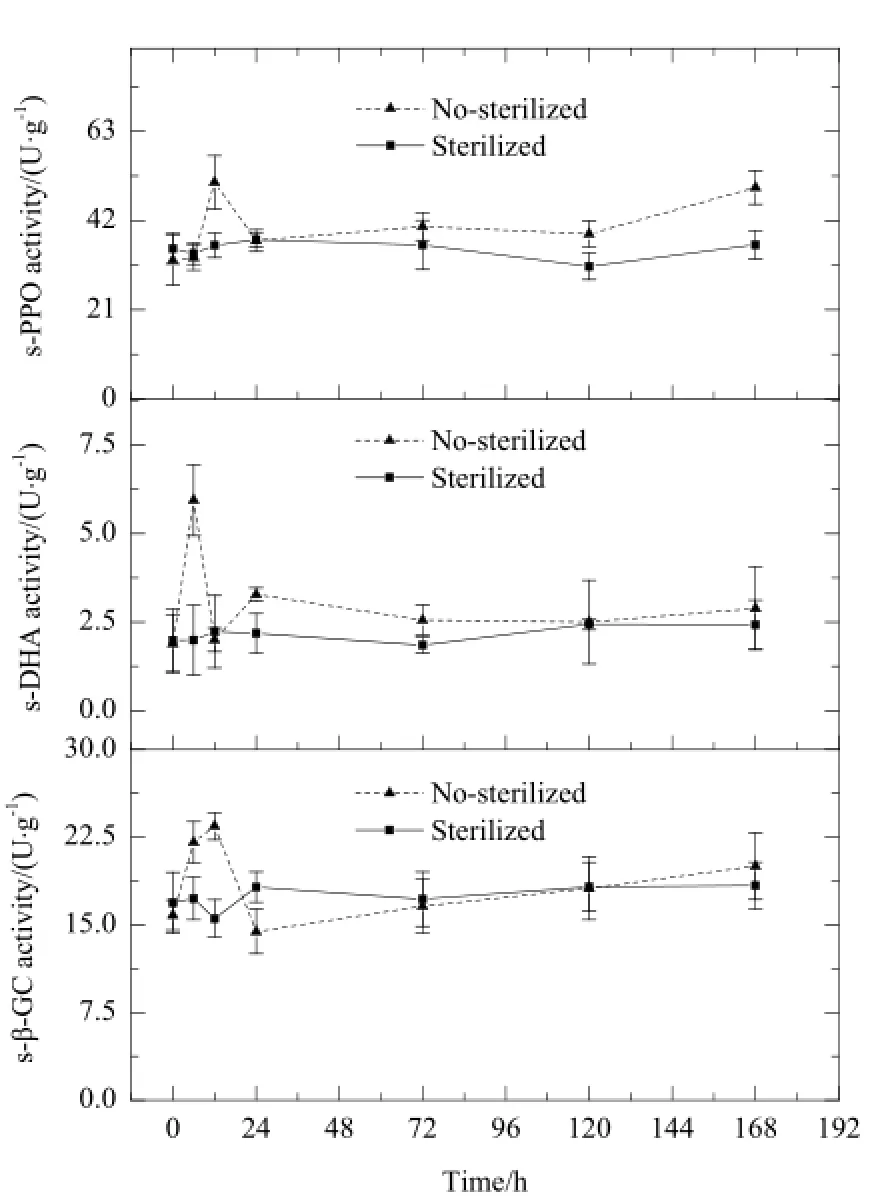
图1 土壤脱氢酶(s-DHA)、多酚氧化酶(s-PPO)以及β-葡萄糖苷酶(s-β-GC)的变化动态Fig.1 Dynamic Changes of the activities of soil dehydrogenase (s-DHA), soil polyphenol oxidase (s-PPO) and β-glycosidase (s-β-GC)
2.3 土壤酶在紫云英苷降解过程中的变化趋势
试验结果显示,紫云英苷加入土壤后,3种土壤酶活性在未灭菌土壤中呈现不同程度的变化,而在灭菌土壤中变化趋势不明显(图1)。土壤脱氢酶(s-DHA)活性在6 h达到高峰,然后趋于平缓,而多酚氧化酶(s-PPO)及β-葡萄糖苷酶(s-β-GC)活性均在12 h达到高峰,然后慢慢升高。可见3种土壤酶活性在紫云英苷快速降解时期及快速降解后期,受到紫云英苷及其降解产物的刺激,呈现不同程度的升高,3种酶在紫云英苷降解过程中可能起一定的作用,但仍需进一步验证。
2.4 土壤细菌群落在紫云英苷降解过程中的变化趋势
对9个土壤样本进行高通量测序,经过拼接和过滤处理后,获得16S rDNA标签序列,共获得561162条序列(reads),各样本序列测序量在49968~65607条之间,覆盖率均高于97.9%,能够较大程度地反映该区域群落的种类和结构。并根据97%的序列相似性划分不同的OTUs(Operational taxonomic units),通过测序共获得19862个OUT,各样本测序获得的细菌OTU序列读数如表5所示。

表5 各土壤样品序列数据统计Table 5 Data statistics of each soil sample sequences

图2 在门级分类水平下各样品土壤细菌群落的相对丰度及聚类情况Fig.2 Relative abundance and clustering analysis of soil bacterial community at Phylum level
从门级分类水平下各处理细菌群落的聚类树可以看出,各样品基本上按照取样时间聚类到一起,且放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)在各处理中为主要优势类群(图2),这3门微生物在各样品中占比均超过了78%。然而,细菌群落结构在对照与紫云英苷处理间存在明显差异。放线菌门的相对丰度在各处理中均呈现下降趋势,紫云英苷处理中放线菌门群落丰度较0 d(45.9%)先升高(66.3%)后逐渐降低(P<0.05),可见紫云英苷加入到土壤中后,刺激了放线菌门群落丰度上升后,又使其降低。紫云英苷处理中变形菌门丰度呈先升高后降低趋势,在第5天和第7天相对丰度分别达到49.6%和31.6%,而同期对照仅为18.0%和17.6%,差异显著(P<0.05)。厚壁菌门群落相对丰度在对照中呈逐渐升高趋势,而紫云英苷处理后,除第7天处理外,厚壁菌门群落相对丰度均低于同期对照,可见,紫云英苷的添加抑制了厚壁菌门中一些细菌的生长。

图3 在属水平下各样品土壤细菌群落组成Fig.3 Composition of the bacterial community at genus level
根据所有样品在属分类水平的物种注释及丰度信息,选取丰度排名前35的属,根据其在每个样品中的丰度信息,分别从物种和样品两个层面进行聚类,并绘制成热图,不同颜色代表细菌的相对丰度(图3)。从图中可以看出,1~3 d样品被聚集在左半区,5~7 d样品被聚集在右半区,说明1~3 d样品群落结构更为相似,而5~7 d样品与1~3 d样品群落结构差异较大。在土壤中加入紫云英苷1 d后(T1),放线菌门的脂肪杆菌属(Pimelobacter)、类诺卡氏菌属(Nocardioides)以及Aeromicrobium属高于同期对照(CK1),有可能是由于此类菌可以紫云英苷及其产物作为碳源,故其丰度提高;而该门小月菌属(Microlunatus.sp)、红球菌属(Rhodococcus)菌群丰度低于同期对照组(CK1),即紫云英苷的加入抑制了该类菌的生长,此外,变形菌门的拜纳蒙纳斯属(Balneimonas)、Skermanella属菌群同样受到了紫云英苷的抑制作用。而中后期(T5),拟杆菌门(Bacteroidetes)的Pedobacter属,变形菌门的Ramlibacter属、拜纳蒙纳斯属、Kaistobacter属、鞘氨醇单胞菌属(Sohingomonas)、溶杆菌属(Lysobacter)、热单胞菌属(Thermomonas)、枝动菌属(Mycoplana)以及新鞘氨醇杆菌属(Novosphingobium)丰度均高于同期对照(CK5),而厚壁菌门的Solibacillus属生长受到了紫云英苷的抑制,丰度低于同期对照。在降解后期(T7),类芽孢杆菌属(Paenibacillus)、红球菌属(Rhodococcus)、支原体属(Mycoplasma)3种菌丰度高于同期对照(CK7),分别属于厚壁菌门、放线菌门、柔膜菌门(Tenericutes),而放线菌门的壤霉菌属(Agromyces)、地嗜皮菌属(Geodermatophilus)、Iamia属低于对照,而其他菌群恢复到对照水平。
3 结论与讨论
3.1 讨论
黄顶菊能够在我国成功定殖并扩散的主要机制之一是具有强烈的化感作用(冯建永等,2009;任艳萍等,2009;皇甫超河等,2010;李建恒等,2014)。国内外研究学者发现,紫云英苷是黄顶菊植株体内重要的化感物质(Varin et al.,1988;Wei et al.,2011;Shaheen et al.,2015),其一旦被释放到土壤中,需迁移至邻近的目标区域才能发挥其生物效应(孔垂华,2010),这种迁移受土壤质地、粒径大小、有机质含量、pH等因素影响。一般而言,粘土土质紧实,土壤水分迁移性差,次生代谢物质的迁移能力差(王延平等,2010;Li et al.,2013),本研究也发现了类似的规律:紫云英苷在土壤中的迁移值Rf与土壤粘粒及粉粒含量呈负相关,与土壤pH及有机质均呈正相关,但相关性较差,这可能与紫云英苷自身化学结构及土壤等因素有关(王延平等,2010)。紫云英苷化学结构中含有较多的羟基(-OH)(张国良,2014)301,容易与土壤中金属离子螯合(Yuting et al.,1990;曾庆平等,1996),因此紫云英苷在土壤中的迁移性与金属离子含量呈负相关,这也是本文在提取土壤中紫云英苷利用螯合剂EDTA的原因之一(程艳等,2009;李瑞等,2014)。
黄酮类物质是黄顶菊植株重要的次生代谢物质(Xie et al.,2010),其在土壤中的降解与其本身结构、土壤理化性质等因素有关,一般来说,黄酮类物质在非灭菌土中比在灭菌土壤中的降解速度要快得多,例如,葱芥(Alliaria petiolata)分泌的黄酮类物质在非灭菌土壤中的半衰期(3~12 h)短于在灭菌土中的半衰期(12~46 h)(Barto et al.,2009)。本研究中紫云英苷在不同的未灭菌土壤中的的半衰期为2.68~18.55 h,在灭菌潮土中的半衰期达111.8 h,可见紫云英苷在灭菌土壤中更易存留,这可能是未灭菌土壤中的土壤酶及土壤微生物在紫云英苷降解过程中起重要作用,而灭菌土壤中紫云英苷仅靠自然降解,因此紫云英苷在灭菌土壤中的半衰期远远高于未灭菌土壤中的半衰期。
紫云英苷在植物体内通过苯丙氨酸途径生物合成,是由两个苯环与中间3个碳原子相连接而形成的,其基本骨架具有C6-C3-C6的特点(Das,1994),且其骨架C-3位被糖苷化(张国良,2014)301。本文选取了在土壤生态系统的物质循环和能量转化中起重要作用的3种酶,分别为能催化有机物质脱氢,起着中间转化传递作用的土壤脱氢酶(Casida et al.,1964);可降解土壤中的酚类物质,完成土壤芳香族化合物循环的土壤多酚氧化酶(Trasar-Cepeda et al.,2000);能够催化、水解芳基或烃基与糖基原子团之间的糖苷键而生成葡萄糖的土壤β-葡萄糖苷酶(Eivazi et al.,1988)。紫云英苷结构中含有这3种酶的作用位点,可用来初步验证土壤酶是否对紫云英苷及其降解产物起降解催化作用。实验开始阶段3种酶的活力均在短时间内(6~12 h)出现了大幅增长,可以推断这3种酶可能在降解紫云英苷及其降解产物中起到了重要作用。
土壤微生物是影响黄酮类物质在土壤中的归趋的一个决定性因素(Sugiyama et al.,2014)。Kong et al.(2008)针对稻田土壤中存在的两种化感物质(黄酮和苯甲酸)在土壤中的降解研究得知降解过程中真菌数量下降而细菌数量的增加。本研究通过对16S rDNA的高变异区V3~V4区的测序分析发现,紫云英苷的加入改变了土壤细菌群落结构,类诺卡氏菌属、鞘氨醇单胞菌属、新鞘氨醇杆菌属等均表现出较高的丰度。有研究发现,上述3种菌在降解芳香族化合物方面起重要作用(Zylstra et al.,1997;Saito et al.,1999;Baraniecki et al.,2002;Yuan et al.,2008),其他菌群(如脂肪杆菌属、Aeromicrobium属、Pedobacter属、溶杆菌属、热单胞菌属、枝动菌属、类芽孢杆菌属、红球菌属、支原体属等)的丰度也均高于同期对照,这些结果说明了这几种菌群可能利用紫云英苷及其产物作为碳源,进而起到降解紫云英苷及其降解产物的作用。而Skermanella属、小月菌属、红球菌属等在紫云英苷加入后丰度显著降低,可能是受到紫云英苷及其产物的抑制。这种富集或抑制的效果,随着培养时间的延长及紫云英苷的逐步降解而逐步降低,故后期细菌群落逐步恢复到对照水平。
紫云英苷在土壤中的降解与土壤酶及部分土壤细菌大量增殖有密切关系,这也进而影响着紫云英苷在土壤中的迁移(王延平等,2010)。目前关于紫云英苷降解产物的文献报道较少,因此本文暂以紫云英苷在土壤中的时空位移作为研究目标。本研究特定类群细菌的富集或消散现象可能是紫云英苷及其降解产物共同作用的结果,这种变化对黄顶菊入侵的影响还有待进一步研究。另外,紫云英苷在土壤中的降解产物是什么?含量是多少?这些都是今后研究的重点。
3.2 结论
紫云英苷添加到土壤中后,在未灭菌土壤中降解较快,半衰期为2.68~18.55 h,并引起土壤脱氢酶、多酚氧化酶和β-葡萄糖苷酶活性升高。高通量分析结果显示紫云英苷改变了土壤细菌群落结构,诺卡氏菌属、鞘氨醇单胞菌属、新鞘氨醇杆菌属、脂肪杆菌属、Aeromicrobium属、Pedobacter属、溶杆菌属、热单胞菌属、枝动菌属、类芽孢杆菌属、红球菌属、支原体属等细菌丰度升高,因此其降解与土壤酶及部分土壤细菌大量增殖有密切关系,这也影响着紫云英苷在土壤中的迁移,另外土壤粒径组成及土壤金属离子等因素也是影响其迁移特性的重要因素。
AGATI G, AZZARELLO E, POLLASTRI S, et al.2012.Flavonoids as antioxidants in plants: location and functional significance [J].Plant Science, 196: 67-76.
AGNESE A M, MONTOYA S N, ESPINAR L A, et al.1999.Chemotaxonomic features in Argentinian species of Flaveria (Compositae) [J].Biochemical systematics and Ecology, 27(7): 739-742.
BAIS H P, WEIR T L, PERRY L G, et al.2006.The role of root exudates in rhizosphere interactions with plants and other organisms [J].Annual Review of Plant Biology, 57: 233-266.
BARANIECKI C A, AISLABIE J, FOGHT J M.2002.Characterization of Sphingomonas sp.Ant 17, an aromatic hydrocarbon-degrading bacterium isolated from Antarctic soil [J].Microbial Ecology, 43(1): 44-54.
BARDON C, PIOLA F, BELLVERT F, et al.2014.Evidence for biological denitrification inhibition (BDI) by plant secondary metabolites[J].New Phytologist, 204: 620–630.
BARTO E K, CIPOLLINI D.2009.Half-lives and field soil concentrations of Alliaria petiolata secondary metabolites [J].Chemosphere, 76(1): 71-75.
BRUNNER W, FOCHT D D.1984.Deterministic three-half-order kinetic model for microbial degradation of added carbon substrates in soil [J].Applied and Environmental microbiology, 47(1): 167-172.
BUER C S, MUDAY G K, DJORDJEVIC M A.2007.Flavonoids are differentially taken up and transported long distances in Arabidopsis [J].Plant Physiology, 145(2): 478-490.
CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al.2010, QIIMEallows analysis of high-throughput community sequencing data [J].Nature Methods, 7(5): 335-336.
CASIDA JR L E, KLEIN D A, SANTORO T.1964.Soil dehydrogenase activity [J].Soil Science, 98(6): 371-376.
CESCO S, MIMMO T, TONON G, et al.2012.Plant-borne flavonoids released into the rhizosphere: impact on soil bio-activities related to plant nutrition.A review [J].Biology and Fertility of Soils, 48(2): 123-149.
DAS D K.1994.Naturally occurring flavonoids: Structure, chemistry, and high-performance liquid chromatography methods for separation and characterization [J].Methods in Enzymology, 234: 410-420.
DASSONVILLE N, GUILLAUMAUD N, PIOLA F, et al.2011.Niche construction by the invasive Asian knotweeds (species complex Fallopia): impact on activity, abundance and community structure of denitrifiers and nitrifiers [J].Biological Invasions, 13(5): 1115-1133.
EICHHOLZ I, ROHN S, GAMM A, et al.2012.UV-B-mediated flavonoid synthesis in white asparagus (Asparagus officinalis L.) [J].Food Research International, 48(1): 196-201.
EIVAZI F, TABATABAI M A.1988.Glucosidases and galactosidases in soils [J].Soil Biology and Biochemistry, 20(5): 601-606.
GAHUKAR R T.2012.Evaluation of plant-derived products against pests and diseases of medicinal plants: a review [J].Crop Protection, 42: 202-209.
GURJAR M S, ALI S, AKHTAR M, et al.2012.Efficacy of plant extracts in plant disease management [J].Agricultural Sciences, 3(3): 425.
HASSAN S, MATHESIUS U.2012.The role of flavonoids in root-rhizosphere signaling: opportunities and challenges for improving plant–microbe interactions [J].Journal of Experimental Botany, 63(9): 3429-3444.
HELLING C S, TURNER B C.1968.Pesticide mobility: determination by soil thin-layer chromatography [J].Science, 162(3853): 562-563.
HENNION M C.1999.Solid-phase extraction: method development, sorbents, and coupling with liquid chromatography [J].Journal of Chromatography A, 856(1): 3-54.
HIDEG É, JANSEN M A K, STRID Å.2013.UV-B exposure, ROS, and stress: inseparable companions or loosely linked associates? [J].Trends in Plant Science, 18(2): 107-115.
HUANG L F, SONG L X, XIA X J, et al.2013.Plant-soil feedbacks and soil sickness: from mechanisms to application in agriculture [J].Journal of Chemical Ecology, 39(2): 232-242.
HUANGFU C H, LI H Y, CHEN X W, et al.2015.The effects of exotic weed Flaveria bidentis with different invasion stages on soil bacterial community structures [J].African Journal of Biotechnology, 14(35): 2636-2643.
JONES W P, KINGHORN A D.2012, Extraction of plant secondary metabolites [J].Methods in Molecular Biology, 864(33): 341-66.
KONG C H, WANG P, GU Y, et al.2008.Fate and impact on microorganisms of rice allelochemicals in paddy soil [J].Journal of Agricultural and Food Chemistry, 56(13): 5043-5049.
LI B, ZHANG X, GUO F, et al.2013.Characterization of tetracycline resistant bacterial community in saline activated sludge using batch stress incubation with high-throughput sequencing analysis [J].Water Research, 47(13): 4207-4216.
LI X J, XIA Z C, KONG C H, et al.2013.Mobility and microbial activity of allelochemicals in soil [J].Journal of Agricultural & Food Chemistry, 61(21): 5072-5079.
MARTINS J M, MERMOUD A.1998.Sorption and degradation of four nitroaromatic herbicides in mono and multi-solute saturated/unsaturated soil batch systems [J].Journal of Contaminant Hydrology, 33(1): 187-210.
PEER W A, BANDYOPADHYAY A, BLAKESLEE J J, et al.2004.Variation in expression and protein localization of the PIN family of auxin efflux facilitator proteins in flavonoid mutants with altered auxin transport in Arabidopsis thaliana [J].The Plant Cell, 16(7): 1898-1911.
POLLOCK J L, HOLBEN W E.2009.Catechin–metal interactions as a mechanism for conditional allelopathy by the invasive plant Centaurea maculosa [J].Journal of Ecology, 97(6):1234-1242.
RAVANEL P, LIEGEOIS M H, CHEVALLIER D, et al.1999.Soil thin-layer chromatography and pesticide mobility through soil microstructures new technical approach [J].Journal of Chromatography A, 864(1): 145-154.
SAITO A, IWABUCHI T, HARAYAMA S.1999.Characterization of genes for enzymes involved in the phenanthrene degradation in Nocardioides sp.KP7 [J].Chemosphere, 38(6): 1331-1337.
SALLES J F, MALLON C A.2014.Invasive plant species set up their own niche [J].New Phytologist, 204(3): 435-437.
SAMANTA A, DAS G, DAS S K.2011.Roles of flavonoids in plants [J].International Journal of Pharmaceutical Science and Technology, 6(1): 12-35.
SCHULZ M, MAROCCO A, TABAGLIO V, et al.2013.Benzoxazinoids in rye allelopathy-from discovery to application in sustainable weed control and organic farming [J].Journal of Chemical Ecology, 39(2): 154-174.
SHAHEEN N, YIN L, GU Y, et al.2015.Separation of isorhamnetin 3-sulphate and astragalin from Flaveria bidentis (L.) Kuntze using macroporous resin and followed by high-speed countercurrent chromatography [J].Journal of Separation Science, 38(11):1933-1941.SUGIYAMA A, YAZAKI K.2014.Flavonoids in plant rhizospheres: secretion, fate and their effects on biological communication [J].Plant Biotechnology, 31(5): 431-443.
TRASAR-CEPEDA C, LEIROS M C, SEOANE S, et al.2000.Limitations of soil enzymes as indicators of soil pollution [J].Soil Biology and Biochemistry, 32(13): 1867-1875.
VARIN L, BARRON D, IBRAHIM R.1998.Identification and Biosynthesis of Glucosylated and Sulfated Flavonols in Flaveria bidentis [J].Zeitschrift für Naturforschung C, 41(9-10):813-819.
WANG Y, SIEMANN E, WHEELER G S, et al.2012.Genetic variation in anti-herbivore chemical defences in an invasive plant [J].Journal of Ecology, 100(4): 894-904.
WEI Y, XIE Q, FISHER D, et al.2011.Separation of patuletin-3-O-glucoside, astragalin, quercetin, kaempferol and isorhamnetin from Flaveria bidentis (L.) Kuntze by elution-pump-out high-performance counter-current chromatography [J].Journal of Chromatography A, 1218(36): 6206-6211.
WENG C J, YEN G C.2012.Flavonoids, a ubiquitous dietary phenolic subclass, exert extensive in vitro anti-invasive and in vivo anti-metastatic activities [J].Cancer and Metastasis Reviews, 31(1-2): 323-351.
XIE Q, WEI Y, ZHANG G.2010.Separation of flavonol glycosides from Flaveria bidentis (L.) Kuntze by high-speed counter-current chromatography [J].Separation and Purification Technology, 72(2): 229-233.
YUAN J, LAI Q, ZHENG T, et al.2008.Polycyclic aromatic hydrocarbon-degrading bacterium Novosphingobium sp.H25 isolated from deep sea and its degrading genes [J].Acta Microbiologica Sinica, 48(9): 1208-1213.
YUTING C, RONGLIANG Z, ZHONGJIAN J, et al.1990.Flavonoids as superoxide scavengers and antioxidants [J].Free Radical Biology and Medicine, 9(1): 19-21.
ZYLSTRA G J, KIM E.1997.Aromatic hydrocarbon degradation bySphingomonas yanoikuyae B1 [J].Journal of Industrial Microbiology and Biotechnology, 19(5-6): 408-414.
白艺珍, 曹向锋, 陈晨, 等.2009.黄顶菊在中国的潜在适生区[J].应用生态学报, 20(10): 2377-2383.
鲍士旦.2000.土壤农化分析[M].北京: 中国农业出版社.
曹向锋, 钱国良, 胡白石, 等.2010.采用生态位模型预测黄顶菊在中国的潜在适生区[J].应用生态学报, 21(12): 3063-3069.
曾庆平, 郭勇.1996.类黄酮—金属离子螯合模拟SOD的研究[J].药物生物技术, 3(4): 210-213.
程艳, 高静, 徐红纳, 等.2009.螯合剂 EDTA 简介[J].化学教育, 30(5): 4-6.
戴灵超.2011.黄檗落叶化感物质的初步研究[D].北京: 北京协和医学院.冯建永, 陶晡, 庞民好, 等.2009.黄顶菊化感物质释放途径的初步研究[J].河北农业大学学报, 32(1): 72-77.
高贤明, 唐廷贵, 梁宇, 等.2004.外来植物黄顶菊的入侵警报及防控对策[J].生物多样性, 12(2): 274-279.
何永美, 湛方栋, 祖艳群, 等.2013.大田条件下UV-B辐射对元阳梯田2个地方水稻品种硅、类黄酮和总酚含量的影响[J].农业环境科学学报, 32(8): 1500-1506.
皇甫超河, 陈冬青, 王楠楠, 等.2010.外来入侵植物黄顶菊与四种牧草间化感互作[J].草业学报, 19(4): 22-32.
黄洪武.2008.外来生物加拿大一枝黄花的化感作用及其化学防除研究[D].南京: 南京农业大学.
纪巧凤, 宋振, 张国良, 等.2014. 黄顶菊入侵对土壤磷细菌多样性的影响[J].农业资源与环境学报, 31(2): 175-181.
孔垂华, 娄永根.2010.化学生态学前沿[M].北京: 高等教育出版社.
李建恒, 侯力峰, 贺学礼.2014.入侵植物黄顶菊的化学成分及生物活性[J].河北大学学报: 自然科学版, 34(1): 107-112.
李瑞, 刘晓娜, 赵中秋.2014.螯合剂和AM菌根对玉米吸收重金属及重金属化学形态的影响[J].生态环境学报, 23(2): 332-338.
刘全儒.2005.中国菊科植物一新归化属--黄菊属[J].植物分类学报, 43(2): 178-180.
彭军, 马艳, 李香菊, 等.2011.黄顶菊化感作用研究进展[J].杂草科学, 29(1): 17-22.
任艳萍, 江莎, 古松, 等.2008.外来植物黄顶菊(Flaveria bidentis)的研究进展[J].热带亚热带植物学报, 16(4): 390-396.
任艳萍, 江莎, 古松, 等.2009.外来植物黄顶菊根、茎、叶的化感作用初探[J].植物保护, 35(3): 36-40.
宋振, 纪巧凤, 付卫东, 等.2016.黄顶菊入侵对土壤中主要功能细菌的影响[J].应用生态学报, 27(8): 2636-2644.
王延平, 王华田, 杨阳, 等.2010.外源酚酸在杨树人工林土壤中的吸附与滞留动态研究[J].水土保持学报, 24(2): 251-256.
王延平, 王华田.2010.植物根分泌的化感物质及其在土壤中的环境行为[J].土壤通报, 41(2): 501-507.
张国良, 付卫东, 郑浩.2014.黄顶菊入侵机制及综合治理 [M].北京:科学出版社.
张凯.2011.黄顶菊中噻吩类和酚酸类物质的研究[D].北京: 北京化工大学.
张彦雄, 李丹, 张佐玉, 等.2010.两种土壤阳离子交换量测定方法的比较[J].贵州林业科技, 38(2): 45-49.
周小理, 方向, 周一鸣, 等.2012.磁场对苦荞种子萌发过程中黄酮类物质的诱导效应[J].食品科学, 33(21): 20-23.
Migration and Degradation of Astragalin in the Suitable Soil for Flaveria bidentis
ZHANG Ruihai, SONG Zhen, FU Weidong, ZHANG Ting, HUANG Chengcheng,
ZHU Changxiong, ZHANG Guoliang*
Institute of Agricultural Environment and Sustainable Development, CAAS, Beijing 100081, China
The secondary metabolites of plant flavonoids have become one research hotspot on the invasion mechanism of alien plant in recent years.An exotic weed native to South America, Flaveria bidentis, is spreading in northern China where it forms dense monospecific patches threatening native aboveground biodiversity and agricultural production from 2001.F.bidentis contains high amounts of astragalin, one flavonoid metabolite, which can inhibit seed germination and affect growth of neighboring plants, the movement and degradation of astragalin in the soil remain unclear after being released into the soil.The regular of the movement and degradation of astragalin in five soils was study.The mechanism of degradation astragalin was evaluated with soil enzyme activity and the high-throughput sequencing method.Results showed that the Rf of astragalin was 0.14~0.51 with weak to moderate- mobility in five soils; The degradation of astragalin fitted well with a first-order kinetic equation, with astragalin concentrations decreasing rapidly and then maintaining relatively constant thereafter.The half-lives of astragalin in the non-sterilized soils were 2.68~18.55 h, and 111.8 h in the sterilized fluvo-aquic soil.The activities of soil dehydrogenase, polyphenol oxidase and β-glycosidase were all increased after adding astragalin.The high-throughput sequencing results showed that the diversity of soil microbial communities was changed and the relative abundances of Nocardioides, Sohingomonas, Novosphingobium, Pimelobacter, Aeromicrobium, Pedobacter, Lysobacter, Thermomonas, Mycoplana, Paenibacillus, Rhodococcus and Mycoplasma was increased, these bacteria may be involved in the degradation of astragalin in soils.
Flaveria bidentis; astragalin; secondary metabolite; soil movement; biodegradation; high-throughput sequencing
10.16258/j.cnki.1674-5906.2016.10.008
Q14
A
1674-5906(2016)10-1644-09
张瑞海, 宋振, 付卫东, 张婷, 黄成成, 朱昌雄, 张国良.2016.紫云英苷在黄顶菊适生土壤中的迁移及降解[J].生态环境学报, 25(10): 1644-1652.
ZHANG Ruihai, SONG Zhen, FU Weidong, ZHANG Ting, HUANG Chengcheng, ZHU Changxiong, ZHANG Guoliang.2016.Migration and degradation of astragalin in the suitable soil for Flaveria bidentis [J].Ecology and Environmental Sciences, 25(10): 1644-1652.
国家重点研发计划项目(2016YFSF03);国家自然科学基金项目(41501280)
张瑞海(1985年生),男,博士研究生,研究方向为入侵植物防控。E-mail: ruihai.321@163.com *通信作者。E-mail: zhangguoliang@caas.cn
2016-09-11
