原位细菌合成纤维素/壳聚糖纳米纤维凝胶膜
2017-01-10张青松
张 鹏, 张青松, 陈 琳, 洪 枫,2*
(1. 东华大学 化学化工与生物工程学院 微生物工程与工业生物技术研究组,上海 201620;2. 东华大学 纤维材料改性国家重点实验室,上海 201620)
原位细菌合成纤维素/壳聚糖纳米纤维凝胶膜
张 鹏1, 张青松1, 陈 琳1, 洪 枫1,2*
(1. 东华大学 化学化工与生物工程学院 微生物工程与工业生物技术研究组,上海 201620;2. 东华大学 纤维材料改性国家重点实验室,上海 201620)
为了改善天然纳米细菌纤维素(BNC)的生物医用特性,同时保留BNC与生俱来的纳米纤维网络结构,研究采用了原位静置培养细菌合成法,在培养基添加溶解壳聚糖(CS),拟在BNC纳米纤维合成时复合CS,从而获得CS/BNC纳米纤维复合凝胶膜。研究了对影响培养基中CS的溶解以及影响木葡糖酸醋杆菌原位合成的主要因素(包括CS浓度、溶解CS的酸种类、pH值以及含CS培养基的灭菌工艺等)。结果表明,共灭菌的乙酸CS培养基的原位合成能够较好地实现CS/BNC的原位复合构想,并且该培养基所获得的CS/BNC复合凝胶中,CS成功掺杂入纳米纤维的内部,并能在碱煮纯化条件下仍能稳定存在,CS含量可达干重的35%~48%。
纳米细菌纤维素;壳聚糖;原位复合;静置培养
纳米细菌纤维素(bacterial nano-cellulose,BNC)由于具有天生类似于细胞外基质(extracellular matrix, ECM)的纳米纤维网状结构以及其它诸多优秀的理化特性和生物相容性,因此被公认为是一种理想生物医用材料,在众多的生物医用产品中都有着美好应用前景[1]。BNC纳米纤维的高亲水性,深亚微米级sub-100 nm)纤维细度及超高润湿状态下的机械强度,目前均很难在其他人工材料上实现[2],因此BNC医用材料的来源依赖于木葡萄糖酸醋杆菌的生物合成。由于不同的应用有不同的要求,因此必须对天然BNC材料进行复合或者改性以满足不同的需求。例如,对于生物医用材料来说,赋予材料一定的抗菌特性能够大幅度降低使用过程中的细菌感染风险。由于纤维素本身并不具备抗菌特性,因此需要和其它抗菌材料进行复合以改善其抗菌特性。
壳聚糖(chitosan,CS)是一类天然的氨基多糖,能够体内降解,无毒副作用,生物相容性高,是一类已经广泛应用的生物材料。由于壳聚糖本身具备天然抗菌特性,且其表面的正电性氨基能够改善纤维素超亲水表面造成的细胞粘附性弱的问题[3],因此CS被认为与BNC是优势互补,可以复合形成一种具备理想特性的生物医用材料。目前常用的复合方式有三种:一是通过浸渍法将CS高分子通过扩散进入已获得的BNC纳米纤维网内部[4-5]。但是,浸渍法将CS填充于BNC纳米纤维网络的纤维间隙中,极大地改变了BNC原先的类ECM纳米纤维微观形貌;且由于采用浸渍方式,复合物可能由于扩散作用而形成不均匀的梯度分布。第二种是将现成的BNC基材溶解或者匀浆分散后与CS混合,再采用人工再生的方式形成新的CS/BNC复合材料[6]。由于目前的人工手段尚难以重现BNC纳米纤维及其微结构,该方式将完全破坏BNC的纳米纤维状结构。第三种是原位复合,即将CS分散于培养基中,在BNC基体合成的过程中与CS复合。原位复合中,目标高分子可能被掺杂于纳米纤维内部,也可仅被包裹于纳米纤维网内,这取决于目标复合物的溶解及分散程度。仅存在于纤维网络间隙的高分子复合稳定性较差,可能会在后续纯化过程中从BNC基体内流失[7]。BNC纳米纤维合成是由菌体通过跨膜蛋白分泌纤维素原纤丝,并在胞外通过氢键、结晶的装配形成宽约100 nm的纳米纤维。纤维素与CS具有高度相似的β-1,4葡萄糖糖苷链结构(如图1所示),两种分子间具有良好的亲和性,能够形成大量的氢键,因此溶解良好的CS分子可在BNC纳米纤维的胞外装配过程中掺杂于BNC原纤丝及分子链间形成CS/BNC复合纳米纤维。因此,溶解CS原位合成CS/BNC复合纳米纤维及其复合水凝胶是一种不改变BNC原有纳米纤维状结构的理想复合方法。
目前国内外原位复合CS/BNC材料报道较少,李朋等曾尝试在培养基中添加CS以获得CS/BNC原位复合膜,但是由于CS具有抗菌性,在培养基中添加CS后抑制了木葡萄糖酸醋杆菌生长,因此未能成功获得CS/BNC复合膜[8]。Phisalaphong和Ciechańska添加低浓度CS至培养基中成功获得CS/BNC原位复合膜,但这些均是初步尝试添加CS的培养效果,他们对CS在培养基中的溶解特征以及CS在CS/BNC原位复合物中的存在性质未进一步优化研究[9-10]。他们所用培养基中CS含量约为0.25%~1%(w/V),而所获BNC凝胶中纤维素含量约为1%(w/w),意味着原位培养获得的复合凝胶中CS与BNC的质量比大约可达1∶3(25% CS)至1∶1(50% CS)。然而最终获得CS/BNC复合膜中实际CS含量仅占膜干重的7%~10%[10],表明培养基中的CS仅有少部分能够成功掺杂入BNC基体内,多数仍游离于凝胶的纤维间隙及培养基溶液中,CS掺杂复合率与利用率均较低。这可能是由于CS分子未充分分散溶解造成的,因此需要进一步优化CS的溶解情况,并对CS在CS/BNC复合膜中存在状况做进一步研究。CS的溶解对其在纳米纤维中掺杂效果、抑菌性等均具有显著影响,可决定所获CS/BNC复合物中CS的掺杂比例及其存在稳定性。为此,本研究采用低浓度水平CS原位复合,详细探讨了CS在培养基中的溶解方式和溶解酸种类、CS浓度对原位合成的影响,考察了不同初始pH值及灭菌方式对原位培养的影响,并对CS在BNC纳米纤维内部的存在及组成情况进行了分析表征。

图1 纤维素与壳聚糖分子结构
1 实验
1.1 材料
菌种:木葡糖酸醋杆菌ATCC 23770,本实验室保藏。
壳聚糖(脱乙酰度80.0%~95.0%,粘度50~800)、乙酸、乳酸、磷酸和盐酸均购自国药集团化学试剂有限公司。
1.2 原位复合培养基的配制
1.2.1标准木葡糖醋酸杆菌培养基的配制
将葡萄糖25 g、胰蛋白胨5 g、酵母粉3 g溶解于1 L去离子水中,以硫酸调整pH至5.0±0.3,按装液量100 mL/个分装至10个250 mL三角瓶中,121℃高压蒸汽灭菌20 min。
1.2.2共混同步灭菌含CS的无菌培养基的配制
先配制系列浓度梯度的各类酸(乙酸、乳酸、磷酸、盐酸,如表1所示)溶液,然后分别添加质量为0、2.5、5.0、7.5、10、15 g的CS至1 L所配制的酸溶液中充分溶解,获得系列浓度梯度的CS酸溶液,再在CS酸溶液中添加培养基组分(葡萄糖25 g,胰蛋白胨5 g,酵母粉3 g),充分溶解,以获得CS浓度为i(i=0%、0.25%、0.50%、0.75%、1.0%、1.5%,w/V)的共混同步灭菌iCS培养基,按装液量100 mL分装至每个250 mL三角瓶中,最后110℃高压蒸汽灭菌30 min。
1.2.3分步灭菌混合的含CS的无菌培养基的配制
配制2倍浓缩的系列浓度梯度的各类酸(乙酸、乳酸、磷酸、盐酸,如表2所示)溶液,然后分别添加质量为0、2.5、5.0、7.5、10、15 g的CS至500 mL所配制的酸溶液中,充分溶解获得2倍浓缩的系列浓度梯度CS酸溶液,按装液量50 mL分装至培养瓶,后110℃高压蒸汽灭菌30 min。另取葡萄糖25 g,胰蛋白胨5 g,酵母粉3 g溶解于500 mL去离子水中,配制成2倍浓缩的培养基,后按装液量50 mL分装至培养瓶中,于110℃高压蒸汽灭菌30 min。使用前,分别取2倍浓缩的系列浓度梯度CS酸溶液与2倍浓缩的培养基按体积比1∶1混合,获得CS浓度为i(i=0%、0.25%、0.50%、0.75%、1.0%、1.5%,w/V)的分步灭菌混合iCS培养基。
1.3 原位培养过程
以标准木葡糖醋酸杆菌培养基为种子液,取2环活化好的种子琼脂斜面上的菌落,接种于含200 mL的500 mL三角瓶中,于160 r/min、30℃恒温摇床中振荡培养12 h作为种子液。按照10 %(V/V)接种量,将培养物接种至各组培养基中,30℃静置培养10天。以标准木葡糖醋酸杆菌培养基培养的BNC作为空白对照。
1.4 BNC和CS/BNC复合凝胶膜的纯化
将原位培养获得的BNC和CS/BNC复合凝胶膜从培养基中取出,以去离子水清洗膜的表面以除去其表面残存培养基,再置于0.5%(w/V)的NaOH水溶液中80℃下碱煮,每2 h更新一次碱液,以除去存在于纳米纤维素网络中的菌体、细胞碎片和残余培养基等,直至洗出碱液变得无色透明为止。之后用去离子水进行反复置换,至置换液pH值接近中性为止。
1.5 BNC和CS/BNC复合膜的产量计算
将纯化后BNC和CS/BNC凝胶膜置于聚四氟乙烯托盘内,于105℃鼓风干燥箱内烘干至衡重,测量其质量为m1(g),其产量以单位体积培养基生产的干膜质量计(g/L)。
1.6 CS/BNC复合凝胶膜的表征
1.6.1微观结构
将纯化后的CS/BNC和BNC水凝胶膜用液氮速冻后,于-50℃、0.2 bar条件下冻干24 h。将冻干后的样品表面低温喷金后,置于场发射扫描电子显微镜(FE-SEM,S-4800,日立,日本)下观察。
1.6.2 ATR-IR分析
复合膜的红外特征采用全反射式反射红外光谱仪(ART-FTIR-8400, Shimadzu Co. Japan)测定,测定波数范围为4500 to 600 cm-1。
1.6.3元素组成及CS含量计算
复合膜中的CS的含量采用元素分析定量法,即通过测定复合样品中的N元素的质量分数最终来确定复合材料中的壳聚糖的质量分数。将CS/BNC冻干膜用剪刀预先裁剪成均匀粉末状小颗粒后混合均匀,精确称取50~100 mg样品于自动进样盘上,采用元素分析仪(Vario ELⅢ,Elementar Analyser Systems,德国哈瑙有限责任公司)测定样品中的C、N、S、H各元素的质量分数。
根据CS/BNC复合膜材料遵循等式(1)的质量守恒:CS/BNC样品的总质量(mCS/BNC)等于样品中纯BNC的质量(mBNC)与复合进的CS的质量(mCS)之和,以及遵循等式(2)的氮元素守恒:CS/BNC样品中的总氮质量(Total N)等于复合材料中壳聚糖的N所占的质量(PCS)和BNC中的N所占的质量(PBNC)之和。

而CS/BNC复合物中的总氮的质量(Total N)等于其样品质量(mCS/BNC)乘以CS/BNC复合材料的N含量(NCS/BNC),这样N元素质量守恒式(2)可以转化为式(3)。

上述公式(3)可以进一步重排,获得CS/BNC样品中的CS含量(αCS)计算表达式(4)。

2 结果与讨论
2.1 溶解条件及方法对原位合成CS/BNC的影响
2.1.1不同酸对含CS培养基配制的影响
由于木葡萄糖酸醋杆菌仅在静态培养的气液界面处合成BNC凝胶膜,因此易沉降的未充分溶解的CS将无法和BNC很好地原位复合。另外,要使得CS在BNC纤维的细菌合成装配过程中掺杂于复合纳米纤维的内部,需要CS充分溶解分散为分子形式,而未完全溶解的CS颗粒或者悬液颗粒,由于尺寸大,仅能被包裹入BNC纤维网内,无法完成BNC纤维的内部掺杂。由于CS分子带有可电离的胺基基团(分子式如图1所示),因此可以在酸液中溶解成溶液。本研究分别尝试了乙酸、盐酸、乳酸、磷酸这四种酸溶解CS,并配成相应的含CS的培养基。
由于培养基中存在的糖及各种蛋白质可以与CS的胺基相互结合,从而极大降低了CS可溶解能力,因此在前期配制培养基的过程中发现,将CS粉末溶解于已配制好加酸的液体培养基非常困难,溶解时间长,CS难分散,容易形成团聚小颗粒。因此本文的培养基的配制采用先获得各浓度的酸性CS溶液,后添加培养基组分溶解的方案。另外,由于在配制的过程中,滴加NaOH回调pH时,溶液会瞬间出现大量不溶颗粒,因此采用了提前控制CS酸溶液浓度,以保证终点pH值,再利用培养基组分溶解过程中,该酸性CS溶液的pH值会由于培养基中蛋白等具有电离能力组分的溶解而逐渐上升,从而让培养基pH值恢复至菌体最适宜pH范围,从而避免了终点酸碱调节。
配制同步共灭菌含CS培养基时的酸添加浓度、pH和溶解情况如表1所示。结果显示,采用盐酸配制时CS溶解性能最高,在维持培养基pH5.0±0.4范围时,获得CS含量为0~1.5%(w/V)的培养基,其次为乙酸,能够获得CS浓度为0~1.0%的培养基。但是其中乙酸配制的1.0%CS含量的培养基,在灭菌冷却后会立刻形成凝胶。这可能是CS与培养基中的蛋白或者多肽类组分发生了受热交联,冷后逐渐联接形成凝胶。类似的,乳酸同样能在pH4.5~5.0范围下,获得含0~1.0% CS的培养基,但是其中0.75%与1.0% CS培养基,在静置培养时会逐渐在其底部出现凝胶,该凝胶难以与形成的BNC膜分离,且在后续碱煮和酸煮中均难以除去。磷酸对含CS培养基的溶解能力最弱,其在pH 4.5~5.0范围下仅能制备含0.25% CS的培养基,即使pH低于4.5也难以溶解0.5%与0.75%的CS培养基。另外对于相同的CS添加量,提高酸浓度有利于CS在培养基中的溶解。譬如,乙酸中同样采用1%(w/V)的CS添加浓度,当乙酸浓度增加到6~7 g/L时,CS可以在培养基中完全溶解,但是相应的pH值也降低至2.11~2.85(如表1所示)。2.1.2灭菌方式对CS培养基溶解的影响
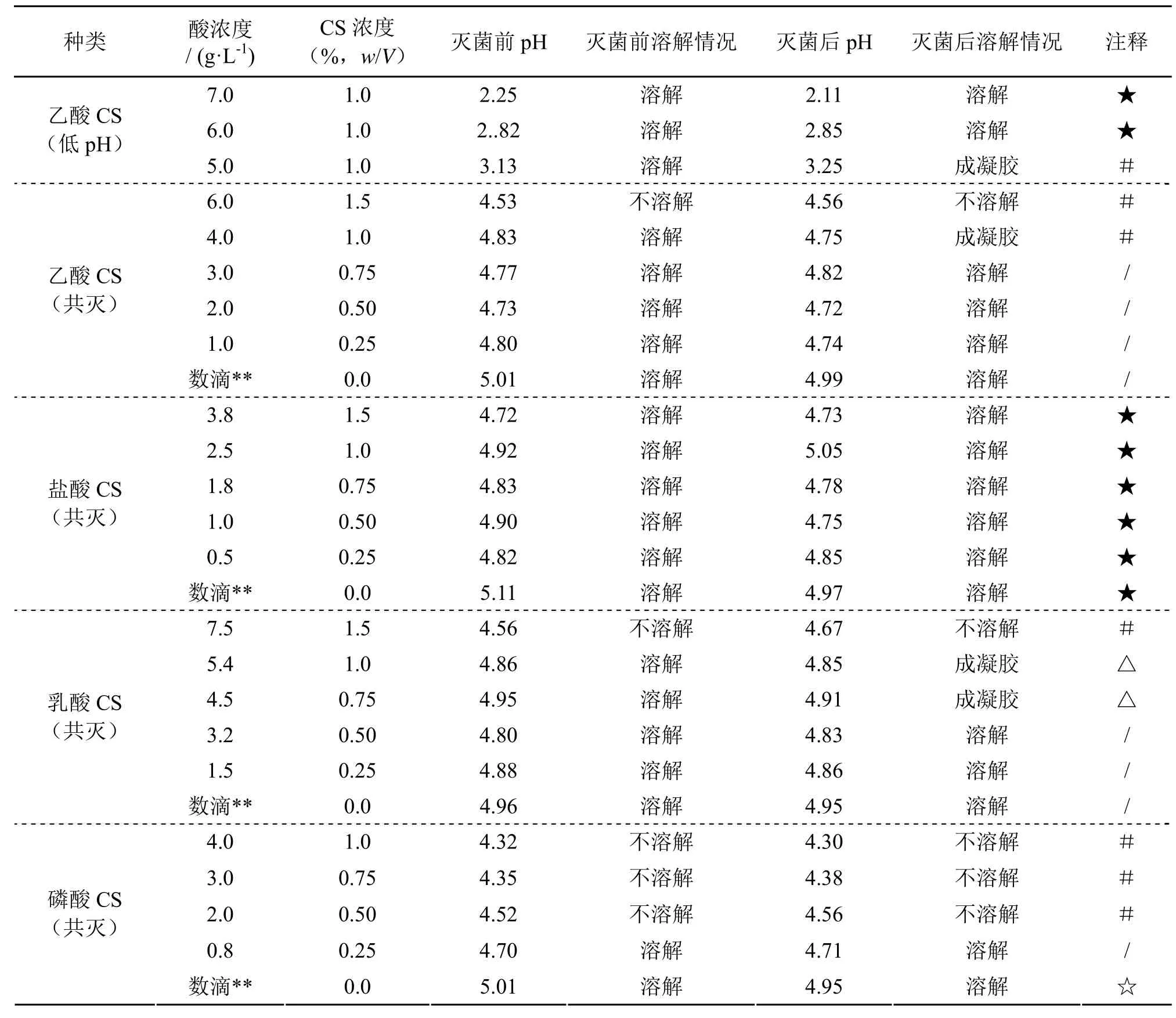
表1 配制同步共灭菌含CS培养基的加酸、pH及溶解情况
如前所述,由于CS和培养基组分(葡萄糖、酵母粉、胰蛋白)共溶解后灭菌,多组出现了不溶性凝胶现象(表1:#和△组)。这可能是因为培养基的组成(如蛋白或多肽)与CS发生热交联反应,使得在高CS浓度条件下高压蒸汽处理后容易形成凝胶,不利于进一步用于CS/BNC的原位合成。因此,对于其中的乙酸制备的CS培养基,本研究也尝试采用让培养基组分与CS先各自配制成溶液分开灭菌后,再于接种前将两者混合配制的方案(如“1.2.3”中所述),其酸的添加比例以及培养基溶解和pH值得结果如表2所示。结果表明,虽然培养基中添加的乙酸、CS和培养基浓度与前面的共灭菌时相同,但是获得的培养基最终pH值在4.4~4.6范围,略低于共灭菌的乙酸溶解的CS培养基,且1.0% CS能够较好溶解,未形成凝胶,这表明分开灭菌方式下CS不会与培养基组分发生热交联,因此避免了不可逆凝胶的形成。

表2 配制分步灭菌的含CS培养基的pH值及溶解情况☆
2.1.3不同CS浓度培养基的原位静置培养结果
以10%(V/V)接种量接入同步共灭菌含CS培养基(表1)及分步灭菌混合的含CS培养基(表2),分别进行原位静置培养,其产量如图2所示,其部分培养基外观如图3所示。其中,添加大量乙酸以溶解CS的两组培养基呈低pH水平的乙酸1% CS培养基(乙酸浓度6和7 g/L,pH 2.11~2.85),未生成任何BNC凝胶膜。这可能是由于高浓度的乙酸和极低的pH环境抑制了木葡糖酸醋杆菌的生长和纤维素的合成能力,因此低pH条件下虽然有利于CS的溶解,但会抑制菌体的原位合成。此外,虽然盐酸具有最好的CS溶解效果,但是所有CS浓度梯度的盐酸CS培养基中,甚至仅以盐酸调节pH未含CS的0.0%组均未见凝胶膜的生长。这可能是由于氯离子本身对木葡糖酸醋杆菌的生长具有较强的抑制性,有文献报道曾指出该菌ATCC 23770对氯离子的耐受能力不超过20 mM[11]。磷酸同样显示出对该菌的抑制特性,其未含CS的磷酸组同样未生成任何BNC膜,但是0.25% CS的磷酸培养基反而出现了少量不完整的膜(0.12 g/L,图3D),原因尚不清楚。
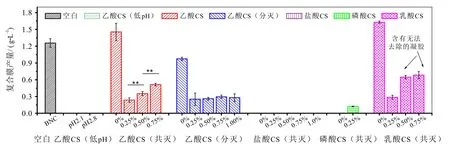
图2 不同CS培养基静态培养的CS/BNC复合膜产量

图3 不同CS浓度培养基的静态原位培养
在以上各培养基组中,同步共灭菌的乙酸CS培养基和乳酸CS培养基,以及分步灭菌的乙酸CS培养基均有CS/BNC复合膜的生成。从培养基颜色上看,同步共灭菌的乙酸CS培养基和乳酸培养基的颜色随着壳聚糖添加量的增加而加深(如图3A和3E)。这是由于壳聚糖本身在蒸汽高温作用下,颜色加深呈现褐色[12];另外在共灭过程中,CS与培养基组分也会发生美拉德反应,从而显现棕色。而对于分步灭菌的乙酸CS培养基,各CS浓度下的培养基颜色均比较接近,显现淡棕色,即使未添加CS的0%组也呈现出明显的棕色(如图3B),这与采用共灭时0% CS组呈现的透明亮黄色明显不同。分步灭菌培养基的颜色主要来自于所配制的2倍浓缩培养基,由于高浓度糖及蛋白胨在高温灭菌时发生美拉德反应程度大大高于常规培养基,因此显现远甚于普通浓度培养基的深棕色(图3 b-1)。2倍浓缩CS酸溶液在灭菌后均显无色至淡黄色,颜色变化小(图3 b-2)。分灭过程避免了共灭过程中CS与培养基发生的显色反应。
同步共灭菌的乙酸CS培养基和乳酸CS培养基,以及分步灭菌的乙酸CS培养基在添加0.25%~1.0% CS后,获得的CS/BNC复合膜的产量均比其相应的0%组低。这主要是由于CS本身具有一定的抗菌性,即使在低浓度水平,还是对菌体产生了一定抑制。另外由于0.5%和0.75%乳酸CS培养基在发酵过程中会形成凝胶,且凝胶与BNC膜粘附在一起,即使碱煮也无法除去(如图3e1和3e2),所以测得CS/BNC凝胶膜量高于真实值,偏高,但是除去凝胶部分的实际产量无法测量。而对于同步共灭菌的0.25%、0.50%和0.75%乙酸CS培养基的CS/BNC复合膜产量分别为0.24、0.35和0.51 g/L,呈现出随着CS添加量的增加而显著增加的趋势(α=0.01,T-test),但是均低于相应的0% CS培养基的BNC产量(1.45 g/L)。这可能是因为CS维持在0.25%~0.75%的低浓度梯度水平,组间CS浓度差异较少,因此CS的抗菌性对菌体的影响差异较小,但是为了溶解CS,原培养基还需添加的大量乙酸,其初始乙酸浓度分别达到0.5、0.75和1.0 g/L。据报道,木葡糖酸醋杆菌不仅能够利用乙酸作为其碳源用于能量代谢或者用于纤维素的生产,而且适量乙酸的存在能够显著增强BNC的生产[13]。本研究证实同步灭菌0%乙酸CS组的BNC产量(用乙酸调pH)要高于标准培养基空白对照组的BNC产量(用硫酸调节pH)。而采用分步灭菌的0.25、0.50、0.75和1.0%乙酸CS培养基所获得的CS/BNC复合膜产量分别为0.26、0.25、0.29和0.28 g/L,CS梯度间差异不显著(α=0.05,ANOVA)。这可能是由于分灭步骤中,浓缩培养基中高浓度的糖和培养基蛋白组分发生强烈的美拉德反应,生成了更多的抑制物,反而不利于BNC的生产。这也使得分步灭菌组中,0%CS乙酸组的BNC产量低于标准培养基空白对照的BNC产量。
综上所述,乙酸适用于溶解CS,是CS/BNC原位合成的较好选择,其中采用同步灭菌法的乙酸CS培养基可以获得更大的CS/BNC复合材料产量,并且CS添加浓度梯度间区分比较明显。
2.2 CS/BNC复合膜的表征
通过对培养基的筛选可知,同步灭菌的乙酸CS培养基是最优的原位制备培养基,因此采用该方案制备iCS/BNC复合膜材料(CS浓度i=0%、0.25%、0.50%、0.75%),并对CS在材料中的复合情况进行初步表征。
2.2.1微观结构观察
图4为采用0.5%乙酸CS培养基原位培养的0.5% CS/BNC复合膜、采用浸渍法将BNC凝胶膜浸渍于0.5% CS乙酸溶液中所获得0.5% CS/BNC复合膜,以及纯BNC的扫描显微镜(SEM)照片。从图中可知,纯BNC呈现出其典型的纳米纤维网络结构。虽然原位培养合成的0.5% CS/BNC仍然呈现出BNC典型的纳米纤维网络结构,但由于CS的抑菌性,使得所获得的0.5% CS/BNC复合膜中的纳米纤维网络远远比纯BNC的稀疏。而作为对照的采用浸渍法获得的0.5% CS/BNC复合膜,明显可见CS沉积于BNC纳米纤维网的孔隙间和纳米纤维表面,填充了纤维间隙。由此可见,原位培养合成的CS/BNC具有近似于原BNC的更好纤维网络结构,且纤维间隙无明显其它材料填充。

图4 BNC和0.5% CS/BNC复合膜的显微结构图(×5 000倍)
2.2.2 ATR-IR谱图分析
纯BNC(0.0%CS/BNC)和iCS/BNC复合膜的ATR-IR谱图如图5所示。由图1可知纤维素与壳聚糖均具有类似的化学结构,均含有D-葡萄糖环通过β-1,4糖苷键连接形成的多糖结构。0.0%CS/BNC显示出在3347.8 cm-1的羟基O-H的尖锐伸缩振动峰,以及在2897 cm-1出现的C-H伸缩振动峰。另一个重要的特征峰为葡萄糖环上的半缩醛的羰基的伸缩振动峰,该峰位于1656 cm-1[14]。而在1200 cm-1至1000 cm-1的指纹区出现的连续的一系列峰组成了纤维素葡萄糖环特征峰,其由呋喃糖环上的半缩醛C-O-C伸缩振动,伯羟基(C6)中的C-O伸缩振动,仲羟基(C2、C3)上的C-O伸缩振动,所组成的呋喃糖环特有的系列峰指纹谱。iCS/BNC复合膜显示了与BNC相似的红外吸收谱图,但是不同之处在于,CS/BNC在BNC的2897 cm-1出现的尖锐C-H伸缩振动峰附近,还存在着N-H的伸缩振动(2875 cm-1),因而叠加形成更宽的峰。另外,iCS/BNC复合膜在1591 cm-1处具有一个尖锐的吸收峰,该吸收来自于N-H的弯曲振动。由于纤维素与壳聚糖的主要化学结构差异仅是后者在β-1,4葡萄糖链糖环的C2上存在一个氨基或乙酰氨基,因此该N-H弯曲振动特征峰的存在,表明CS成功与BNC纳米纤维网基体复合。另外,由于CS上的C2上还存在的乙酰氨基,CS/BNC复合膜在1654~1660 cm-1的羰基伸缩振动峰明显强于BNC的仅具有葡萄糖环上的半缩醛的羰基的伸缩振动峰。

图5 iCS/BNC(CS浓度i=0.0%、0.25%、0.50%、0.75%)复合膜的ATR-IR图

图6 同步灭菌乙酸CS培养基原位培养制备的iCS/BNC的产量及CS组成
2.2.3元素分析及CS含量测定
通过元素分析,同步灭菌乙酸CS培养基所制备的iCS/BNC复合膜的C、N元素以及CS含量见表3,iCS/BNC的产量及组成如图6所示。表3显示0%CS/BNC中的N元素仅约0.1%,表明现有的碱煮纯化处理方式能比较有效地除去BNC凝胶中残余培养基组成和细胞,而iCS/BNC中N元素含量在3%左右(i为培养基中的CS添加浓度),显著高于0%CS/BNC组(约30倍),显然该N元素增量应主要来自于掺杂复合的CS,并且CS能在8 h碱煮后稳定地存在于BNC纳米纤维内。根据公式(4)计算同步灭菌乙酸培养基所获得的iCS/BNC复合膜(i=0.25%、0.50%、0.75%时)中的CS质量分数分别达到48.26%、39.96%和35.54%(w/w)。扣除相应的CS质量占比后,各个CS添加浓度下获得的相应BNC实际产量分别为0.12、0.22和0.33 g/L(如图6所示)。随着培养基中CS浓度从0.25%增至0.75%,纤维素的产量并未下降,相反却呈现出显著增加的趋势,但均远远低于0%CS/BNC。这可能主要是因为,一方面CS的抗菌性对木葡糖酸醋杆菌具有显著的抑制性作用,但另一方面CS浓度提高的同时也增加了乙酸的添加量,乙酸能被木葡糖酸醋杆菌利用并促进BNC合成[13]。获得的iCS/BNC复合膜中CS的质量分数并未随着CS添加浓度的增加而上升(本研究中反而随着浓度的提高而下降),这是因为复合膜中CS含量不仅取决于培养基中CS的浓度,而且也取决于BNC纤维素产量这两方面因素的综合影响。

表3 i CS/BNC复合膜中C、N元素及CS质量百分率
3 结论
本文探索采用原位生物合成法,通过在培养基中溶解CS分子,使得CS在BNC纳米纤维的生物装配过程中,掺杂复合进BNC纳米纤维内部,从而获得了具有超细纳米纤维网络结构的CS/BNC复合凝胶膜。
结果发现共灭菌的乙酸CS培养基的原位培养能够较好地实现CS/BNC的原位复合构想,CS能稳定存在于精细的纳米纤维内部,并且在碱煮纯化条件下仍能稳定存在,CS组成可达复合膜干重的35%~48%,具有较高的复合效率。该复合材料兼具了BNC的类细胞外基质的纳米纤维网络结构及CS材料特性,在生物医用材料领域具有广泛的应用前景。但是由于受到CS抗菌特性的影响且在静态发酵工艺中菌体受到溶氧及营养物传质限制,菌体活性较低,CS/BNC原位复合膜的产量远远低于无CS添加条件下BNC产量,且发酵生产周期漫长,需要通过后期进一步改进培养工艺,通过提高菌体密度、菌体活性及抗逆特性并改善发酵过程中的传质来进一步增强CS/BNC复合材料的生产。
[1] Ross P, Mayer R, Benziman M. Cellulose biosynthesis and function in bacteria[J]. Microbiological Reviews, 1991, 55(1): 35-58.
[2] Koyama M, Helbert W, Imai T, et al. Parallel-up structure evidences the molecular directionality during biosynthesis of bacterial cellulose[J]. Proceedings of the National Academy of Sciences, 1997, 94(17): 9091-9095.
[3] Pillai C K S, Paul W, Sharma C P. Chitin and chitosan polymers: Chemistry, solubility and fiber formation[J]. Progress in Polymer Science, 2009, 34(7): 641-678.
[4] Ul-islam M, Shah N, Ha J, et al. Effect of chitosan penetration on physico-chemical and mechanical properties of bacterialcellulose[J]. Korean Journal of Chemical Engineering, 2011, 28(8): 1736-1743.
[5] Lin W C, Lien C C, Yeh H J, et al. Bacterial cellulose and bacterial cellulose-chitosan membranes for wound dressing applications[J]. Carbohydrate Polymers, 2013, 94(1): 603-611.
[6] Wu Y B, Yu S H, Mi F L, et al. Preparation and characterization on mechanical and antibacterial properties of chitsoan/cellulose blends[J]. Carbohydrate Polymers, 2004, 57(4): 435-440.
[7] Cheng K-C, Catchmark J, Demirci A. Effect of different additives on bacterial cellulose production by Acetobacter xylinum and analysis of material property[J]. Cellulose, 2009, 16(6): 1033-1045.
[8] 李朋, 唐水佳, 杨光, 等. 细菌纤维素复合材料的发酵制备研究[J]. 纤维素科学与技术, 2011, 19(4): 1-5.
[9] Phisalaphong M, Jatupaiboon N. Biosynthesis and characterization of bacteria cellulose-chitosan film[J]. Carbohydrate Polymers, 2008, 74(3): 482-488.
[10] Ciechańska D. Multifunctional bacterial cellulose/chitosan composite materials for medical applications[J]. Fibres and Textiles in Eastern Europe, 2004, 12(4): 69-72.
[11] Hong F, Zhu Y X, Yang G, et al. Wheat straw acid hydrolysate as a potential cost-effective feedstock for production of bacterial cellulose[J]. Journal of Chemical Technology & Biotechnology, 2011, 86(5): 675-680.
[12] Yang Y M, Zhao Y H, Liu X H, et al. The effect of different sterilization procedures on chitosan dried powder[J]. Journal of Applied Polymer Science, 2007, 104(3): 1968-1972.
[13] Yang X Y, Huang C, Guo H J, et al. Beneficial effect of acetic acid on the xylose utilization and bacterial cellulose production by Gluconacetobacter xylinus[J]. Indian J Microbiol, 2014, 54(3): 268-273.
[14] Cai Z, Hou C, Yang G. Preparation and characterization of a bacterial cellulose/chitosan composite for potential biomedical application[J]. Journal of Applied Polymer Science, 2011, 121(3): 1488-1494.
In Situ Biosynthesis of CS/BNC Nano-fibrillar Composite Hydrogels by Static Cultivations
ZHANG Peng1, ZHANG Qing-song1, CHEN Lin1, HONG Feng1,2*
(1. Group of Microbiological Engineering and Industrial Biotechnology, College of Chemistry, Chemical Engineering and Biotechnology, Donghua University, Shanghai 201620, China; 2. State Key Laboratory for Modification of Chemical Fibers and Polymer Materials,Donghua University, Shanghai 201620, China)
In order to improve the properties of bacterial nano-cellulose (BNC) for medical applications, chitosan (CS) was composited with BNC using In Situ biosynthesis of static cultivations, by which CS could be incorporated into BNC nanofiber during its assembly and formed CS/BNC nanofiber composite hydrogels. In this study, the effects of acid type, CS concentration, pH value and autoclaving procedure on dissolution of CS in culture media, as well as on CS/BNC biosynthesis of Gluconacetobacter xylinus, were investigated in detail. The CS-contained culture media, where CS and culture medium components were dissolved in acetic acid aqueous solutions and then autoclaved synchronously with the culture components, was the optimal media for CS/BNC composites biosynthesis. With the optimal media, CS was incorporated into BNC nanofiber successfully and existed stably in nanofibers with CS content of 35%~48%.
bacterial nano-cellulose; chitosan; In Situ biosynthesis; static cultivation
Q815;TB332
A
1004-8405(2016)04-0001-11
10.16561/j.cnki.xws.2016.04.09
2016-06-27
国家自然科学基金(51373031);上海市科委项目(15520720800);中央高校基本科研业务费专项资金资助项目(2232014A3-04);东华大学博士创新基金资助项目(CUSF-DH-D-2013041)。
张 鹏(1988~),男,浙江淳安人,博士研究生;研究方向:新型细菌纳米纤维素复合膜的制备及表征。
* 通讯作者:洪 枫(1970~),教授,博士生导师;研究方向:细菌纤维素的低成本高效制备及其应用。fhong@dhu.edu.cn
