一株脱硫菌株的分离鉴定及其对硫化物的去除效果验证*
2017-01-10周一民刘晓风廖银章
赵 鹏,李 东,周一民,刘晓风,廖银章
(1.中国科学院成都生物研究所,成都 610041;2.中国科学院大学,北京 100049;3.中国科学院成都有机化学有限公司,成都 610041)
一株脱硫菌株的分离鉴定及其对硫化物的去除效果验证*
赵 鹏1,2,李 东1†,周一民3,刘晓风1†,廖银章1
(1.中国科学院成都生物研究所,成都 610041;2.中国科学院大学,北京 100049;3.中国科学院成都有机化学有限公司,成都 610041)
为获得适合生物脱硫工程应用的硫氧化细菌,取污水处理厂曝气池活性污泥,采用人工模拟硫化物废水作为硫源富集培养并经分离纯化,得到一株能够高效快速去除废水中硫化物的硫氧化细菌菌株DS-7。该菌为短杆状、长0.8~2 μm、宽0.6~0.8 μm、革兰氏阴性,最适生长温度为30℃,最适生长pH值为7.0。通过对该菌的16SrDNA序列测定,并结合其形态和生理特性鉴定,该菌株属于鞘氨醇杆菌属(Sphingobacterium)。Sphingobacterium sp.DS-7去除硫化物性能研究结果
硫氧化细菌;生物脱硫;硫化物;16SrDNA;鉴定
0 引 言
天然气或沼气等燃气中含有高浓度的硫化氢,硫化氢的存在不仅会对人体健康和环境造成严重的威胁,还会腐蚀金属管道等设备[1-2]。因此,这些燃气中硫化氢的脱除越来越受到人们的重视。目前最常用的脱硫方法包括物理法、化学法以及生物法[3]。其中生物脱硫(biological desulfurization)是自20世纪80年代发展起来的一门新技术[4]。生物脱硫具有不需要催化剂、效率高、低成本、硫转化率高等特点,拥有广阔的工业应用前景,可应用于石油脱硫、天然气脱硫、沼气脱硫、烟道气脱硫、污水处理厂废水脱硫和制革废水脱硫等领域,生物脱硫技术也成为了目前脱硫行业中的研究热点以及产业发展的重要环节[5]。
生物脱硫的核心在于硫氧化细菌。对于工程应用,需要选择能够耐受较高硫化物浓度、硫化物去除率较高、硫化物氧化速率较快的细菌。本研究取污水处理厂曝气池活性污泥进行富集驯化,并从驯化培养物中分离得到一株能够高效快速地去除硫化物的硫氧化细菌,对该菌的形态、生理特性进行研究,并测定其16SrDNA序列;同时对该菌去除硫化物的能力进行了研究,为该菌株的生物脱硫工程应用提供参考。
1 材料和方法
1.1 样品来源
样品取自成都市第二污水处理厂曝气池活性污泥。
1.2 培养基
富集培养基成分[6-8]:Na2S·9H2O,5.0 g/L;NaHCO3,1.0 g/L;KH2PO4,1.0 g/L;K2HPO4,1.0 g/L;MgCl2·6H2O,0.4 g/L;NH4Cl,0.4 g/L;微量元素溶液1 mL;维生素溶液1 mL;最后,pH值调至7.0。
分离纯化培养基成分[9-11]:Na2S2O3·5H2O,10 g/L;NaHCO3,1.0 g/L;KH2PO4,1.0 g/L;K2HPO4,1.0 g/L;MgCl2·6H2O,0.8 g/L;NH4Cl,0.4 g/L;微量元素溶液1 mL;维生素溶液1 mL;最后,pH值调至7.0。
1.3 脱硫菌的富集培养和筛选
1.3.1 脱硫菌的富集培养
富集培养装置如图1。
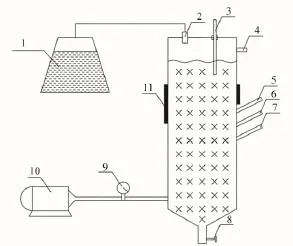
图1 富集驯化反应器Fig.1 The reactor of enrichment and acclimatization
配置5 L含有硫化物的富集培养基,加入装有软性填料的反应器中,然后按照总体积20%的接种量接种活性污泥。每天定时添加置换500 mL富集培养基,曝气速率为0.1 L/min,培养环境温度为28℃~30℃,如此连续7 d,当填料上出现一层淡黄色的絮状生物膜时,即可取富集液进行分离。
1.3.2 脱硫菌的分离纯化
将富集液进行稀释,分别取各稀释液(10-2~10-7稀释度)0.1 mL于各琼脂平板上进行涂布[12]。将涂布后的平板于30℃培养3~4 d直至培养皿内出现明显的菌落。选取合适稀释度的培养皿,用接种环在无菌环境中挑取形态和颜色不一的单菌落接入下一批已灭菌的培养皿中,待菌落长出后,重复之前的步骤3~4次,不断分离纯化,得到纯的菌株。挑取菌落在斜面上保藏。
本实验一共筛选得3株菌株,包括鞘氨醇杆菌(Sphingobacterium sp.)DS-7、假单胞菌(Pseudomonas)DS-8、脱氮副球菌(Paracoccus denitrificans)DS-4,通过对这三株菌株的生理和分子鉴定,我们选取目前尚无文献报道的鞘氨醇杆菌进行研究。
1.4 菌株的鉴定
1.4.1 菌株的形态和生理特性
在振荡速度200 r/min的条件下培养25 h,确定最适生长温度和最适生长pH,每组设三个平行,采用分光光度法测定菌液的OD600值。在初始pH=7.0条件下确定最适生长温度,培养温度为20℃~40℃;在温度30℃条件下确定最适生长pH,初始pH值为5.0 ~9.0[13]。
采用自动生长曲线仪(芬兰Bioscreen)测定该菌株的生长曲线,设置培养温度为30℃,波长λ=600 nm。培养基为通用细菌培养基,成分为:牛肉膏5.0 g/L,蛋白胨10.0 g/L,氯化钠5.0 g/L,酵母粉2.0 g/L,pH值调至7.0~7.2。
1.4.2 菌株16SrDNA序列分析
将生长有菌株DS-7的培养物送至生物工程(上海)股份有限公司进行16SrDNA鉴定,其使用的引物为细菌通用的引物27F(正向)(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(反向)(5’-GGTTACCTTGTTACGACTT-3’)。最后将测定的16SrDNA序列用BLAST中已知的16SrDNA序列进行同源性比较[9,11,14-16]。系统发育树的构建采用软件MEGA6.0。
1.5 脱硫特性研究
1.5.1 硫化物浓度对脱硫效果的影响
分别配制实测硫(S2-)浓度为78、176、359、460、700、896、1 121 mg/L的人工模拟硫化物废水150 mL,接种菌液50 mL,温度30℃、振荡速度200 r/min的条件下培养,不加菌的作为空白对照,每隔2 h测定硫化物的浓度以及单质硫的浓度。
1.5.2 脱硫效果验证
将菌液在无菌环境中倒入装有200 mL硫(S2-)浓度为650 mg/L(实测)人工模拟硫化物废水的500 mL三角瓶中,温度30℃、振荡速度200 r/min的培养条件下,每隔30 min取样一次,测定硫化物浓度、单质硫浓度。
1.5.3 硫颗粒形态
对脱硫后的培养液进行离心分离,将沉淀物预处理后在扫描电子显微镜(SEM)下观察其形态[17]。
1.6 测定方法
硫化物的测定方法采用亚甲基蓝分光光度法(λ=660 nm)[18];菌液浓度的测定方法为OD值法(λ=600 nm);单质硫浓度采用四氯化碳萃取-高效液相色谱(HPLC)法(λ=240 nm)对离心后的萃取液进行检测[19];pH值采用便携式pH计测定。
2 结果与分析
2.1 菌株的形态及生理特性
2.1.1 菌株的形态特征
富集培养液经多次分离筛选得到一株具有脱硫能力的菌株DS-7。在平板培养基上该菌落呈圆形,湿润,凸出,边缘整齐,颜色为淡黄色。在扫描电子显微镜下观察,该菌均为短杆状(如图2)、长0.8~2 μm、宽0.6~0.8 μm、革兰氏染色阴性。

图2 菌株DS-7在扫描电子显微镜下的细胞形态Fig.2 Morphology of the strain DS-7 under SEM
2.1.2 菌株的最适生长温度
如图3所示,菌株在20℃~40℃范围内均能生长,在30℃环境下生长效果最好。
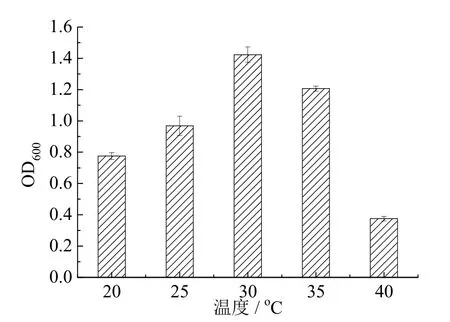
图3 温度对菌株DS-7生长的影响Fig.3 The influence of temperature on the growth of strain DS-7
2.1.3 最适生长pH
从图4可以看出,该菌在6.0~8.0的pH环境中可以生长,最适pH值为7.0;在pH ≤ 5.0和pH ≥ 9.0时,该菌基本上不生长。其生长符合大多数脱硫细菌在pH值为6.0~8.0范围生长的特点[6],其最适pH为中性值,在环境中较易调节。
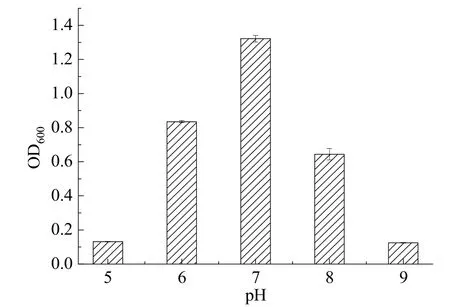
图4 pH值对菌株DS-7生长的影响Fig.4 The influence of pH on the growth of strain DS-7
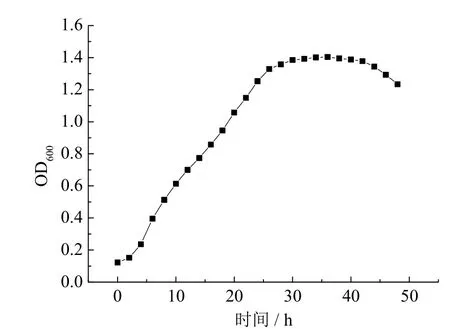
图5 菌株DS-7在好氧条件下的生长曲线Fig.5 Growth curve of the strain DS-7 under aerobic condition
2.1.4 菌株的生长曲线
由图5可知,菌株DS-7的延滞期约为3 h,然后进入对数生长期,生长25 h后进入稳定期,稳定期持续时间较长,达17 h,生长约42 h之后进入衰亡期。
2.2 菌株的分子生物学鉴定
测序所得菌株DS-7的16SrDNA序列长度为1391 bp,在Gene Bank数据库中的BLAST比对分析结果显示,菌株DS-7与鞘氨醇杆菌(Sphingobacterium sp.,Accession number为KU668559.1)的同源性达99%。使用MEGA 6.0构建其系统发育树如图6所示。
从图6中的系统发育树可以发现,在所获得的16条有效序列中,有8条与已知菌株DS-7的16SrRNA序列相似度较高,为95%~98%;8条与Sphingobacterium sp.的16SrRNA序列相似度为94%。因此,鉴定该菌株属于鞘氨醇杆菌(Sphingobacterium sp.)。
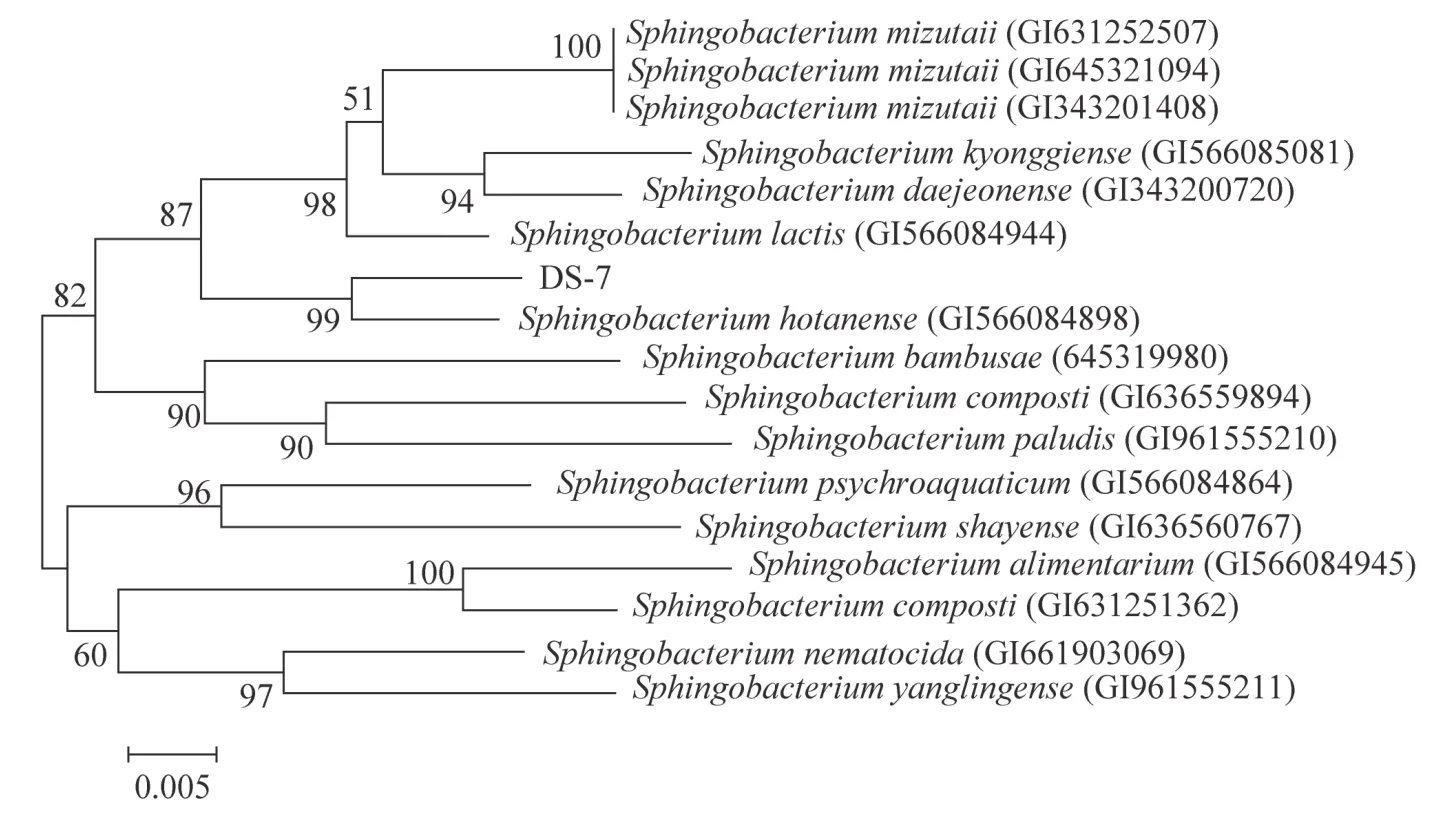
图6 菌株DS-7的系统发育树Fig.6 Phylogenetic tree of DS-7 strain
2.3 菌株的脱硫性能
菌株DS-7在不同浓度的硫化物中培养4 h后硫化物去除率和硫化物转化成单质硫的转化率见表1。
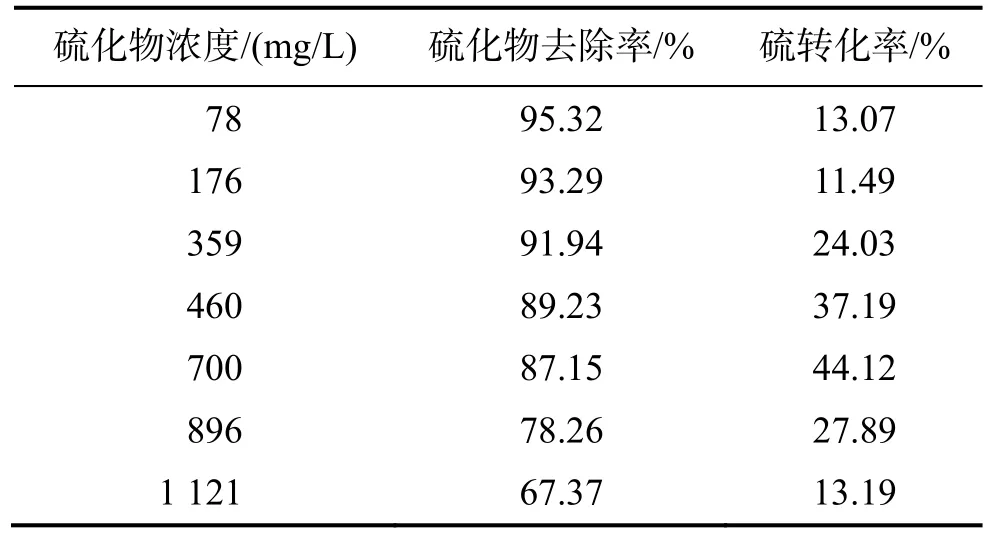
表1 菌株DS-7处理各浓度废水4 h的结果Table 1 The consequence of strain DS-7 disposing wastewater of various concentrations for 4 h
由表1可知,硫化物的去除率随着硫化物浓度的增加而降低。当浓度小于700 mg/L时,去除率可达到87.15%以上;当硫化物浓度大于700 mg/L时,去除率迅速下降。此外在460 mg/L和700 mg/L两个浓度之间,硫化物转化为单质硫的转化率较高,分别为37.19%和44.12%。
2.4 菌株的脱硫效果验证
将菌株接种至硫(S2-)浓度为650 mg/L的人工模拟废水中,该菌株在30℃、震荡速度为200 r/min条件下的脱硫效果如图7所示。菌株DS-7培养4 h后硫化物的去除效率达到95%以上,单质硫的累计最高浓度达到293.013 mg/L,相应的硫转化率实际达到了45.08%。这说明该菌株对硫化物具有良好的脱除效果。闫旭等[20]分离得到一株具有氧化能力的那不勒斯硫杆菌(Thiobacillus neapolitanus),在硫化物为唯一硫源,质量浓度分别为60 mg/L、120 mg/L、180 mg/L、240 mg/L时,4 h硫化物去除率分别为89.72%、71.25%、63.45%和13.31%。王庭等[21]的研究结果表明,溶氧和氧化还原电位对硫转化率有较大影响,今后将通过工艺优化,进一步提高该菌的单质硫转化率。
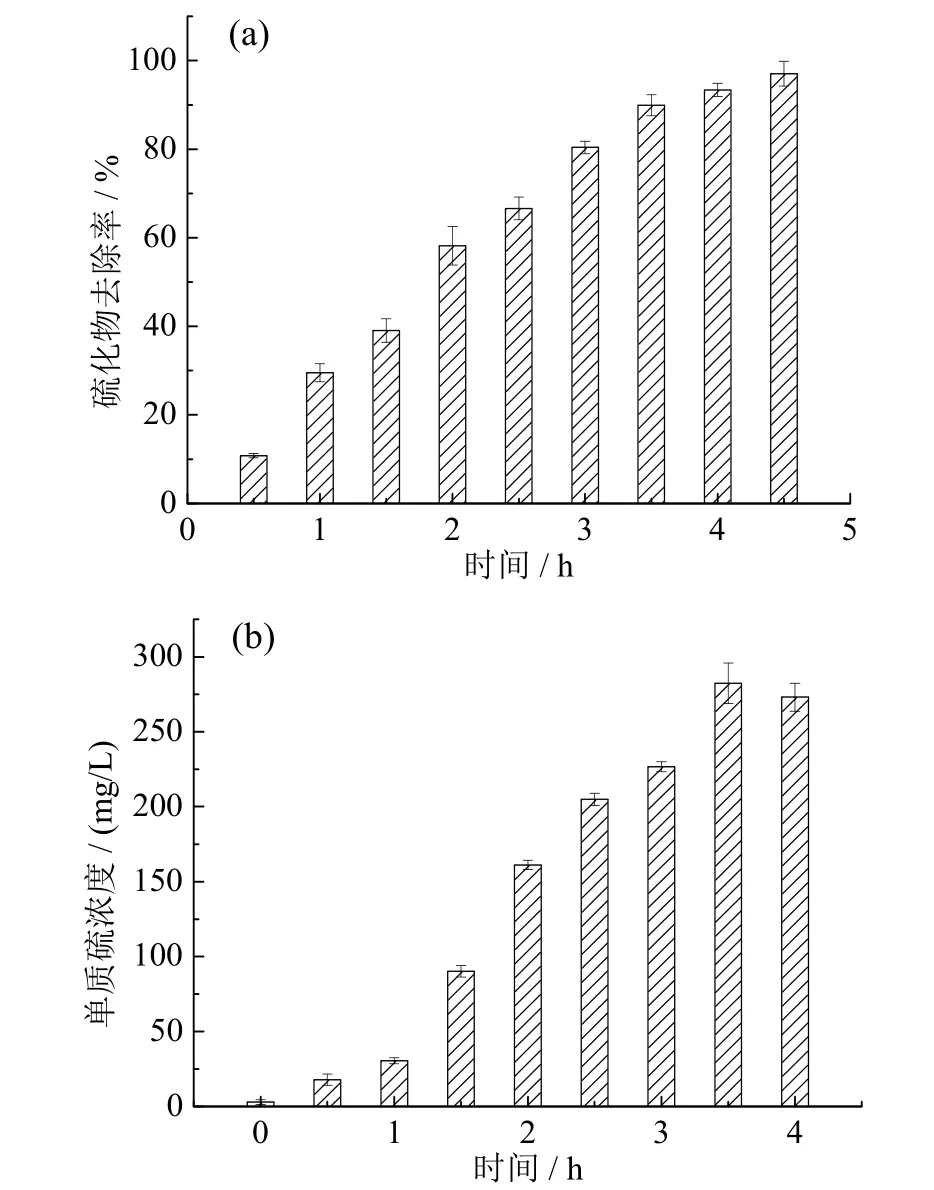
图7 菌株DS-7在人工模拟废水中的脱硫表现Fig.7 The performance of the desulfurization of strain DS-7 in the artificial wastewater
鞘氨醇杆菌脱硫性能为首次发现,为生物脱硫拓展了菌种库。与目前文献报道的生物脱硫菌株相比,菌株DS-7具有快速高效去除高负荷硫化物废水中S2-的优势;且该菌营养类型为兼性营养型,在有机碳源培养基中培养5 h即可进入对数期。因此,可以通过有机碳源培养基培养来获得高密度的菌体用于生物脱硫工程的快速启动。
2.5 单质硫的形态

图8 生物硫颗粒在扫描电镜下的形态Fig.8 The morphology of biological sulfur particles under the SEM
本实验对菌株DS-7处理后的模拟废水中的硫颗粒进行了预处理,在扫描电镜下进行了观察,结果如图8所示。从图中可以看出处理后的废水中硫颗粒形态大致呈不规则的八面体,粒径远大于菌体。BOSCH等[17]也对生物脱硫反应器中生物硫颗粒做了电镜观察,发现其生物硫颗粒大多呈形状一致的不规则多面体。
3 结 论
(1)从污水处理厂曝气池活性污泥中分离获得一株能够高效快速地去除废水中硫化物的硫氧化细菌菌株DS-7。根据形态和生理特性、16SrDNA序列分析以及系统发育树鉴定,初步确定菌株DS-7为鞘氨醇杆菌(Sphingobacterium sp.)。菌株DS-7的最适生长温度为30℃,最适生长pH值为7.0。
(2)当硫(S2-)浓度为650 mg/L时,培养4 h后S2-的去除率达到95%以上;单质硫的累积浓度达到293.013 mg/L,相应的单质硫转化率为45.08%。
[1] 孙秋君,陈晓晔,朱建良,等.沼气脱硫技术的研究进展[J].现代化工,2012,32(6):30-33.DOI:10.3969/j.issn.0253-4320.2012.06.007.
[2] 王钢,王欣,高德玉,等.沼气生物脱硫技术研究[J].应用能源技术,2008(5):33-35.DOI:10.3969/j.issn.1009-3230.2008.05.015.
[3] LI L,HAN Y P,YAN X,et al.H2S removal and bacterial structure along a full-scale biofilter bed packed with polyurethane foam in a landfill site[J].Bioresource technology,2013,147:52-58.DOI:10.1016/j.biortech.2013.07.143.
[4] 汪家铭.Shell-Paques生物脱硫技术及其应用[J].化肥设计,2010,48(2):39-42.DOI:10.3969/j.issn.1004-8901.2010.02.011.
[5] 白金莲,蒲万芬,赵发海.微生物法去除H2S的研究进展[J].石油与天然气化工,2008,37(3):209-213.DOI:10.3969/j.issn.1007-3426.2008.03.010.
[6] 张卫江,曲萌,徐姣.高效脱硫菌的分离、鉴定及脱硫特性研究[J].现代化工,2014,34(8):119-122.
[7] 黄强.一株硫氧化菌的筛选及其生理生化特性[J].实验室研究与探索,2013,32(11):28-32,36.DOI:10.3969/ j.issn.1006-7167.2013.11.007.
[8] 高超.高效脱硫菌的分离、鉴定及其特性研究[D].合肥:安徽大学,2010:19-35.
[9] LUO J F,TIAN G L,LIN W T.Enrichment,isolation and identification of sulfur-oxidizing bacteria from sulfide removing bioreactor[J].Journal of environmental sciences,2013,25(7):1393-1399.DOI:10.1016/S1001-0742(12)60179-X.
[10] KLOK J B M,DE GRAAFF M,VAN DEN BOSCH P LF,et al.A physiologically based kinetic model for bacterial sulfide oxidation[J].Water research,2013,47(2):483-492.DOI:10.1016/j.watres.2012.09.021.
[11] MA Y L,YANG B L,ZHAO J L.Removal of H2S by Thiobacillus denitrificans immobilized on different matrices[J].Bioresource technology,2006,97(16):2041-2046.DOI:10.1016/j.biortech.2005.09.023.
[12] ZHANG J B,ZHANG T,MA K,et al.Isolation and identification of the thermophilic alkaline desulphuricant strain[J].Science in China series B:chemistry,2008,51(2):158-165.DOI:10.1007/s11426-008-0008-5.
[13] VAN DEN BOSCH P L F,SOROKIN D Y,BUISMAN C J,et al.The effect of pH on thiosulfate formation in a biotechnological process for the removal of hydrogen sulfide from gas streams[J].Environmental science &technology,2008,42(7):2637-2642.DOI:10.1021/ es7024438.
[14] MESA M M,MACIAS M,CANTERO D.Biological iron oxidation by Acidithiobacillus ferrooxidans in a packed-bed bioreactor[J].Chemical and biochemical engineering quarterly,2002,16(2):69-73.
[15] SUBLETTE K L,SYLVESTER N D.Oxidation of hydrogen sulfide by thiobacillus denitrificans:desulfurization of natural gas[J].Biotechnology and bioengineering,1987,29(2):249-257.DOI:10.1002/bit.260290216.
[16] SOUTHERLAND W M,TOGHROL F.Sulfite oxidase activity in Thiobacillus novellus[J].Journal of bacteriology,1983,156(2):941-944.
[17] BOSCH J,LEE K Y,JORDAN G,et al.Anaerobic,nitrate-dependent oxidation of pyrite nanoparticles by Thiobacillus denitrificans[J].Environmental science &technology,2012,46(4):2095-2101.DOI:10.1021/es2022329.
[18] 关秀存,彭红艳.亚甲基蓝分光光度法测定水中硫化物[J].安阳工学院学报,2012,11(4):25-27.DOI:10.3969/j.issn.1673-2928.2012.04.009.
[19] 赵由之,梁小兵,安宁,等.液相色谱法测定湖泊沉积物中单质硫[J].矿物学报,2006,26(1):29-32.DOI:10.3321/j.issn:1000-4734.2006.01.005.
[20] 闫旭,马忠良,严群,等.一株硫化物氧化细菌的分离、鉴定和脱硫效果初步验证[J].食品与生物技术学报,2008,27(5):113-116.DOI:10.3321/j.issn:1673-1689.2008.05.021.
[21] 王庭,阮文权,严群,等.ORP控制在硫化物生物氧化成单质硫过程中的应用[J].环境工程学报,2008,2(3):366-369.
Isolation and Identification of a Desulfurization Strain and Its Sulfide Removal Performance
ZHAO Peng1,2,LI Dong1,ZHOU Yi-min3,LIU Xiao-feng1,LIAO Yin-zhang1
(1.Chengdu Institute of Biology,Chinese Academy of Sciences,Chengdu 610041,China;2.University of Chinese Academy of Sciences,Beijing 100049,China;3.Chengdu Organic Chemicals Co.,Ltd.,Chinese Academy of Sciences,Chengdu 610041,China)
In order to obtain sulfur-oxidizing bacteria for engineering application of biodesulfurization,the enrichment and acclimation of aerobic activated sludge was carried out by using artificial sulfide wastewater as a sulfur source.A sulfur-oxidizing bacteria strain DS-7 with strong ability of sulfide removal was isolated from the enrichment culture.The strain DS-7 was Gram-negative and short rod shaped with length of 0.8~2 μm and width of 0.6~0.8 μm.The optimal growth temperature and pH was 30oC and 7.0,respectively.The identified strain DS-7 belongs to the genus of Sphingobacterium according to the 16SrDNA bacterial sequences and the morphological and physiological characterization.The sulfide removal performance tests of Sphingobacterium sp.DS-7 showed that the sulfide removal rate was more than 95% and the sulfur conversion rate reached 45.08% after culturing for 4 h at the initial sulfide concentration of 650 mg/L.The sulfur formed by Sphingobacterium sp.DS-7 was in the shape of irregular octahedron.
sulfur-oxidizing bacteria;biodesulfurization;sulfide;16SrDNA;identification
TK6
A
10.3969/j.issn.2095-560X.2016.06.001
2095-560X(2016)06-0425-06
赵 鹏(1992-),男,硕士研究生,主要从事生物脱硫研究。
李 东(1982-),男,博士,副研究员,主要从事生物燃气高效制备与高值利用研究。
刘晓风(1964-),男,研究员,主要从事固体废弃物处置和生物质能源研究。
2016-09-14
2016-10-21
国家科技支撑计划项目(2015BAD21B01)
† 通信作者:李 东,E-mail:lidong@cib.ac.cn;刘晓风,E-mail:liuxf@cib.ac.cn
表明:当硫化物浓度为650 mg/L时,该菌的4 h硫化物去除率达到95%以上,相应的硫转化率最高达到45.08%,生成的单质硫颗粒形状为不规则八面体。
