辽河保护区河岸带土壤微生物群落结构特征
2017-01-09孙丽娜孙家君陈宗聪
郭 娜, 孙丽娜, 孟 越, 孙家君, 陈宗聪
(1. 沈阳大学 区域污染环境生态修复教育部重点实验室, 辽宁 沈阳 110044;2. 北京桑德环境工程有限公司, 北京 101102)
辽河保护区河岸带土壤微生物群落结构特征
郭 娜1, 孙丽娜1, 孟 越1, 孙家君2, 陈宗聪1
(1. 沈阳大学 区域污染环境生态修复教育部重点实验室, 辽宁 沈阳 110044;2. 北京桑德环境工程有限公司, 北京 101102)
为了解辽河保护区河岸带土壤微生物群落结构特征,采用PCR-DGGE技术对辽河保护区河岸带上中下游几种不同土壤微生物群落结构特征进行研究.结果表明:辽河保护区河岸带各采样点土壤微生物多样性指数(H)、丰富度(R)和均匀度指数(J)均有所不同,从上游到下游土壤的微生物多样性呈波动性变化,玉米土壤和向日葵土壤微生物多样性指数低于草地土壤微生物多样性指数;大豆土壤微生物多样性指数高于草地土壤微生物多样性指数.辽河保护区土壤的微生物群落结构变化是多种环境因子共同作用的结果,其中人类活动会通过改变植被种类多样性影响土壤理化性质,进而改变微生物的群落结构特征,影响生态系统的稳定性.
土壤; 微生物群落; PCR-DGGE; 河岸带
土壤微生物群落的种群多样性一直是微生物生态学和环境学科研究的重点.在土壤有机物质分解和养分释放、能量转移等生物地化循环中起着重要作用.
河岸带土壤质量决定了在其上生长的植被量,影响河岸带的生态功能[1].在河流生态系统中,河岸带土壤微生物是河岸带土壤的重要组成部分,是表征河流生态现状的生物标志物[2].土壤微生物对物质循环和能量流动发挥着巨大的作用,为了有效研究微生物的作用就必须对其群落结构进行分析,以得到丰富的微生物多样性信息[3],进而确定河岸带土壤微生物群落状况.目前,因为环境中存活的大多数微生物处于不能培养的状态,因此传统培养法有很大局限性,难以准确研究微生物多样性与其生态功能的关系,而且精度差.而DGGE方法因其具有快速、重复性好、可靠性强等优点被广泛应用于土壤微生物群落结构的研究[4].从理论上讲,DGGE/TGGE指纹图上的一个条带就代表一个微生物类群.因而,指纹图谱直观反映了微生物群落的结构和多样性[5].
本研究采用从辽河保护区河岸带的上、中、下游19个采样点4种不同种植方式的土壤中直接提取微生物的总DNA,然后利用PCR-DGGE技术对土壤中微生物群落的动态变化进行研究,运用Quantity one软件对图谱进行初步分析,了解辽河保护区河岸带微生物群落结构的差异性,探讨河岸带不同位点和相同位点的不同种类作物根际土壤的微生物群落结构的多样性,为辽河保护区的土壤微生物资源利用提供基础研究资料,同时也为今后辽河保护区的管理提供理论依据和科学支撑.
1 材料与方法
1.1 采样点及采样方法
辽河保护区是2010年3月由辽宁省委、省政府批准依辽河干流设立的狭长区域.保护区起源于东、西辽河交汇处的铁岭昌图县福德店,流经铁岭、沈阳、鞍山、盘锦四个城市于盘锦入海,全长538 km,总面积1 869.2 km2,地理坐标为东经123°55′30″~121°41′,北纬43°02′~40°47′.保护区属温带半湿润大陆性季风气候,年均温度在4~9 ℃,降水量为600~700 mm,土壤类型主要为棕壤、风砂土和泥炭沼泽土.辽河保护区内有支流36条,其中流域面积100 km2以上的一级排干支流22条,包括流域面积5 000 km2以上的大型河流4条,流域面积1 000~5 000 km2的中型河流7条,流域面积100~1 000 km2的小型河流11条[6-7].
为明确辽河保护区河岸带土壤微生物群落结构多样性特征,根据辽河保护区水文地质特征和人类活动情况,沿辽河保护区河岸带自上而下共设19个土壤采样点.在上游设置采样点7个,分别是福德店、三河下拉、通江口、哈大高铁、双安桥、蔡牛、汎河口,中游设置采样点7个,分别是石佛寺水库、马虎山、巨流河、毓宝台、满都户、红庙子、达牛,在下游设置采样点5个,分别是大张桥、盘山闸、曙光大桥、红海滩入海口和赵圈河,采样点的空间分布见图1.在河岸带的19个采样点采集草地土壤样品,同时,为了对比不同种植方式对微生物群落结构的影响,针对保护区作物生长实际情况分别在双安桥(S5-1)、红庙子(S13-1)、达牛(S14-1)样点采集了玉米土壤,在蔡牛(S7-1)采样点采集了大豆土壤,在毓宝台(S11-1)采样点采集了向日葵土壤.
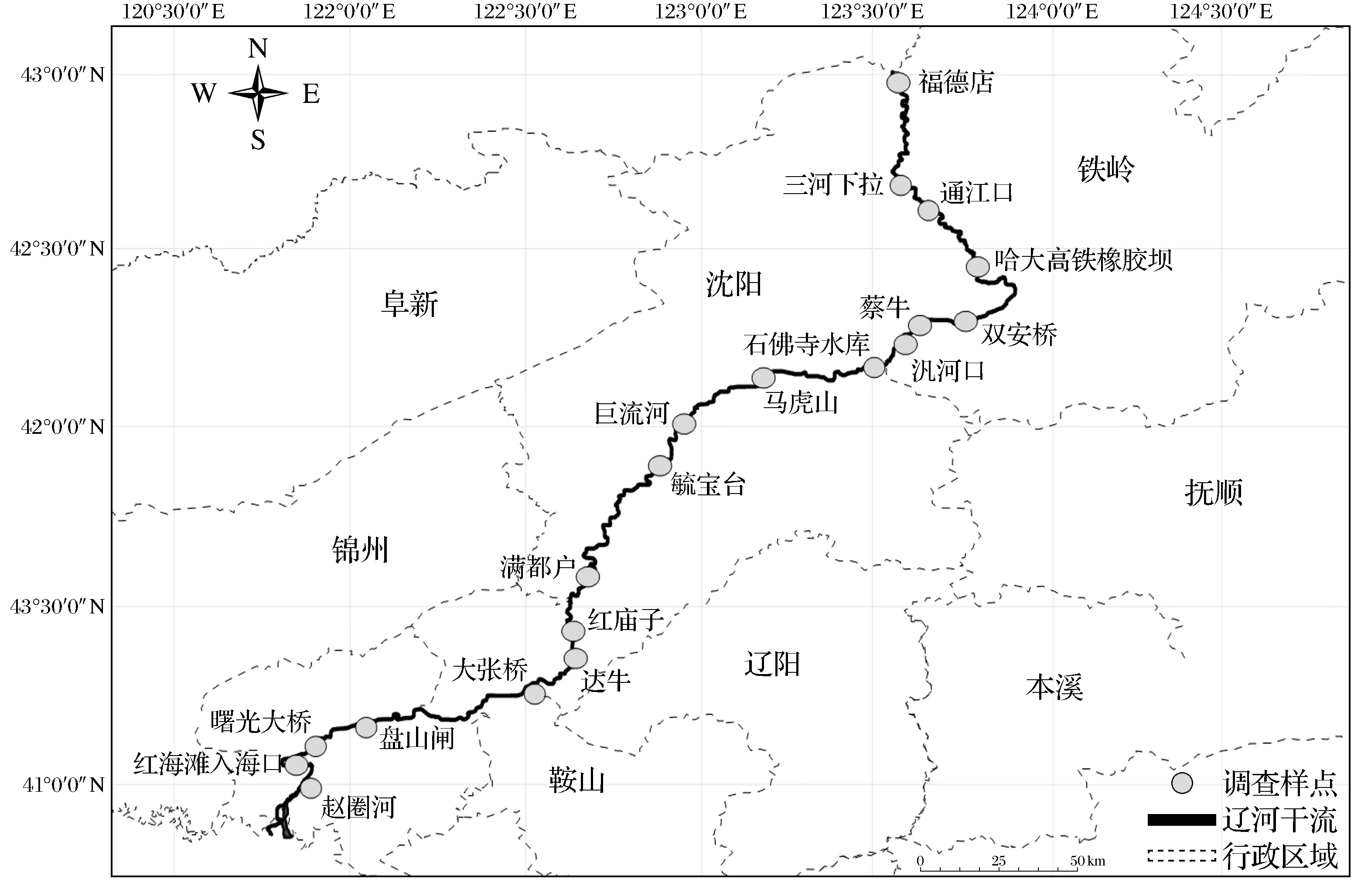
图1 辽河保护区河岸带采样点位分布图
土壤样品采集的采集时间为2015年7月,为植物生长旺盛期.土壤样品按梅花取样法距河岸边缘处10~20 m进行采集,采样深度为0~20 cm.每个采样点等量采取5个样品进行混合,混合后的样品按四分法取出一个土壤样品,标记后放入无菌塑封袋中.将土样带回试验室后,去掉植物根系和碎片等侵入体,过2 mm筛后混合均匀,分成两份,一份放置于-20 ℃冰箱用于土壤DNA 的提取,另一份用于土壤理化性质的测定.
1.2 样品分析测试
(1) 微生物DNA 的提取.采用E.Z.N.ATM Soil DNA Kit试剂盒(Omega)方法,取0.5 g土壤样品,按照试剂盒上的说明步骤将土壤样品中的总DNA提取出来,提取到的总DNA用1%的琼脂糖凝胶电泳检测.
(2) PCR-DGGE 的引物序列、反应体系和反应条件.本实验扩增区域为细菌16SrDNA的V3区,选用的上游引物P1为GC-338f和下游引物P2为518R,直接对总DNA进行PCR扩增[8].
① PCR引物序列:
GC-338f:5′-GCclamp-CCT ACG GGA GGC AGC AG-3′
518R:5′-ATT ACC GCG GCT GCT GG-3′
GC-clamp:5′-CGC CCG CCG CGC GCG GCG GGC GGG GCG GGG GCA CGG GGG G-3′
② PCR反应体系:50 μL的PCR反应溶液的配置(见表1).
③ PCR反应条件:94 ℃预变性5 min;94 ℃变性1 min,65 ℃退火1 min(每个循环降低1 ℃),72 ℃延伸1 min,一共10个循环;然后94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min;35个循环最后72 ℃伸长10 min.降温到4 ℃立即使用或存放在冰箱中待用.

表1 PCR反应溶液的配置
④ PCR产物的检测
用2%琼脂糖凝胶进行检测,凝胶的制作方法和电泳条件与DNA的检测一致,在凝胶成像系统上观察各样品电泳条带的亮度和分布情况,最后照相并保存图像.
(3) DGGE 凝胶电泳.经过多次的优化操作, 实验确定本次DGGE实验的基本条件为电压150 V,电泳7.5 h, 变性剂梯度范围35%~65%. 将 PCR产物与上样缓冲液按照1∶1混合, 用微量注射器加入到凝胶孔中, 每个凝胶孔中加入50 μL混合后的样品; 连接电源打开加热电源和水泵电源, 使样品在60 ℃的缓冲液与150 V的电压中, 电泳7 h.电泳结束后, 在1×TAE缓冲液中卸下凝胶, 然后将凝胶放入到与少量EB混合后的1×TAE缓冲液中, 使凝胶染色时间为30 min[9],再将染好色的凝胶放到凝胶成像系统的样品台上, 最后用Quantity One软件(Bio-Rad)对DGGE图谱进行观察电泳条带亮度和分布,并拍照保存. 以便于后续数字化处理和分析, 评估不同样品中微生物群落的多样性指数和丰富度.
1.3 数据处理
应用图像分析软件Quantity One (Bio-Rad)对DGGE图像进行处理,然后对各群落采用Shannon-Wiener多样性指数(H) 、丰富度指数(S)和Pielou均匀度指数(J)来评价辽河保护区河岸带土壤中微生物的多样性[10].
它们的计算公式如下:
(1)
(2)
式中:S为每个样品的条带数目;ni为第i种种群的个体数;N为种群中的个体总数,个体数用波峰面积表示.
所有实验数据采用Microsoft Excel 2007和SPSS 19. 0进行计算和统计分析.
2 结果与讨论
2.1 PCR-GGE 指纹图谱分析
PCR-GGE指纹图谱能分离长度相同而序列不同DNA片段,从图谱中可以分辨出数目不等、位置各异的电泳条带,不同的条带代表不同的细菌16SrDNA V3区基因片段,条带数越多,说明生物多样性越丰富;条带染色后的荧光强度反映该细菌的丰富度,条带信号越亮,表示该菌属的数量越多[11].
按照仪器设备条件,对保护区的土壤样品分为两组进行DNA提取和PCR扩增,并对扩增产物进行DGGE凝胶成像,形成DGGE指纹图谱.图2和图3为保护区土壤样品DGGE图谱.从DGGE指纹图谱可以看出,图谱中很多条带稳定存在于所有的DGGE泳道中,说明了它们代表的微生物群落广泛存在于辽河保护区河岸带土壤中.
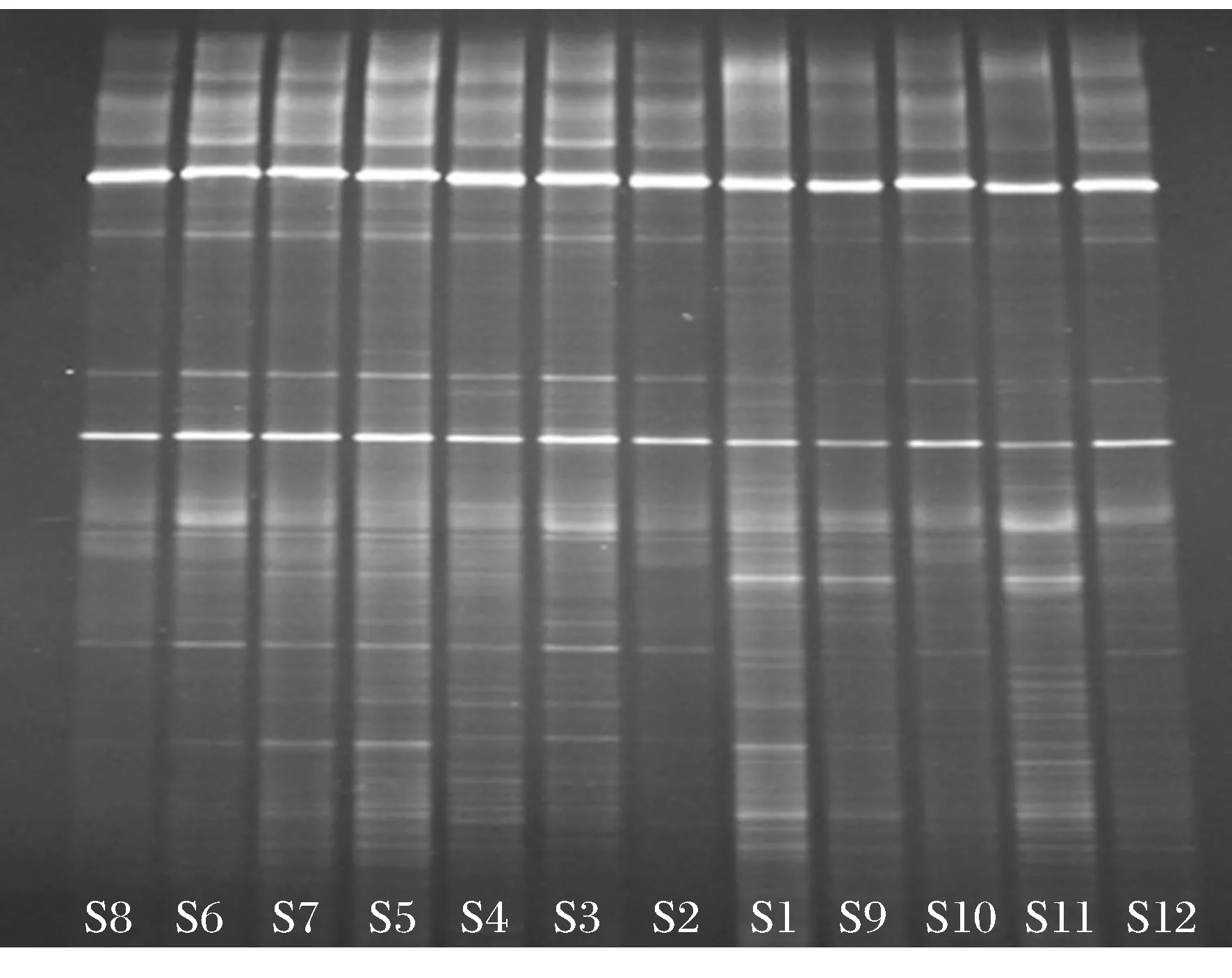
图2 保护区土壤样品DGGE图谱
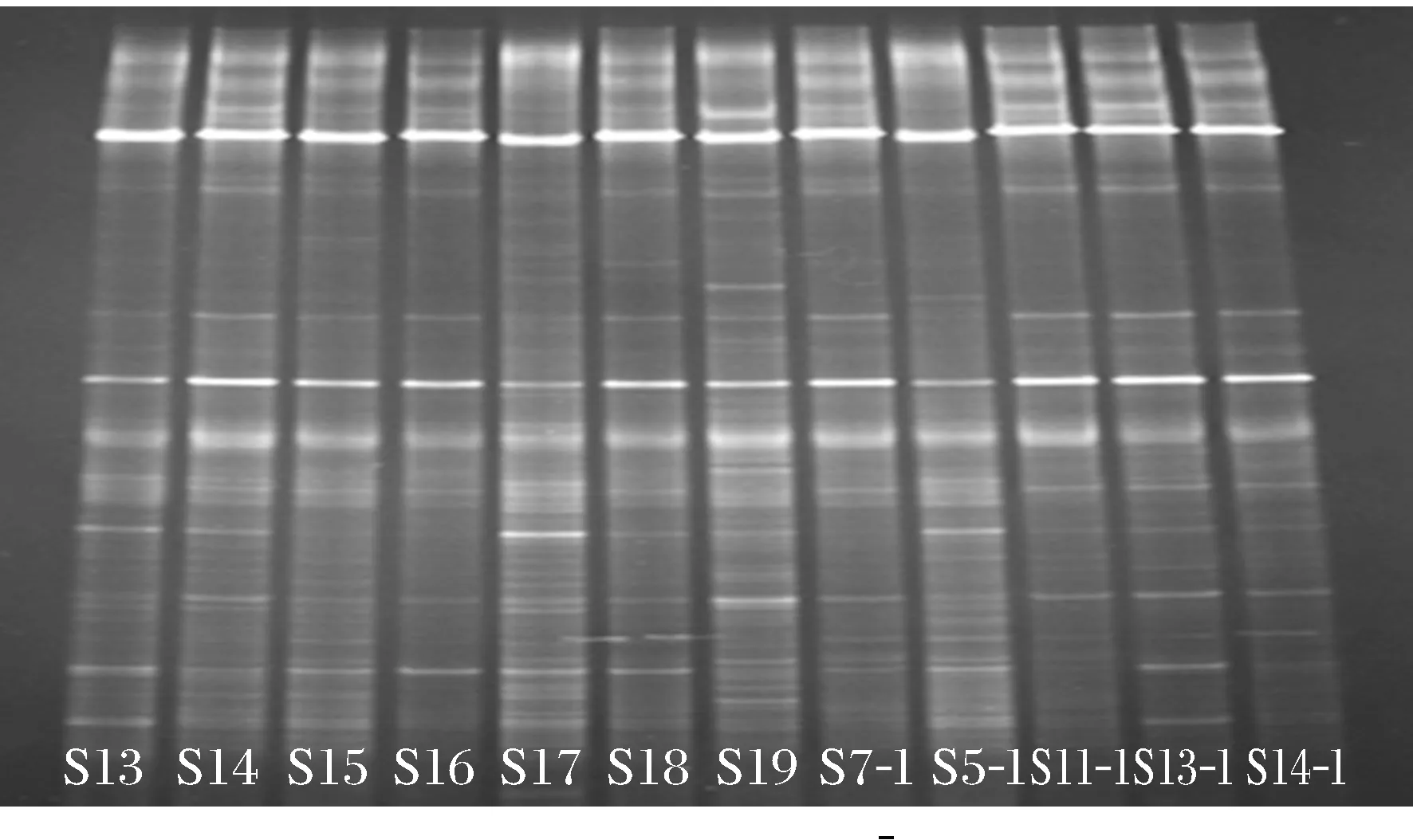
图3 保护区土壤样品DGGE图谱
2.2 辽河保护区河岸带微生物群落结构多样性
多样性指数(Shannon-Wiener)是衡量生态系统物种多样性的一个经典指标,它可反映种群内及种群之间的遗传多样性的分布和差异,一般来讲,Shannon-Wiener指数越高,生态系统的物种越丰富,生态系统越稳定,其维持、繁衍和保护物种多样性的能力越强.物种均匀度指数是指一个群落或生境中全部物种个体数目的分配状况.反映的是各个物种个体数目分配的均匀程度.用Pielou均匀度指数(J)来衡量微生物分布均匀程度,指数越大微生物在群落中的分布越均匀[12-14].
用Quantity One软件对两组DGGE图谱进行定量分析,并计算了辽河保护区土壤微生物群落的Shannon-Wiener指数、Pielou均匀度指数和丰富度指数,结果见图4~图6.
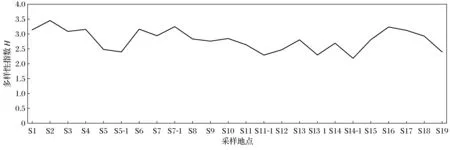
图4 辽河保护区河岸带土壤微生物群落多样性指数
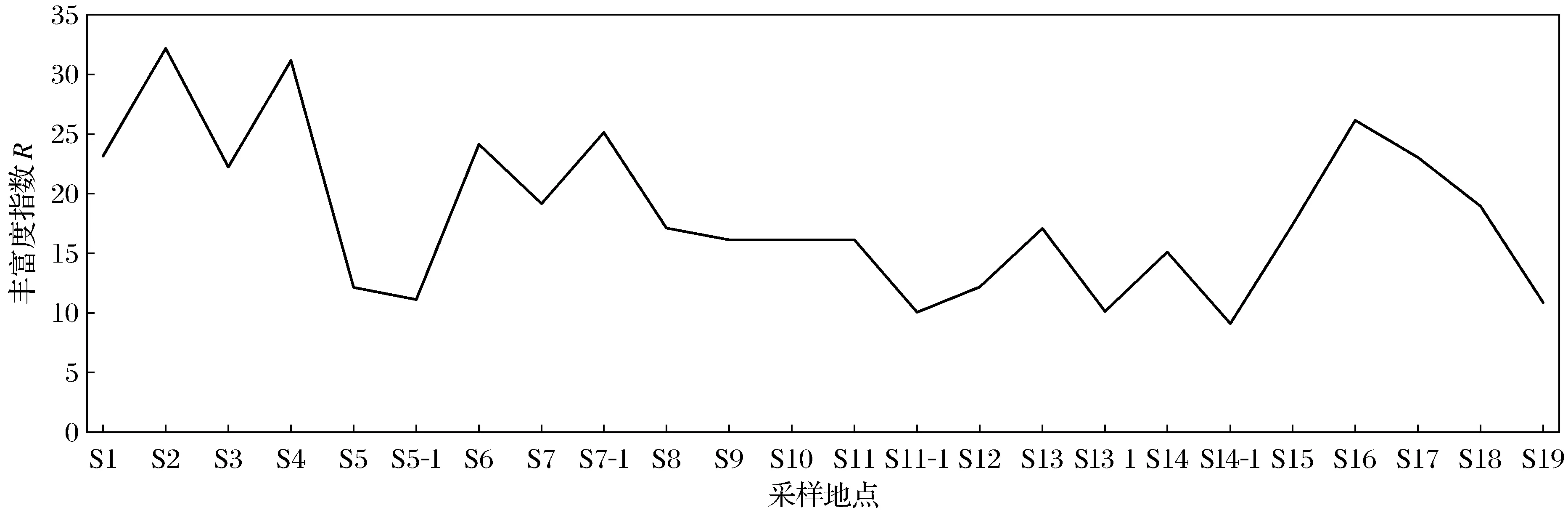
图5 辽河保护区河岸带土壤微生物群落丰富度
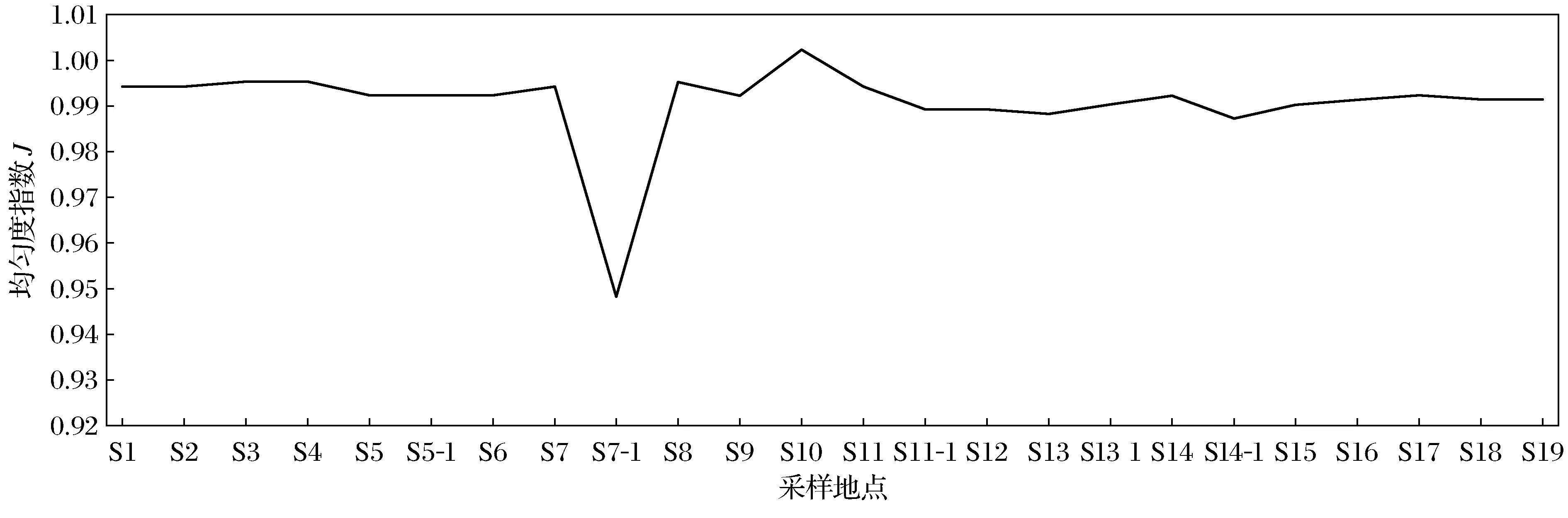
图6 辽河保护区河岸带土壤微生物群落均匀度指数
从图4可以看出,从保护区上游到下游土壤微生物多样性指数呈波动性变化.福德店(S1)、三河下拉(S2)、通江口(S3)、哈大高铁橡胶坝(S4)、汎河口(S6)、马虎山(S9)、盘山闸(S16)、曙光(S17)采样点土壤的微生物多样性指数较高(大于3.0),表明这些点位处土壤微生物种类丰富,生态系统稳定性较好;在双安桥(S5)、满都户(S12)、赵圈河(S19)采样点多样性指数偏低,都小于2.5,表明这些采样点位处微生物种类丰富度相对较低,生态系统稳定性稍差;其他采样点土壤微生物多样性指数在2.5~3.0之间,表明这些点位土壤微生物种类丰富度居中,生态系统稳定性一般.
从图5可以看出,保护区上游的土壤微生物的丰富度指数最大,为22~32,平均为27,最高点为三河下拉(S2)和哈达高铁橡胶坝(S4),说明上游土壤微生物多样性丰富度较高;保护区下游和中上游的土壤DGGE丰富度指数相近,分别为11~26和10~25,平均值分别为19.2和16.6,表明保护区下游和中上游地区土壤微生物多样性丰富度相近;保护区中下游的土壤DGGE丰富度指数最低,为9~17,平均为12.6,表明保护区中下游的土壤微生物多样性丰富度最低.
从图6可以看出,除巨流河(S10)点位土壤微生物的均匀度指数略偏高,蔡牛(S7-1)点位土壤微生物的均匀度指数偏低外,保护区其他点位土壤微生物的均匀度指数相近,在1左右,说明保护区各采样点微生物群落分配均匀程度相近.蔡牛(S7-1)点位由于大豆的种植,使植物根系固氮菌落显著增加,影响了土壤根际微生物的分布,导致均匀度偏低.
2.3 土壤微生物群落结构多样性影响因素分析
影响土壤微生物群落结构多样性的因素较多,主要有土壤湿度、pH值、有机质等理化性质,土壤N、P等营养元素含量与可利用形态,土壤污染性质与强化,以及土地利用方式、利用强度等人类活动.
对微生物多样性指数,丰富度,均匀度指数与土壤的理化性质,进行相关性分析(见表2),结果表明,微生物多样性指数与丰富度与土壤水分含量呈显著正相关.Joshua等[15]研究了桦树凋落物分解过程中湿度对微生物活性和群落结构的影响,发现土壤渍水或干旱都会引起土壤微生物数量的变化,干燥的土壤会导致微生物量减少,微生物群落结构发生变化;土壤湿度高,植物代谢旺盛,向土壤中释放一些根际分泌物而刺激微生物繁殖,使土壤微生物数量增加;微生物多样性指数与土壤有机质和黏粒含量呈显著性正相关,可能是由于土壤微生物的营养主要来源于植物残体,在有机质丰富的土壤中,微生物数量相应偏多,而在缺乏有机质的土壤中其数量较少;土壤黏粒含量会通过对土壤通气性、保水性的影响而使微生物群落结构发生变化,土壤黏粒含量越高,土壤空隙就会越小,土壤保水性就会增强,土壤湿度发生变化进而影响到土壤中微生物的群落多样性发生变化.
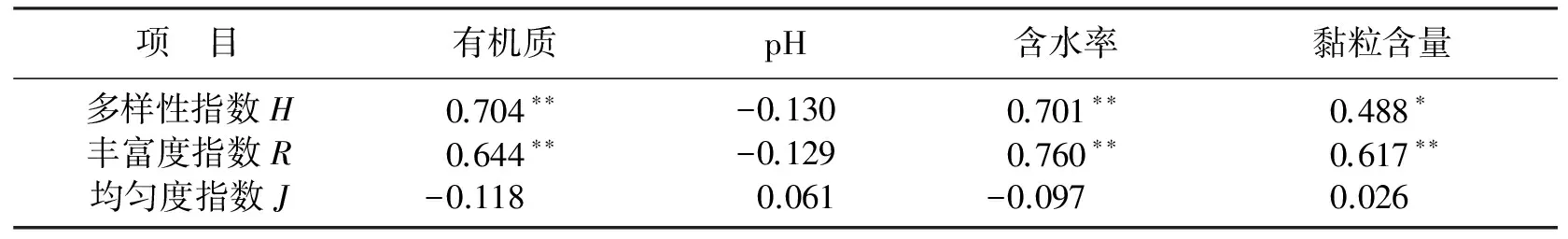
表2 土壤微生物多样性指数、丰富度、均匀度指数和土壤理化性质的相关性分析
注:数值为Pearson相关性指数;**为在0.01水平(双侧)上显著相关;*为在0.05水平(双侧)上显著相关.
人类活动是影响土壤微生物多样性的主要因素之一.其中,土地利用方式不同,会影响土壤理化性质而引起土壤微生物生长环境的变化.对辽河保护区河岸带同一采样点不同种植作物的土壤进行比较,发现种植玉米和向日葵的土壤微生物多样性都比非耕地土的多样性指数降低.实验表明,保护区河岸带中上游双安桥(S5)、中下游毓宝台(S11)、红庙子(S13-1)、达牛(S14-1)采样点处玉米、向日葵土壤中微生物多样性指数均小于同一采样点草地土微生物多样性指数(HS52.465>HS5-12.378,HS112.629>HS11-12.279,HS132.798>HS13-12.279,HS143.685>HS14-12.169).研究表明不同土地利用类型会导致土壤微生物数量、组成及活性在某种程度上存在着较大差别,进而使土壤微生物群落结构和功能发生改变.土壤由于玉米、向日葵的种植,影响了其理化性质、物理结构、根系分泌物等因素,导致土壤微生物量下降[16],进而影响了微生物的多样性.
不同作物的种植对土壤微生物群落的影响也有所不同[17],研究发现大豆土壤微生物多样性指数高于同一采样点非耕地土(HS7-13.239>HS72.925),同时高于不同采样点的玉米土和向日葵土(HS7-1>HS5-1>HS11-1>HS14-1),由于大豆植物根际分泌物和一些落叶等植物残体进入土壤中,与土壤中的微生物发生相互作用,使植物根系固氮菌落显著增加,提高了微生物群落的多样性.
植被种类与数量的不同,可以通过影响土壤的含水量、温度、pH值、有机质等因素从而改变土壤的微生物群落结构.调查发现,河岸带上游人类活动较少,植被类型多样且极为丰富,植被的凋落物较为丰富且易于分解,因而微生物种类较多,微生物多样性指数和丰富度较高;河岸带中下游处于人口密集区,建在河岸带周围的渡口、橡胶坝、公园等设施增加了人类活动对生态系统中的植物多样性的影响.
3 结 论
土壤微生物作为河岸带土壤生态系统重要组成部分,微生物的个体小、数量多、繁殖快,在物质循环中起关键作用.同时,土壤微生物对环境变化较为敏感,因此能够较好的指示生态系统功能发生的变化.河岸带微生物群落结构多样性的研究,对于维持土壤生态系统稳定健康发展具有重要的作用.本研究在辽河保护区河岸带上游到下游设定19个草地土壤采样站位和5个种植不同作物的耕地土壤采样站位, 采用PCR-DGGE技术对土壤微生物群落结构进行了比较分析,应用图像分析软件Quantity One (Bio-Rad)对微生物群落结构的多样性进行定量分析,研究结果表明:辽河保护区河岸带各样点土壤微生物多样性指数(H)、丰富度指数(R)和均匀度指数(J)均有所不同,从上游到下游土壤的微生物多样性指数呈波动性变化,中上游、下游的土壤微生物多样性指数较高,中下游土壤微生物多样性指数偏低.玉米土壤微生物多样性指数和丰富度小于草地土壤,大豆土壤微生物多样性指数和丰富度大于种植玉米地和种植向日葵地的土壤多样性指数和丰富度.
辽河保护区土壤的群落结构变化是多种环境因子共同作用的结果,其中土壤湿度、pH值、有机质等理化性质和人类活动是影响土壤微生物多样性的主要因素,人类的活动影响植被的种类和数量,而植被可以通过影响土壤的含水量、pH值、有机质、氮磷含量等因素从而改变土壤的微生物群落结构[18].高质量的土壤应该具有稳定的微生物群落结构和组成、高的微生物数量及良好的微生物活性.由于草地土壤微生物丰富度和多样性指数较高,土壤质量高,是辽河保护区河岸带发展的很好的生态形式,而种植玉米和向日葵的土壤质量较低,而且由于施肥会污染河岸带的水体,不适合作为河岸带的植被类型,因此应减少对河岸带植被的人为扰动.
[ 1 ] 孔涛,吴祥云,赵雪淞,等. 浑河上游河岸带土壤微生物数量及酶活性特征[J]. 水土保持通报, 2014,34(1):123-128 (KONG T,WU X Y,ZHAO X X,et al. Soil microbial quantity and soil enzyme activity characteristics of riparian zone in upper reaches of Hunhe River[J]. Bulletin of Soil and Water Conservation, 2014,34(1):123-128.)
[ 2 ] PANKHURST C E,OPHEL-KELLER K,DOUBE B M,et al. Biodiversity of soil microbial communities in agricultural systems[J]. Biodiversity and Conservation, 1996,5(2):197-209.
[ 3 ] 赵兴青,杨柳燕,陈灿,等. PCR-DGGE技术用于湖泊沉积物中微生物群落结构多样性研究[J]. 生态学报, 2006,26(11):3610-3616. (ZHAO X Q,YANG L Y,CHEN C,et al. Study on the microbial diversity in lake sediments by the method of PCR-DGGE[J]. Acta Ecologica Sinica, 2006,26(11):3610-3616.)
[ 4 ] DOUTERELO I,GOULDER R,LILLIE M. Soil microbial community response to land-management and depth, related to the degradation of organic matter in English wetlands:implications for the in situ preservation of archaeological remains[J]. Applied Soil Ecology, 2010,44(3).
[ 5 ] 车玉伶,王慧,胡洪营,等. 微生物群落结构和多样性解析技术研究进展[J]. 生态环境, 2005,14(1):127-133. (CHE Y L,WANG H,HU H Y,et al. Research progresses on analytical technologies used in microbial community structure and diversity[J]. Ecology and Environment, 2005,14(1):127-133.
[ 6 ] 张鸿龄,郭鑫,孙丽娜. 辽河保护区河岸带自然生境恢复现状[J]. 沈阳大学学报(自然科学版), 2016,28(2):98-104. (ZHANG H L,GUO X,SUN L N. Status of natural habitat restoration of riparian zone in Liaohe River conservation area[J]. Journal of Shenyang University (Natural Science), 2016,28(2):98-104.)
[ 7 ] 张远,徐成斌,马溪平,等. 辽河流域河流底栖动物完整性评价指标与标准[J]. 环境科学学报, 2007,27(6):919-927. (ZHANG Y,XU C B,MA X P,et al. Biotic integrity index and criteria of benthic organisms in Liao River Basin[J]. Acta Scientiae Circumstantiae, 2007,27(6):919-927.)
[ 8 ] 王芸,韩宾,史忠强,等. 保护性耕作对土壤微生物特性及酶活性的影响[J]. 水土保持学报, 2006,20(4):120-122,142. (WANG Y,HAN B,SHI Z Q,et al. Conservation tillage on soil microbial characteristics and the influence of the enzyme activity[J]. Journal of Soil and Water Conservation, 2006,20(4):120-122,142.)
[ 9 ] YU Z,MORRISON M. Comparisons of different hypervariable regions of rrs genes for use in fingerprinting of microbial communities by PCR-Denaturing gradient gel electrophoresis[J]. Applied Environmental Microbiology, 2004,70(8):4800-4806.
[10] BELL T,AGER D,SONG J I, et al. Larger islands house more bacterial taxa[J]. Science, 2005,308(5730):1884.
[11] 蒋建文,林文辉,王亚军,等. 应用DGGE技术比较池塘人工生物膜与水体微生物多样性差异[J]. 安徽农业科学, 2008,36(21):8956-8959. (JIANG J W,LIN W J,WANG Y J,et al. Using DGGE technology more artificial biological membrane and water pond microbial diversity[J]. Journal of Anhui Agricultural Sciences, 2008,36(21):8956-8959.
[12] CALHEIROS C,DUQUE A,MOURA A,et al. Substrate effect on bacterial communities from constructed wetlands planted with Typha latifolia treating[J]. Ecological Engineering, 2009,35:744-753.
[13] 刘慧杰,杨彩云,田蕴,等. 基于PCR-DGGE技术的红树林区微生物群落结构[J]. 微生物学报, 2010,50(7):923-930. (LIU H J,YANG C Y,TIAN Y,et al. Analysis of microbial community structure in mangrove sediments by PCR-DGGE technique[J]. Acta Microbiologica Sinica, 2010,50(7):923-930.
[14] 尹宁宁,王丽萍,何士龙,等. 辽河口湿地生态修复过程中土壤微生物群落结构特征[J]. 河北师范大学学报(自然科学版), 2014,38(2):196-199. (YIN N N,WANG L P,HE S L,et al. Characteristics of soil microbial community structure in the process ecological restoration of Liaohe estuary wetland[J]. Journal of Hebei Normal University(Natural Science), 2014,38(2):196-199.)
[15] JOSHUA P S,JAY M G,JOY S C C,et al. Moisture effects on microbial activity and community structure in decomposing birch litter in the Alaskan taiga[J]. Soil Biol Biochem, 1999,31(6):831-838.
[16] 郑诗樟,肖青亮,吴蔚东,等. 丘陵红壤不同人工林型土壤微生物类群、酶活性与土壤理化性状关系的研究[J]. 中国生态农业学报, 2008,16(1):57-61. (ZHENG S Z,XIAO Q L,WU W D,et al. Relationship among microbial groups enzyme activity and physic-chemical properties under different artificial forestry in hilly red soil[J]. Chinese Journal of Eco-Agriculture, 2008,16(1):57-61.
[17] BRONWN D H,RAYMOND L C. Using the gini coefficient with biologsubstrate utilization data to provide an alternative quantitative measure for comparing bacterial soil communities[J]. Journal of Microbiological Methods, 1997,30:91-101.
[18] 刘丽,段争虎,汪思龙,等. 不同发育阶段杉木人工林对土壤微生物群落结构的影响[J]. 生态学杂志, 2009,28(12):2417-2423. (LIU L,DUAN Z H,WANG S L,et al. Effects of Cunninghamia lanceolata plantations at different developmental stages microbial community structure[J]. Chinese Journal of Ecology, 2009,28(12):2417-2423.)
【责任编辑: 胡天慧】
Soil Microbial Community Structure Characteristics of Riparian Zone in Liaohe River Conservation Area
GuoNa1,SunLina1,MengYue1,SunJiajun2,ChenZongcong1
(1. Key Laboratory of Regional Environment and Eco-Remediation (Ministry of Education), Shenyang University, Shenyang 110044, China; 2. Beijing Sander Environmental Engineering Co., Ltd., Beijing 101102, China)
To research the soil microbial community structure characteristics of riparian zone in Liaohe River conservation area, with PCR-DGGE, riparian zone in Liaohe River conservation area on the upstream, middle and lower reaches of several different soil microbial community structure characteristics were studied. The result indicates that soil microbial diversity index (H), richness (R) and evenness index (J) of riparian zone in Liaohe River conservation area are different at each sampling point, the soil microbial diversity is volatility changed from the upstream to the downstream, corn and sunflower soil microbial diversity index is lower than the grassland soil microbial diversity index, soybean soil microbial diversity index is higher than the meadow soil diversity index. The soil microbial community structure change of Liaohe River conservation area is the outcome of a variety of environmental factors work together, in which human activities affected by changing vegetation species diversity of soil physical and chemical properties, and then change the microbial community structure characteristics, influence the stability of ecosystem.
soil; microbial community structure; PCR-DGGE; riparian zone
2016-08-16
国家科技重大专项课题资助项目(2012ZX07202-004); 中华环境保护基金会格平绿色行动-辽宁环境科研“123工程”资助项目(CEPF2014-123-2-3).
郭 娜(1991-),女,辽宁朝阳人,沈阳大学硕士研究生; 孙丽娜(1960-),女,辽宁北票人,沈阳大学教授,博士生导师.
2095-5456(2016)06-0457-07
Q 938
A
