壳寡糖对大肠杆菌抑菌活性研究
2017-01-09钱建瑛丁振中朱玉霞史劲松
钱建瑛, 丁振中, 朱玉霞, 李 恒, 史劲松*
1江南大学药学院,江苏无锡 214122; 2扬州日兴生物科技股份有限公司,江苏扬州 225601
壳寡糖对大肠杆菌抑菌活性研究
钱建瑛1, 丁振中2, 朱玉霞1, 李 恒1, 史劲松1*
1江南大学药学院,江苏无锡 214122; 2扬州日兴生物科技股份有限公司,江苏扬州 225601
分析壳寡糖对大肠杆菌抑菌效果的影响因素。采用摇瓶法和ELISA板法对不同浓度的壳寡糖进行抑菌试验;比较不同pH、不同脱乙酰度的壳寡糖对大肠杆菌抑菌效果的差异;比较不同聚合度的单一聚合度壳寡糖抑菌效果的差异。 壳寡糖浓度大于5 mg/mL时抑菌效果与同浓度苯甲酸钠相近; pH为4时,0.156 mg/mL的壳寡糖溶液抑菌活性即能超过90%;pH为7时,5 mg/mL的壳寡糖才能达到90%抑菌活性。脱乙酰度为95%时,5 mg/mL的壳寡糖溶液抑菌活性能超过97%;脱乙酰度为45%时,40 mg/mL的壳寡糖溶液抑菌活性仅有56%;聚合度大于4的单一聚合度壳寡糖40 mg/mL时抑菌活性能达到99%。结果表明:提高壳寡糖溶液浓度、降低pH、提高脱乙酰度,能提高壳寡糖的抑菌活性,单一聚合度壳寡糖聚合度越高,对大肠杆菌的抑制作用越强。此外,采用ELISA板的方法进行实验,即节省试药又方便快捷。
壳寡糖; 单体; 抑菌活性
壳寡糖(Chitosan oligosaccharide,COS)也称几丁寡糖,学名β-1,4-寡糖-葡萄糖胺,是壳聚糖经物理、化学或酶降解而成的水溶性好、生物活性高、聚合度为2~10的低分子量壳聚糖[1]。壳寡糖是自然界中唯一含有正电荷的碱性氨基寡糖,绿色天然、无副作用,作为一类新的生理活性物质,除了具有增强免疫、抗肿瘤抗癌、降低胆固醇、降血压、降血糖、加速体内钙和铁的吸收以及关节组织的修复等功能外[2],还具有防腐抑菌等作用,且抑菌作用较壳聚糖更强[3],这也是壳寡糖区别于其他寡糖的重要特征。
近年来壳寡糖的抑菌特性受到国内外研究者的关注,以壳寡糖作为食品防腐剂和保鲜剂,对延长食品保质期、减少化学防腐剂的使用具有积极意义,因其天然、安全和优良的生物相容性,其潜在的应用领域包括食品、乳制品、饮料以及冷链环境下的水产、畜禽肉制品的保鲜[4-5]。壳寡糖的抑菌活性不仅与壳寡糖的分子量、溶液的pH值、壳寡糖的乙酰化程度有关,还与壳寡糖的特定分子结构、制备方法及菌种等有关[6]。夏文水等[7]比较了分子量分别为1 500、3 000、5 000、8 000的4种壳寡糖对大肠杆菌的抑菌活性,发现分子量为1 500的壳寡糖抑菌效果最强,且随着分子量上升抑菌效果逐渐下降。而Jeon等[8]比较了高、中、低三种分子量的壳寡糖对四种革兰阴性菌(E.coli,E.coliO-157,Salmonellatyphi,Pseudomonasaeruginosa)、五种革兰阳性菌(Streptococcusmutans,Micrococcusluteus,S.aureus,Staphylococcusepidermidis,Bacillussubtilis)和四种乳酸菌(Lactobacillusbulgaricus,Lactobacilluscasei,Lactobacillusfermentum,Streptococcusfaecalis)的抑菌活性,得出高分子量的壳寡糖抑菌效果更好,指出相对分子量是壳寡糖抑制微生物生长的最重要因素。陈建国[9]研究认为,抑菌效果因壳聚糖酶的酶切方式、壳寡糖的质量浓度和供试菌种而异,由壳聚糖内切酶降解制备的数均分子质量为3 726的壳寡糖对几种植物病原菌的抑菌效果明显优于由混合酶降解制备的数均分子质量为2 133的壳寡糖,由壳聚糖外切酶降解制备的壳寡糖分子量较小基本没有抑菌活性。Seyfarth等[10]研究了脱乙酰度为84%和52%的壳寡糖溶液对蜡样芽胞杆菌(B.cereus),大肠杆菌(E.coli),沙门氏菌(salmonella)和三个脂多糖突变的大肠杆菌和沙门氏菌的抑制作用,通过细胞膜的完整性检测发现,脱乙酰度为84%的壳寡糖的比脱乙酰度为52%的壳寡糖抑菌效果好。不同聚合度的壳寡糖分子量分布不同,生产方法不同,抑菌效果差异极大,在评价寡糖抑菌性能方面,不能单纯以分子量、脱乙酰度、pH等因素来衡量壳寡糖的活性,其抑菌的浓度也随壳寡糖本身的性质及菌种的种类而不同,不能做统一定论。为了方便动态观察壳寡糖的抑菌效果,本实验采用了在ELISA板中对大肠杆菌进行抑菌试验的方法,将其与传统的摇瓶法进行了比较,并将不同pH、不同脱乙酰度的壳寡糖抑菌活性进行了比较,将自制的单一聚合度壳寡糖进行结构验证后分别进行抑菌试验,能够全面表征壳寡糖对大肠杆菌的抑菌活性。
1 材料与方法
1.1 材料与试剂
壳寡糖:脱乙酰度> 95%,平均分子量700左右,淮海工学院制备并提供;氨基葡萄糖:sigma公司;聚丙烯酰胺凝胶(Bio-Gel P-2):美国 Bio-Rad 公司;FPT015型ELISA板:碧云天生物技术研究所;胰蛋白胨、酵母浸膏:分析纯,上海生工生物工程有限公司;苯甲酸钠、琼脂:生化试剂,国药集团化学试剂有限公司;氢氧化钠、盐酸、氯化钠、吡啶、乙酸、乙酸酐、氨水、无水乙醇等均为分析纯:国药集团化学试剂有限公司;乙腈:色谱纯,国药集团化学试剂有限公司;大肠杆菌菌种由江南大学药学院提供。
1.2 仪器与设备
Waters Acquity 超高效液相色谱仪,SYNAPT QTOF MS(配有电喷雾电离源,ESI)质谱仪:美国Waters公司;Ascent 酶标仪:赛默飞世尔科技公司;玻璃层析柱(1 500 mm×25 mm):苏州科盛实验设备有限公司;BSZ-30自动部分收集器:上海沪西分析仪器有限公司;FD-ID冷冻干燥机:北京博医康实验仪器有限公司;旋转蒸发器RE-52A:上海亚荣生化仪器厂;高压灭菌锅MLS-3020CH:上海涵今仪器仪表有限公司;超净工作台:上海华线医用核子仪器厂;EL 204电子天平:梅特勒-托利多仪器有限公司;SPX-100B-Z型生化培养箱:上海博迅实业有限公司医疗设备厂。
1.3 方法
1.3.1 摇瓶法与ELISA板法测定壳寡糖抑菌活性的比较
(1)摇瓶法[11]
称取一定量的壳寡糖溶解于LB液体培养基中,配成pH为5、质量浓度为10 g/L、5 g/L、2.5 g/L、1.25 g/L和0.625 g/L的含壳寡糖的培养基,加入摇瓶中,然后加入0.1 mL活化好的大肠杆菌的菌悬液(菌浓度为1×108CFU/mL),以5 mg/mL苯甲酸钠溶液为阳性对照,同时设置一个空白对照,试验组每个浓度、阳性对照和空白对照均平行设置3瓶,37 ℃、150 r/min培养,每隔2 h取样测定其在630 nm下的吸光度值。以取样时间为横坐标,每次测定的吸光度平均值与0点时的吸光值的差值为纵坐标绘制壳寡糖对大肠杆菌的抑制曲线。
(2)ELISA板法
在ELISA板中每孔加入pH 5的LB液体培养基170 μL,10 μL大肠杆菌菌悬液(菌浓度为1×108cfu/mL),并加入20 μL不同浓度的壳寡糖溶液使壳寡糖的终浓度为10 mg/mL、5 mg/mL、2.5 mg/mL、1.25 mg/mL和0.625 mg/mL,以5 mg/mL苯甲酸钠溶液为阳性对照,同时设置一个空白对照,试验组每个浓度、阳性对照和空白对照均平行设置3个孔,37 ℃培养,每隔2 h测定其在630 nm下的吸光度值,结果取平均数。以时间为横坐标,每个时间点的吸光度平均值与0点时的吸光度值之差为纵坐标绘制壳寡糖对大肠杆菌的抑制曲线。
根据以下公式(1)计算抑菌活性[12]:
(1)
U:抑菌活性;
A0:空白对照测得的吸光度平均值;
A:试验组测得的吸光度平均值,当A>A0时,不计算抑菌活性。
1.3.2 不同pH下壳寡糖对大肠杆菌的抑菌活性测定
在ELISA板中每孔加入10 μL大肠杆菌菌悬液(菌浓度为1×108CFU/mL)、190 μL pH分别为4、5、6和7的含有壳寡糖(脱乙酰度为95%)的LB液体培养基,使壳寡糖溶液的终浓度为40 mg/mL、20 mg/mL、10 mg/mL、5 mg/mL、2.5 mg/mL、1.25 mg/mL、0.625 mg/mL、0.316 5 mg/mL、0.156 4 mg/mL和0.078 2 mg/mL,以5 mg/mL苯甲酸钠溶液为阳性对照,同时设置一个空白对照,试验组每个浓度、阳性对照和空白对照均平行设置3个孔,37 ℃培养24 h,测定其在630 nm的吸光度值,结果取平均数。按公式(1)计算不同pH条件下,不同浓度壳寡糖溶液对大肠杆菌的抑菌活性。
1.3.3 不同脱乙酰度壳寡糖对大肠杆菌的抑菌效果观察
称取一定量的壳寡糖溶于水中配成质量浓度为0.1 g/mL的水溶液,用甲醇钠调节pH为9,加入一定量的乙酸酐,室温下反应3 h~5 h,透析除去未反应的小分子物质,旋转浓缩,40 ℃真空干燥得不同脱乙酰度壳寡糖样品,用双突跃电位滴定法测定脱乙酰度[13]。制得乙酰化程度为35%和55%的壳寡糖,即脱乙酰度分别为65%和45%的样品,将其与壳寡糖原料即脱乙酰度95%的壳寡糖进行抑菌效果的观察。
抑菌试验方法同1.3.1的ELISA板法,试验组采用不同脱乙酰度的壳寡糖溶液。按公式(1)计算抑菌活性。
1.3.4 单一聚合度壳寡糖的制备及纯度检测方法
将0.5 g壳寡糖溶于10 mL水中,完全溶解后过滤,滤液上样于活化好的Bio-Gel P-2凝胶层析柱中,柱子内径25 mm,柱高1 500 mm,实装凝胶高度为1 200 mm。用双蒸水洗脱,流速为1 mL/min,自动收集器每30 min收集一次[14]。用薄层层析法[15]分析各管中糖的种类,根据层析结果,合并相同的组分,分别旋蒸浓缩,冷冻干燥得单一聚合度壳寡糖。
单一聚合度壳寡糖的检测采用UPLC/MS,分析条件如下[16]:色谱柱:BEH Amide(1.7 μm,2.1 mm×100 mm);样品浓度:1 mg/mL;进样量:1 μL;流动相:乙腈-水,0 min~15 min:80%乙腈-20%乙腈梯度洗脱;流速:0.3 mL/min;柱温:45 ℃。质谱分析采用电喷雾离子源(ESI+),离子源温度:100 ℃;脱溶剂气温度:300 ℃;毛细管电压:3.5 kV;锥脱溶剂气流量:500 L/h;锥孔电压:30 V;锥孔气流量: 50 L/h;四级杆范围m/z:100~1 200;碰撞能量:6 V。
1.3.5 单一聚合度壳寡糖对大肠杆菌的抑菌效果观察
方法同1.3.1的ELISA板法,试验组为纯化后的壳二糖、壳三糖、壳四糖、壳五糖、壳六糖和氨基葡萄糖。按公式(1)计算抑菌活性。
2 结果与分析
2.1 摇瓶法和ELISA板法测定壳寡糖抑菌活性的差别
壳寡糖对大肠杆菌的抑制作用在摇瓶法和ELISA板法上的结果见图1。通过比较吸光度值的大小,来判断微生物生长情况:吸光度值越高,即大肠杆菌生长越旺盛,抑菌活性越差。由图1(A)摇瓶法抑菌曲线可见,当壳寡糖浓度为0.625 mg/mL、1.25 mg/mL和2.5 mg/mL时0 h~4 h内大肠杆菌生长情况与空白对照相差无几,培养时间继续延长后菌体生长才受到一定的抑制,这与闫海侠等[17]采用平板计数大肠杆菌活菌数的结果一致,他们发现0 h~4 h内低浓度壳寡糖试验组活菌数反而比空白对照组多,随着时间的延长,活菌数量才逐渐减少。ELISA板法的结果显示,所有实验组在前12 h均可完全抑制菌体的生长,抑菌效果优于摇瓶法,因为大肠杆菌为好氧菌,摇瓶的供氧条件优于ELISA板,因此大肠杆菌生长更旺盛,抑菌效果不如ELISA板。不管是摇瓶法还是ELISA板法,当壳寡糖浓度大于5 mg/mL时都可完全抑制大肠杆菌的生长,抑菌效果与同浓度苯甲酸钠相近。由此可见抑菌能力随壳寡糖浓度增大而增强,因为壳寡糖分子中存在—NH2基团,随着浓度增加,溶液中—NH2的浓度也增加,从而增强抑菌效果[18]。
ELISA板法和传统的摇瓶法相比,节省试剂试药,操作更简便,无需取样,酶标仪一次可以同一板上所有数据,因此后续实验均采用ELISA板法。
2.2 pH对抑菌效果的影响
从表1中可以看出,pH为4时,各浓度实验组均能有效抑制大肠杆菌的生长,0.078 mg/mL的壳寡糖抑菌活性即可接近90%,这可能与过酸的环境导致菌体不生长或生命力较低,使得壳寡糖对其抑制作用比较明显。而当pH增加到7时,5 mg/mL的壳寡糖才能达到90%的抑菌活性,是前者的64倍。pH增大,壳寡糖生成质子化胺减少,低浓度的实验组没有抑菌效果,反而作为碳源被细菌利用,促进了细菌生长[19-20]。

(A)

(B)
○:空白对照;■:壳寡糖0.625 mg/mL;×:壳寡糖1.25 mg/mL;△:壳寡糖2.5 mg/mL;◇:壳寡糖5 mg/mL;●:壳寡糖10 mg/mL;□:苯甲酸钠5 mg/mL。
(A:摇瓶法;B:ELISA板法)
图1 壳寡糖对大肠杆菌的抑制作用
2.3 脱乙酰度对抑菌效果的影响
从表2中可以看出,脱乙酰度越高,抑菌效果越好。脱乙酰度为95%的壳寡糖浓度极低时就表现出抑菌活性,5 g/L时就可完全抑制大肠杆菌的生长;而脱乙酰度为45%的壳寡糖在浓度为10 mg/mL时才表现出抑菌作用,40 mg/mL也不能完全抑制大肠杆菌的生长,抑菌活性只有56%。因为抑菌作用的发挥,主要是靠游离氨基,脱乙酰度增加,游离氨基含量增加,其抑菌活性越高[21]。

表1 不同pH下各浓度壳寡糖的抑菌活性
注:—表示菌体生长情况超过空白对照,无法计算抑菌活性。
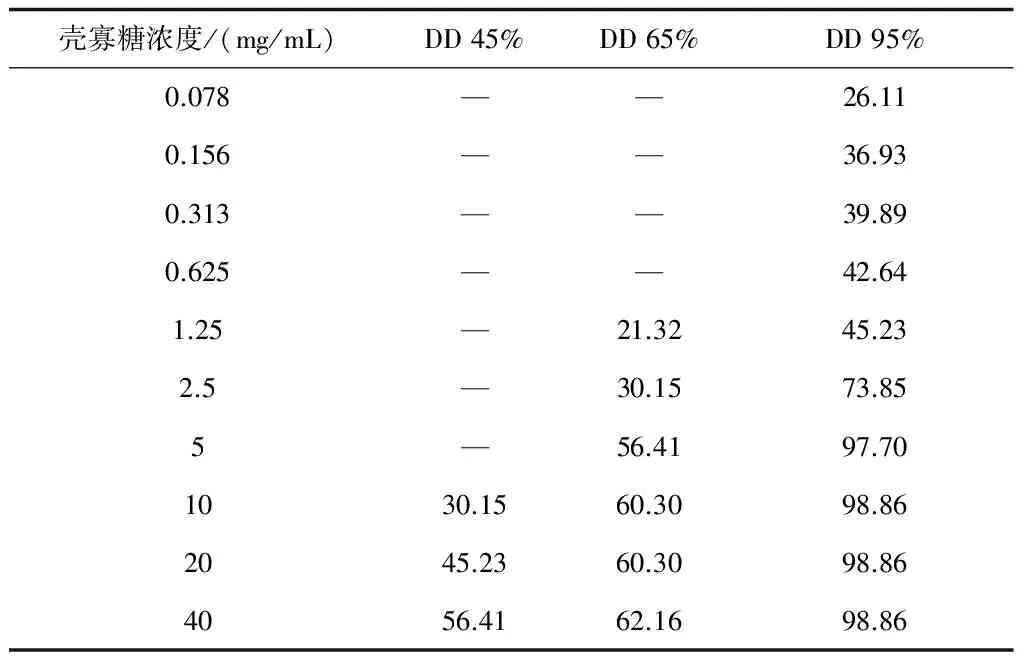
表2 不同脱乙酰度壳寡糖对大肠杆菌的抑制作用
注:—表示菌体生长情况超过空白对照,无法计算抑菌活性。
2.4 不同单一聚合度壳寡糖的抑菌性能
根据液质联用来确认分离得到的单一聚合度壳寡糖,根据液相图谱确定单体纯度,根据质谱图确认单体的聚合度[22]。从图2、3的液相图中可以看出,壳二糖和壳三糖的纯度均在96%以上,对应时间的质谱图显示,m/z分为341.2和502.2,确认为壳二糖和壳三糖的分子离子峰。图4的液相图中出现两个峰,根据对应时间的质谱图判断m/z为663.3的主要为壳四糖,并混有少量的壳三糖。图5中m/z为824.4的主要为壳五糖,并混有少量壳三糖、壳四糖、壳六糖及更高聚合度的糖;图6中m/z为985.5的主要为壳六糖,并混有少量的壳三糖、壳四糖、壳五糖及更高聚合度的糖。
将制备得到的单一聚合度壳寡糖和氨基葡萄糖分别进行抑菌试验,根据表3的结果可以看出,氨基葡萄糖非但没有抑菌作用,反而作为碳源促进了菌体生长,随着单一聚合度壳寡糖聚合度的提高,抑菌效果越来越好;这与李克成等[23]利用单一聚合度的壳寡糖对金黄色葡萄球菌进行的抑菌实验结果相符,根据他们的报道,对于金黄色葡萄球菌而言,聚合度大于5的壳寡糖分子结构是抑菌活性所必须的。根据本实验,对于大肠杆菌,当壳寡糖聚合度大于4、浓度为40 mg/mL时,抑菌活性能达到99%以上。


图2 壳二糖的UPLC-MS图谱
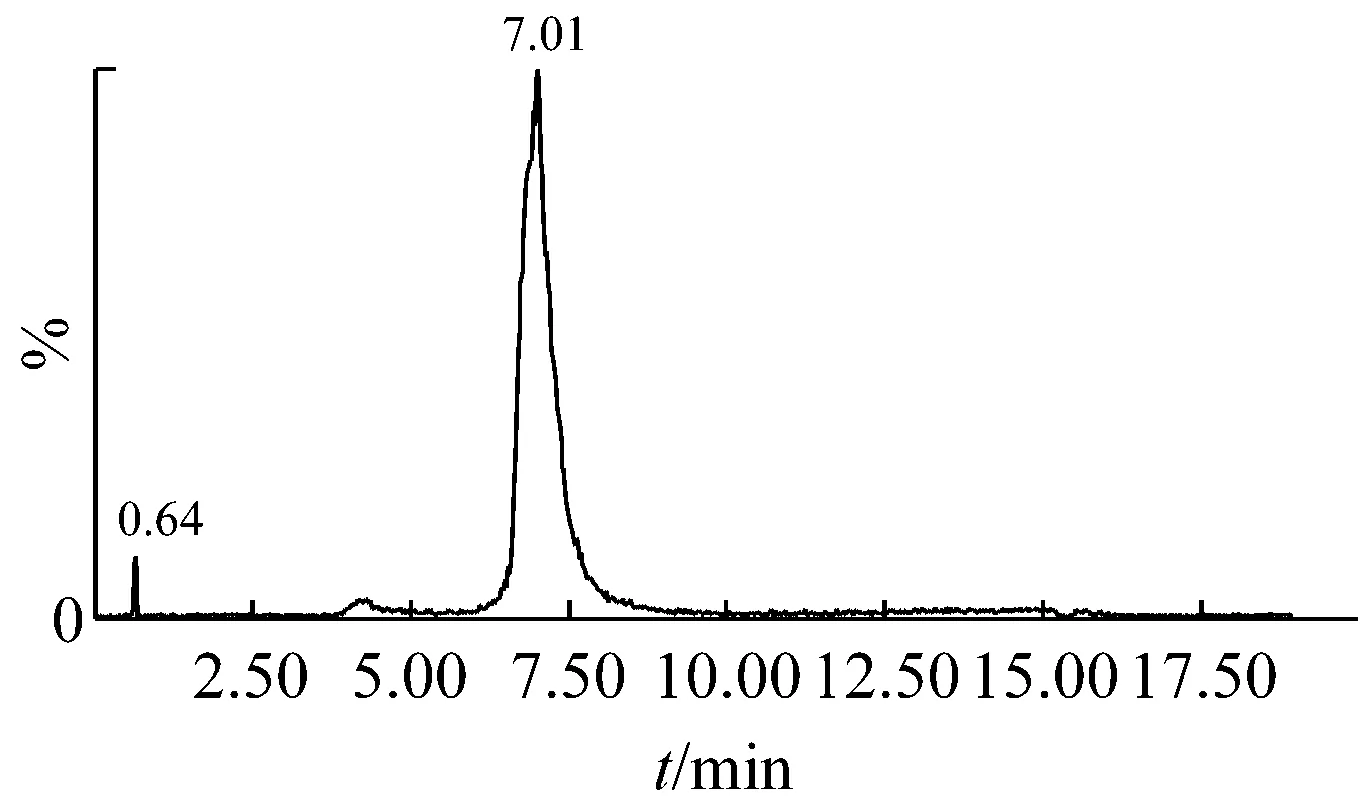
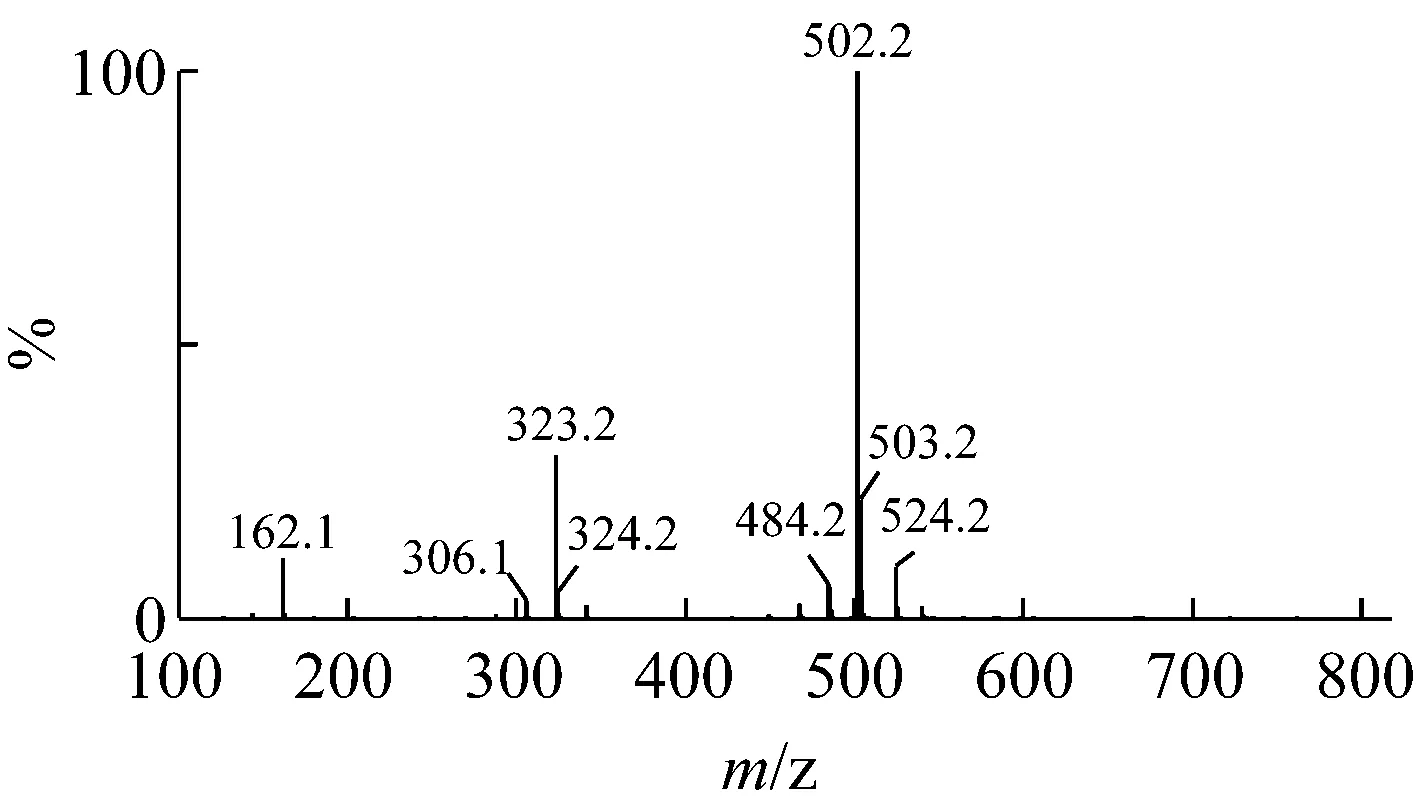
图3 壳三糖的UPLC-MS图谱


图4 壳四糖的UPLC-MS图谱
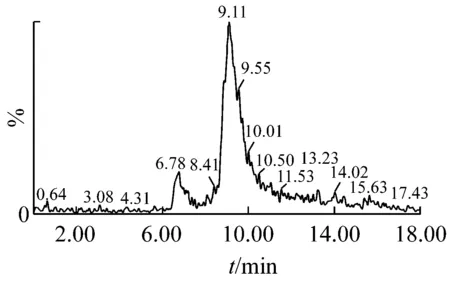

图5 壳五糖的UPLC-MS图谱
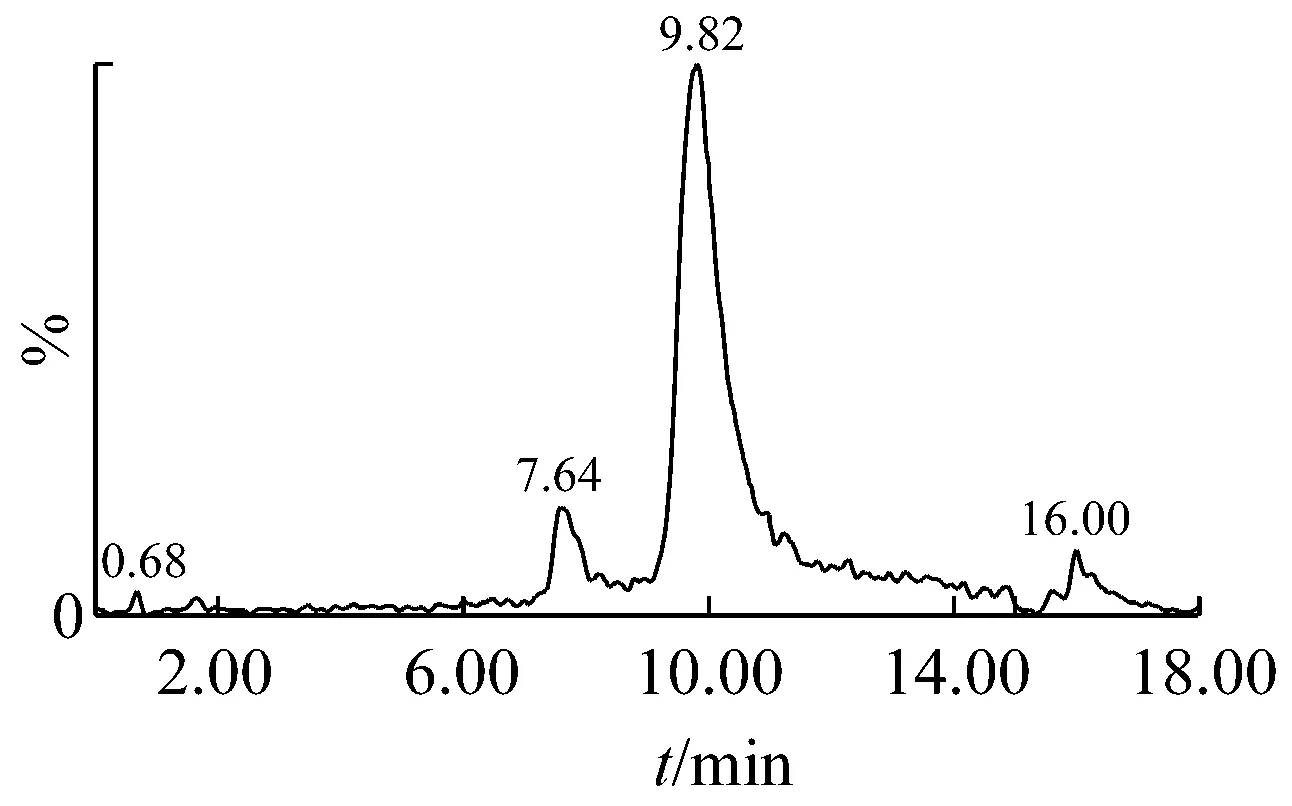

图6 壳六糖组分6的UPLC-MS图谱
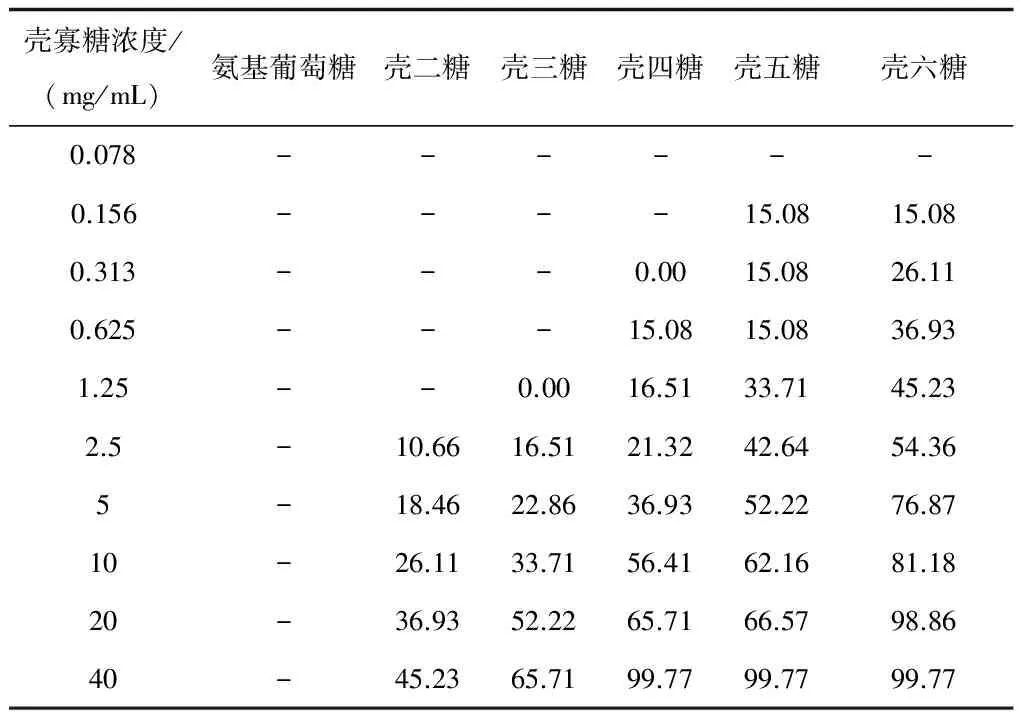
壳寡糖浓度/(mg/mL)氨基葡萄糖壳二糖壳三糖壳四糖壳五糖壳六糖0.078------0.156----15.0815.080.313---0.0015.0826.110.625---15.0815.0836.931.25--0.0016.5133.7145.232.5-10.6616.5121.3242.6454.365-18.4622.8636.9352.2276.8710-26.1133.7156.4162.1681.1820-36.9352.2265.7166.5798.8640-45.2365.7199.7799.7799.77
注:-表示菌体生长情况超过空白对照,无法计算抑菌活性。
3 结 论
不管是摇瓶法还是ELISA板法,当壳寡糖浓度大于5 mg/mL时抑菌效果与同浓度苯甲酸钠相近;采用ELISA板的方法进行实验,即节省试药又方便快捷。pH为4时,0.156 mg/mL的壳寡糖溶液抑菌活性即能超过90%;pH为7时,5 mg/mL的壳寡糖才能达到90%抑菌活性。脱乙酰度为95%时,5 mg/mL的壳寡糖溶液抑菌活性能超过97%;脱乙酰度为45%时,40 mg/mL的壳寡糖溶液抑菌活性仅有56%;ELISA板法显示,聚合度越高抑菌活性越好,聚合度大于4的单一聚合度壳寡糖40 mg/mL时抑菌活性能达到99%。壳寡糖因含有质子化铵,能与细菌带负电荷的细胞膜作用,干扰细菌细胞膜功能,造成细菌体内细胞质流失,干扰细胞的正常生理代谢,从而达到杀菌的目的[24]。因此,如降低pH、提高脱乙酰度、提高壳寡糖溶液浓度等能增加质子化铵的措施,都能提高壳寡糖的抑菌活性。
[1] 竺国芳,赵鲁杭.几丁寡糖和壳寡糖的研究进展[J].中国海洋药物,2000,73(1):43-46.
[2] Xia WSh, Liu P, Zhang JL,etal. Biological activities of chitosan and chitooligosaccharides[J]. Food Hydrocolloids, 2011, 25(2): 170-179.
[3] 常江波,余晓斌,谭秀花. 绿色木霉粗纤维素酶解液水解壳聚糖的研究[J].工业微生物,2011,41(4):26-30.
[4] 赵希荣,夏文水.食品级壳聚糖乳酸盐的制备、表征和抗菌活性[J].中国乳品工业,2005,33(8):24-26.
[5] 王光华,张燕婉.脱乙酰壳多糖醋酸混合液对含氧包装鲜猪肉中细菌生长的影响[J].食品与发酵工业,1992,(2):1-8.
[6] Mellegard H, Strand SP, Christensen BE,etal. Antibacterial activity of chemically defined chitosans: Influence of molecular weight, degree of acetylation and test organism[J]. Int J Food Microbiol, 2011, 148(1): 48-54.
[7] 夏文水, 吴焱楠. 甲壳低聚糖功能性质[J]. 无锡轻工大学学报, 1996, 15(4): 297-302.
[8] Jeon YJ, Park PJ, Kim SK. Antimicrobial effect of chitooligosaccharides produced by bioreactor[J]. Carbohydrate Polymers, 2001, 44(1): 71-76.
[9] 陈建国, 郑连英. 不同酶切方式制备的壳寡糖抑菌活性的研究[J]. 浙江大学学报, 2006, 40(11): 1905-1908.
[10] Seyfarth F, Schliemann S, Elsner P,etal. Antifungal effect of high-and low-molecular-weight chitosan hydrochloride, carboxymethyl chitosan, chitosan oligosaccharide and N-acetyl-d-glucosamine againstCandidaalbicans,CandidakruseiandCandidaglabrata[J]. International journal of pharmaceutics, 2008, 353(1): 139-148.
[11] Jeon YJ,Park PJ,Kim SK. Antimicrobial effect of chitooligosaccharides produced by bioreactor[J].Carbohydrate Polymers,2001,44:71-76.
[12] Hancock REW,Lehrer R. Cationic peptides:a new source of antibiotics[J].Trends Biotechnol,1998,16:82-88.
[13] 张龙, 夏文水. 双突跃电位滴定法测定壳聚糖脱乙酰度的影响因素[J]. 2004, 23(4): 20-27.
[14] 纪莹, 赵轶, 周翔. 壳寡糖的制备及组分分析[J]. 中国现代应用药学, 2003(3): 195-196.
[15] 陈小娥, 方旭波, 余辉.壳寡糖的薄层层析分析[J]. 浙江海洋学院学报(自然科学版)2008, 27(4): 361-365.
[16] 朱玉霞,李恒,陈列欢等. 低聚合度壳寡糖制备及其组分的色谱行为分析[J].食品工业科技,2013,34(15):281-284.
[17] 闫海侠,刘佳,孟祥红. 壳寡糖对大肠杆菌抑菌作用的研究[J].农产品加工,2014,349(4):1-5.
[18] 蒋玉燕,毕忆群,汪子伟. 聚氨基葡萄糖的体外抗菌活性[J].中国抗生素杂志,1996,21(1):54-56.
[19] 杨宇民,马振祥,尹继成等. 系列水溶性壳聚糖衍生物的抑菌性能研究[J].中国公共卫生,2005,21(9):1080-1081.
[20] 严钦,沈月新,王造. 壳寡糖的制备及其抑菌性能研究[J].食品研究与开发,2003,24(2):26-27.
[21] 王鸿,沈月新.不同脱乙酰度壳聚糖的抑菌性[J].上海水产大学学报,2001,10(4):380-382.
[22] 高丽霞,李春霞,王世欣.不同聚合度的壳寡糖单体的制备及其分析[J].中国海洋药物,2013,32(3):21-27.
[23] 李克成,邢荣娥,刘松等. 单一聚合度壳寡糖对金黄色葡萄球菌(Staphylococcusaureus)的抑制作用研究[C].全国第九届海洋生物技术与创新药物学术会议摘要集.赤峰:2014.
[24] 冯小强,李小芳,杨声等. 壳聚糖抑菌性能影响因素、机理及其应用研究进展[J].中国酿造,2009,202(1):19-23.
Antibacterial activity of chitosan oligosaccharide on Escherichia coli
QIAN Jian-ying1, DING Zhen-zhong2, ZHU Yu-xia1, LI Heng1, SHI Jing-song1
1. School of Pharmaceutical Science, Jiangnan University, 214122, China; 2. Yangzhou Rixing Bio-Tech CO. LTD, 225601, China
In order to observe the effects of the antibacterial activity of chitosan oligosaccharide (COS) onEscherichiacoli, shake-flask method and ELISA-plate method were performed under the environments of different concentrations, different pH, different degree of deacetylation (DD) and different polymerization degree of monomers. Results revealed that its inhibitory effect was similar to that of the same concentration of sodium benzoate when the concentration ≥5 mg/mL. When pH was 4, the antibacterial activity of 0.156 mg/mL COS solution was over 90%. While pH was 7, the concentration of COS solution was 5 mg/mL. When DD was 95%, 5 mg/mL COS solution had antibacterial activity >97%. while DD was 45%, 40 mg/mL COS solution had antibacterial activity about 56%. When degree of polymerization was more than 4, the antibacterial activity of 40 mg/mL COS solution could reach 90%. These results showed that antibacterial activity onE.coliincreased with the increasing of concentration, DD, polymerization degree of monomer and the decreasing of pH. In addition, the ELISA-plate method had advantages of processing sample easily, fast analysis and saving reagents.
chitosan oligosaccharide; monomer; antibacterial activity
10.3969/j.issn.1001-6678.2016.06.003
十二五国家科技支撑计划项目(2012BAD33B06);江苏省重大成果转化(BA2015006)。
钱建瑛(1982~),女,硕士,实验师,研究方向为生物制药。
*通信作者:史劲松,E-mail:shijs@163.com。
