脑内节细胞胶质瘤并胶质母细胞瘤样成分一例
2017-01-07陈志晔李白鸽刘梦琦
陈志晔,李白鸽,刘梦琦,马 林
1中国人民解放军总医院海南分院放射科,海南三亚 5720132中国人民解放军总医院放射科,北京 100853
·病例报告·
脑内节细胞胶质瘤并胶质母细胞瘤样成分一例
陈志晔1,2,李白鸽1,刘梦琦1,2,马 林2
1中国人民解放军总医院海南分院放射科,海南三亚 5720132中国人民解放军总医院放射科,北京 100853
节细胞胶质瘤;胶质母细胞瘤;脑部;磁共振成像
节细胞胶质瘤(ganglioglioma,GG)是一种边界清楚、缓慢生长的神经上皮肿瘤,包括肿瘤性节细胞成分及肿瘤性胶质细胞成分,好发于儿童及青少年,通常伴随有颞叶癫痫。GG病理学上为Ⅰ级(80%)或Ⅱ级,间变型GG(WHO Ⅲ级)较为少见,GG伴胶质母细胞瘤(glioblastoma,GBM)样成分更为罕见[1]。现报告中国人民解放军总医院海南分院病理学确诊的GG伴胶质母细胞瘤样成分1例。
临床资料
患者,女,40岁,头痛、头晕,伴视力下降、视物重影10 d入院。患者于2014年7月12日开始无明显诱因突然出现头痛、头晕,以左侧明显,伴视力下降、视物重影,就诊当地医院,按“偏头痛”治疗,效果欠佳;2014年7月19日就诊三亚市中医院,行头颅CT示“左侧枕叶占位”;2014年7月21日就诊我院神经内科,完善头颅磁共振成像(magnetic resonance imaging,MRI)检查示左枕叶占位,考虑胶质瘤。2014年7月22日拟行手术治疗来我院,门诊以“左枕叶脑胶质瘤”收入院。病程中患者无恶心、呕吐、行走不稳、肢体无力、肢体麻木、肢体及口角抽搐、意识不清、癫痫、听力下降、肢体感觉障碍、肢体运动障碍、发热等,饮食睡眠好,大小便正常。实验室检查及神经系统查体均为阴性。
影像学及手术病理学表现 CT及MRI表现病变位于左侧枕叶皮质区,病灶主体呈囊性,CT呈低密度影(图1),MRI呈长T1长T2脑脊液样信号影,扩散加权成像(diffusion weighted imaging,DWI)呈低信号影(图2)。病变内可见多发分隔,分隔均匀,囊后壁可见实性结节影,CT平扫等密度影(图1),MRI呈稍长T1稍长T2信号影,DWI呈高信号影,周围可见明显水肿及占位效应,增强扫描实性部分显著均匀强化,囊壁可见强化。左侧颞、枕部硬脑膜增厚强化。邻近骨质未见明确异常(图2)。
手术记录 在枕部外侧剪开硬膜,可见墨绿色的囊液流出,因囊壁与硬膜黏连,囊壁一并剪开,吸除囊液,继续弧形剪开硬膜,在窦汇旁可见灰黄色病变组织与硬膜黏连明显,电灼分离,硬膜翻向枕部,该病变为囊实性病变,大小6 cm×3 cm,囊腔分隔,囊壁已破,实性部分大小2.2 cm×1.2 cm,色泽灰黄,血供一般,显微镜下剥离囊壁,分块切除实性部分病灶。
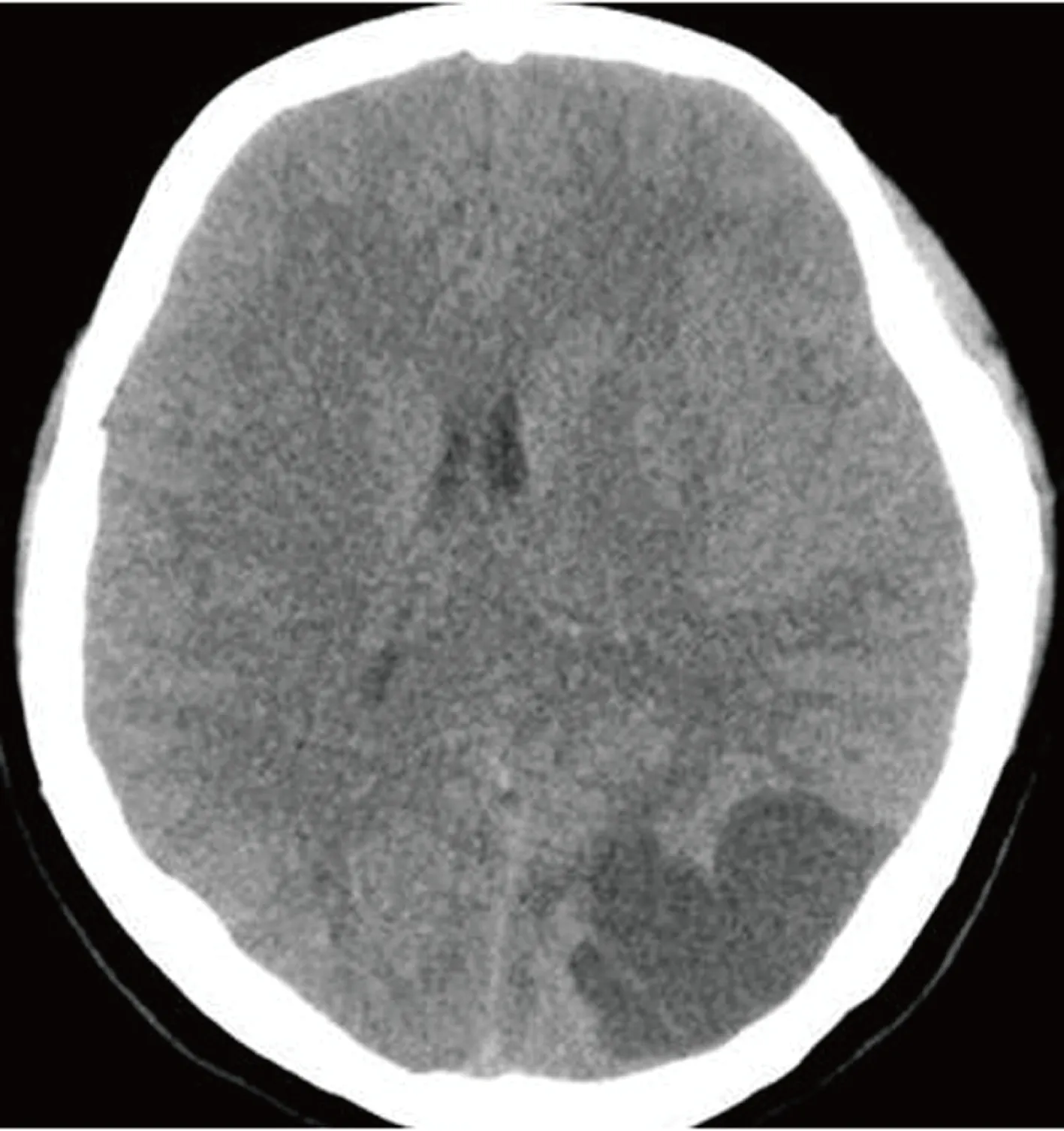
图 1 横轴位CT平扫,病变位于左侧枕叶皮质区,以囊性成分为主,囊性成分呈脑脊液样密度,实性成分呈等密度影,病变内未见明确钙化,邻近骨质未见明显异常
病理学结果 提示左侧枕叶GG伴胶质母细胞瘤样成分。镜下可见细胞呈疏松分布的双极神经元,以及细胞呈致密分布的肿瘤性胶质细胞,细胞核大深染,核浆比例增大,伴地图样坏死及血管内皮增生,送检瘤体体积为4 cm×2.5 m×0.7 cm(图3)。
讨 论
GG占脑内原发肿瘤的1%,占儿童中枢神经系统肿瘤的1%~4%。其恶性变主要转换为GBM,神经母细胞瘤也有报道[1]。目前文献关于GG恶变的报道较少,均为个案报道。总结文献可以发现恶性GG主要分为两类:第1类为GG术后(化疗或放疗干预)恶变为GBM的共有6例(其中1例为脊髓圆锥、5例为脑部)[2- 6],可以称为胶质母细胞瘤转换;第2类为GG与胶质母细胞瘤共生,共有5例报道,其中仅1篇对影像学进行了描述,节细胞胶质瘤位于左侧颞后回,呈环形强化,未见实性结节;而胶质母细胞瘤位于左侧颞极,呈显著结节样强化,灶周可见水肿[7- 10]。
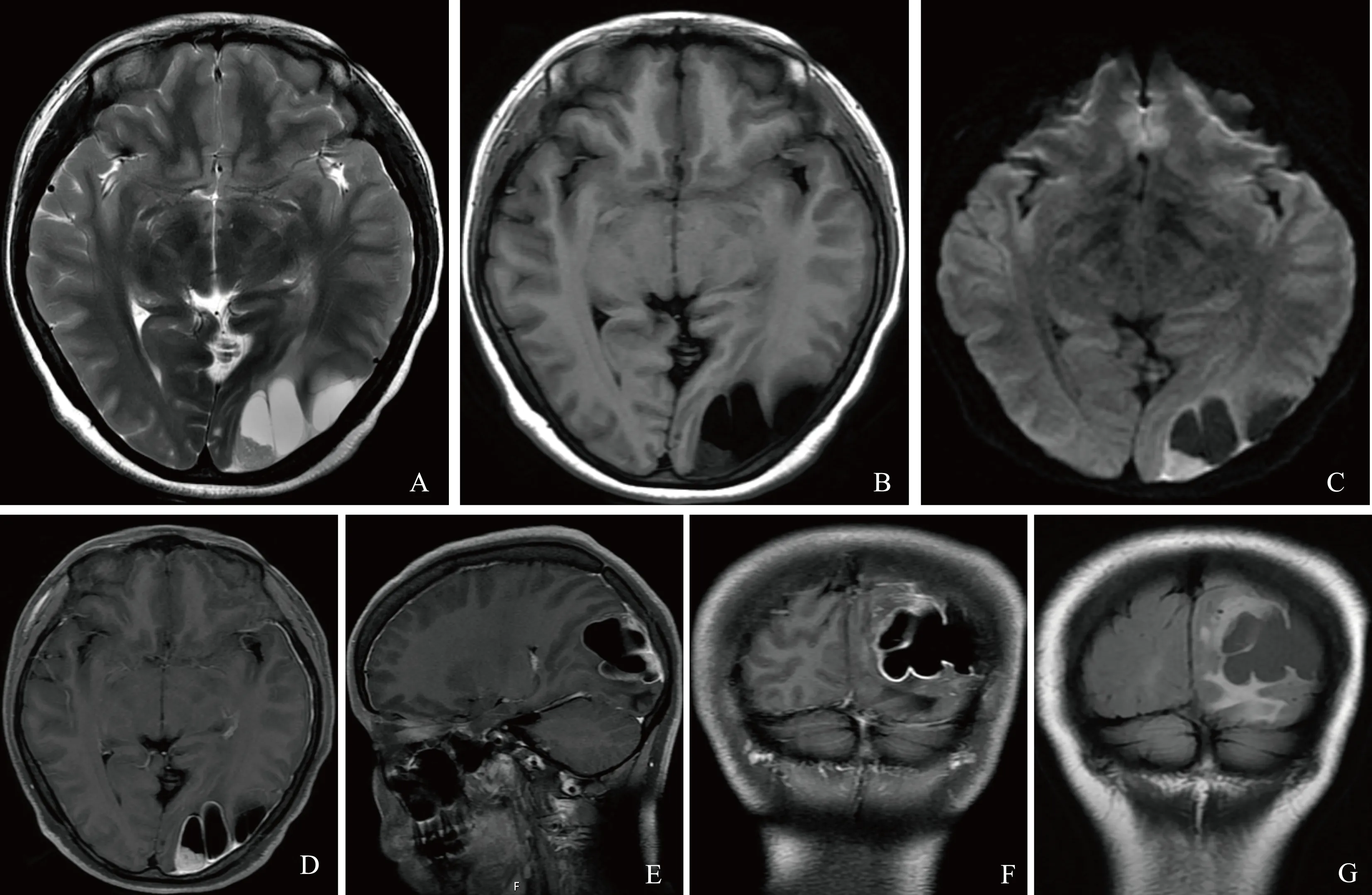
A.横轴位T2加权成像;B.横轴位T1加权成像;C.横轴位扩散加权成像(b=1000 s/mm2);D.横轴位T1加权成像增强;E.矢状位T1加权成像增强;F.冠状位T1加权成像增强扫描;G.冠状位T2液体衰减翻转恢复成像
图 2 磁共振平扫及增强扫描,病变实性部分扩散加权成像呈高信号影,增强扫描显著强化
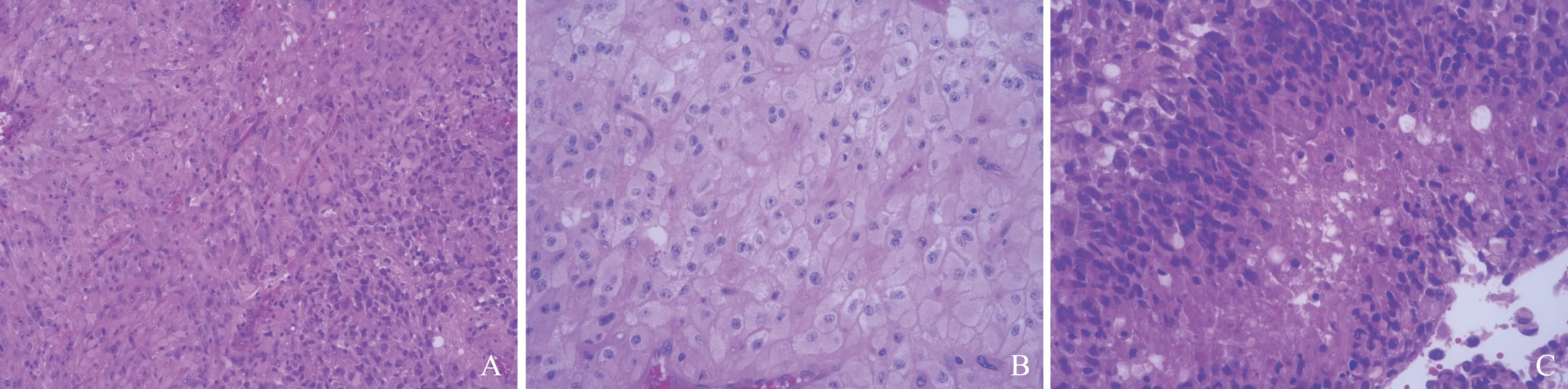
A.左侧细胞密度相对疏松,右侧细胞相对致密(HE染色,×100);B.双核神经元(HE染色,×200);C.细胞核大深染、细胞致密、核浆比例大(HE染色,×200)
图 3 病理学结果提示节细胞胶质瘤并胶质母细胞瘤成分
对于第1类,胶质母细胞瘤转换可能与基因改变有一定关系,尤其是p16基因的甲基化及缺少[2]。对于第2类,结合文献及此病例可分为两个亚型,第1种亚型为脑内同时有2个独立的病变,一个为GG,一个为胶质母细胞瘤,正如Steven等[7]报道的病例,由于这两个病变具有不同的组织病理学、影像学及临床演变,可以认为两者是独立的病变,也可称之为GG合并胶质母细胞瘤;第2种为同一个病变既含有GG成分,又含有GBM样成分,可称之为GG伴胶质母细胞瘤样成分。病理学研究提示可能与p53基因的突变有一定的关系[8]。
GG通常基于皮层生长,可分为3种形成:最常见的为囊及壁结节,其次为实性肿块,少见类型为具有侵袭性、边界模糊的肿块,其中50%会发生钙化[1]。因此,根据其相对特征性的影像学表现,GG首次正确诊断是可行的。对于节细胞瘤与胶质母细胞瘤共生的影像学诊断要谨慎,不同的诊断可能会影响到临床选择不同的干预方式,对患者的预后具有一定的影响。因此,当遇到脑内多发肿瘤性病变时,尤其是儿童及年轻人,其中某一个病变位于皮质区时,要考虑此病的可能性。而对于GG伴胶质母细胞瘤样成分的患者,在诊断时要重点观察实性成分的DWI信号,胶质母细胞瘤通常为明显高信号[11]。本例报道可见病变实性成分DWI呈显著高信号,由此提示恶性程度较高,同时考虑病变的位置及囊实性特点,以及病灶周围的水肿,可以做出GG并胶质母细胞瘤样成分的影像学诊断。
GG的鉴别诊断主要包括:(1)胚胎发育不良性神经上皮肿瘤,基于皮层生长,边界清楚,呈多囊“皂泡样”改变,T2加权成像为高信号,罕见强化或轻度强化,邻近颅骨重塑改变。(2)多形性黄瘤,表浅的皮质肿块,硬膜尾征常见,常为囊及壁结节,也可以为实性,邻近脑膜侧结节强化,颞叶常见。(3)毛细胞性星形细胞瘤,幕上除了下丘脑及视交叉外罕见,典型表现为实性或囊实性肿块,显著强化。(4)低级别星形细胞瘤,边界清楚,但邻近白质受侵,无强化。(5)少突胶质细胞瘤,常为钙化不均质的肿块,典型病变较节细胞胶质瘤弥漫,可以重塑或侵蚀邻近颅骨。
综上,GG术后的恶性转换(胶质母细胞瘤转换)、GG合并胶质母细胞瘤及GG伴胶质母细胞瘤样成分均为GG恶变的不同表现方式,及时准确的影像诊断对于临床诊治具有重要意义。
[1]Osborn AG,Salzman KL,Barkovich AJ. Diagnostic imaging:brain[M]. 2nd Edition. UT Amirsys:Salt Lake City,2010:82- 85.
[2]Kim NR,Wang KC,Bang JS,et al. Glioblastomatous transformation of ganglioglioma:case report with reference to molecular genetic and flow cytometric analysis[J]. Pathol Int,2003,53(12):874- 882.
[3]Amini A,Chin SS,Schmidt MH. Malignant transformation of conus medullaris ganglioglioma:case report[J]. J Neurooncol,2007,82(3):313- 315.
[4]Naydenov E,Tzekov C,Minkin K,et al. Malignant progression of an anaplastic ganglioglioma into a glioblastoma multiforme-report on two cases and review of the literature[J]. Khirurgiia,2009,(2- 3):69- 74.
[5]Hayashi Y,Iwato M,Hasegawa M,et al. Malignant transformation of a gangliocytoma/ganglioglioma into a glioblastoma multiforme:a molecular genetic analysis. Case report[J]. J Neurosurg,2001,95(1):138- 142.
[6]Araujo JF,Souza MR,Sperlescu A,et al. Malignant course of a ganglioglioma:case report[J]. Arq Neuropsiquiatr,1998,56(3A):486- 490.
[7]Stevens QE,Howes G,Dickerman RD,et al. Ganglioglioma occurring with glioblastoma multiforme:separate lesions or the same lesion[J]. Clin Neurol Neurosurg,2007,109(2):195- 199.
[8]Rogojan L,Olinici CD. Ganglioglioma with glioblastoma component[J]. Rom J Morphol Embryol,2008,49(3):403- 406.
[9]Schittenhelm J,Reifenberger G,Ritz R,et al. Primary anaplastic ganglioglioma with a small-cell glioblastoma component[J]. Clin Neuropathol,2008,27(2):91- 95.
[10]Mekni A,Chelly I,Haouet S,et al. Malignant cerebellar ganglioglioma. A case report and review of the literature[J]. Neurochirurgie,2006,52(2- 3 Pt 1):119- 122.
[11]Chen Z,Ma L,Lou X,et al. Diagnostic value of minimum apparent diffusion coefficient values in prediction of neuroepithelial tumor grading[J]. J Magn Reson Imaging,2010,31(6):1331- 1338.
三亚市医疗卫生科技创新项目(2016YW37)和中国博士后科学基金特别资助项目(2014T70960)
马 林 电话:010- 66939592,电子邮件:cjr.malin@vip.163.com
R445.2
B
1000- 503X(2016)06- 0750- 03
10.3881/j.issn.1000- 503X.2016.06.022
2016- 08- 09)
