巧用注射器改进部分中学化学实验更安全环保
2017-01-06孙硕
孙硕
摘要:利用注射器气密性好的优点,改进铜与浓硝酸反应等使用或产生有毒有害气体的实验,改进制备氢氧化亚铁、一氧化氮等无氧环境下的实验;利用注射器透明有刻度的优点,改进二氧化氮与水反应等观察容积(体积)变化的实验。节约药品,环保安全,效果明显。
关键词:注射器; 改进实验; 绿色化学
文章编号:1008-0546(2016)12-0093-03 中图分类号:G633.8 文献标识码:B
doi:10.3969/j.issn.1008-0546.2016.12.032
医用注射器透明度高,有刻度能测量,可调节容积,在化学实验中可以用来量取、转移、作反应容器,安全可靠、价格低廉,具有气密性好、体积小、可调节、易观察、操作简便等特点。利用注射器的这些优点,可以对部分中学化学实验进行改进,使实验药品用量少、液体药品可测量,反应均在密闭体系中进行,产生的有毒有害气体量少可控,余气用浓NaOH溶液吸收,不会排到外环境,既环保又安全,符合绿色化学理念,有利于培养学生的环保意识[1]。实验器材主要是医用注射器、静脉注射针头,蝴蝶夹、学生橡皮等,价格低廉,取材容易,且不易碎裂,学生常见常用,有助于激发学生兴趣,便于开展分组实验和课外实验,有利于培养青少年的创新意识和实践精神。
一、利用注射器气密性好的优点,改进一些使用或产生有毒有害气体的实验
1. Cu与浓HNO3、NO2与H2O、NO与O2反应的联合实验
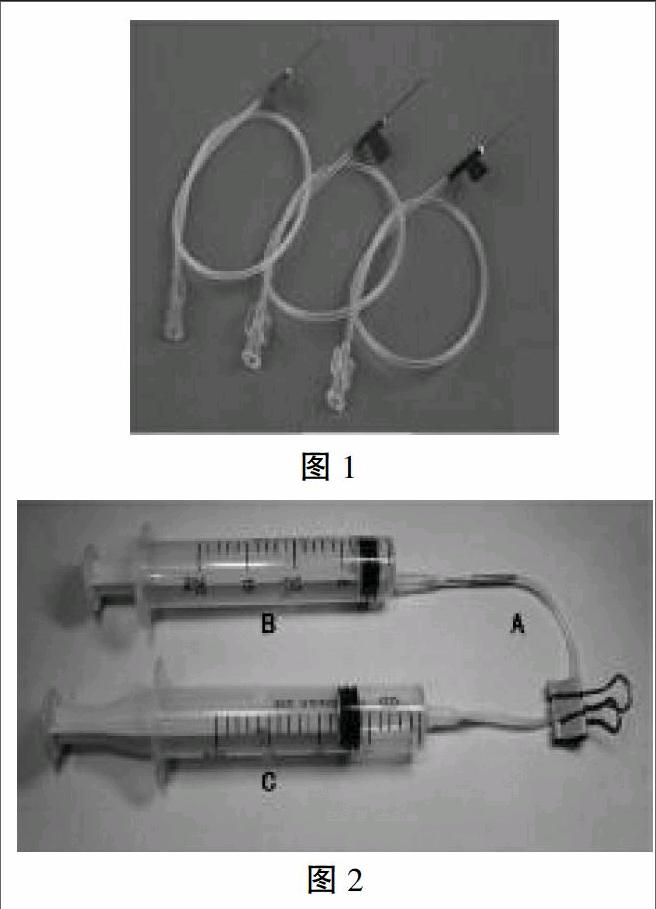
取一个如图1所示的静脉输液针管,去掉针头,截去部分细管,作为连接两个注射器的导管A。
取一个20mL注射器B,将针头插入导管A的细管中。
再取一个20mL注射器C,拔掉针头,连接导管A。
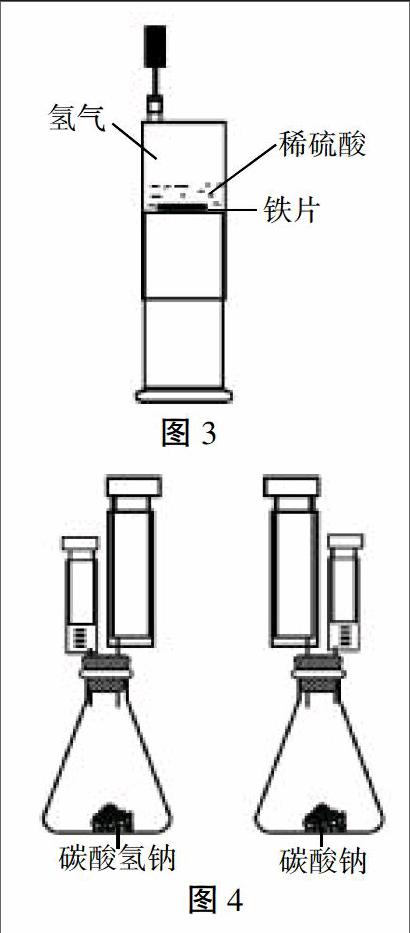
将注射器B作为加液和集气装置,将注射器C作为反应装置,做成如图2所示的密闭装置。
(1)拔出注射器C的活塞,取小拇指盖大小的铜片平放在注射器底部,推进活塞至注射器底部。
(2)用注射器B抽取1mL浓硝酸,不要有气泡(保证Cu与浓HNO3反应收集到的NO2气体较为纯净,便于测量NO2与H2O反应前后体积变化)。
(3)将注射器B、C如图2连接起来。打开止水夹,将B中的浓硝酸推入C中,观察反应现象(铜片与浓硝酸剧烈反应,产生大量红棕色气体,活塞向外移动,同时生成蓝绿色溶液)。
(4)将注射器C针头端向上,使气体在针头端,反应液在活塞端,推进活塞,使气体全部进入注射器B,此时收集到的是较为纯净的NO2气体。
必要时,可以将注射器C针头端向下,将反应液排入注射器B,推拉注射器的活塞,使反应液与铜片脱离来控制反应进程,保证实验安全可靠。
(5)当注射器B的气体约15mL时,关闭止水夹,将导管A与注射器B连在一起分离注射器C。
(6)将注射器C中的反应液推入到小烧杯中,然后吸入氢氧化钠浓溶液,振荡吸收多余的气体。
(7)记下注射器B气体的体积,将B连接的导管A插入盛水的烧杯中,吸入2mL水,关闭止水夹。充分振荡B,使水与NO2充分反应,观察现象,再次记下剩余气体体积,比较两次气体读数之差(红棕色气体变为无色气体,注射器内气体体积明显减少,大约是原来的三分之一)。
实验原理解释:
Cu+4HNO3[=]Cu(NO3)2+2NO2+2H2O,由于该装置气密性较好,实验前基本没有空气混入,注射器B收集到的15mL气体是较为纯净的NO2。生成的Cu(NO3)2溶液因溶解部分NO2而呈黄绿色。
3NO2+H2O[=]2HNO3+NO,15mL NO2与水反应生成了5mL NO。注射器内气体只有原来的约三分之一。
2. 利用NO2演示压强、温度对化学平衡的影响
利用本文Cu与浓HNO3反应的实验方法,用注射器收集10mL NO2气体。推压和拉提注射器活塞,当注射器内气体体积变小和增大时,观察平衡体系颜色的变化。
采用两套图2的实验装置,利用本文Cu与浓HNO3反应的实验方法,用2个注射器各收集10mL NO2气体。一个放入盛热水的烧杯中,一个放入盛冰水的烧杯中,比较两个注射器内平衡体系颜色的不同。也可以用一个注射器内的NO2气体作为参照;另一个注射器放入盛热水的烧杯中观察平衡体系气体颜色的变化,再放入盛冰水的烧杯中观察气体颜色的变化。
3. SO2与H2S的反应实验
用静脉输液针管制作导管一根,取两个50mL注射器,连接成如图2所示的装置,用注射器A抽入SO2 10mL,注射器B抽取H2S气体20mL。将A中的气体缓缓推入B中,观察现象(注射器B的壁上有淡黄色粉末,注射器内气体体积明显减小,反应最后注射器A、B几乎没有多余气体存在)。
4. Cl2与NaBr、NaI的反应实验
(1)取20mL注射器,事先抽入10mL Cl2,演示实验时再抽取2mL NaBr浓溶液,将针头插入橡皮塞中,密闭注射器。振荡,使溶液与气体充分反应,观察反应现象[2](橙红色的溴蒸气充满整个针筒空间)。将注射器埋入冰块中,5分钟后拿出,迅速观察注射器内变化(注射器壁上有橙红色的溴单质液滴,受热很快又挥发为溴蒸气)。
(2)取20mL注射器,抽入10mL Cl2,再抽取2mL NaI浓溶液,将针头插入橡皮塞中,密闭注射器。振荡,使溶液与气体充分反应。观察反应现象(注射器壁上有紫黑色的碘单质固体)。
二、利用注射器密封性好的优点,改进无氧环境下的实验
1. Cu与稀HNO3反应实验
实验器材:
利用如图2所示的Cu与浓HNO3反应的注射器装置。
实验过程及现象:
(1)用注射器B抽取5mL稀硝酸,不要有空气,若有气泡则针头向上推进活塞赶出气泡。
(2)拔出注射器C的活塞,取一小片铜片平放在注射器底部,推进活塞至注射器底部,连接导管A,将导管A放入盛蒸馏水的烧杯中抽取少许蒸馏水入注射器中,针头向上,排出注射器及导管A内的空气。然后连接盛有稀硝酸的注射器B,关闭止水夹。如图2所示。
(3)打开止水夹,将B中的稀硝酸全部推入C中,观察反应现象(铜片与稀硝酸缓慢反应,产生无色气体,活塞向外移动,同时生成蓝色溶液)。
若反应缓慢,可以将注射器C放入盛有热水的烧杯中,水浴加热。
(4)将注射器C针头端向上,使气体在针头端、反应液在活塞端,推进活塞,使气体全部进入注射器B,此时收集到的是较为纯净的NO气体。
(5)当注射器B的气体约10mL时,关闭止水夹,将注射器B与导管A连在一起,分离注射器C。
(6)将注射器C中的反应液推入到小烧杯中,然后吸入氢氧化钠浓溶液并振荡,吸收注射器内多余的气体。
(7)在注射器B后面放一张白纸,观察注射器内气体颜色(无色);打开止水夹,吸入少许空气,观察气体颜色变化(红棕色);待红棕色颜色较深时,将注射器B连接的导管C插入盛水的烧杯中,吸入2mL水,关闭止水夹,充分振荡,观察现象(红棕色气体再次变为无色气体,注射器内气体体积变小)。可反复多次操作,直至打开止水夹抽入空气气体不再变色。
实验原理解释:
2NO+O2[=]2NO2
3NO2+H2O[=]2HNO3+ NO
理论上反应最后注射器内应无气体存在,但由于吸入的是空气不是纯O2,只能观察到注射器内气体体积减小。
2. Fe(OH)2溶液的制备
(1)将一小片金属铁平放在注射器底部,将活塞推入注射器底部,吸入少量煮沸过的蒸馏水,针头向上排出注射器内的空气。
(2)抽入适量稀H2SO4(注意:注射器针头插入稀H2SO4溶液底部,缓慢抽入,注射器内不能有气泡),然后针头插入橡皮塞中,密封注射器,如图3所示,观察现象(注射器内产生无色气泡,活塞向外移动)。此步骤要控制稀H2SO4的量,以免反应剧烈或者产生气体过多,冲顶活塞脱离注射器导致实验失败。
(3)取下橡皮塞,针头向上推出反应生成的部分气体,再吸入适量NaOH溶液,封闭橡皮塞,观察现象(有白色沉淀生成,可放置一段时间不变色)。将反应液排出到小烧杯中,将沉淀物涂在烧杯壁上观察现象(白色沉淀迅速变为黄褐色)。
三、利用注射器有刻度的优点,改进一些观察容积(体积)变化的实验
1. CO2、Cl2、H2S、HCl、NH3等溶于水的实验
(1)易溶于水的CO2、Cl2、H2S等气体:
用50mL注射器,事先抽取30mL的CO2气体,演示实验时再抽取20mL蒸馏水,将注射器针头插入橡皮塞中(也可将学生橡皮切成条块作橡皮塞使用),封闭注射器。充分振荡,使水、气充分接触混合,可看到注射器针栓向里移动,注射器内余下气体约10mL。证明CO2溶于水,溶解度大约为1∶1。
采用同样的方法,事先用50mL注射器吸入30mL Cl2,演示实验时再抽取10mL水,将注射器针头插入橡皮塞中封闭注射器。充分振荡混合,可看到注射器余下约10mL Cl2,溶液变为黄绿色。证明Cl2溶于水,溶解度大约为2∶1。
也可用50mL注射器抽取10mL水再吸入30mL H2S,粗略验证H2S在水中的溶解度为1∶2.6。
(2)极易溶于水的HCl、NH3等气体
事先用50mL注射器抽取40mLHCl(NH3),用橡皮塞封闭注射器。演示实验时,准备一个500mL烧杯,装半烧杯水,在烧杯中滴几滴石蕊(酚酞)。去掉针头,将注射器插入烧杯盛装的水中,抽入少许水后,用手固定住活塞,观察现象。由于这些气体极易溶于水,可以看到在注射器内形成美丽的“红色喷泉”[3]。
2. 比较不同气体溶解度的不同
用多个50mL注射器分别抽取等体积的CO2、Cl2、H2S、SO2等气体,和等体积的蒸馏水,密闭后,每个注射器用手振荡同样的次数和幅度。静置在台面上,通过读取注射器内剩余气体的刻度,观察气体溶解度的不同。
3. 比较盐酸与Na2CO3和NaHCO3反应的快慢
利用20mL和50mL注射器、100mL锥形瓶、瓶塞,做成如图4所示的装置。
将足量的Na2CO3和NaHCO3分别放入两个集气瓶中,塞紧瓶塞。将两个50mL注射器活塞推入底部,作为集气装置,分别插穿两个广口瓶塞。取两个20mL注射器,分别吸入5mL的1mol/L盐酸,分别插穿广口瓶塞,同时向瓶内注射盐酸,压住20mL注射器活塞到底部。观察反应现象。(装NaHCO3的装置反应剧烈,50mL注射器活塞向外移动快,产生气体较多)
4. 证明分子间存在分子间隙
用50mL注射器抽取20mL水,再抽取20mL酒精,用上述静脉输液针管制成的“橡皮塞”封闭注射器,充分振荡后观察混合液刻度,发现两者体积小于40mL。说明水分子和酒精分子之间有间隙,二者混合时,部分分子钻入间隙中,导致总体积减小。
5. NO2与H2O反应的实验
具体见上文Cu与浓HNO3、NO2与H2O、NO与O2反应的联合实验中的第8步骤。用20mL注射器收集15mL NO2,再吸入2mL水,密闭注射器,振荡注射器使反应充分,可观察到红棕色气体变为无色,反应后注射器内气体约为原来的三分之一。
参考文献
[1] 荣卢耀,赵承志.加强课堂实验设计体现绿色化学思想[J].中学化学教学参考,2007(4):42
[2] 张正飞.例析注射器在中学化学实验改进中的妙用[J].化学教与学,2013(9):89~90
[3] 刘继能.多功能化学实验演示器[J].化学教育,2015(4):65~67
