绝经后体脂异常分布对雌性SD大鼠内脏脂肪组织脂肪因子及TNF-α表达的影响
2017-01-06翟玉娥田清武赵希芹赵鹏孙树凯岳康翟木绪
翟玉娥,田清武,赵希芹,赵鹏,孙树凯,岳康,翟木绪
(1青岛大学附属医院,山东青岛266555;2淄博市妇幼保健院)
·基础研究·
绝经后体脂异常分布对雌性SD大鼠内脏脂肪组织脂肪因子及TNF-α表达的影响
翟玉娥1,田清武1,赵希芹1,赵鹏1,孙树凯1,岳康1,翟木绪2
(1青岛大学附属医院,山东青岛266555;2淄博市妇幼保健院)
目的 探讨绝经后体脂异常分布对雌性SD大鼠内脏脂肪组织脂肪因子(包括瘦素、脂联素、抵抗素)及TNF-α表达的影响。方法 选择6周龄雌性SD大鼠30只,随机分为假手术组、去卵巢组和去卵巢高脂组(OVXH组)各10只,去卵巢组、OVXH组切除双侧卵巢制备去卵巢去势(绝经)模型,假手术组仅摘除腹腔内与卵巢体积相当的脂肪组织。术后1周,假手术组和去卵巢组给予普通饲料喂养,OVXH组给予高脂饲料喂养。连续干预12周后,麻醉大鼠迅速剥离内脏脂肪组织,分别采用免疫组化染色法和RT-PCR法检测各组脂肪组织瘦素、脂联素、抵抗素、TNF-α蛋白及mRNA表达的变化。结果 与假手术组相比,去卵巢组和OVXH组内脏脂肪组织瘦素蛋白表达降低,脂联素、抵抗素、TNF-α蛋白及mRNA表达均增强(P<0.05或0.01)。与去卵巢组相比,OVXH组内脏脂肪组织抵抗素、TNF-α蛋白及mRNA表达均增强(P均<0.05)。结论 去卵巢后体脂分布异常大鼠内脏脂肪组织脂联素、抵抗素和TNF-α的表达显著增强,瘦素表达显著减弱,可能与绝经后代谢综合征的发病有关。
绝经;代谢综合征;脂肪组织;脂肪因子;胰岛素抵抗;肿瘤坏死因子α
绝经后女性存在脂肪组织再分布的现象,主要表现为体脂趋于上半身型分布。这种体脂再分布可导致绝经后女性代谢综合征和肥胖症的发病率增高,其发生风险甚至高于同龄男性[1,2],严重影响绝经后女性的身心健康。研究证实,绝经后女性雌激素的缺乏与其内脏脂肪堆积密切相关[3,4],但其具体机制尚未完全阐明。2015年3~11月,我们对雌性SD大鼠去卵巢模拟绝经后模型,然后给予高脂饮食模拟绝经后体脂分布异常状态,观察大鼠内脏脂肪组织脂肪因子(包括脂联素、瘦素、抵抗素)及TNF-α的表达变化,探讨绝经后体脂异常分布状态对绝经后女性代谢综合征的影响机制。
1 材料与方法
1.1 材料与试剂 6周龄SD雌性大鼠30只,体质量(200±20)g,由青岛药品研究所实验动物中心提供。分笼饲养,在室温23~25 ℃、相对湿度50%~70%的清洁环境中饲养。高脂饲料配方为普通饲料68%、猪油10%、蛋黄粉10%、蔗糖10%、胆固醇2%[5]。TRIzol试剂盒(美国Invitrogen公司);PCR引物(上海生工生物工程技术公司);Fast Quant cDNA第一链合成试剂盒、Super Real荧光定量PCR(SYBR Green)试剂盒(北京天根生物技术公司);兔抗鼠瘦素单克隆抗体、兔抗鼠脂联素抗体、兔抗鼠TNF-α单克隆抗体(英国Abcam公司);兔抗鼠抵抗素单克隆抗体(英国Biorbyt公司);山羊抗兔二抗PV-6001、DAB显色试剂盒(北京中杉金桥生物有限公司);葡萄糖(FBS)、TC、TG、LDL-C、HDL-C(北京利德曼公司);游离脂肪酸(NEFA,浙江东瓯生物工程公司)。
1.2 模型构建、分组及干预方法 SD大鼠适应性饲养1周后,采用随机数字表法分为假手术组10例、手术组20例。手术前大鼠禁食12 h,腹腔注射10%水合氯醛麻醉。手术组在无菌条件下经腰背部双侧切口进入腹腔,切除双侧卵巢后分层缝合切口,构建去卵巢去势(绝经)模型。假手术组打开腹腔后,摘除腹腔内与卵巢体积相当的脂肪组织,缝合切口。术后1周美蓝染色观察阴道上皮细胞,如无动情周期变化则确定去势成功,术后1周开始干预。手术组大鼠随机分为去卵巢组、去卵巢+高脂饮食组(OVXH组)各10只。假手术组、去卵巢组给予基础饲料喂养,OVXH组给予高脂饲料喂养模拟绝经后体脂异常分布状态,连续12周,每周称体质量1次,自由进食和饮水。12周后OVXH组体质量、内脏脂肪指数均明显高于去卵巢组,血清LDL-C和NEFA水平均明显高于假手术组,确定存在绝经后体脂异常分布状态。
1.3 样品采集 12周后,采用腹腔注射10%水合氯醛溶液麻醉各组大鼠,固定于手术台,迅速剥离内脏脂肪组织,速冻于液氮中,隔日移入-80 ℃冰箱中保存待测。
1.4 内脏脂肪组织瘦素、脂联素、抵抗素、TNF-α蛋白表达检测 采用免疫组化法。取各组内脏脂肪组织,4%多聚甲醛固定,经乙醇梯度脱水、二甲苯透明、浸蜡、包埋制成蜡块。常规石蜡切片,梯度脱蜡至水,抗原热修复,3%过氧化氢10 min灭活内源性酶。山羊血清工作液封闭,分别加稀释好的一抗瘦素(1∶300)、脂联素(1∶300)、抵抗素(1∶200)、TNF-α(1∶300)37 ℃孵育1 h。PBS清洗后加二抗PV-6001,37 ℃30 min,PBS清洗后加DAB显色1 min,清洗,苏木素复染、脱水、透明、封片,显微镜观察,拍照,灰度分析采用Image-Pro Plus6.0图像分析软件。
1.5 内脏脂肪组织瘦素、脂联素、抵抗素、TNF-α mRNA表达检测 采用RT-PCR法。提取内脏脂肪组织总RNA,紫外分光光度计检测确定总RNA浓度及纯度。严格按照cDNA第一链合成试剂盒说明,合成cDNA第一链。瘦素引物序列:正义链5′-AGCAGCTGCAAGGTCCAAG-3′,反义链5′-CCGACTGCGTGTGTGAAATG-3′,产物长度197 bp。脂联素引物序列:正义链5′-ACAAGGCCGTTCTCTTCACC-3′,反义链5′-ACACTTGGAGCCAGACTTGG-3′,产物长度111 bp。抵抗素引物序列:正义链5′-TCATGCCCAGAACCGAGTTG-3′,反义链5′-GGCTTCATCCATGGGACACA-3′,产物长度148 bp。TNF-α引物序列:正义链5′-GCTCCCTCTCATCAGTTCCA-3′,反义链5′-GCTTGGTGGTTTGCTACGAC-3′,产物长度102 bp。β-actin引物序列:正义链5′-CCCATCTATGAGGGTTACGC-3′,反义链5′-TTTAATGTCACGCACGATTTC-3′,产物长度165 bp。取2 μL合成的cDNA产物及相应的上下游引物加入SuperReal PreMix Plus实时荧光定量PCR反应体系中,总反应体系为20 μL ,扩增条件为95 ℃预变性15 min,95 ℃ 10 s、60 ℃ 30 s共40个循环,β-actin作为内参。以β-actin基因的表达量作为内参来校正目的基因的表达量,每个标本做3个复孔,取平均值,结果以2-ΔΔCT表示。RT-PCR引物序列由上海生工生物工程技术公司设计、合成。
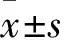
2 结果
2.1 各组内脏脂肪组织瘦素、脂联素、抵抗素和TNF-α蛋白表达比较 瘦素、脂联素、抵抗素和TNF-α均在脂肪细胞胞质表达,棕黄色颗粒散在分布,细胞核内几乎没有表达。与假手术组相比,去卵巢组和OVXH组内脏脂肪组织瘦素蛋白表达降低,脂联素、抵抗素及TNF-α蛋白表达均增强(P<0.05或<0.01)。与去卵巢组相比,OVXH组内脏脂肪组织抵抗素及TNF-α蛋白表达均增强(P均<0.05)。见表1。
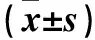
表1 各组内脏脂肪组织瘦素、脂联素、抵抗素和TNF-α蛋白表达比较
注:与假手术组相比,*P<0.05,#P<0.01;与去卵巢组相比,△P<0.05。
2.2 各组内脏脂肪组织瘦素、脂联素、抵抗素和TNF-α mRNA表达比较 去卵巢组和OVXH组内脏脂肪组织脂联素、抵抗素和TNF-α mRNA表达水平高于假手术组(P<0.05或<0.01),OVXH组内脏脂肪组织抵抗素和TNF-α的mRNA表达水平均高于去卵巢组(P均<0.05)。见表2。
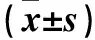
表2 各组内脏脂肪组织瘦素、脂联素、抵抗素和TNF-α mRNA表达比较
注:与假手术组相比,*P<0.05,△P<0.01;与去卵巢组相比,#P<0.05。
3 讨论
绝经后女性超重和肥胖特别是中心性肥胖的发病率显著升高,这种绝经后女性脂肪组织的再分布可促进一系列代谢性疾病的发生,特别是使代谢综合征患病率显著增加[6],与之相对应的心血管疾病发病风险也显著增高。绝经后女性雌激素缺乏与绝经后体脂增加、体脂分布密切相关[7]。有研究显示,雌激素缺乏可通过影响糖脂代谢关键酶的活性,以及调控胰岛素信号转导通路的不同环节,进而诱导或加重胰岛素抵抗[8~10]。此外,雌激素缺乏可直接或间接作用下丘脑,进而通过调控机体物质和能量代谢[11],增强机体对肥胖和代谢综合征的易感性。胰岛素抵抗是代谢综合征发病的中心环节,与代谢有关的炎症因子增多是代谢综合征发生发展的关键。脂肪组织作为一个活跃的内分泌器官,在胰岛素抵抗、代谢综合征的发生中发挥重要作用。肥胖可造成脂肪组织及肝脏等脏器的脂肪堆积和巨噬细胞浸润,产生大量的促炎因子和脂肪因子,如瘦素、脂联素、抵抗素、TNF-α、IL-6等,这些细胞因子可通过影响摄食中枢和调节机体胰岛素敏感性,干扰包括胰岛素信号传导通路在内的多种代谢通路,从而导致胰岛素抵抗[12~16]。
瘦素主要由白色脂肪组织合成和分泌的,其最主要功能是调节机体的能量平衡。当机体脂肪含量上升时,脂肪组织可分泌大量瘦素,激活下丘脑-神经肽通路,进而发挥减低食欲、增加耗能、降低体质量的作用。研究显示,雌激素可提高大鼠血液循环中瘦素和脂肪组织中瘦素的表达,从而起到抑制食欲,减少大鼠摄食量的作用[17]。本研究发现,去卵巢组和OVXH组内脏脂肪组织瘦素蛋白表达降低,提示去卵巢后大鼠内脏脂肪组织瘦素蛋白表达明显减弱,可能与去卵巢后造成的性激素水平降低有关,与Fungfuang等[18]研究一致。
脂联素是由脂肪细胞分泌的一种糖蛋白,参与了血脂、血糖代谢以及炎症病理过程,在代谢综合征及拮抗动脉粥样硬化方面有重要作用。研究发现,绝经后女性血清脂联素水平显著高于绝经前女性,无论绝经与否,肥胖者均具有较低的脂联素水平,提示血清低脂联素与代谢综合征相关组分密切相关[19]。本研究发现,去卵巢组、OVXH组大鼠内脏脂肪组织脂联素蛋白表达高于假手术组,且OVXH组内脏脂肪组织脂联素蛋白表达高于去卵巢组,去卵巢和高脂饮食诱导大鼠模型脂肪组织脂联素呈高分泌模式,这与绝经后女性血清低脂联素水平不一致[19],具体机制还有待进一步研究。
抵抗素是由白色脂肪特异分泌的一种富含半胱氨酸的蛋白质。抵抗素可通过作用于胰岛素受体和胰岛素受体底物、上调细胞因子信号转导等途径降低组织对胰岛素的敏感性,从而导致胰岛素抵抗的发生[20]。绝经后代谢综合征女性抵抗素水平显著增高,特别是与血脂异常和中心型肥胖密切相关[21]。本研究发现,去卵巢组、OVXH组大鼠内脏脂肪组织抵抗素蛋白及mRNA表达均高于假手术组,且OVXH组抵抗素蛋白及mRNA表达高于去卵巢组,提示去卵巢大鼠体脂分布异常可通过脂肪组织抵抗素的高表达,以降低组织胰岛素敏感性,诱导胰岛素抵抗,参与代谢综合征的发生。
TNF-α是一种多功能的细胞因子,它除了激活白细胞,介导内毒素性休克、调节炎症及免疫反应外,脂肪组织TNF-α的高表达与胰岛素抵抗、BMI密切相关。研究显示,脂肪细胞分泌的TNF-α进入血液后可以通过胰岛素受体抑制酪氨酸激酶的活性,使葡萄糖转运受阻,导致胰岛素抵抗[22]。无论男女,代谢综合征患者血清中TNF-α的水平明显增高[23]。本研究发现,去卵巢组、OVXH组大鼠内脏脂肪组织TNF-α蛋白及mRNA表达均高于假手术组,且OVXH组内脏脂肪组织TNF-α蛋白及mRNA表达高于去卵巢组,提示去卵巢大鼠体脂分布异常可通过脂肪组织TNF-α高表达,诱导胰岛素抵抗,参与代谢综合征的发生。
综上所述,去卵巢后雌性大鼠可出现体脂分布异常,内脏脂肪细胞脂联素、抵抗素和TNF-α的表达显著增强,瘦素表达显著减弱,高脂饮食可进一步增加对以上脂肪因子的影响,提示绝经后的体脂分布异常可导致内脏脂肪组织的脂肪因子及TNF-α表达异常,可能与绝经后代谢综合征的发病有关。
[1] Hidalgo LA, Chedraui PA, Morocho N, et al. The metabolic syndrome among postmenopausal women in Ecuador[J].Gynecol Endocrinol, 2006,22(8):447-454.
[2] He Y, Jiang B, Wang J, et al. Prevalence of the metabolic syndrome and its relation to cardiovascular disease in an elderly Chinese population[J]. J Am Coll Cardiol, 2006,47(8):1588-1594.
[3] Panotopoulos G, Ruiz JC, Raison J, et al. A menopause, fat and lean distribution in obese women[J]. Maturitas, 1996,25(11):11-19 .
[4] Tchernof A, Poehlman A. Effects of the menopause transition on body fatness and body fat distribution[J]. Obes Res, 1998,6(3):246-254 .
[5] 陈娟,邓军,张宇燕,等.丹参素对高脂血症大鼠脂代谢调节机制研究[J].中国中药杂志,2015,40(2):313-317.
[6] Lobo RA. Metabolic syndrome after menopause and the role of hormones[J]. Maturitas, 2008,60(1):10-18.
[7] Liedtke S, Schmidt ME, Vrieling A, et al. Postmenopausal sex hormones in relation to body fat distribution[J]. Obesity (Silver Spring), 2012,20(5):1088-1095.
[8] Kim JY, Jo KJ, Kim BJ, et al. 17β-estradiol induces an interaction between adenosine monophosphate-activated protein kinase and the insulin signaling pathway in 3T3-L1 adipocytes[J]. Int J Mol Med, 2012,30(4):979-985.
[9] Handgraaf S, Riant E, Fabre A, et al. Prevention of obesity and insulin resistance by estrogens requires ERα activation function-2 (ERαAF-2), whereas ERαAF-1 is dispensable[J].Diabetes, 2013,62(12):4098-4108.
[10] Narasimhan A, Sampath S, Jayaraman S, et al. Estradiol favors glucose oxidation in gastrocnemius muscle through modulation of insulin signaling molecules in adult female rats[J]. Endocr Res, 2013,38(4):251-262.
[11] Lizcano F, Guzmán G. Estrogen deficiency and the origin of obesity during menopause[J]. Biomed Res Int, 2014,2014:757461.
[12] Asrih M, Jornayvaz FR.Inflammation as a potential link between nonalcoholic fatty liver disease and insulin resistance[J]. J Endocrinol, 2013,218(3):25-36.
[13] Kim OK, Jun W, Lee J. Mechanism of ER stress and inflammation for hepatic insulin resistance in obesity[J].Ann Nutr Metab, 2015,67(4):218-227.
[14] Stefanska A, Bergmann K, Sypniewska G. Metabolic syndrome and menopause: pathophysiology, clinical and diagnostic significance[J]. Adv Clin Chem, 2015,72:1-75.
[15] Barbarroja N, Lopez-Pedrera C, Garrido-Sanchez L, et al. Progression from high insulin resistance to type 2 diabetes does not entail additional visceral adipose tissue inflammation[J]. PLoS One, 2012,7(10):e48155.
[16] Smitka K, Mareová D.Adipose tissue as an endocrine organ: an update on pro-inflammatory and anti-inflammatory microenvironment[J].Prague Med Rep, 2015,116(2):87-111.
[17] Fungfuang W, Nakada T, Nakao N, et al. Serum leptin concentrations, leptin mRNA expression, and food intake during the estrous cycle in rats[J]. Lab Anim Res, 2013,29(1):1-6.
[18] Fungfuang W, Terada M, Komatsu N, et al. Effects of estrogen on food intake, serum leptin levels and leptin mRNA expression in adipose tissue of female rats[J]. Lab Anim Res, 2013,29(3):168-173.
[19] Ben AS, Jemaa R, Ftouhi B, et al. Relationship of plasma leptin and adiponectin concentrations with menopausal status in Tunisian women[J]. Cytokine, 2011,56(2):338-342.
[20] Iwasa T, Matsuzaki T, Matsui S, et al. The effects of ovariectomy and LPS-induced endotoxemia on resistin levels in female rats[J].Cytokine, 2015,76(2):558-560.
[21] Chedraui P, Pérez-López FR, Escobar GS, et al. Circulating leptin, resistin, adiponectin, visfatin, adipsin and ghrelin levels and insulin resistance in postmenopausal women with and without the metabolic syndrome[J]. Maturitas, 2014,79(1):86-90.
[22] Yamakawa J, Moriga J, Takahashi T, et al. A kampo medicine, boi-ogi-to, inhibits obesity in ovariectomized Rats[J]. ECAM, 2010,7(1):87-95.
[23] 洪玉,吴小川,罗兰.脂肪细胞因子与代谢综合征的相关性研究[J].山东医药,2012,52(40):31-34.
山东省青岛经济技术开发区重点科技发展计划项目(2013-1-83)。
翟木绪(E-mail: mxzhai@163.com)
10.3969/j.issn.1002-266X.2016.46.008
R589.2;R711.5
A
1002-266X(2016)46-0031-04
2016-03-27)
