2型糖尿病增殖期视网膜病变患者血清胆红素、镁离子水平变化及意义
2017-01-06商书霞刘晓耕吕飞段丽君宋光耀
商书霞,刘晓耕,吕飞,段丽君,宋光耀
(1冀中能源峰峰集团有限公司总医院,河北邯郸056200;2河北省人民医院)
2型糖尿病增殖期视网膜病变患者血清胆红素、镁离子水平变化及意义
商书霞1,刘晓耕1,吕飞1,段丽君1,宋光耀2
(1冀中能源峰峰集团有限公司总医院,河北邯郸056200;2河北省人民医院)
目的 探讨血清胆红素和镁(Mg)离子水平变化在2型糖尿病增殖期视网膜病变(PDR)发病中的意义。方法 选择2型糖尿病患者340例,按照是否存在糖尿病性视网膜病变(DR)分为糖尿病无视网膜病变(NDR)组130例、糖尿病非增殖期视网膜病变(NPDR)组115例、PDR组95例。收集各组患者的一般资料,包括姓名、性别、年龄、病程、身高、体质量、BMI、收缩压(SBP)。采集清晨空腹肘静脉血,测定各组糖化血红蛋白(HbA1c)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IBIL)、血清Mg离子水平。采用 Logistic回归分析法分析导致PDR的危险因素。结果 NPDR组及PDR组血清TBIL、IBIL及Mg离子水平均低于NDR组,PDR组血清TBIL及Mg离子水平均低于NPDR组(P均<0.05)。TBIL(OR=0.641,95%CI为0.576~0.714)、Mg(OR=0.251,95%CI为0.066~0.960)是PDR的保护性因素。结论 PDR患者血清TBIL及Mg离子水平均低于NPDR患者,TBIL、Mg离子是PDR的保护性因素。
胆红素;镁;糖尿病视网膜病变;2型糖尿病;氧化应激
糖尿病性视网膜病变(DR)是糖尿病患者最常见的眼部微血管并发症,也是糖尿病患者致盲最危险的因素[1]。近年研究表明,氧化应激反应在DR的发生和发展过程中发挥重要作用[2,3]。机体长期处于高糖状态时,可导致细胞产生氧化应激反应,致使神经节细胞损伤;氧化应激反应还可致体内抗氧化剂大量消耗,引起视网膜细胞损伤甚至凋亡,从而导致DR发生。血清胆红素是人体内的一种天然抗氧化剂,可参与氧化应激反应。研究发现,胆红素可清除氧自由基,抑制脂质及脂蛋白的氧化,是2型糖尿病发病的潜在保护性因素[4,5]。在人体中,血清镁(Mg)离子水平与机体氧化应激状况有关[6]。Silva等[7]研究发现,血清Mg离子水平变化与糖尿病微血管病变相关。血清胆红素及Mg离子水平在DR诊断中的价值尚不明确。2013年9月~2014年12月,我们对不同阶段的DR患者血清胆红素及Mg离子水平变化进行了检测,探讨胆红素及Mg离子在不同DR病变阶段的变化及意义。
1 资料与方法
1.1 临床资料 选择同期在河北省人民医院内分泌科住院的2型糖尿病患者340例,男166例、女174例,年龄41~83(62.50±11.20)岁,病程10~21(12.47±2.37)年。诊断标准均符合1999年WHO制定的2型糖尿病诊断标准。经眼底检查,参照2002年DR国际分级标准,分为无视网膜病变(NDR)组130例、非增殖期糖尿病性视网膜病变(NPDR)组115例、增殖期糖尿病性视网膜病变(PDR)组95例。纳入标准:年龄>18岁;2型糖尿病诊断明确;血清AST和(或)ALT≤40 U/L;无胆囊结石及肝脏疾患;血肌酐≤107 μmol/L。排除标准:影响胆红素水平变化的疾病如肝炎、溶血性黄疸、胰腺炎、胆道结石及炎症等;糖尿病急性并发症、感染等应激情况;恶性肿瘤;营养不良;贫血;痛风;严重心、肺、肾疾病;甲亢、垂体瘤、慢性胰腺炎等疾病;肝肾功能异常;服用除降糖药以外的影响血糖药物者。
1.2 研究方法 收集各组患者的一般资料,包括姓名、性别、年龄、病程、身高、体质量、BMI、收缩压(SBP)。采集清晨空腹肘静脉血,测定各组糖化血红蛋白(HbA1c)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IBIL)、血清Mg离子水平。
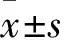
2 结果
2.1 三组一般资料、血脂、肝功能指标及Mg离子水平比较NPDR组及PDR组血清TBIL、IBIL及Mg离子水平均低于NDR组,PDR组血清TBIL及Mg离子水平均低于NPDR组(P均<0.05)。见表1。
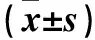
表1 三组一般资料、血脂、肝功能指标及Mg离子水平比较
注:与NDR组比较,#P<0.05;与NPDR组比较,△P<0.05。
2.2 DR危险因素分析结果 NPDR危险因素分析:将对NPDR有意义的参数带入回归方程,结果显示TG(OR=1.892,95%CI为1.272~2.814)、LDL-C(OR=1.425,95%CI为1.163~1.746)是NPDR的危险因素(P均<0.05),而TBIL(OR=0.680,95%CI为0.602~0.767)是NPDR的保护性因素(P<0.05)。PDR危险因素分析:将对PDR有意义的参数带入回归方程,结果显示TG(OR=1.760,95%CI为1.222~2.533)、LDL-C(OR=1.446,95%CI为1.186~1.762)是PDR的危险因素(P均<0.05),而TBIL(OR=0.641,95%CI为0.576~0.714)、Mg离子(OR=0.251,95%CI为0.066~0.960)是PDR的保护性因素(P均<0.05)。
3 讨论
DR是由于糖尿病患者长期视网膜微血管的持续损害所致,其中PDR是严重阶段,患者常出现视网膜前出血、硬性渗血、微动脉瘤等非正常变化,导致视力逐渐下降,严重者甚至失明。视网膜新生血管(RNV)形成在PDR的发生及发展过程中起重要作用,RNV合并出血、脂质渗出、增生一系列非正常变化,是机体对长期缺氧的一种顺应性代偿反应,组织的慢性缺血和缺氧以及血流切应力的变化均可导致炎性细胞在管壁四周聚积,使得血管组织增生、成熟和迁移,最后逐渐形成新生血管。眼部组织的缺血缺氧是导致PDR患者PNV形成的根本原因[8]。供氧不足导致缺氧诱导因子-1(HIF-1)水平升高,HIF-1刺激血管内皮生长因子VEGF、PDGF-B、基质细胞衍生生长因子-1(SDF-1)的表达,致氮氧化合物(NOX)活化,使细胞产生氧化应激反应,产生更多的活性氧(ROS),促进细胞凋亡,造成血管内皮细胞损伤及新生血管的生长。胆红素可清除氧自由基,有抗炎和抗氧化作用[9],参与氧化应激反应。血清Mg离子水平也与机体氧化应激有关[6]。多项研究表明,血清胆红素和Mg离子可参与氧化应激反应,使机体抗氧化能力增强、抑制ROS产生,从而保护视网膜毛细血管周细胞免受损伤。
Sharma等[10]研究证实,缺血再灌注后,猪心肌细胞胞质内血红素氧合酶1(HO-1)mRNA表达明显升高,提示胆红素具有抗氧化作用。Oda等[11]对3 681例非糖尿病受试者进行了一项横断面研究,结果显示TBIL与糖尿病前期呈负相关。Hamur等[12]研究表明,TBIL可预测糖尿病前期患者血管并发症的发生发展。本研究发现,PDR组的TBIL、DBIL、IBIL较NPDR 及NDR组降低,Logistic 回归分析示血清TBIL水平为DR保护性因素,提示胆红素可通过抗氧化应激系统,清除自由基,减轻和消除机体的氧化损伤、血管内皮细胞损伤及新生血管的生长,阻止DR的发生发展。
血清Mg离子是人体正常生命活动及代谢过程必不可少的元素,也是糖代谢过程中多种酶的重要辅助因子和激活剂。如机体缺乏Mg离子,将导致磷酸化过程受阻,致使多种酶功能不全,直接影响糖代谢,从而使机体产生炎症反应及过多ROS,损伤细胞线粒体功能,使细胞抗氧化能力减弱,导致糖尿病微血管并发症的发生。Gommers等[13]研究显示,低镁血症可导致胰岛素抵抗,而胰岛素抵抗加剧血清中Mg离子水平的降低,提示2型糖尿病与低镁血症密切相关,并相互影响形成恶性循环。Guerrero-Romero等[14]研究表明,健康儿童血Mg离子水平的降低与血管内皮损伤有关。Hamdan等[15]研究显示,合并DR的患者血清Mg离子水平明显低于NDR者,提示低镁血症与DR的发病相关。本研究发现,PDR组血清Mg离子水平较NPDR 组及NDR组降低,且PDR组血清Mg离子水平低于NPDR组;Logistic回归分析示Mg离子是PDR的保护性因素。提示血清Mg离子水平升高在NDR、NPDR进展至PDR中起重要作用,提高Mg离子水平可能通过减少ROS的生成,保护细胞膜的完整性,从而延缓或阻止PDR的进展。考虑PDR与血清TBIL及Mg离子有关,其可能机制是二者均通过抗氧化应激,抑制ROS产生,保护视网膜毛细血管周细胞免受损伤,从而参与对预防DR的发生及NPDR进展至PDR过程中起保护作用。
[1] McAuley AK, Sanfilippo PG, Hewitt AW, et al. Vitreous biomarkers in diabetic retinopathy: a systematic review and meta-analysis[J]. J Diabetes Complications, 2014,28(3):419-425.
[2] Brzovic-Saric V, Landeka I, Saric B, et al. Levels of selected oxidative stress markers in the vitreous and serum of diabeticretinopathy patients[J]. Mol Vis, 2015,21:649-664.
[3] Taylor-Phillips S, Mistry H, Leslie R, et al. Extending the diabetic retinopathy screening interval beyond 1 year:systematic review[J]. Br J Ophthalmol, 2016,100(1):105-114.
[4] Abbasi A, Deetman PE, Corpeleijn E, et al. Bilirubin as a potential causal factor in type 2 diabetes risk: a Mendelian randomization study[J]. Diabetes, 2015, 64(4): 1459-1469.
[5] O′Malley SS, Wu R, Mayne ST, et al. Smoking cessation is followed by increases in serum bilirubin an endogenous antioxidant associated with lower risk of lung cancer and cardiovascular disease[J]. Nicotine Tob Res, 2014,16(8):1145-1149.
[6] Kundu D, Osta M, Mandal T, et al. Serum magnesium levels in patients with diabetic retinopathy[J]. J Nat Sci Biol Med, 2013,4(1):113-116.
[7] Silva AP, Mendes F, Fragoso A, et al. Altered serum levels of FGF-23 and magnesium are independent risk actors for anincreased albumin-to-creatinine ration in type 2 diabetics with chronic kidney disease[J]. J Diabetes Complications, 2016,30(2):275-280.
[8] 张雯,柯亭羽.Netrin-1在糖尿病肾病及糖尿病视网膜病变中作用的研究进展[J].山东医药,2016,56(30):105-107.
[9] Zhu KF, Wang YM, Wang YQ, et al. The relationship between serum levels of total bilirubin and coronary plaque vulnerability[J]. Coron Artery Dis, 2016,27(1):52-58.
[10] Sharma HS, Das DK, Verdouw PD.Enhanced expression and localization of heme oxygenase-1 during recovery phase of porcine Stunned myocardium[J]. Mol Cell Biochem,1999,196(1-2):133-139.
[11] Oda E. Cross-sectional and longitudinal associations between serum bilirubin and prediabetes in a health screening population[J]. Can J Diabetes, 2016,40(3):270-275.
[12] Hamur H, Duman H, Demirtas L, et al. Total bilirubin levels predict subclinical atherosclerosis in patients with prediabetes[J]. Am J Cardiol, 2016,117,Suppl(1):S105-106.
[13] Gommers LM, Hoenderop JG, Bindels RJ, et al. Hypomagnesemia in type 2 diabetes: a vicious circle[J]. Diabetes, 2016,65(1):3-13.
[14] Guerrero-Romero F, Rodriguez-Moran M, Hernandez-Ronquillo G, et al. Low serum magnesium levels and its association with high blood pressure in children[J]. J Pediatr, 2016,168:93-98.
[15] Hamdan HZ, Nasser NM, Adam AM, et al. Serum magnesium, iron and ferritin levels in patients with diabetic retinopathy attending makkah eye complex, khartoum, sudan[J]. Biol Trace Elem Res, 2015,165(1):30-34.
Changes in levels of serum bilirubin and magnesium in patients with proliferative diabetic retinopathy of type 2 diabetes
SHANGShuxia1,LIUXiaogeng,LYUFei,DUANLijun,SONGGuangyao
(JizhongEnergyFengfengGroupHospital,Handan056200,China)
Objective To investigate the significance of changes in levels of serum bilirubin and magnesium (Mg) in the pathogenesis of proliferative diabetic retinopathy (PDR) of type 2 diabetes.Methods Totally 340 patients with type 2 diabetes mellitus (T2DM) were recruited.According to whether having diabetic retinopathy (DR) or not, all patients were divided into non-diabetic retinopathy (NDR) group (n=130), non-proliferative diabetic retinopathy (NPDR) group (n=115) and PDR group (n=95). General data including name, sex, age, course, height, body mass, BMI, and systolic blood pressure (SBP) were collected. The morning fasting elbow vein blood was collected. Glycosylated hemoglobin A1c(HbA1c), total cholesterol (TC), triglyceride (TG), low-density lipoprotein cholesterol (LDL-C), high-density lipoprotein cholesterol (HDL-C), alanine aminotransferase (ALT) , aspartate aminotransferase (AST), total bilirubin (TBIL), direct bilirubin (DBIL), indirect bilirubin (IBIL) and serum Mg levels were detected. Logistic regression analysis was used to analyze the risk factors of PDR.Results TBIL, DBIL, IBIL and Mg levels were significant lower in the NPDR and PDR groups than those in the NDR group. TBIL and Mg levels were significant lower in the PDR group than those in the NPDR group (allP<0.05). Logistic regression analysis showed TBIL (OR=0.641, 95%CI: 0.576-0.714), Mg (OR=0.251, 95%CI: 0.066-0.960) were protective factors for PDR.Conclusions TBIL and Mg levels in PDR patients were significant lower than those in NPDR patients, and TBIL, Mg were protective factors for PDR.
bilirubin; magnesium; diabetic retinopathy; type 2 diabetes mellitus; oxidative stress
河北省卫生厅医学科学重点课题资助项目(20160744)。
商书霞(1973-),女,硕士学位,副主任医师,主要研究方向为内分泌及代谢疾病。E-mail: shangji137@sina.com
简介:宋光耀(1961-),男,博士学位,主任医师,主要研究方向为内分泌及代谢疾病。E-mail: sguangyao2@163.com
10.3969/j.issn.1002-266X.2016.46.006
R587.2;R774.1
A
1002-266X(2016)46-0024-03
2016-07-15)
