炎症对高磷所致大鼠血管平滑肌细胞钙化的影响及机制探讨
2017-01-06冯灵张艺姜慧玲冯志强盘强文
冯灵,张艺,姜慧玲,冯志强,盘强文
(西南医科大学,四川泸州646000)
炎症对高磷所致大鼠血管平滑肌细胞钙化的影响及机制探讨
冯灵,张艺,姜慧玲,冯志强,盘强文
(西南医科大学,四川泸州646000)
目的 探讨炎症对高磷所致大鼠血管平滑肌细胞钙化的影响及可能机制。方法 原代培养大鼠血管平滑肌细胞,分为空白对照组、高磷组、炎症组及高磷+炎症组。高磷组、高磷+炎症组在加入4.8 mmol/L磷的基础培养基中培养,建立高磷诱导的大鼠血管平滑肌细胞钙化模型。高磷+炎症组加入10 μg/mL细菌脂多糖(LPS),炎症组只加入10 μg/mL细菌脂多糖(LPS),空白对照组在基础培养基中培养。各组均培养48 h后,检测培养液C反应蛋白(CRP)水平、细胞碱性磷酸酶(ALP)活性及钙沉积量;Realtime-PCR法检测细胞骨形成蛋白-2(BMP-2)、肿瘤抑制基因4(Smad4)、肌肉片段同源盒2(Msx2)及成骨细胞特异性转录因子(Osterix)mRNA相对表达量。结果 高磷组、炎症组及高磷+炎症组培养液中CRP水平、细胞ALP活性及钙沉积量均高于空白对照组(P均<0.05),且高磷+炎症组培养液中CRP水平、细胞ALP活性及钙沉积量均高于高磷组及炎症组(P均<0.05),炎症组培养液中CRP水平和细胞钙沉积量均低于高磷组(P均<0.05)。高磷组、炎症组及高磷+炎症组细胞中BMP-2、Smad4、Msx2及Osterix mRNA相对表达量均高于空白对照组(P均<0.05),且高磷+炎症组细胞中BMP-2、Smad4、Msx2及Osterix mRNA相对表达量均高于高磷组及炎症组(P均<0.05),炎症组细胞中Smad4、Msx2及Osterix mRNA相对表达量均低于高磷组(P均<0.05)。结论 炎症可显著加重高磷所致的大鼠血管平滑肌细胞钙化,其作用机制可能与上调BMP-2、Smad4、Msx2、Osterix表达及ALP活性等有关。
炎症;高磷;平滑肌细胞;血管钙化;终末期肾病
心血管疾病(CVD)是终末期肾病(ESRD)常见的并发症,ESRD诱发的心血管钙化又是导致CVD发生的独立危险因素。ESRD患者发生血管钙化的危险因素有高血压、糖尿病、脂质代谢异常、钙磷代谢紊乱及慢性炎症等。研究发现,ESRD患者血管钙化与骨的矿化过程类似,由血管平滑肌细胞(VSMCs)参与,且受多种因子和信号通路调控[1]。目前研究证实,参与调节VSMCs转分化为成骨样细胞的骨形成相关因子有骨形成蛋白-2(BMP-2)和肿瘤抑制基因4(Smad4)等[2]。研究证实,高磷导致VSMCs钙化的机制是使平滑肌细胞向成骨样细胞转变、细胞外基质重塑及平滑肌细胞凋亡等,而炎症对血管中膜平滑肌细胞钙化影响的研究则较少。高血磷、慢性炎症作为两种普遍存在于ESRD患者体内对血管钙化起主要促进作用的因素,是否通过促进VSMCs向成骨样细胞转变而导致血管钙化,其机制尚不明确。2015年3月~2016年1月,我们通过体外原代培养大鼠VSMCs,用高磷培养基建立VSMCs钙化模型,并加入细菌脂多糖(LPS)引发炎症,观察培养液中C反应蛋白(CRP)水平、细胞碱性磷酸酶(ALP)活性和细胞钙沉积量的改变及细胞BMP-2、Smad4、肌肉片段同源盒2(Msx2)和成骨细胞特异性转录因子(Osterix) mRNA的表达变化,探讨炎症对高磷所致血管钙化的影响,为ESRD患者血管钙化的防治提供新的思路。
1 材料与方法
1.1 动物、试剂及仪器 雄性SD大鼠60只,体质量(150±10)g,由西南医科大学实验动物中心提供。胰蛋白酶、青链霉素、RIPA裂解液、BCA蛋白定量检测试剂盒(江苏海门碧云天生物技术有限公司);M199培养基、胎牛血清(HyClone,赛默飞世尔生物化学制品北京有限公司);DAB试剂盒(ZLI-9017,北京中杉金桥生物技术有限公司);ALP测试盒(A059-2,南京建成生物工程研究所);大鼠CRP酶联免疫分析试剂盒(F15232,上海西唐生物科技有限公司);逆转录试剂盒(K1622,Fermentas,加拿大);CO2培养箱(MCO-15AC,Sanyo,日本);倒置相差显微镜(CKX41SF,Olympus,日本);多功能酶标仪(SpectraMax M3,Molecular Devices,美国);PCR 扩增仪(2720,Applied Biosystems,美国);实时定量PCR 仪(Rotor-Gene 3000,Corbett Research,澳大利亚)等。
1.2 细胞培养 采用组织贴块法原代培养大鼠VSMCs,待VSMCs爬出并增殖至皿底面积的80%左右时传代。将VSMCs以0.5×105/mL、2 mL/孔接种于20块6孔板中,待细胞长满70%时,换含100 U/mL青霉素、0.1 mg/mL链霉素及0.5%牛血清白蛋白(BSA)的M199细胞培养基同步化处理24 h。
1.3 高磷诱导的VSMCs钙化模型构建及鉴定 将VSMCs分别加入含磷1.01、2.4、3.6及4.8 mmol/L的培养基,均培养48 h,构建高磷诱导的VSMCs钙化模型构建。茜素红钙染色发现,48 h时含磷浓度为4.8 mmol/L培养基中的细胞有明显的橘红色染液附着,而含磷浓度为1.01、2.4及3.6 mmol/L的培养基中细胞橘红色染料附着不明显。邻甲酚酞络合酮(OCPC)法检测细胞钙沉积量,结果示含磷3.6及4.8 mmol/L时的细胞钙沉积量均高于含磷1.01及2.4 mmol/L时(P均<0.05)。故选择含磷4.8 mmol/L时的细胞模型进行后续实验。
1.4 细胞分组、模型制备及干预方法 将VSMCs以0.5×105/mL于6孔板内传代培养,同步化处理24 h后,分为空白对照组、高磷组、炎症组及高磷+炎症组。高磷组、高磷+炎症组在加入4.8 mmol/L磷的基础培养基中培养,建立高磷诱导的大鼠血管平滑肌细胞钙化模型。高磷+炎症组加入10 μg/mL LPS;炎症组只加入10 μg/mL LPS;空白对照组在基础培养基中培养。各组均培养48 h。
1.5 各组培养液中CRP水平、细胞ALP活性及钙沉积量检测 吸取培养液,2 000 r/min离心20 min,吸取上清液装入无菌管后,按CRP酶联免疫分析试剂盒说明书进行操作,测得各组培养液中CRP含量。弃细胞培养上清,用RIPA裂解细胞,取适量已裂解细胞按ALP测试盒说明书进行操作,检测细胞ALP活性。OCPC比色法检测各组细胞内钙浓度,BCA法检测蛋白含量以标化钙含量,最终得出各组细胞钙沉积量。
1.6 各组细胞中骨形成相关基因mRNA表达检测 采用Realtime-PCR法检测各组细胞中骨形成相关基因mRNA表达,包括BMP-2、Smad4、Msx2及Osterix。由上海生工生物工程股份有限公司合成各引物。大鼠BMP-2引物序列:正义链5′-GGGACCCGCTGTCTTCTA-3′,反义链5′-CAGCCTCAACTCAAACTC-3′。大鼠Smad4引物序列:正义链5′-CACTATGAGCGGGTTTC-3′,反义链5′-GTGGGTAAGGATGGCTGT-3′。大鼠Msx2引物序列:正义链5′-CGCCGTGGATACAGGA-3′,反义链5′-GCTGGGACGTGGTGAA-3′。大鼠Osterix引物序列:正义链5′-GCCTACTTACCCGTCTGACTTT-3′,反义链5′-GCCCACTATTGCCAACTGC-3′。内参β-actin:正义链5′-CACGATGGAGGGGCCGGACTCATC-3′,反义链5′-TAAAGACCTCTATGCCAACACAGT-3′。提取总RNA,细胞总RNA质量鉴定,逆转录成cDNA,以2-ΔΔCt得到mRNA相对表达量。
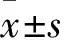
2 结果
2.1 各组培养液中CRP水平、细胞ALP活性及钙沉积量比较 高磷组、炎症组及高磷+炎症组培养液中CRP水平、细胞ALP活性及钙沉积量均高于空白对照组(P均<0.05),且高磷+炎症组培养液中CRP水平、细胞ALP活性及钙沉积量均高于高磷组及炎症组(P均<0.05)。炎症组培养液中CRP水平和细胞钙沉积量均低于高磷组(P均<0.05)。见表1。
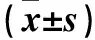
表1 各组培养液中CRP水平、细胞ALP活性及细胞钙沉积量比较
注:与空白对照组比较,*P<0.05;与高磷组比较,#P<0.05;与炎症组比较,△P<0.05。
2.2 各组细胞中骨形成相关基因mRNA表达比较 高磷组、炎症组及高磷+炎症组细胞中BMP-2、Smad4、Msx2及Osterix mRNA相对表达量均高于空白对照组(P均<0.05),且高磷+炎症组细胞中BMP-2、Smad4、Msx2及Osterix mRNA相对表达量均高于高磷组及炎症组(P均<0.05)。炎症组细胞中Smad4、Msx2及Osterix mRNA相对表达量均低于高磷组(P均<0.05)。见表2。
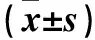
表2 各组细胞中骨形成相关基因mRNA表达比较
注:与空白对照组比较,*P<0.05;与高磷组比较,#P<0.05;与炎症组比较,△P<0.05。
3 讨论
ESRD患者体内广泛存在高磷血症,而高磷血症引起ESRD发生血管钙化的机制复杂,可能通过以下途径触发血管钙化:①高磷通过钠/磷共转运体致使细胞内磷升高,促进成骨相关的蛋白表达,从而引起钙化;②高磷诱导VSMCs发生凋亡,凋亡小体为钙化提供基础;③高磷刺激ALP、基质小泡、钙结合蛋白等潜在的矿化成核分子分泌;④高磷激活致炎信号途径,使血管平滑肌向成骨/成软骨样细胞转化[3]。ESRD患者血清中磷及钙水平是动脉硬化的一个重要因素,血磷增高可增加血清中矿物质水平、诱导血管平滑肌转化成为类成骨细胞,也可使钙磷乘积增高,形成不溶的磷酸钙,沉积于血管壁,导致血管钙化[4]。本课题组前期研究[5]证实,ESRD所致高磷血症可引起大鼠主动脉的钙化。高磷血症和慢性炎症常共存于大部分ESRD患者体内,其发生血管钙化的风险较大,而临床防治更注重改善这类患者的矿物质代谢紊乱,对其慢性炎症则不够重视。若能做到二者并重,也许会有更好的防治效果。Raggi等[6]研究发现,高磷血症是维持性血液透析患者发生血管钙化的独立危险因素。刘翻利等[7]研究发现,维持性血液透析患者使用低钙透析液后血清成纤维细胞生长因子23(FGF-23)水平下降,提示低钙透析液可能通过降低血清FGF-23水平,从而减少血管钙化的发生。研究[8]发现,使用无钙的磷酸盐结合剂治疗尿毒症大鼠能有效控制血管钙化的发展。
血管钙化是一个主动、可调节、有炎症参与的复杂过程。炎症反应与血管钙化密切相关,其部位涉及到血管内膜、中层和外膜。血管钙化的中心环节是VSMCs向成骨细胞的表型转化,而动脉壁炎症细胞激活及炎症因子释放引发的氧化级联反应,可通过改变VSMCs的表型等启动程序化的骨生成过程,最终导致并加速动脉钙化。Agharazii等[9]研究发现,慢性肾脏病(CKD)大鼠在发生胸主动脉钙化过程中,VSMCs向成骨样细胞转分化伴BMP-2和骨钙素表达增加的同时,IL-1β、IL-6和TNF-α的表达也明显增加。TNF-α是已被证实的在体内外可促进血管钙化的炎症因子。炎症和高磷均是诱导血管钙化的重要因素,且高磷饮食可诱发系统炎症,促进TNF-α表达增加,诱导成骨标志物表达,从而共同促进血管钙化。研究显示,血液透析患者的CRP显著升高,表明体内的炎症反应亢进,而降低血磷则可显著降低CRP的水平,可见高血磷与炎症反应关系密切[10]。然而,高磷引起炎症反应的具体机制尚不完全清楚。Yamada等[11]研究发现,炎症反应可能与炎性因子的活化及氧化应激有关。本研究发现,高磷组、炎症组及高磷+炎症组钙含量均高于空白对照组,且高磷+炎症组钙含量高于高磷组、炎症组,提示高磷和炎症均可促使VSMCs钙化,若二者同时存在则其促进作用更强。
CRP是一种炎症介质,参与炎症和免疫反应过程[12]。CRP与慢性肾衰竭患者动脉粥样硬化和心血管病变等并发症密切相关。李相等[13]研究发现,作为炎症特异性敏感指标的CRP与桡动脉钙化程度显著相关。刘小峰等[14]发现,高磷可通过增加线粒体膜电位,促进线粒体氧自由基产生增加,激活致炎信号途径NF-κB,使VSMCs向成骨/成软骨样细胞转化,是导致血管钙化的重要环节之一。本研究发现,高磷组、炎症组及高磷+炎症组培养液中的CRP含量高于空白对照组,提示高磷和LPS均可诱发VSMCs发生炎症反应,且高磷和炎症可通过增强CRP的表达促使VSMCs向成骨样细胞转化,进而发生钙化。
ALP是反映成骨细胞活性增强的重要标志,任何引起成骨细胞增生和活动旺盛的因素都可以使血清ALP活性增高。Murshed等[15]研究发现,除骨组织和牙齿外,只要能表达ALP或其他焦磷酸酶、细胞外基质纤维的任何组织都能出现钙化。同时,ALP还可以通过经典的Wnt信号通路和Msx2来增强其活性,从而加快血管钙化的发生发展。本研究发现,高磷组、炎症组及高磷+炎症组ALP活性明显高于空白对照组,提示高磷和炎症可能通过提高ALP活性促进VSMCs钙化。
BMP-2是目前较明确的血管钙化促进因子,是一种强效的骨形成因子,其机制可能是通过激活Smads信号转导,上调其下游基因Msx2表达,增强经典的Wnt3a/β连环信号通路从而促进成骨过程。Buendía等[16]研究发现,用TNF-α刺激血管内皮细胞后,可引起BMP-2和内皮微粒出现高表达,导致VSMCs成骨和钙化。Msx2是膜内成骨形成的必需成分,在成骨细胞分化、软骨形成及新生血管形成的过程中有重要作用,可通过上调Osterix表达以促进成骨作用[17]。而Osterix则是成骨细胞分化的一个关键性转录因子,在Osterix基因缺失的小鼠体内可发现成骨细胞形成障碍。Smads是TGF-β信号转导过程中重要的基因家族,其中Smad4在信号转导中起瓶颈作用。Zeini等[18]研究发现,Smad4的核移位可直接诱导细胞凋亡,VSMCs来源的凋亡小体可提供钙化核从而导致血管钙化。本研究发现,高磷组和炎症组BMP-2、Smad4、Msx2和Osterix mRNA相对表达量均高于空白对照组,结合高磷组和炎症组的钙含量也高于空白对照组的结果,考虑炎症及高磷都能通过这一途径促使VSMCs向成骨样细胞转化形成钙化;同时高磷+炎症组BMP-2、Smad4、Msx2和Osterix mRNA相对表达量及钙含量也高于高磷组和炎症组,提示炎症与高磷的结合可加速VSMCs钙化进程。
综上所述,高磷与炎症均可诱导体外培养的大鼠VSMCs钙化,炎症若结合高磷可显著加重体外培养的大鼠VSMCs钙化,其作用机制可能与上调BMP-2、Smad4、Msx2、Osterix和ALP等骨形成相关因子的表达有关。
[1] Pecovnik-Balon B.Cardiovascular calcification in patients with end-stage renal disease[J]. Ther Apher Dial, 2005, 9(3):208-210.
[2] Maecki R, Adamiec R.The role of calcium ions in the pathomechanism of the artery calcification accompanying atherosclerosis[J]. Postepy Hig Med Dosw (Online), 2005,59(6):42-47.
[3] Dai XY, Zhao MM, Cai Y,et al.Phosphate-induced autophagy counteracts vascular calcification by reducing matrix vesicle release[J].Kidney Int, 2013,83(6):1042-1051.
[4] Kwak SM,Kim JS,Choi Y,et al.Dietary intake of calcium and phosphorus and serum concentration in relation to the risk of coronary artery calcification in asymptomatic adults[J].Arterioscler Thromb Vasc Biol, 2014,34(8):1763-1769.
[5] 张艺,马玲,肖业伟,等.慢性炎症状态下成纤维细胞生长因子23与终末期肾病血管钙化的相关性[J].中国老年学杂志,2015,35(19):5422-5424.
[6] Raggi P, James G, Burke SK, et al. Decrease in thoracic vertebral bone attenuation with calcium-based phosphate binders in hemodialysis[J]. J Bone Miner Res, 2005,20(5):764-772.
[7] 刘翻利,王琴,徐海燕,等.低钙透析液对MHD患者血管钙化及血清FGF-23水平的影响[J].山东医药,2016,56(30):62-64.
[8] Phan O, Maillard M, Peregaux C, et al. PA21, a new iron-based noncalcium phosphate binder, prevents vascular calcification in chronic renal failure rats[J]. J Pharmacol Exp Ther, 2013, 346(2):281-289.
[9] Agharazii M, Louis SR, Gautier BA,et al.Inflammatory cytokines and reactive oxygen species as mediators of chronic kidney disease-related vascular calcification[J].Am J Hypertens, 2015,28(6):746-755.
[10] Calò LA,Savica V,Piccoli A,et al.Reduction of hyperphosphatemia is related with the reduction of C-reactive protein in dialysis patients.Study in sevelamer-resistant dialysis patients treated with chitosan chewing gum as salivary phosphate binder[J].Ren Fail, 2011,33(1):11-14.
[11] Yamada S, Taniguchi M, Tokumoto M, et al. The antioxidant tempol ameliorates arterial medial calcification in uremic rats: important role of oxidative stress in the pathogenesis of vascular calcification in chronic kidney disease[J].J Bone Miner Res, 2012,27(2):474-485.
[12] Shibata M, Nishiyama HL. Serum levels of rapid turnover proteins are decreased and related to systemic inflammation in patients with ovarian cancer [J]. Oncol Lett, 2014,7(2):373-377.
[13] 李相,邹洪斌,于金宇,等.老年终末期肾脏病患者血管钙化相关危险因素[J].中国老年学杂志,2013,7(33):3289-3292.
[14] 刘小锋,何菂,蔡嫣,等. 高血磷诱导慢性肾衰患者血管钙化作用机制[J].生理科学进展,2014,45(1):21-26.
[15] Murshed M, McKee MD. Molecular determinants of extracellular matrix mineralization in bone and blood vessels[J]. Curr Opin Nephrol Hypertens, 2010, 19(4):359-365.
[16] Buendía P, Montes de OA, Madueno JA, et al. Endothelial microparticles mediate inflammation induced vascular calcification[J].FASEB J, 2015,29(1):173-181.
[17] Rodríguez CE, Ulsamer A, Susperregui AR, et al. Conserved regulatory motifs in osteogenic gene promoters integrate cooperative effects of canonical Wnt and BMP pathways[J]. J Bone Miner Res, 2011,26(4):718-729.
[18] Zeini M, López-Fontal R, Través PG, et al. Differential sensitivity to apoptosis among the cells that contribute to the atherosclerotic disease[J]. Biochem Biophys Res Commun, 2007,363(2):444-450.
Effects and mechanisms of inflammation on the calcification of rat vascular smooth muscle cells caused by high phosphate
FENGLing,ZHANGYi,JIANGHuiling,FENGZhiqiang,PANQiangwen
(SouthwestMedicalUniversity,Luzhou646000,China)
Objective To study the effects and possible mechanisms of inflammation on the calcification of rat vascular smooth muscle cells (VSMCs) primarily caused by high phosphate.Methods Rat VSMCs were primarily cultured and then were divided into the control (Ctr) group, high phosphate (Pi) group, inflammation (LPS) group, high phosphate and inflammation (Pi+LPS) group. Rat VSMCs in the Pi group and Pi+LPS group were cultured in basal medium containing 4.8 mmol/L Pi to establish the calcification models successfully. Rat VSMCs in the Pi + LPS group were cultured in basal medium containing 4.8 mmol/L Pi and 10 μg/mL LPS. Rat VSMCs in the LPS group were cultured in basal medium only containing 10 μg/mL LPS. Rat VSMCs in the Ctr group were cultured in basal medium. The C-reactive protein (CRP) level of culture medium, alkaline phosphatase (ALP) activity and calcium deposition of cells in each group were respectively measured after 48-hour culture; real-time PCR was used to detect the relative mRNA expression of bone morphogenetic protein-2 (BMP-2), Smad4, Msx2 and Osterix.Results The CRP level of culture medium, ALP activity and calcium deposition of cells in the Pi group, LPS group and Pi+LPS group were higher than those of the Ctr group (allP<0.05). The CRP level of culture medium, ALP activity and calcium deposition of cells in the Pi+LPS group were higher than those in the Pi group and LPS group (allP<0.05). The CRP level of culture medium and calcium deposition of cells in the LPS group were lower than those of the Pi group (allP<0.05). The relative mRNA expression of BMP-2, smad4, msx2, and Osterix in the Pi group, LPS group and Pi+LPS group was higher than that of the Ctr group (allP<0.05). The relative mRNA expression of BMP-2, smad4, msx2 and Osterix in the Pi+LPS group was higher than that of the Pi group amd LPS group (allP<0.05). The relative mRNA expression of smad4, msx2 and Osterix in the LPS group was lower than that of the Pi group (allP<0.05).Conclusions The calcification of rat VSMCs cultured in vitro could be induced by both high phosphate and inflammation. Inflammation combined with high phosphate could aggravate the calcification of rat VSMCs cultured in vitro significantly. The mechanisms may be ralted with the up-regulation of BMP-2, Smad4, Msx2, Osterix expression and the ALP activity.
inflammation; high phosphate; smooth muscle cells; vascular calcification; end-stage renal disease
四川省教育厅项目基金资助项目(09ZC118)。
冯灵(1982-),女,本科,助教,主要研究方向为代谢紊乱与器官损害。E-mail: 272227751@qq.com
简介:盘强文(1971-),男,硕士,教授,主要研究方向为代谢紊乱与器官损害。E-mail: qwpan@swmu.edu.cn
10.3969/j.issn.1002-266X.2016.46.004
R364.3;R692.5
A
1002-266X(2016)46-0015-05
2016-05-17)
