丹参素对高糖环境下心肌细胞的保护作用及其机制
2017-01-06李显辉
李显辉
(天津市第三中心医院,天津 300170)
丹参素对高糖环境下心肌细胞的保护作用及其机制
李显辉
(天津市第三中心医院,天津 300170)
目的 探讨丹参素对高糖环境下心肌细胞损伤的保护作用及其机制。方法 取指数生长期的H9C2细胞,随机分为6组,A组使用10% FBS低糖(5 mmol/L葡萄糖)DMEM培养基,B组使用含10% FBS及高糖(30 mmol/L葡萄糖)DMEM培养基,C、D、E、F组在B组培养液基础上分别加2、4、8、16 mg/L丹参素。培养20 h后采用CCK-8法检测H9C2细胞的活力,培养18 h后采用生化法检测细胞培养液中乳酸脱氢酶(LDH)、肌酸激酶(CK)、丙二醛(MDA)、超氧化物岐化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)的含量,ELISA法检测细胞培养液中IL-6、IL-1β、TNF-α、单核细胞趋化因子1(MCP1)及巨噬细胞移动抑制因子(MIF)的含量,培养18 h后采用实时荧光定量PCR法检测H9C2细胞Caspase-3、Caspase-8、Caspase-9、Bcl-2 mRNA表达。结果 与A组比较,B组A450值明显下降(P<0.05);细胞培养液中LDH、CK、MDA、IL-6、IL-1β、TNF-α、MCP1、MIF含量增加,SOD、GSH-Px含量降低(P均<0.05);H9C2细胞Caspase-3、Caspase-8、Caspase-9 mRNA相对表达水平上升,Bcl-2 mRNA相对表达水平下降(P均<0.05)。与B组比较,C、D、E、F组A450值升高(P均<0.05);细胞培养液中LDH、CK、MDA、IL-6、IL-1β、TNF-α、MCP1、MIF含量低,SOD、GSH-Px含量高(P均<0.05);H9C2细胞Caspase-3、Caspase-8、Caspase-9 mRNA表达水平不同程度地降低,Bcl-2 mRNA表达水平不同程度升高(P均<0.05)。结论 丹参素对于高糖环境下的H9C2细胞具有保护作用,其机制与减轻细胞氧化应激损伤,降低炎性因子和凋亡基因表达有关。
心肌细胞损伤;丹参素;炎症反应;细胞凋亡
糖尿病心肌病(DCM)是持续性高血糖所引起的多系统组织器官损害而出现的主要并发症。持续的高血糖可诱导心肌细胞产生氧化应激损伤、慢性炎症反应及细胞凋亡等,导致心脏结构重塑、机械功能障碍、心肌电活动异常,进而出现心肌肥厚、心律失常,最终发生心力衰竭等临床病症[1~3]。因此,早期阻抑由高血糖引起的心肌损伤进程对于DCM患者的预后至关重要。丹参素是活血化瘀类中药丹参的主要水溶性成分之一,其通过抗氧化、抗炎、抗凋亡、降低钙离子超载等途径保护心肌细胞[4~7]。然而,丹参素在高糖条件下能否发挥心肌保护作用尚不确定。2015年10月~2016年6月,本研究在体外建立高糖诱导的心肌细胞损伤模型,观察丹参素对高糖条件下心肌细胞的保护效应及其机制。
1 材料与方法
1.1 材料 H9C2大鼠心肌细胞(美国ATCC细胞库),丹参素(中国食品药品检定研究院),FBS(美国Hyclone公司),DMEM细胞培养基(美国Gibco公司),0.25%胰酶消化溶液(以色列Biological Industries公司),葡萄糖(美国Amresco公司),CCK-8细胞活力检测试剂盒(日本同仁公司),乳酸脱氢酶(LDH)、肌酸激酶(CK)、丙二醛(MDA)、超氧化物岐化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)生化检测试剂盒(南京建成生物工程研究所),IL-6、IL-1β、TNF-α、单核细胞趋化因子1(MCP1)、巨噬细胞移动抑制因子(MIF)ELISA检测试剂盒(武汉优尔生商贸有限公司),细胞总RNA提取试剂盒(美国OMEGA公司),RNA反转录试剂盒、PCR扩增试剂盒以及Caspase-3、Caspase-8、Caspase-9、Bcl-2、GAPDH基因验证型引物(广州复能基因公司)。细胞观察倒置显微镜(日本Olympus公司)、 CO2细胞培养箱(美国Thermo公司)、酶标仪(美国Thermo Scientific Multiskan公司)、实时荧光定量PCR仪(美国ABI公司)。
1.2 细胞培养及分组 将H9C2细胞用含10% FBS的低糖(5 mmol/L)DMEM培养基以2×107/L接种于T25培养瓶中,置于37 ℃、5% CO2细胞培养箱中培养。2~3 d后待细胞密度近90%时用0.25%胰酶溶液消化后传代培养。取指数生长期的H9C2细胞随机分为6组:A组:使用10%FBS低糖(5 mmol/L葡萄糖)DMEM培养基;B组:使用含10% FBS及高糖(30 mmol/L葡萄糖)DMEM培养基;C组:在高糖组培养液基础上加2 mg/L丹参素;D组:在高糖组培养液基础上加4 mg/L丹参素;E组:在高糖组培养液基础上加8 mg/L丹参素;F组:在高糖组培养液基础上加16 mg/L丹参素。
1.3 细胞活力检测 采用CCK法。取指数生长期H9C2细胞,用10%FBS低糖DMEM培养基将细胞制成1×105/mL的细胞悬液,按每孔100 μL细胞悬液加入至96孔细胞培养板,放置于细胞培养箱中培养1 d后弃去细胞培养液,每组设置6个复孔分别加入100 μL相应的细胞培养液干预18 h后每孔中加入10 μL CCK-8溶液继续孵育2 h,孵育结束后在酶标仪450 nm波长下测定吸光度值(A450)。
1.4 细胞培养液中氧化应激及炎症因子检测 取指数生长期H9C2细胞,用10% FBS低糖DMEM培养基将细胞制成1×105/mL的细胞悬液,按每孔500 μL细胞悬液加入至24孔细胞培养板,放置于细胞培养箱中培养1 d后弃去细胞培养液,每组设置6个复孔分别加入500 μL相应的细胞培养液干预18 h后收集细胞培养液于EP管中,将细胞培养液以12 000 r/min离心5 min后取上清液。按照生化检测试剂盒操作要求检测上清液中LDH、CK、MDA、SOD、GSH-Px含量。按照ELISA检测试剂盒操作要求检测上清液中IL-6、IL-1β、TNF-α、MCP1、MIF含量。
1.5 H9C2细胞Caspase-3、Caspase-8、Caspase-9、Bcl-2 mRNA相对表达的检测 采用实时荧光定量PCR法。取指数生长期H9C2细胞,用10% FBS低糖DMEM培养基将细胞制成1×105/mL的细胞悬液,按每孔2 mL细胞悬液加入至6孔细胞培养板,放置于细胞培养箱中培养1 d后弃去细胞培养液,每组设置3个复孔分别加入2 mL相应的细胞培养液干预18 h后收集H9C2细胞,按照各试剂盒要求提取细胞总RNA,反转录后将cDNA及待测基因引物加入扩增反应体系中进行实时荧光定量PCR检测。ΔCt值=样本基因平均Ct值-相应内参基因平均Ct值;ΔΔCt值=每组ΔCt值-对照组ΔCt值;每组待测目的基因的相对表达倍数值=2-ΔΔCT,根据得出的该相对表达倍数值进行统计分析。
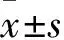
2 结果
2.1 各组H9C2细胞活力比较 与A组比较,B组A450值明显下降(P<0.05);与B组比较,C、D、E、F组A450值升高(P均<0.05),以E组为最高。见图1。
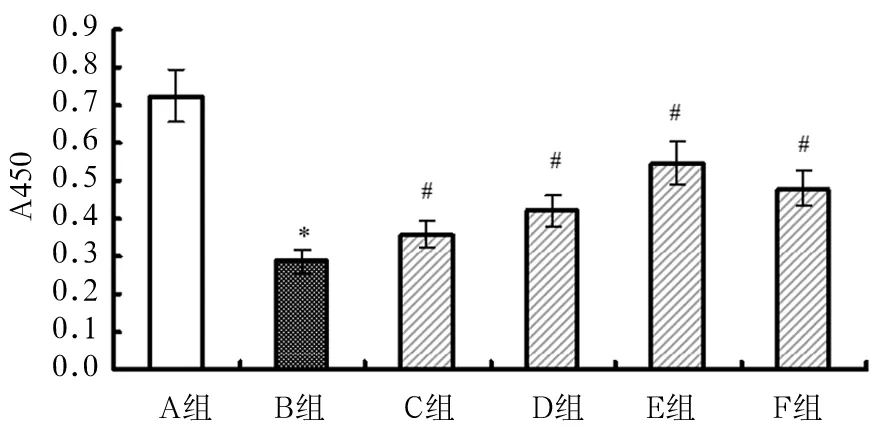
注:与A组比较,*P<0.05;与B组比较,#P<0.05。
图1 6组H9C2细胞活力比较
2.2 各组细胞培养液LDH、CK、MDA、SOD、GSH-Px含量比较 与A组比较,B组细胞培养液中LDH、CK、MDA含量增加,SOD、GSH-Px含量降低(P均<0.05);与B组比较,C、D、E、F组细胞培养液中LDH、CK、MDA含量低,SOD、GSH-Px含量高(P均<0.05)。见表1。

表1 各组细胞培养液LDH、CK、MDA、SOD、GSH-Px含量比较
注:与A组比较,*P<0.05;与B组比较,#P<0.05。
2.3 各组细胞培养液IL-6、IL-1β、TNF-α、MCP1、MIF含量比较 与A组比较,B组细胞培养液中IL-6、IL-1β、TNF-α、MCP1、MIF含量高(P均<0.05);与B组比较,C、D、E、F组细胞培养液中IL-6、IL-1β、TNF-α、MCP1、MIF含量低(P均<0.05)。见表2。
2.4 各组H9C2细胞凋亡因子mRNA相对表达比较 与对照组比较,B组H9C2细胞Caspase-3、Caspase-8、Caspase-9 mRNA相对表达水平上升,Bcl-2 mRNA相对表达水平下降(P均<0.05);与B组比较,C、D、E、F组H9C2细胞Caspase-3、Caspase-8、Caspase-9 mRNA表达水平不同程度地降低,Bcl-2 mRNA表达水平不同程度升高(P均<0.05)。见表3。

表2 各组H9C2细胞培养液IL-6、IL-1β、TNF-α、MCP1、MIF含量比较
注:与A组比较,*P<0.05;与B组比较,#P<0.05。

表3 各组H9C2细胞凋亡因子mRNA相对表达比较
注:与A组比较,*P<0.05;与B组比较,#P<0.05。
3 讨论
DCM的病理过程是细胞氧化应激、细胞凋亡坏死、炎症反应等诸多机制交互作用的复杂病理状态[3]。持续高糖状态刺激心肌细胞产生过度的氧化应激反应进而出现应激损伤,大量活性氧物质(ROS)的生成进一步激活线粒体依赖的细胞凋亡途径;与此同时大量糖化终产物(AGEs)堆积促使心肌细胞炎性因子表达,进而募集炎症细胞进一步导致心肌组织损伤坏死,最终致使心肌结构各功能的破坏和失常。本研究发现,高糖条件培养的H9C2大鼠心肌细胞活力明显下降,细胞上清液LDH与CK水平明显升高,表明H9C2细胞在高糖条件下出现了细胞膜的破坏;MDA水平明显升高,SOD、GSH-Px水平明显降低,表明H9C2细胞在高糖条件下抗氧化能力降低,清除ROS的能力减弱,进而出现了脂质过氧化物导致细胞毒作用。H9C2细胞在高糖条件下炎性因子IL-6、IL-1β、TNF-α、MCP1、MIF大量表达,表明心肌细胞在高糖状态下出现了早期的炎症状态,这种瀑布式的炎症级联反应会进一步募集炎症细胞进入心肌组织加重心肌坏死。高糖条件下H9C2细胞Caspase-3、Caspase-8、Caspase-9 mRNA表达水平升高,Bcl-2 mRNA表达水平下降,说明Caspase信号级联瀑布的关键调控节点被激活及线粒体膜破坏,出现了线粒体依赖的细胞凋亡。该凋亡途径一方面由ROS大量生成和AGEs堆积介导产生,另一方面也与炎性因子的刺激有关。本研究结果提示,不同浓度的丹参素在高糖诱导的心肌细胞氧化应激损伤、炎症反应以及细胞凋亡等状态激活方面的指标表达均具有一定的反转作用,说明丹参素通过如上几条途径对高糖条件下的心肌细胞发挥了保护性作用。糖尿病合并症常涉及到视网膜病变、肾脏病变、神经病变、心肌病变等诸多系统组织器官病变,涉及范围十分广泛遍及周身。糖尿病患者一旦出现并发症仅仅通过调节血糖水平并不能完全阻抑受累组织器官的病变进程。DCM患者的治疗同样在调控血糖的基础治疗之上应当重视心肌细胞的保护。本研究为DCM患者心肌保护的药物治疗策略提供了一定的参考。
[1] Huynh K, Bernardo BC, McMullen JR, et al. Diabetic cardiomyopathy: mechanisms and new treatment strategies targeting antioxidant signaling pathways[J]. Pharmacol Ther, 2014,142(3):375-415.
[2] Palomer X, Salvado L, Barroso E, et al. An overview of the crosstalk between inflammatory processes and metabolic dysregulation during diabetic cardiomyopathy[J]. Int J Cardiol, 2013,168(4):3160-3172.
[3] Varga ZV, Giricz Z, Liaudet L, et al. Interplay of oxidative, nitrosative/nitrative stress, inflammation, cell death and autophagy in diabetic cardiomyopathy[J]. Biochim Biophys Acta-Mol Basis Dis, 2015,1852(2):232-242.
[4] Zhou XL, Chan SW, Tseng HL, et al. Danshensu is the major marker for the antioxidant and vasorelaxation effects of danshen (salvia miltiorrhiza) water-extracts produced by different heat water-extractions[J]. Phytomedicine, 2012,19(14):1263-1269.
[5] Yin Y, Guan Y, Duan JL, et al. Cardioprotective effect of danshensu against myocardial ischemia/reperfusion injury and inhibits apoptosis of h9c2 cardiomyocytes via akt and erk1/2 phosphorylation[J]. Eur J Pharmacol, 2013,699(1-3):219-226.
[6] Yu JH, Wang LY, Akinyi M, et al. Danshensu protects isolated heart against ischemia reperfusion injury through activation of akt/erk1/2/nrf2 signaling[J]. Int J Clin Exp Med, 2015,8(9):14793-14804.
[7] Meng Y, Li WZ, Shi YW, et al. Danshensu protects against ischemia/reperfusion injury and inhibits the apoptosis of h9c2 cells by reducing the calcium overload through the p-jnk-nf-kappa b-trpc6 pathway[J]. J Mol Med, 2016,37(1):258-266.
天津市卫生局课题(07025)。
10.3969/j.issn.1002-266X.2016.45.015
R363
A
1002-266X(2016)45-0048-03
2016-10-10)
