拉米夫定对人肝癌细胞MMP-9及p53蛋白表达的影响
2017-01-06王雪杨伟李靖马存花
王雪,杨伟,李靖,马存花
(1胜利油田中心医院,山东东营257000;2中国人民解放军第89医院;3潍坊医学院)
拉米夫定对人肝癌细胞MMP-9及p53蛋白表达的影响
王雪1,杨伟2,李靖2,马存花3
(1胜利油田中心医院,山东东营257000;2中国人民解放军第89医院;3潍坊医学院)
目的 探讨拉米夫定作用于人肝癌细胞系HepG2.2.15后对细胞中基质金属蛋白酶9(MMP-9)及p53蛋白表达的影响。方法 不同浓度(100、200、300 μg/mL)拉米夫定(拉米夫定100、200、300 μg/mL组)作用于HepG2.2.15细胞不同时间(3、6 d),并设立不应用拉米夫定的HepG2.2.15细胞作为对照组。MTT比色法测定细胞增殖活性;ELISA法测定细胞培养上清及细胞中MMP-9及p53蛋白相对表达量。结果 拉米夫定100、200、300 μg/mL组与对照组不同时间细胞增殖活力比较差异无统计学意义(P均>0.05)。作用3、6 d,与对照组比较,拉米夫定各处理组HepG2.2.15细胞及其培养液中MMP-9及p53蛋白表达水平均明显降低(P均<0.05)。结论 拉米夫定作用后HepG2.2.15细胞MMP-9及p53蛋白水平降低。
肝肿瘤;HepG2.2.15细胞;基质金属蛋白酶9;p53蛋白;拉米夫定
肝癌(HCC)是临床常见、恶性程度较高的肿瘤。在亚洲和非洲,HCC发病主要与感染乙肝病毒(HBV)有关[1]。HCC的特点是早期转移,由肿瘤细胞和微环境中分泌的生物分子,如基质金属蛋白酶9(MMP-9)、p53,在其发展和转移的关键环节发挥了重要作用。拉米夫定作为核苷类似物,可通过终止HBV DNA链合成抑制HCC发展[2]。2015年6月~2016年5月,本研究用拉米夫定作用于人HCC细胞系HepG2.2.15,对其细胞内和细胞培养上清液中MMP-9及p53蛋白表达进行检测,探讨拉米夫定治疗HCC的分子机制。
1 材料与方法
1.1 材料 人HCC细胞系HepG2.2.15(上海博谷生物科技有限公司),α-MEM培养基、胎牛血清(Gibco),G418(北京格林博远生物科技有限公司),胰蛋白酶/EDTA、青链霉素混合液、PBS、MTT细胞增殖及细胞毒性检测试剂盒(北京Solarbio公司),拉米夫定(葛兰素史克公司),MMP-9及p53试剂盒(上海博谷生物科技有限公司)。
1.2 细胞培养及分组 常规复苏HepG2.2.15细胞,用含10%胎牛血清的α-MEM培养基(含青霉素100 U/mL、链霉素100 μg/mL、G418 200 μg/mL),于5% CO2、37 ℃孵育箱中培养。3~4 d更换1次培养基。待细胞生长至80%~90%融合度时使用胰蛋白酶/EDTA消化,按比例1∶3传代。取对数期HepG2.2.15细胞,用胰蛋白酶/EDTA消化,细胞计数,调整细胞悬液浓度,按照104/孔接种于96孔板。设对照组(加细胞、培养基)和拉米夫定100、200、300 μg/mL组。拉米夫定100、200、300 μg/mL组添加不同浓度(100、200、300 μg/mL)拉米夫定200 μL。每组设5个复孔,于5% CO2、37 ℃孵育箱中培养。
1.3 细胞增殖活力的检测 采用MTT法。分别于拉米夫定干预后0、2、4、6、8 d采用MTT法测定每组细胞增殖情况。操作:吸弃上清,加入无血清培养基90 μL及MTT 10 μL,于5% CO2、37 ℃孵育箱中培养4 h。吸弃上清,每孔加入Formazan溶解液110 μL,振荡10 min,待结晶物充分溶解后,用酶标仪测各孔波长490 nm处吸光度(A)值,计算均值。
1.4 细胞及其培养上清液中MMP-9、p53蛋白表达检测 采用ELISA法。分别于拉米夫定干预后3、6 d收集细胞及其上清液。胰酶消化回收细胞,12 000 r/min离心5 min后弃上清液,加PBS 200 μL重悬。液氮 37 ℃水浴反复冻融法裂解细胞,重复3次。12 000 r/min离心10 min,留取上清液,-70 ℃冻存。严格按照ELISA试剂盒说明书测定细胞及培养上清液中MMP-9、p53蛋白表达。
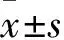
2 结果
2.1 各组不同时间细胞增殖活力比较 拉米夫定100、200、300μg/mL组与对照组不同时间细胞增殖活力比较差异无统计学意义(P均﹥0.05)。见表1。

表1 各组不同时间细胞增殖活力比较
2.2 各组细胞及其培养上清液中MMP-9、p53蛋白表达比较 干预后第3、6天,与对照组比较,拉米夫定各处理组HepG2.2.15细胞及其培养上清液中MMP-9、p53蛋白表达水平均降低(P均<0.05)。见表2、3。

表2 各组细胞及其上清液中MMP-9蛋白表达比较
注:与对照组同时点比较,*P<0.05。

表3 各组细胞及其上清液中p53蛋白表达比较
注:与对照组同时点比较,*P<0.05。
3 讨论
VEGF可以增强细胞通透性,尤其是微小血管的通透性,引起血浆蛋白渗漏到细胞外基质,在细胞外基质中沉着,为成纤维细胞和血管内皮细胞的迁入提供条件基质,为肿瘤细胞的生长和新生毛细血管网的建立提供营养。MMP-9作为一种明胶酶,可以有效降解细胞外基质中Ⅳ、Ⅴ型胶原和明胶。研究发现,MMP-9与多种恶性肿瘤侵袭转移存在一定的关系[3~5]。Riedel等[6]报道,MMP-9可作为肿瘤血管形成的调控因素参与肿瘤血管形成。其发挥作用时能在细胞表面激活MMP-2,并促进MMPs家族其他因子的活化,共同发挥降解细胞外基质的作用[7,8]。在肿瘤细胞复杂的转移和浸润过程中,MMP-9可通过刺激肿瘤细胞迁移、侵袭,促进血管生成而在肿瘤的发生发展中起核心作用[9,10]。有研究发现,MMP-9与HCC、胶质瘤、乳腺癌等多种肿瘤的浸润、转移和术后复发相关[11,12]。此外,MMPs还可以增强血管生长因子的作用,促进新生血管形成[13,14],已逐渐成为抗肿瘤治疗中重要的药物作用靶点。p53基因是目前研究较早的抑癌基因,分为突变型和野生型。野生型p53是抑癌基因,对细胞增殖起负调控作用。野生型p53突变后失去抑癌基因功能,并且与野生型p53结合成复合物,抑制p53基因功能,导致细胞异常增殖,可诱导一些异常基因表达,促进肿瘤发生;可以下调抑制血管增生的凝血酶的反应素-1和上调促血管增生的VEGF,因而成为调控肿瘤血管形成的重要因素。
HCC的特点是早期转移,MMP-9及p53基因在其中起了关键作用。HBV是HCC公认的致病因子,它在细胞内的复制有可能激发p53,使其表达升高、功能增强,进而可能导致细胞某些生物学活性(如细胞凋亡、细胞周期等)改变。有研究证实,p53失活与MMP-9的表达在HCC发展中起协同作用。Franchi等认为,p53的突变可以上调MMP-9基因转录,并且通过NOS和EGFR途径影响MMP-9的表达。本试验中,拉米夫定各处理组与对照组细胞增殖活力差异无统计学意义,而拉米夫定各处理组细胞及上清液中p53及MMP-9蛋白的表达均降低,提示拉米夫定并不是通过直接抑制肿瘤细胞的增殖来抑制肿瘤生长,而是通过某种机制导致p53、MMP-9的表达降低进而抑制HCC的侵袭转移。试验结果提示:核苷类药物不仅可以抑制HBV复制,还可能通过某种机制降低p53及MMP-9的表达,从而抑制HCC的发生和进展。
[1] Lupberger J, Hildt E. Hepatitis B virus-induced oncogenesis[J].World J Gastroenterol, 2007,13 (1):74-81.
[2] Dienstag JL, Schiff ER, Wright TL. Lamivudine as initial treatment for chronic hepatitis B in the United States[J]. N Engl J Med, 1999,341(17):1256.
[3] Raghu H, Sodadasu PK, Malla RR, et al. Localization of uPAR and MMP-9 in lipid rafts is critical for migration,invasion and angiogenesis in human breast cancer cells [J]. BMC Cancer, 2010,24(10):647.
[4] Canete A, Gerrard M, Rubie H, et al. Poor survival for infants with MYCN-amplified metastatic neuroblastoma despite intensified treatment: the International Society of Paediatric Oncology European Neuroblastoma Experience[J]. J Clin Oncol, 2009,27(7):1014-1019.
[5] Park JR, Eggert A, Caron H. Neuroblastoma: biology, prognosis and treatment[J]. Pediatr Clin North Am, 2008,55(1):97-103.
[6] Riedel F, Gotte K, Schwalb J, et al. Expression of 92 KD type Ⅳ collagenase correlates with angiogenic markers and poor survival in head and neck squamous cell carcinoma[J]. Int J Oncol, 2000,17(6):1099-1105.
[7] Zarrabi K, Dufour A, Li J, et al. Inhibition of matrix metalloproteinase 14(MMP-14)mediated cancer cell migration[J]. J Biol Chem, 2011,286(38):33167-33177.
[8] Koyama Y, Naruo H, Yoshitomi Y, et al. Matrix metalloproteinase-9 associated with heparan sulphate chains of GPI anchored cell surface proteoglycans mediates motility of murine colon adenocarcinoma cells[J]. J Biochem, 2008,143(5):581-592.
[9] Chen JS, Huang XH, Wang Q, et al. Sonic hedgehog signaling pathway induces cell migration and invasion through focal adhesion kinase/AKT signaling-mediated activation of matrix metallo proteinase(MMP)-2 and MMP-9 in liver Cancer[J]. Carcinogenesis, 2013,34(1):10-19.
[10] Cockrada AM, Medjkane S, Janski N, et al. SMYD3 promotes Cancer invasion by epigenetic upregulation of the metalloproteinase MMP-9[J]. Cancer Res, 2012,72 (3):810-820.
[11] Chetty C, Ponnala S, Gujrati M, et al. Knockdown of MMP-9 inhibits radiation-induced invasive phenoltype, angiogenesis and tum or growth in glioma cancer stem cell [J]. Cancer Res, 2013,73(8s):4907.
[12] 夏庆安,付玉环,姜广建.HSG、MMP-9和MMP-2在乳腺癌组织中的表达及意义[J].现代预防医学,2012,39 (2):323-324,327.
[13]Yu C, Pan K, Xing D, et al. Correlation between a single nucleotide polymorphism in the matrix metallopro teinase-2 promoter and risk of lung cancer[J]. Cancer Res, 2002,62(22):6430-6433.
[14] Huo N, Ichikawa Y, Kamiyama M, et al. MMP-7(matrilysin)accelerated growth of human umbilical vein endothelial cells[J]. Cancer Lett, 2002,177(1):95-100.
杨伟(E-mail:ywcyw723@sina.com)
10.3969/j.issn.1002-266X.2016.45.013
R735.7
A
1002-266X(2016)45-0043-03
2015-09-28)
