白细胞介素37对食管癌细胞增殖、迁移、炎症反应的影响及其机制
2017-01-06刘良忠李小红马楼艳胡建蛾张力邓超李刚张军
刘良忠,李小红,马楼艳,胡建蛾,张力,邓超,李刚,张军
(1重庆三峡中心医院,重庆404000;2西安市第九医院)
·基础研究·
白细胞介素37对食管癌细胞增殖、迁移、炎症反应的影响及其机制
刘良忠1,李小红1,马楼艳2,胡建蛾1,张力1,邓超1,李刚1,张军1
(1重庆三峡中心医院,重庆404000;2西安市第九医院)
目的 探讨白细胞介素37(IL-37)对食管癌细胞增殖、迁移、炎症反应的影响及其可能的分子机制。方法 用不同浓度(0、10、50、100 ng/mL)的重组IL-37蛋白分别处理食管癌细胞Eca-109和TE-1 24、48、72 h,MTT法检测其对细胞增殖率的影响;用100 ng/mL的重组人IL-37蛋白(IL-37组)干预两种细胞株,对照组加入等量培养基,24 h后Transwell侵袭小室试验检测迁移细胞数目,流式细胞术检测细胞凋亡率,RT-PCR检测肿瘤坏死因子(TNF)α、IL-1β和IL-6的表达,Western blotting法检测pSTAT3 Y705、Bcl-2和Caspase-3的表达;两种细胞株分别转染pcDNA3.1空质粒(对照组)、pcDNA3.1-IL-6质粒(IL-6组),IL-6+IL-37组转染pcDNA3.1-IL-6质粒24 h后换含100 ng/mL重组人IL-37蛋白的培养基培养24 h,检测TNF-α、IL-1β、IL-6、pSTAT3 Y705、Bcl-2和Caspase-3的表达。结果 与其他浓度相比,100 ng/mL IL-37对细胞增殖具有明显的抑制效果(P均<0.05)。Eca-109和TE-1细胞中,与对照组相比,IL-37组中的迁移数目均明显减少,凋亡率均明显增加(P均<0.05)。IL-37组中TNF-α、IL-1β、IL-6 mRNA,pSTAT3 Y705、Bcl-2蛋白表达均降低(P均<0.05),Caspase-3的表达增加(P均<0.05)。与对照组及IL-37+IL-6组比较,IL-6组pSTAT3Y 705和Bcl-2蛋白的表达增加,Caspase-3蛋白表达降低(P均<0.05)。结论 IL-37能够抑制食管癌细胞的增殖、迁移及炎症反应,并促进细胞凋亡,这些作用可能是通过IL-6/STAT3信号通路发挥作用。
食管肿瘤;白细胞介素37;细胞增殖;炎症;IL-6/STAT3信号通路
食管癌是全球最常见的恶性肿瘤,尽管目前该疾病在治疗方法上有了很大进展,但是仍有超过40%的食管癌患者术后出现复发[1],因此迫切需要探索新的治疗药物。白细胞介素37(IL-37)是最新发现的IL-1家族的一员,是先天性免疫反应和获得性免疫反应的抑制剂。已经发现,IL-37在结肠炎[2]、关节炎、银屑病[3]等炎症性疾病中表现出明显的抗炎作用。近年研究发现,IL-37也具有明显的抗肿瘤活性[4, 5],但是IL-37在食管癌中的作用及机制还不清楚。2016年1月~2016年7月,本文进行了相关探讨。
1 材料与方法
1.1 材料 人食管癌细胞株Eca-109和TE-1购自美国ATCC公司,DMEM培养基和胎牛血清购自美国Hyclone公司,胰酶购自美国Gibco公司,MTT购自美国Sigma公司,AnnexinV: FITC/PI细胞凋亡试剂盒购自美国BD公司,NanoFectin转染试剂购自上海依科赛生物制品有限公司,RNAisoPlus试剂购自大连宝生物公司,SYBR RT-PCR试剂盒购自上海吉玛制药技术有限公司,RIPA裂解液、PMSF和结晶紫染色液购自上海碧云天生物技术有限公司,重组人IL-37蛋白购自美国R&D公司,BCA法蛋白定量试剂盒购自上海捷瑞生物工程有限公司,Anti-信号转导子与转录活化子3 (STAT3) (phospho Y705)抗体(1∶200 000)、Anti-Bcl-2抗体(1∶1 000)和Anti-active Caspase-3抗体(1∶500)购自英国Abcam公司。Anti-β-actin抗体和Goat Anti-rat IgG/HRP抗体购自北京博奥森生物技术有限公司。
1.2 细胞培养、分组及处理 Eca-109和TE-1细胞均培养在含有10%胎牛血清的DMEM完全培养基中,置于37 ℃、5% CO2细胞培养箱中,待细胞长至90%左右时胰酶消化传代。首先用不同浓度(0、10、50、100 ng/mL)的重组人IL-37蛋白处理两种细胞,检测其对细胞增殖活力的影响。将部分细胞随机分成对照组和IL-37组,IL-37组用指定浓度的重组人IL-37蛋白处理,对照组加入等量的培养基,检测IL-37对细胞迁移、凋亡和炎性细胞因子表达的影响。将另一部分细胞随机分成对照组、IL-6组和IL-37+IL-6组,Eca-109和TE-1细胞接种到6孔板中,待细胞融合度达到60%左右时,对照组转染pcDNA3.1空质粒;IL-6组及IL-37+IL-6组用NanoFectin转染试剂转染pcDNA3.1-IL-6质粒;转染24 h,IL-37+IL-6组换成含有100 ng/mL重组人IL-37蛋白的培养基,继续培养24 h,检测各组中相关蛋白表达情况。
1.3 食管癌细胞增殖活力的测算 采用MTT法。取对数生长期Eca-109和TE-1细胞,按照1×103/孔的密度分别接种于96孔板中,加入不同浓度(0、10、50、100 ng/mL)的重组人IL-37蛋白分别培养24、48、72 h后,换成含有500 μg/mL MTT的新鲜培养基继续培养5 h,弃上清,加入异丙醇溶解甲臜晶体,然后在570 nm条件下测定吸光值。
1.4 食管癌细胞迁移能力的检测 采用Transwell侵袭小室试验。将Transwell小室放入24孔板中,上室加入100 μL无血清的DMEM培养基,含2×105个细胞;下室加入600 μL含有100 ng/mL重组人IL-37蛋白的完全培养基,常规培养24 h后,取出小室,倒掉小室中的培养基,用棉签轻轻擦掉上层未迁移细胞,4%多聚甲醛固定30 min,0.1%结晶紫染色20 min,PBS漂洗3遍,显微镜下随机选取6个视野进行计数,计算每个视野中平均迁移细胞数目。
1.5 食管癌细胞凋亡率的检测 使用流式细胞术。将两种食管癌细胞按照1×106/孔的密度分别接种到6孔板中,培养24 h后,换成含有100 ng/mL重组人IL-37蛋白的DMEM培养基,继续常规培养24 h,按照AnnexinV:FITC/PI细胞凋亡试剂盒说明书操作,在FACSCalibur流式细胞仪上检测凋亡细胞。计算细胞凋亡率。
1.6 食管癌细胞中肿瘤坏死因子(TNF)-α、IL-1β和IL-6 mRNA的相对表达量检测 采用RT-PCR法。按照RNAisoPlus说明书操作,提取细胞总RNA。取2 μg总RNA进行逆转录,然后按照RT-PCR试剂盒说明书操作,以β-actin为内参,按照2-ΔΔCt的方法计算细胞中 TNF-α、IL-1β和IL-6的相对表达量。引物序列:IL-1β上游5′TATAGCCTGGACTTTCCTGTT3′,下游5′GCTGACTGTCCTGGCTGATG3′;IL-6:上游5′CCTCCAGAACAGATTTGAG3′,下游5′ATTTGTGGTTGGGTCAGG3′;TNF-α:上游5′GCCGCATCGCCGTCTCCTAC3′,下游5′CCTCAGCCCCCTCTGGGGTC3′;β-actin:上游5′GCAAATGCTTCTAGGCGGAC3′,下游5′GCTGTCACCTTCACCGTTCC3′。
1.7 IL-37及IL-6对Eca-109和TE-1细胞中pSTAT3 Y705、Bcl-2和Caspase-3蛋白表达的影响 采用Western blotting法。细胞用冰冷的无菌PBS清洗2遍,加入100 μL RIPA裂解液(含10 mmol/L PMSF)充分裂解细胞,4 ℃、12 000 g离心15 min收集上清液,即为总蛋白。BCA法测定总蛋白的浓度后,每孔取总蛋白40 μg进行SDS-PAGE凝胶电泳,然后将蛋白转移到PVDF膜上,用5%脱脂奶粉封闭后,加入提前稀释好的一抗4 ℃孵育过夜,TBST清洗后加入HRP标记的二抗室温孵育1 h,再用TBST洗膜3次,加ECL发光液,充分覆盖膜后拍照并进行灰度值分析。
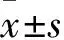
2 结果
2.1 不同时间不同浓度IL-37对食管癌细胞增殖活力的影响 重组IL-37蛋白以时间剂量依赖的方式抑制Eca-109和TE-1细胞的生长(P均<0.05)。
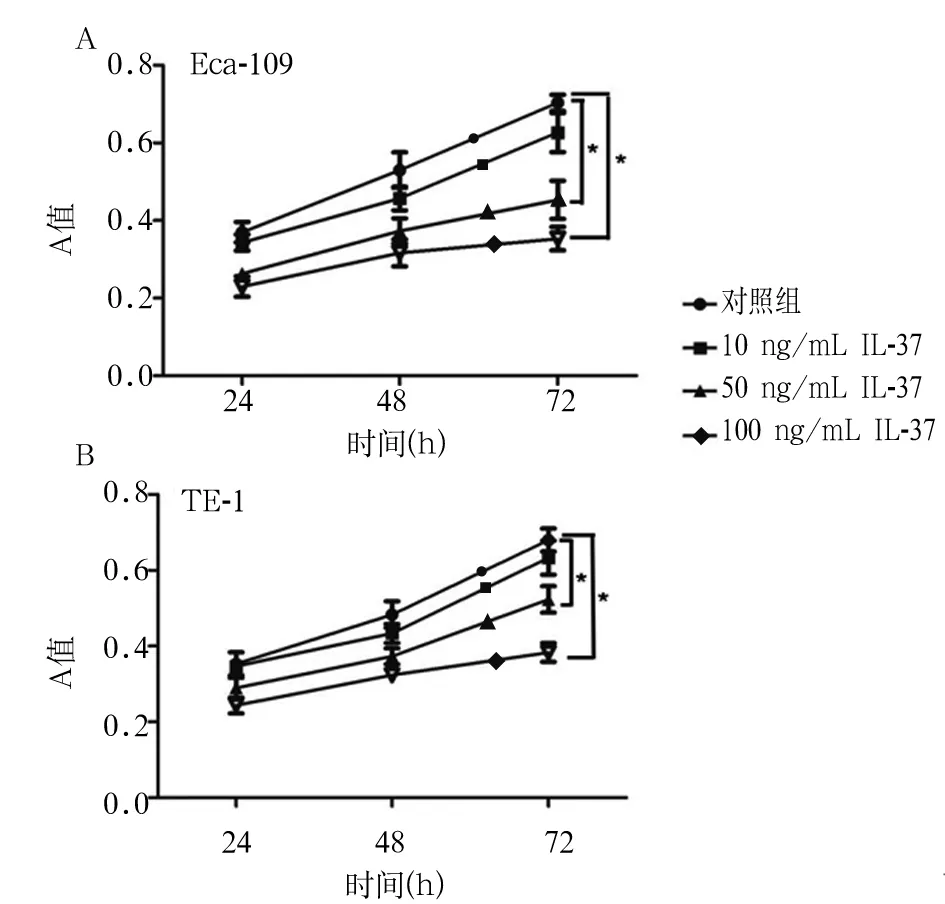
注:与对照组相比,*P<0.05。
图1 不同浓度的IL-37对Eca-109和TE-1细胞增殖的影响
2.2 IL-37对食管癌细胞迁移力及细胞凋亡率的影响 Eca-109细胞中,对照组、IL-37组细胞迁移数分别为119.83±6.24、44.00±4.94个/视野,凋亡率分别为8.29%±0.85%、35.44%±2.97%;TE-1细胞中分别为 151.50±9.38、31.83±8.26个/视野,3.16%±0.98%、45.26%±3.21%。与对照组相比,Eca-109和TE-1细胞IL-37组中的迁移数目均明显减少,凋亡率均明显升高(P均<0.05)。
2.3 IL-37对Eca-109和TE-1细胞中TNF-α、IL-1β和IL-6 mRNA表达的影响 RT-PCR检测结果见图2。与对照组相比,两种细胞IL-37组中TNF-α、IL-1β和IL-6的表达均明显降低(P<0.05)。
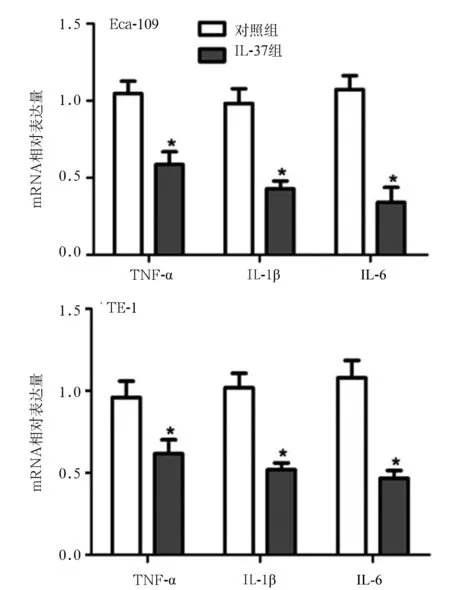
注:与对照组相比,*P<0.05。
图2 IL-37对Eca-109和TE-1细胞中TNF-α、IL-1β和IL-6 mRNA表达的影响
2.4 IL-37对Eca-109和TE-1细胞中pSTAT3 Y705、Bcl-2和Caspase-3蛋白表达的影响 Eca-109细胞中,对照组、IL-37组pSTAT3 Y705、Bcl-2、Caspase-3相对表达量分别为0.68±0.14、0.49±0.07、0.02±0.01,0.11±0.05、0.19±0.06、0.83±0.07;TE-1细胞中分别为0.74±0.05、0.54±0.07、0.04±0.05,0.26±0.03、0.30±0.04、1.25±0.07。Eca-109和TE-1细胞中,与对照组比较,IL-37组pSTAT3 Y705与Bcl-2的表达均降低,Caspase-3的表达增加(P均<0.05)。
2.5 IL-37及IL-6对Eca-109和TE-1细胞中pSTAT3 Y705、Bcl-2 和Caspase-3蛋白表达的影响 Eca-109细胞中,对照组pSTAT3 Y705、Bcl-2、Caspase-3分别为0.56±0.07、0.37±0.09、0.12±0.04,IL-6组分别为1.55±0.13、1.61±0.16、0.02±0.02,IL-37+IL-6组分别为0.82±0.65、0.56±0.07、0.15±0.03。与对照组及IL-37+IL-6组比较,IL-6组pSTAT3Y 705和Bcl-2的表达增加,Caspase-3表达降低(P均<0.05);TE-1细胞中,对照组pSTAT3 Y705、Bcl-2、Caspase-3分别为0.77±0.08、0.64±0.07、0.17±0.05,IL-6组分别为1.47±0.09、1.33±0.08、0.05±0.03,IL-37+IL-6组分别为0.91±0.05、1.02±0.10、0.25±0.07。与对照组及IL-37+IL-6组比较,IL-6组pSTAT3Y 705和Bcl-2蛋白的表达增加,Caspase-3蛋白表达降低(P均<0.05)。
3 讨论
IL-37被认为是先天性免疫反应的天然抑制剂,炎性组织中高表达的IL-37可抑制过多的炎症反应[5]。近年IL-37的抗肿瘤活性也逐渐被发现。研究显示,瘤内注射腺病毒介导的IL-37能够抑制小鼠肺纤维瘤生长[6]。IL-37还可以抑制肝癌、肾癌[4]、宫颈癌[7]和非小细胞肺癌等癌症进程,但是IL-37在食管癌中的作用还不清楚。
本研究结果显示,IL-37能够抑制食管癌细胞Eca-109和TE-1的增殖,并且具有剂量依赖性,同时IL-37还可以抑制两种细胞迁移,并促进细胞凋亡。肿瘤相关性炎症被认为是肿瘤的第七个特征,在肿瘤微环境中,过多的炎症能够促进肿瘤细胞增殖、血管生成、细胞转移,破坏获得性免疫反应,还可以减少细胞对激素和化学治疗药物的反应[8]。细胞因子在炎症过程中发挥着重要作用,因此我们探究了IL-37对细胞因子表达的影响。TNF-α是与炎症和免疫密切相关的一个细胞因子,它能够促进肿瘤的生长和转移,从而加速肿瘤形成[9]。IL-1β在包括食管癌在内的多种肿瘤中的表达增加,它能够促进肿瘤的增殖、转移和药物耐受[10]。IL-6是参与炎症相关肿瘤形成中的一个主要促炎因子,在食管癌中它与血管生成、上皮细胞间质化和不良预后有关。Leu等[11]的研究还发现IL-6能够抑制星孢菌素诱导的食管癌细胞凋亡。本研究结果显示,重组IL-37蛋白能够降低Eca-109和TE-1食管癌细胞中TNF-α、IL-1β和IL-6的表达,这表明IL-37能够抑制食管癌细胞的炎症反应。
STAT3是STAT家族的一个重要成员,酪氨酸磷酸化激活后形成二聚体,易位到核内,识别STAT3特异性DNA结合位点,转录激活靶基因。STAT3在人类多种肿瘤中处于活化状态,活化的STAT3与肿瘤细胞的生长、增殖、侵袭,血管生成和转移有关。本研究发现,IL-37能够降低食管癌细胞pSTAT3 Y705的表达。这表明IL-37可能是通过IL-6/STAT3信号通路发挥作用的。我们通过瞬时转染pcDNA3.1-IL-6使IL-6过表达,然后加入重组IL-37蛋白,验证IL-37是否是通过该信号通路起作用的。结果发现,过表达IL-6导致pSTAT3 Y705、Bcl-2表达增加,Caspase-3表达降低。Bcl-2是一个重要的抗凋亡因子,在肿瘤细胞的抗凋亡机制中具有关键作用;活化的Caspase-3能够促进细胞凋亡。过表达IL-6后,Bcl-2表达增加及Caspase-3表达减少也进一步验证了IL-6的抗凋亡作用。加入重组IL-37蛋白后降低了IL-6过表达诱导的pSTAT3 Y705、Bcl-2的表达,增加了Caspase-3的活化,这表明IL-37在食管癌细胞中是通过IL-6/STAT3发挥作用的。另外,IL-37还可以下调IL-6诱导的TNF-α和IL-1β的表达,这表明IL-37对炎症的抑制作用也与IL-6/STAT3信号通路有关。
总之,IL-37能够抑制食管癌细胞的增殖、迁移和炎症反应,而且还可以诱导其凋亡,这些作用可能是通过抑制IL-6/STAT3信号通路发挥作用的。这为临床上食管癌的治疗提供了一定的理论基础和新的治疗方向。但是本研究仅在体外探究了IL-37对食管癌细胞的作用,它在体内对食管癌的作用仍需进一步探究。
[1] Yue D, Zhang Z, Li J, et al. Transforming growth factor-beta1 promotes the migration and invasion of sphere-forming stem-like cell subpopulations in esophageal cancer[J]. Exp Cell Res, 2015,336(1):141-149.
[2] McNamee EN, Masterson JC, Jedlicka P, et al. Interleukin 37 expression protects mice from colitis[J]. Proc Natl Acad Sci U S A, 2011,108(40):16711-16716.
[3] Teng X, Hu Z, Wei X, et al. IL-37 ameliorates the inflammatory process in psoriasis by suppressing proinflammatory cytokine production[J]. J Immunol, 2014,192(4):1815-1823.
[4] Jiang Y, Wang Y, Liang L, et al. IL-37 mediates the antitumor activity in renal cell carcinoma[J]. Med Oncol, 2015,32(11):250.
[5] Nold MF, Nold-Petry CA, Zepp JA, et al. IL-37 is a fundamental inhibitor of innate immunity[J]. Nat Immunol, 2010,11(11):1014-1022.
[6] Gao W, Kumar S, Lotze MT, et al. Innate immunity mediated by the cytokine IL-1 homologue 4 (IL-1H4/IL-1F7) induces IL-12-dependent adaptive and profound antitumor immunity[J]. J Immunol, 2003,170(1):107-113.
[7] Wang S, An W, Yao Y, et al. Interleukin 37 expression inhibits STAT3 to suppress the proliferation and invasion of human cervical cancer cells[J]. J Cancer, 2015,6(10):962-969.
[8] Colotta F, Allavena P, Sica A, et al. Cancer-related inflammation, the seventh hallmark of cancer: links to genetic instability[J]. Carcinogenesis, 2009,30(7):1073-1081.
[9] Balkwill F. Tumour necrosis factor and cancer[J]. Nat Rev Cancer, 2009,9(5):361-371.
[10] Chen MF, Lu MS, Chen PT, et al. Role of interleukin 1 beta in esophageal squamous cell carcinoma[J]. J Mol Med (Berl), 2012,90(1):89-100.
[11] Leu CM, Wong FH, Chang C, et al. Interleukin-6 acts as an antiapoptotic factor in human esophageal carcinoma cells through the activation of both STAT3 and mitogen-activated protein kinase pathways[J]. Oncogene, 2003,22(49):7809-7818.
重庆市万州区科委项目(201203051)。
张军(E-mail:cbaoqing@163.com)
10.3969/j.issn.1002-266X.2016.45.010
R735.1
A
1002-266X(2016)45-0034-04
2016-05-28)
