2,3-吲哚醌对神经母细胞瘤细胞SH-SY5Y侵袭转移的影响及机制
2017-01-06魏尧悦侯琳
魏尧悦,侯琳
(青岛大学医学院生物化学与分子生物学教研室, 山东青岛 266021)
2,3-吲哚醌对神经母细胞瘤细胞SH-SY5Y侵袭转移的影响及机制
魏尧悦,侯琳
(青岛大学医学院生物化学与分子生物学教研室, 山东青岛 266021)
目的 探讨2,3-吲哚醌对神经母细胞瘤细胞SH-SY5Y侵袭转移的影响及机制。方法 体外培养SH-SY5Y细胞,用不同浓度(50、100、200、300 μmol/L)的2,3-吲哚醌处理细胞48 h, 并设不加药物处理的细胞作为对照组,CCK-8法检测细胞活性,筛选合适的2,3-吲哚醌浓度;用吖啶橙染色法检测对照组和 200 μmol/L 2,3-吲哚醌处理组(加药组)的自噬溶酶体细胞数量;将细胞分别用50、100、200、300 μmol/L 2,3-吲哚醌处理(加药组),并设空白对照,48 h后用Western blotting法检测自噬标志性蛋白LC3-Ⅱ的表达水平,Transwell小室试验检测细胞的侵袭能力,划痕试验检测细胞迁移能力。结果 与对照组相比,随着2,3-吲哚醌浓度的升高,细胞A450值降低,药物对细胞的抑制率升高(P<0.05或<0.01)。吖啶橙染色结果显示,与对照组相比,加药组产生自噬溶酶体的细胞数增多(P<0.01)。Western blotting结果显示,与空白对照比较,随着药物浓度增加,加药组LC3-Ⅱ表达增多(P<0.05或<0.01);Transwell小室试验和划痕试验表明,随着2,3-吲哚醌浓度的增加,SH-SY5Y细胞侵袭转移能力逐渐减弱(P均<0.05)。结论 2,3-吲哚醌可能通过诱导神经母细胞瘤细胞SH-SY5Y自噬,从而抑制其侵袭转移。
神经母细胞瘤;SH-SY5Y细胞;2,3-吲哚醌;侵袭;转移
神经母细胞瘤是儿童最常见实体瘤,近50%发生在一岁左右的婴幼儿[1],其起源于胚胎期交感神经系统神经嵴细胞,是小儿癌症死亡的首要原因,占所有儿童癌症病死率的13%[2]。神经母细胞瘤的最显著特点是其临床异质性,约有一半的病例被列为高风险,尽管使用多种方法治疗仍然只有40%左右的生存率[1]。2,3-吲哚醌不仅作为一种海洋活性药物发挥抗癌作用,而且是人体内源性物质,其具有多种药理学活性,如保护神经、抗菌、抗病毒等[3]。研究表明,2,3-吲哚醌可以抑制神经母细胞瘤细胞侵袭转移,其机制可能与下调MMP-2和MMP-9表达有关[4],但未见有关2,3-吲哚醌对神经母细胞瘤细胞自噬及侵袭转移影响的报道。2015年9月~2016年7月,我们观察了2,3-吲哚醌对SH-SY5Y细胞自噬及侵袭转移的影响。现报告如下。
1 材料与方法
1.1 材料 细胞:人神经母细胞瘤细胞SH-SY5Y(购自中国科学院典型培养物保藏委员会昆明细胞库)。试剂与仪器:2,3-吲哚醌(Sigma公司);DMEM培养基(Hyclone公司);Gibco胎牛血清(青岛浩赛科技有限公司);青链霉素混合液、0.25%胰蛋白酶消化液(北京索莱宝科技有限公司);甘氨酸、Tris碱、牛血清白蛋白(BSA)(上海生工生物工程有限公司);6×Protein Loading Buffer(北京全式金生物技术有限公司);Tris 8.8缓冲液、Tris 6.8缓冲液(武汉博士德生物工程有限公司);丙烯酰胺、甲叉双丙烯酰胺,N,N,N′,N′-四甲基乙二胺、过硫酸铵(Sigma公司);苯甲基磺酰氟(武汉博士德生物工程有限公司);Protein Marker(北京全式金生物技术有限公司);聚偏二氟乙烯(PVDF)膜(MILLIPORE公司);BCA蛋白质定量试剂盒(武汉博士德生物工程有限公司);兔抗人LC3B单克隆抗体、鼠抗人β-actin单克隆抗体(Abcam公司);垂直电泳仪、湿法转膜仪(Bio-Rad公司);发光呈像系统(型号Fusion FX7);增强型化学发光试剂盒(北京全式金生物技术有限公司);细胞培养瓶、6孔板、24孔板、96孔板(Thermo Fisher公司);吖啶橙(AO)(Sigma公司);Transwell小室(Corning公司);Matrigel基质胶(BD公司);超净工作台(苏净安泰公司);CO2培养箱(Thermo Fisher公司);倒置显微镜(Olympus公司);荧光显微镜(Olympus公司);超速离心机(Eppendorf公司);pH计(上海雷磁仪器厂);-80 ℃超低温冰箱(Thermo Fisher公司)。
1.2 人神经母细胞瘤细胞SH-SY5Y体外培养 人神经母细胞瘤细胞SH-SY5Y在含10%胎牛血清的DMEM培养基(含青霉素100 kU/L,链霉素100 μg/mL),37 ℃、5% CO2、饱和湿度环境下,使用培养皿连续培养,细胞达80%~90%融合度时,用0.25%胰蛋白酶消化液消化传代。
1.3 不同浓度2,3-吲哚醌对SH-SY5Y细胞抑制率影响的检测 采用CCK-8法。取大约90%融合的细胞,用胰蛋白酶消化,吹打均匀,调整密度,每孔加细胞悬液100 μL,接种到96孔板。设置5个复孔。待细胞完全贴壁,进入对数生长期后,更换新的血清浓度为10%的DMEM培养基,并加入2,3-吲哚醌至终浓度50、100、200、300 μmol/L,对照组不加药物处理。作用48 h后每孔加入10 μL CCK-8溶液,在培养箱孵育2 h。450 nm测定吸光度,并进行统计分析。
1.4 2,3-吲哚醌处理后SH-SY5Y细胞自噬溶酶体的检测 采用AO染色法。取对数期生长的细胞接种于6孔板,24 h后加200 μmol/L 2,3-吲哚醌(加药组)处理,对照组不做药物处理,作用48 h后,把药物处理好的细胞用PBS清洗2次,用0.25%的胰蛋白酶消化制成细胞悬液,将细胞悬液以1 000 r/min离心3 min后弃上清,加PBS把细胞调至1×105~10×105/mL吹打混匀,取300 μL吸到EP管中,加入AO 3 μL,37 ℃避光孵育15 min。加PBS 0.5 mL,1 500 r/min、4 ℃、离心5 min,收集细胞,弃上清。然后用PBS 1 mL 把细胞沉淀打散,同样条件离心,去PBS,再加PBS 1 mL洗2次。最后一次离心后,留下少量液体约10 μL滴加到载玻片上,盖上盖玻片在荧光倒置显微镜上(放大倍数20倍蓝光激发)观察拍照。荧光显微镜下观察到的橘红色点状体即自噬囊泡。
1.5 SH-SY5Y细胞LC3-Ⅱ蛋白相对表达的检测 采用Western blotting法。取对数期生长细胞接种于6孔板,待细胞贴壁后加2,3-吲哚醌(药物浓度分别为100、200、300 μmol/L)处理48 h,提取总蛋白,BCA法测蛋白浓度,8%分离胶和10%浓缩胶进行SDS-PAGE电泳,然后转膜,封闭液室温封闭2 h,加β-actin和LC3B一抗(1∶1 000) 4 ℃孵育过夜。然后用1×TBST洗膜3次,每次10 min,加入二抗孵育1 h,再次用1×TBST洗膜10 min,重复3次。最后将ECL发光液按说明书加到PVDF膜上,室温放置1 min,放入成像系统显影并拍照。以内参GAPDH条带的灰度值比较目的蛋白的表达。
1.6 SH-SY5Y细胞侵袭能力的检测 采用Transwell小室试验。将Matrigel 基质胶与无血清培养液按1∶6 配制后每孔50 μL加入Transwell 小室,放入CO2培养箱中1 h使基质胶凝固。吸出Transwell 小室中未凝固的培养基,加入50 μL 含10 mg/mL BSA 的无血清培养液,37 ℃、30 min。取对数期生长细胞加2,3-吲哚醌处理(药物浓度分别为100、200、300 μmol/L),消化细胞,配成细胞悬液;每孔上室加入 200 μL细胞悬液和2,3-吲哚醌;下腔室中加入 600 μL 10%胎牛血清DMEM培养基后放入 37 ℃ 培养箱中,孵育24 h。对照组加入无血清培养基培养24 h。取出 Transwell小室 用 PBS 洗 2 遍, 5%甲醛固定, 再用PBS 洗 2 遍,加入0.1%结晶紫染色,室温 0.5 h , PBS 洗 2 遍,用棉球擦去上表面细胞,显微镜下拍照计数。
1.7 SH-SY5Y细胞迁移能力的检测 采用细胞划痕试验。将细胞接种于6 孔板,待细胞贴壁后,用1 000 μL 规格的枪头在孔板底部划十字,用PBS洗净刮下的细胞, 换上新的培养基后加入浓度梯度分别为100、200、300 μmol/L的2,3-吲哚醌处理,并设空白对照,37 ℃培养箱中继续培养。分别观察12、24、48 h同一视野下划痕处细胞迁移的距离并拍照对比分析。
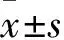
2 结果
2.1 不同浓度2,3-吲哚醌对SH-SY5Y细胞抑制率的影响 对照组及2,3-吲哚醌浓度为50、100、200、300μmol/L时,细胞A450值分别为1.610±0.050、 1.580±0.031、1.540±0.045、1.443±0.094、1.242±0.053,细胞抑制率分别为0、5.370%±0.431%、21.160%±1.738%、32.280%±0.924%、55.740%±1.708%。与对照组比较,随着2,3-吲哚醌浓度的升高,A450值降低,药物对细胞的抑制率升高(P<0.05或<0.01)。
2.2 2,3-吲哚醌对SH-SY5Y细胞自噬溶酶体形成的影响 200μmol/L2,3-吲哚醌处理SH-SY5Y细胞48h,AO染色后可见经2,3-吲哚醌处理的SH-SY5Y细胞出现较多的红色点状聚集。加药组及对照组的自噬细胞阳性率分别为81.397%±3.856%、13.333%±1.528%,两者比较,P<0.01。
2.3 不同浓度2,3-吲哚醌处理后LC3-Ⅱ蛋白的表达 空白对照及100、200、300μmol/L2,3-吲哚醌处理48h后SH-SY5Y细胞LC3-Ⅱ水平分别为0.17±0.04、0.41±0.11、0.59±0.26、0.78±0.19,与空白对照比较,随着2,3-吲哚醌浓度升高,SH-SY5Y细胞LC3-Ⅱ表达升高(P<0.05或<0.01)。
2.4 不同浓度2,3-吲哚醌对细胞侵袭能力的影响 空白对照及100、200、300μmol/L2,3-吲哚醌处理48h后发生侵袭的SH-SY5Y细胞数分别为(327.33±26.63)、(185.67±11.24)、(147.33±2.52)、(75.33±6.03)个,SH-SY5Y细胞抑制率分别为0、43.11%±4.37%、54.80%±3.59%、76.99%±0.23%,与空白对照相比,不同浓度2,3-吲哚醌(100、200、300μmol/L)穿过Matrigel基质小室的SH-SY5Y细胞数量随药物浓度的升高而减少,细胞抑制率升高(P均<0.01)。
2.5 不同浓度2,3-吲哚醌对细胞迁移能力的影响 与对照相比,同一作用时间下,随着2,3-吲哚醌浓度的升高,细胞迁移能力减弱(P均<0.05);随着作用时间的延长(12、24、48h),同一浓度下,2,3-吲哚醌对细胞的抑制作用逐渐增强(图1)。
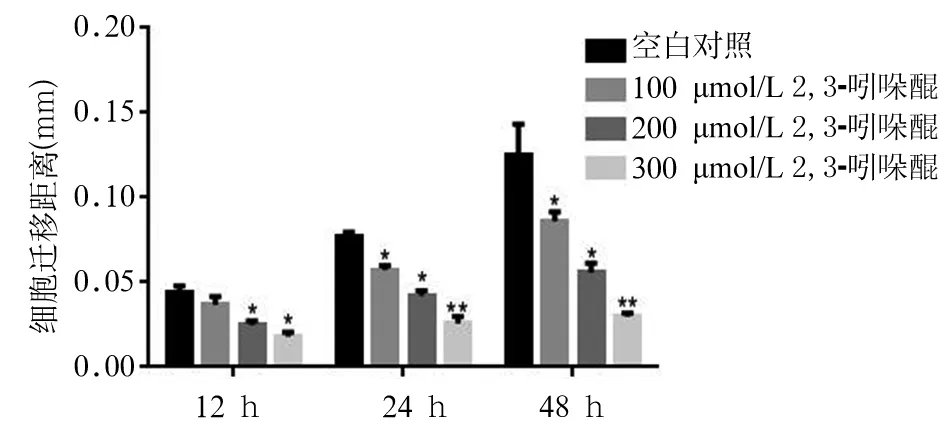
注:与空白对照同时点比较,*P<0.05,**P<0.01。
图1 2,3-吲哚醌对细胞迁移的抑制作用
3 讨论
肿瘤的侵袭和转移是恶性肿瘤的主要特征,也是影响治疗结果和预后的重要因素[5]。神经母细胞瘤恶性程度高,预后差,不同神经母细胞瘤患者预后差别很大。大多数神经母细胞瘤患者死亡的主要原因是淋巴转移和骨转移[6,7],因此抑制神经母细胞瘤的侵袭和转移是其治疗的关键。2,3-吲哚醌毒性低、不良作用小。诸多研究表明,2,3-吲哚醌可以抑制肿瘤血管生成,促进SH-SY5Y细胞凋亡,抑制其增殖、侵袭转移等[8~10]。本试验通过Transwell小室试验和划痕试验分别检测细胞侵袭和迁移能力,结果提示,2,3-吲哚醌能显著抑制神经母细胞瘤细胞的侵袭和迁移能力,且抑制能力随药物浓度的升高和作用时间的增加而增强。
自噬是真核细胞普遍存在的一种现象,是细胞受到外界或内在刺激发生的一种应激反应,是细胞用来达到动态平衡的重要机制之一[11]。自噬在肿瘤形成和发展中扮演抑制和促进的双重角色;自噬一方面通过质量控制功能抑制慢性组织损伤和炎性反应以及维持基因稳定来抑制肿瘤,另一方面通过营养回收维持肿瘤生长代谢从而促进肿瘤存活[12]。虽然自噬对肿瘤发生发展具有双重作用, 但由于多数肿瘤细胞自噬能力降低,因此,自噬的缺陷可能是导致肿瘤发生、发展的重要机制, 诱导肿瘤细胞自噬性死亡是治疗肿瘤的潜在途径[11]。 LC3 是哺乳动物细胞中酵母Atg8基因的同源物,有两种形式:LC3-Ⅰ和LC3-Ⅱ, LC3-Ⅰ在细胞内,而LC3-Ⅱ与细胞膜结合。LC3-Ⅰ是新合成的pre-LC3经过剪切修饰除去C末端22个氨基酸构成的,随后LC3-Ⅰ的一小部分转化为LC3-Ⅱ。因此,LC3-Ⅱ的表达量与自噬程度相关[13]。本试验通过AO染色和Western blotting法分别在细胞水平和蛋白水平检测2,3-吲哚醌对神经母细胞瘤细胞自噬作用的影响。结果显示,与对照组相比,加药组产生自噬溶酶体的细胞数显著增多;Western blotting结果显示,随着药物浓度的增加,自噬标志蛋白LC3-Ⅱ表达量显著增多,提示2,3-吲哚醌能促进神经母细胞瘤细胞自噬。
综上所述,2,3-吲哚醌可能通过促进神经母细胞瘤细胞自噬来抑制其侵袭转移。然而,自噬和侵袭转移是非常复杂的过程,2,3-吲哚醌对神经母细胞瘤细胞自噬的具体机制以及其与侵袭转移之间的关系,仍待进一步研究。
[1] Maris JM, Matthay KK. Molecular biology of neuroblastoma[J]. J Clin Oncol, 1999,17(7):2264-2279.
[2] Louis CU, Shohet JM. Neuroblastoma: molecular pathogenesis and therapy[J]. Annu Rev Med, 2015,66(1):49-63.
[3] Ren A, Benhua SU, Siyong YE, et al. A pharmacokinetic study of Isatin in Beagles′ bodies[J]. Exp Ther Med, 2016,11(6):2225-2228.
[4] 陈晓锋,顾振纶,梁中琴,等.基质金属蛋白酶与肿瘤侵袭和转移研究进展[J].中国药理学通报,2001,17(3):253-256.
[5] 白帆,刘小龙,易俊,等.Hippo通路与恶性肿瘤侵袭转移的相关性研究进展[J].癌症进展,2016,14(3):213-216.
[6] Matthay KK, Villablanca JG, Seeger RC, et al. Treatment of high-risk neuroblastoma with intensive chemotherapy, radiotherapy, autologous bone marrow transplantation, and 13-cis-retinoic acid. Children′s Cancer Group[J]. N Engl J Med, 1999,341(16):1165-1173.
[7] Cohn SL, Pearson AD, London WB, et al. The International Neuroblastoma Risk Group (INRG) classification system: an INRG Task Force report[J]. J Clin Oncol, 2009,27(2):289-297.
[8] Xu P, Hou L, Ju C, et al. Isatin inhibits the proliferation and invasion of SH-SY5Y neuroblastoma cells[J]. Mol Med Rep, 2016,13(3):2757-2762.
[9] 鞠传霞,侯琳,孙福生,等.2,3-吲哚醌对血管内皮细胞生长因子的影响及作用机制研究[J].中国药房,2006,17(24):1851-1853.
[10] Song J, Hou L, Ju C, et al. Isatin inhibits proliferation and induces apoptosis of SH-SY5Y neuroblastoma cells in vitro, and in vivo[J]. Eur J Pharmacol, 2013,702(1-3):235-241.
[11] 温莹浩,殷正丰.自噬与肿瘤[J].实用肿瘤杂志,2006,21(5):482-486.
[12] 程尼涛,马立峰,郭艾.自噬与肿瘤研究现状[J].基础医学与临床,2015,35(3):401-404.
[13] Kabeya Y, Mizushima N, Ueno T, et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosomemembranes after processing[J]. EMBO J, 2000,19(21):5720-5728.
Effect of 2,3-isatin on invasion and metastasis of neuroblastoma SH-SY5Y cells and its mechanism
WEIYaoyue,HOULin
(DepartmentofBiochemistryandMolecularBiology,MedicalCollegeofQingdaoUniversity,Qingdao266021,China)
Objective To investigate the effect of 2,3-isatin on the invasion and metastasis of neuroblastoma SH-SY5Y cells and the mechanism. Methods SH-SY5Y cells cultured in vitro were treated for 48 h with different concentrations of 2,3-isatin (25, 50, 100, 200 and 300 μmol/L). The cell viability was measured by CCK-8. The number of cells with autolysosome in the control group and 200 μmol/L isatin-treated group was detected by acridine orange staining fluorescence. The expression of LC3 Ⅱ, a marker protein for autophagy was examined by Western blotting. The invasion of SH-SY5Y cells was tested by Transwell assay and the motile ability was detected by Scratch test.Results Compared with the control group, the A450 value decreased and the inhibition rate increased when the concentration of 2,3-isatin was higher than 100 μmol/L (P<0.05 orP<0.01). AO staining showed that the number of autolysosomes increased in the 200 μmol/L 2,3-isatin treatment group as compared with that of the control group (P<0.01). Western blotting showed that the expression of LC3-Ⅱincreased with the increasing drug concentration (P<0.05). Transwell assay and Scratch test showed that the invasion and motile abilities of SH-SY5Y cells diminished with the increasing concentration of 2,3-isatin (allP<0.05). Conclusion 2,3-isatin may inhibit the invasion and metastasis of SH-SY5Y cells by inducing the autophagy.
neuroblastoma; SH-SY5Y cells; 2,3-isatin; invasion; metastasis
国家自然科学基金项目( 81472542)。
魏尧悦(1990- ),女,硕士,主要研究方向为抗肿瘤药物。E-mail:hanyue810713791@163.com
侯琳(1962- ),女,教授,博士研究生导师,主要研究方向为肿瘤分子生物学。E-mail:qingdaodxyy@163.com
10.3969/j.issn.1002-266X.2016.45.007
R739.4
A
1002-266X(2016)45-0023-04
2016-08-19)
