慢性阻塞性肺疾病大鼠肺组织JNK/SAPK水平变化及意义
2017-01-06田雪张杏怡李锋肖辉周新
田雪,张杏怡,李锋,肖辉,周新
(上海交通大学附属第一人民医院,上海200080)
慢性阻塞性肺疾病大鼠肺组织JNK/SAPK水平变化及意义
田雪,张杏怡,李锋,肖辉,周新
(上海交通大学附属第一人民医院,上海200080)
目的 探讨C-Jun氨基末端蛋白激酶(JNK)/应激激活蛋白激酶(SAPK)在慢性阻塞性肺疾病(COPD)大鼠肺组织中的水平变化及意义。方法 16只Ⅱ级Wistar雄性大鼠随机分为对照组和COPD组。对照组不予任何处理,COPD组给予烟熏刺激,造成大鼠COPD动物模型。造模成功后,光镜下观察肺组织病理,动物肺功能检测仪检测肺功能,ELISA法检测大鼠肺组织TNF-α水平,免疫组化法检测肺组织JNK/SAPK表达,RT-PCR检测肺组织JNK/SAPK mRNA表达水平。结果 COPD组光镜下出现了大量炎性细胞浸润,部分肺泡融合,肺泡数量减少,证明COPD造模成功。与对照组比较,COPD组第0.3秒用力呼气容积与用力呼气容积的比值降低,呼气阻力、吸气阻力升高,动态顺应性下降(P<0.05或<0.01),TNF-α升高(P<0.05);免疫组化结果显示,COPD组肺组织中JNK/SAPK蛋白表达高于对照组(P均<0.05)。RT-PCR结果显示,与对照组相比,COPD组JNK/SAPK mRNA水平升高(P均<0.05)。JNK/SAPK mRNA表达水平与TNF-α呈正相关(r=0.751,P<0.05)。结论 烟雾诱导的COPD大鼠JNK/SAPK水平升高,其可能通过激活烟雾诱导的炎症因子,导致气道炎症和肺气肿,促进COPD发生。
慢性阻塞性肺疾病;C-Jun氨基末端蛋白激酶;应激激活蛋白激酶;作用机制
C-Jun氨基末端蛋白激酶(JNK)/应激激活蛋白激酶(SAPK)是一类丝氨酸/苏氨酸激酶,为哺乳动物丝裂素活化蛋白激酶家族中的一员。胞外多种刺激信号,如生长因子、细胞因子、环境应激,促使JNK/SAPK磷酸化,使其从细胞质中移位到细胞核,与其下游核转录因子NF-κB、ATF2或c-Jun的氨基末端区域结合,使转录因子的活性区域发生磷酸化,促进相关基因表达,提高核转录能力,介导细胞生长、基因转化、细胞分化和细胞凋亡等多种生物学效应[1]。JNK/SAPK被激活后,能通过不同的下游分子调控机体和细胞的各种功能,如mRNA转录、蛋白合成、线粒体功能等,其中很重要的一项功能是调控细胞自噬[2,3]。目前,在肿瘤[4]、肥胖和糖尿病[5]、神经退行性疾病[6]以及衰老[7]等疾病过程中可见JNK/SAPK作用的相关研究,然而关于JNK/SAPK在各种呼吸系统疾病中作用的研究非常少。在呼吸系统疾病中,有文献报道,吸入含盐酸的胃液可通过调控JNK/SAPK和ERK1/2从而阻止TNF-α受体基因转录而促进急性上呼吸道感染[8]。另有研究报道,结核杆菌通过调控JNK/SAPK和p38信号通路共同介导PI3K/PDK1/AKT信号通路,从而提高细胞趋化因子Leukotactin-1表达,加速肺结核形成[9]。除此之外,临床研究报道,JNK/SAPK信号通路在呼吸道变态反应性疾病中起了至关重要作用[10]。然而其对慢性阻塞性肺疾病(COPD)的影响尚未明确。2015年5月~2016年3月,本研究构建大鼠COPD模型,采集肺组织标本,观察COPD大鼠肺组织JNK/SAPK表达变化,分析JNK/SAPK与COPD发生发展的相关性。
1 材料与方法
1.1 材料 Ⅱ级Wistar雄性大鼠16只,6~7周龄,体质量(200±20)g,购于第二军医大学动物实验中心,SPF级,适应性饲养一周。鼠代谢笼(L2890339,西域机电系统有限公司);匀浆机(德国IKA公司,型号:T25 basic);Buxco PFT系统肺功能检测仪(美国BUXCO公司);台式离心机(美国Eppendorf 公司);戊巴比妥钠进口分装(上海国药集团);脂多糖(美国Sigma公司);一抗JNK/SAPK试剂盒和二抗(上海宝曼生物科技有限公司);TRIzol试剂(上海生工生物工程公司);RNA分离纯化试剂盒(加拿大BBI公司)。
1.2 分组及处理 将大鼠随机分为对照组和COPD组,各8只。对照组不予任何处理。COPD组采用烟雾熏吸法。将大鼠放入自制的有机玻璃染毒箱(100 cm×80 cm×50 cm)内,香烟点燃后,用60 mL注射器吸满烟雾,然后通过三通管将香烟烟雾快速注入染毒箱内。为减少香烟燃烧所产的水蒸气对大鼠的影响,在箱底放置适量硅胶干燥剂。每次持续时间大约1 h、间隔4 h一次,共28 d,同时第1、14天给予气管内注入脂多糖。
1.3 肺组织形态学观察 28 d后处死大鼠,暴露肺部,取部分左肺及气管支气管置于10%甲醛溶液中充分固定48 h。梯度乙醇脱水、二甲苯透明、浸蜡(时间>3 h),包埋,每一组织块行厚4 μm连续切片两张,常规HE染色,于光学显微镜下摄片观察肺组织形态学改变。
1.4 肺功能的测定 将大鼠以4%的戊巴比妥钠(50 mg/kg)腹腔注射麻醉,仰卧位固定于大鼠固定板,纵行切开颈部皮肤约2 cm,机械钝性分离皮下组织,暴露并分离气管后,在第三、四气管环中间切开倒“T”型切口,将气管插管插入气管中,并用线系紧。动物肺功能分析系统调试后,将大鼠放入体描箱,将气管插管与体描箱气路相连。设定呼吸机参数:呼吸比15∶10,呼吸频率75次/min。调整流量阀,使动物的潮气量为5 mL/kg。从气道压力曲线上观察动物是否有呼吸对抗。如有呼吸对抗,则逐次按50 mg/kg剂量追加麻醉,直至对抗消失。呼吸对抗消失后,关闭体描箱,点击“开始”按钮,开始测定肺功能,采集数据。
1.5 大鼠肺组织中TNF-α水平检测 采用ELISA法。暴露肺部,取部分左肺组织,加入生理盐水,匀浆。用大鼠TNF-α单抗包被于酶标板上,标准品与样品中的TNF-α与单抗结合,加入生物素化的抗大鼠TNF-α形成免疫复合物连接在板上,辣根过氧化物酶标记的Streptavidin与生物素结合,加入底物工作液显蓝色,最后加终止液硫酸,在波长450 nm处测A值,TNF-α水平与A值成正比,可通过绘制标准曲线求出标本中TNF-α水平。
1.6 肺组织JNK/SAPK蛋白相对表达的检测 采用免疫组化法。取部分右肺组织样本浸泡于4%多聚甲醛中固定、包蜡、切片(厚度为4 μm),贴片于载玻片,60 ℃烤片,存于通风处。免疫组化法顺序如下:脱蜡,抗原修复,加入一抗(靶蛋白),4 ℃过夜;次日,加入二抗、HRP生物标志链,DAB显色,苏木素染色,盐酸乙醇分化,自来水冲洗泛蓝20 min,常规脱水、透明、封片。采用Image J软件对结果进行分析,镜下观察到棕黄色颗粒为阳性表达,每张切片取10个高倍镜视野,以阳性细胞的积分吸光度(IA)为判定指标进行统计。
1.7 肺组织JNK/SAPK mRNA相对表达水平的检测 采用RT-PCR技术。取部分右肺组织,以高速匀浆机制备组织匀浆。以TRIzol试剂进行总RNA提取,以Oligo DT为引物从总RNA中合成cDNA,然后用上述特异性引物进行PCR扩增。RT-PCR反应检测JNK/SAPK mRNA表达,GAPDH作为内参。JNK上游引物: 5′GGTATGCCCAAGAGGACAGAGGA3′,下游引物:5′AGCCCAGATAGAGCCAGTCGTAA3′,产物228 bp。GAPDH 上游引物:5′CCTTCCGTGTTCCTACCCCC3′,下游引物:5′AGCCCAAGATGCCCTTCAGT 3′,产物481 bp。以系统的SPOT DENSITY软件分别测量内参和JNK/SAPK mRNA基因扩增条带的密度,以JNK/SAPK mRNA条带的密度与内参基因的密度比值代表基因表达的相对水平。
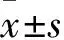
2 结果
2.1 两组肺组织病理表现 对照组(图1A)肺组织无明显变化;COPD组(图1B)小气道上皮细胞变性坏死糜烂脱落,气道黏膜充血水肿,同时管腔内可见较多中性粒细胞聚集和炎性渗出物,气管、支气管周围大量炎性细胞浸润,管腔变小、狭窄,肺泡管、肺泡囊及肺泡明显扩大,部分肺泡出现融合现象。肺泡数量减少,肺泡毛细血管床减少,以上表现均与COPD的病理改变一致,说明造模成功(图1)。

图1 对照组 (A)和COPD组(B)大鼠肺组织病理变化
2.2 两组肺功能指标比较 与对照组比较,COPD组大鼠第0.3秒用力呼气容积与用力呼气容积的比值(FEV0.3/FVC)降低,呼气阻力(Ri)、吸气阻力(Re)升高,动态顺应性(Cldyn)下降(P<0.05或<0.01)。见表1。

表1 两组肺功能指标比较
注:与对照组比较,△P<0.05,△△P<0.01。
2.3 两组肺组织TNF-α、JNK/SAPK蛋白、JNK/SAPK mRNA比较 与对照组比较,COPD组TNF-α、JNK/SAPK蛋白、JNK/SAPK mRNA表达水平升高(P均<0.05)。见表2。

表2 两组肺组织TNF-α、JNK/SAPK蛋白、JNK/SAPK mRNA表达比较
注:与对照组比较,△P<0.05,△△P<0.01。
2.4 JNK/SAPK mRNA表达水平与TNF-α的相关性 JNK/SAPK mRNA表达水平与TNF-α呈正相关(r=0.751,P<0.05)。
3 讨论
COPD是一种可防治的慢性气道炎症性疾病,吸烟为其主要诱因,炎症反应为其发生发展的主要病理机制,病变部位主要涉及全部气道、肺泡壁、肺部血管和肺实质,涉及的细胞主要有中性粒细胞、上皮细胞、巨噬细胞、淋巴细胞等,激活的炎症细胞释放多种炎症介质和细胞因子,包括IL-8、IL-6、TNF-α、MMP-9、IL-1、GM-CSF等近50种细胞因子。研究发现,COPD患者的小叶中心肺气肿部位、小气道、肺泡巨噬细胞、肺泡灌洗液和血管有颗粒污染物残留[11]。同时,香烟烟雾中含有丙烯醛、过氧化氢及活性氧等多种氧化物,能通过增加体内氧化负荷及活化炎性细胞,释放内源性氧化剂,从而打破体内氧化/抗氧化系统平衡,引起肺部炎症[12]。另外,烟雾还可诱导中性粒细胞释放蛋白酶,导致蛋白酶-抗蛋白酶系统的失衡,损害肺组织弹力纤维,从而进一步导致肺气肿形成。鉴于COPD与吸烟密切相关以及COPD发生发展与炎症反应、氧化损伤、蛋白酶/抗蛋白酶失调、免疫障碍等多个方面异常密切相关,因此,近年对COPD治疗研究逐步受到医学界广泛重视。
JNK/SAPK是一类丝氨酸/苏氨酸激酶,为哺乳动物丝裂素活化蛋白激酶家族中的一员。JNK/SAPK被激活后,能通过不同的下游分子调控机体和细胞的各种功能,如mRNA转录、蛋白合成、线粒体功能等,还可以调控细胞自噬。JNK/SAPK信号通路是机体正常与疾病状态时细胞调节的重要靶点。而JNK/SAPK磷酸化,可以在炎症反应方面发挥免疫调节作用。
Oltmanns等[13]通过构建支气管哮喘模型发现,JNK是支气管哮喘发病过程中重要的信号分子,在气道炎症中发挥重要作用,可促进气道平滑肌细胞分泌大量炎性因子如活性调节蛋白、粒单集落刺激因子、IL-8等。Bennett等[14]发现,JNK/SAPK的特异性抑制剂SP600125(一种可逆的ATP竞争性抑制剂)可抑制c-Jun的磷酸化及一些炎症因子如TNF-α、IL-2、INF-γ的表达。而吸烟可直接或间接损伤气道组织细胞,使肺局部中性粒细胞聚集、巨噬细胞凋亡,并激活、释放多种炎性介质,如TNF-α、IL-2、IL-6、INF-γ、巨噬细胞炎性蛋白、粒单集落刺激因子和蛋白酶[15~17],产生异常炎症反应,是COPD发病的中心环节。近年来,人们已意识到JNK/SAPK信号通路在气道炎症反应中可能具有重要意义。但有关JNK/SAPK蛋白磷酸化水平的变化及其与COPD炎症反应机制的关系尚未见报道。
本研究发现,构建烟雾诱导的大鼠COPD模型,大鼠出现了精神萎靡,活动量减少,寒战明显,呼吸急促,呼吸动度增加,喷嚏较多,部分大鼠鼻部出现黏性分泌物,呼吸时伴有明显痰鸣音,心率明显加快;光镜下出现了大量炎性细胞浸润,肺泡壁变薄,部分肺泡融合,肺泡数量减少,肺泡毛细血管床减少等典型的COPD病理现象;肺功能提示FEV0.3/FVC明显下降,Ri、Re升高,Cldyn下降,表明成功建立COPD大鼠模型。采集肺组织标本,分析JNK/SAPK在肺组织中的表达及其与COPD发展的相关性。免疫组化结果显示,COPD大鼠肺组织中JNK/SAPK蛋白表达增强。与对照组相比,COPD组大鼠JNK/SAPK mRNA表达水平升高,差异有统计学意义,且与TNF-α有显著的线性相关关系。考虑JNK/SAPK导致气道炎症和肺气肿,促进COPD发生发展,与JNK/SAPK磷酸化导致一些炎症因子如TNF-α、IL-2、INF-γ的表达升高有关。而肺组织的异常炎症反应则是COPD发病的中心环节。因此JNK/SAPK在烟雾诱导的COPD发生发展中发挥了一定作用。根据以上体内实验,我们推测,JNK/SAPK信号通路可能通过激活烟雾诱导的炎症因子来导致气道炎症和肺气肿发病。
综上所述,本研究初步探讨了JNK/SAPK在烟雾诱导COPD大鼠中的表达及作用,认为JNK/SAPK可以通过激活烟雾诱导的相关炎症因子,促进气道炎症和肺气肿,导致COPD发生。但其更加准确的调控机制还需进一步探讨。同时,JNK/SAPK很有可能成为COPD治疗的新靶点,而JNK/SAPK研究理论的完善,必将为未来COPD及其他呼吸系统疾病的治疗提供新的思路。
[1] Takahashi O, Komaki R, Smith PD, et al. Combined MEK and VEGFR inhibition in orthotopic human lung cancer models results in enhanced inhibition of tumor angiogenesis, growth, and metastasis[J]. Clin Cancer Res, 2012,18(6):1641-1654.
[2] Zhou YY, Li Y, Jiang WQ, et al. MAPK/JNK signaling: a potential autophagy regulation pathway[J]. Biosci Rep, 2015,35(3) pii:e00199.
[3] Ryter SW, Nakahira K, Haspel JA, et al. Autophagy in pulmonary diseases[J]. Annu Rev Physiol, 2012,74(10):377-401.
[4] Tournier C. The 2 faces of JNK signaling in cancer[J]. Genes Cancer, 2013,4(9-10):397-400.
[5] Bennett BL, Satoh Y, Lewis AJ. JNK: a new therapeutic target for diabetes [J]. Curr Opin Pharmacol, 2003,3(4):420-425.
[6] Mehan S, Meena H, Sharma D, et al. JNK: a stress-activated protein kinase therapeutic strategies and involvement in Alzheimer′s and various neurodegenerative abnormalities[J]. J Mol Neurosci, 2011,43(3):376-390.
[7] Gabai VL, Meriin AB, Yaglom JA, et al. Role of Hsp70 in regulation of stress-kinase JNK: implications in apoptosis and aging[J]. FEBS Lett, 1998,438(1-2):1-4.
[8] Maniatis NA, Sfika A, Nikitopoulou I, et al. Acid-induced acute lung injury in mice is associated with p44/42 and c-Jun N-terminal kinase activation and requires the function of tumor necrosis factor α receptor I[J]. Shock, 2012,38(4):381-386.
[9] Cho JE, Park S, Cho SN, et al.c-Jun N-terminal kinase (JNK) and p38 mitogen-activated protein kinase (p38 MAPK) are involved in mycobacterium tuberculosis-induced expression of Leukotactin-1[J]. BMB Rep, 2012,45(10):583-588.
[10] Bennett BL. c-Jun N-terminal kinase-dependent mechanisms in respiratory disease[J]. Eur Respir J, 2006,28(3):651-661.
[11] Hogg JC, Chu F, Utokaparch S, et al. The nature of small-airway obstruction in chronic obstructive pulmonary disease[J]. N Engl J Med, 2004,350(26):2645-2653.
[12] Bodas M, Tran I, Vij N. Therapeutic strategies to correct proteostasis-imbalance in chronic obstructive lung diseases[J]. Curr Mol Med, 2012,12(7):807-814.
[13] Oltmanns U, Issa R, Sukkar MB, et al. Role of c-jun N-terminal kinase in the induced release of GM-CSF,RANTES and IL-8 from human airway smooth muscle cells[J]. Br J Pharmacol, 2003,139(6):1228-1234.
[14] Bennett BL, Sasaki DT, Murray BW, et al. SP600125, an anthrapyrazolone inhibitor of Jun N-terminal Kinase[J]. Proc Natl Acad Sci USA, 2001,98(24):13681-13686.
[15] Provinciali M, Cardelli M, Marchegiani F. Inflammation, chronic obstructive pulmonary disease and aging[J]. Curr Opin Pulm Med, 2011,17(Suppl 1):3-10.
[16] Kim V, Rogers TJ, Criner GJ. New concepts in the pathobiology of chronic obstructive pulmonary disease[J]. Proc Am Thorac Soc, 2008,5(4):478-485.
[17] Murugan V, Peck MJ. Signal transduction pathways linking the activation of alveolar macrophages with the recruitment of neutrophils to lungs in chronic obstructive pulmonary disease[J]. Exp Lung Res, 2009,35(6):439-485.
Changes in levels of JNK/SAPK of rats with chronic obstructive pulmonary disease
TIANXue,ZHANGXingyi,LIFeng,XIAOHui,ZHOUXin
(ShanghaiGeneralHospitalofShanghaiJiaotongUniversity,Shanghai200080,China)
Objective To investigate the changes in levels of c-Jun N-terminal kinase/stress-activated protein kinase (JNK/SAPK) in the lung tissues of rats with chronic obstructive pulmonary disease (COPD). Methods Sixteen Ⅱ male Wistar rats were randomly divided into two groups: the control group and COPD group. The control group was not treated, while the COPD group was stimulated with smoke to set up COPD models. After models were established, we detected the lung pathology through optical microscope, pulmonary function through animal pulmonary instrument, TNF-α expression in lung tissue through ELISA, JNK/SAPK expression through immunohistochemistry, and JNK mRNA expression through RT-PCR. Results In the COPD group, light microscope showed that there was a large number of inflammatory cell infiltration, alveolar fusion, and alveolar reduction, which proved the COPD model was successful. Compared with the control group, FEV0.3/FVC decreased, Ri and Re increased, and Cldyn decreased (P<0.05 orP<0.01), and TNF-α increased in the COPD group (P<0.05). Immunohistochemistry showed that JNK/SAPK expression improved in the COPD group. RT-PCR result showed JNK mRNA expression increased in the COPD group as compared with that of the control group (allP<0.05). JNK mRNA expression was positively correlated with TNF-α (r=0.751,P<0.05).Conclusion The level of JNK/SAPK increases in smoke-stimulated COPD rats, which can cause airway inflammation and emphysema, and promote the occurrence of COPD through activating smoke-induced inflammatory cytokines.
chronic obstructive pulmonary disease; c-Jun N-terminal kinase; stress-activated protein kinase; effect mechanism
国家自然科学基金面上项目(81470218);中国医师协会呼吸免疫专项课题(2014)。
田雪(1984-),女,主治医师,主要研究方向为慢性阻塞性肺疾病的发病机制。E-mail:lwtianxue@126.com
周新(1953-),男,主任医师,主要研究方向为慢性阻塞性肺疾病的发病机制。E-mail:xzhou53@163.com
10.3969/j.issn.1002-266X.2016.45.005
R563.13
A
1002-266X(2016)45-0015-04
2016-09-11)
