晚期肺鳞癌患者RRM1基因多态性与吉西他滨化疗效果及预后的关系
2017-01-06仇为民
仇为民
(扬州市江都人民医院,江苏扬州225200)
晚期肺鳞癌患者RRM1基因多态性与吉西他滨化疗效果及预后的关系
仇为民
(扬州市江都人民医院,江苏扬州225200)
目的 探讨晚期肺鳞癌患者核糖核酸还原亚单位M1(RRM1)基因多态性与吉西他滨化疗效果及预后的关系。方法 对122例晚期肺鳞癌患者进行RRM1 C37A、RRM1 C524T位点基因多态性检测,并均给予吉西他滨方案化疗。化疗3个疗程结束时评价各基因型患者的化疗效果;统计化疗过程中各基因型患者出现的毒副反应情况;所有患者随访至2016年1月,统计各基因型患者死亡、转移、复发情况。结果 RRM1 C37A、RRM1 C524T位点各基因型患者化疗有效率比较P均>0.05。RRM1 C37A位点C/C基因型患者3~4级恶心呕吐发生率为65.4%(17/26),3~4级白细胞减少发生率为65.4%(17/26),均高于其他基因型患者(P均<0.05)。RRM1 C37A位点C/C基因型患者随访期间死亡2例(7.7%)、转移3例(11.5%)、复发3例(11.5%),均高于其他基因型患者(P均<0.05)。结论 晚期肺鳞癌患者RRM1 C37A位点C/C基因型患者吉西他滨化疗毒副反应重、预后差。
肺鳞癌;核糖核酸还原亚单位M1;基因多态性;吉西他滨
肺癌是全球发病率及病死率最高的恶性肿瘤之一,多数患者确诊时已属于肿瘤晚期(Ⅲ、Ⅳ期),需进行以全身化疗为主的综合治疗。鳞癌是肺癌常见病理类型,对化疗药物较为敏感,以吉西他滨为主的化疗方案是目前治疗肺鳞癌的主要方案,但化疗效果存在个体差异[1]。核糖核酸还原亚单位M1(RRM1)是DNA损伤修复过程中的关键酶,是吉西他滨的作用靶点[2]。本研究探讨晚期肺鳞癌患者RRM1基因多态性与吉西他滨化疗效果及预后的关系。
1 资料与方法
1.1 临床资料 选择2013年5月~2015年5月在扬州市江都人民医院确诊为晚期肺鳞癌并接受吉西他滨化疗的患者122例,男72例、女50例,年龄(52.8±6.9)岁,BMI 22.1±3.2,Ⅲ期84例、Ⅳ期38例,低分化60例、中分化36例、高分化26例。排除合并严重心血管系统疾病、肝肾功能不全、精神异常、严重免疫功能缺陷等患者及妊娠者。
1.2 基因多态性检测 患者入院时均采集外周血液标本,采用DNA分离试剂盒(Promega公司)及eppendorf核酸定量仪分离DNA并检测其含量,采用ABI-2700型测序及扩增仪扩增RRM1 C37A、RRM1 C524T位点的相应基因片段,双相测序法分析PCR产物,确定RRM1 C37A、RRM1 C524T位点的基因型,具体方法参照文献[5]。结果显示,122例患者中RRM1 C37A位点基因型为A/A 89例、C/C 26例、A/C 7例;RRM1 C524T位点基因型为T/T 76例、C/T 37例、A/A 9例。各基因型患者性别、年龄、肿瘤临床分期及分化程度等资料均具有可比性。
1.3 化疗方案 化疗前均常规给予叶酸、维生素等对症支持治疗。化疗方案:吉西他滨1 000 mg/m2静滴,第1、8、15天;顺铂 60 mg/m2静滴,第1~3天;28天为一个疗程,均连续化疗3个疗程。
1.4 相关指标观察 ①化疗效果:化疗3个疗程结束时依据WHO实体瘤疗效评价标准评价各基因型患者化疗效果。目标病灶最长直径总和增大>20%或出现新病灶为疾病进展(PD),目标病灶最长直径总和缩小≥30%为部分缓解(PR),目标病灶最长直径总和变化介于PD、PR之间为稳定(SD),所有已知病灶消失为完全缓解(CR)。PR、CR均记为有效,计算化疗有效率(RR)。②毒副反应:统计化疗过程中各基因型患者出现各级中性粒细胞减少、恶性呕吐的例数,中性粒细胞减少、恶性呕吐分级标准参照国立癌症研究所通用毒性标准(NCI-CTC)3.0版。③预后:所有患者随访至2016年1月,统计各基因型患者死亡、转移及复发情况。每个疗程后均常规检测患者血尿常规、肝肾功能、心电图、胸片等,观察肿瘤转移或复发情况。转移、复发诊断标准参照第7版《内科学》。
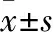
2 结果
2.1 化疗效果RRM1C37A位点A/A基因型患者RR为24.8%(22/89)、C/C为26.9%(7/26)、A/C为28.6%(2/7),各基因型比较P均>0.05。RRM1C524T位点T/T基因型患者RR为21.1%(16/76)、C/T为32.4%(12/37)、C/C为33.3%(3/9),各基因型比较P均>0.05。见表1。

表1 各基因型肺鳞癌患者化疗效果比较
2.2 毒副反应RRM1C37A位点C/C基因型患者3~4级恶心呕吐发生率为65.4%(17/26),3~4级白细胞减少发生率为65.4%(17/26),均高于其他基因型患者(P均<0.05)。见表2。

表2 各基因型肺鳞癌患者化疗期间出现恶性呕吐、白细胞减少情况[例(%)]
2.3 预后RRM1C37A位点C/C基因型患者随访期间死亡2例(7.7%)、转移3例(11.5%)、复发3例(11.5%),均高于其他基因型患者(P均<0.05)。见表3。
3 讨论
肺癌是多基因疾病,其发生是基因与基因、基因与环境之间交互作用的结果[3]。肺鳞癌占原发性肺癌的40%~51%。其生长缓慢,但确诊时多已经发生远处转移,化疗是其主要治疗方法[4,5]。随着肿瘤分子生物学研究领域的不断发展,人们逐渐认识到分子生物学基因表达谱的显著差异是不同个体对化疗药物反应性差异的根本原因, 也是指导肿瘤个体化治疗的基础[6]。与药物作用靶标、 药物代谢、 转运以及细胞信号转导途径相关的特定基因的多态性,对药物的疗效起着决定性作用。临床研究发现,肺癌组织或外周血标本中GSTP1、ERCC1、RRM1 等基因的多态性可显著影响铂类和(或)吉西他滨治疗非小细胞肺癌的疗效[7,8]。

表3 各基因型肺鳞癌患者随访期间死亡、转移、复发情况[例(%)]
吉西他滨是一种破坏细胞复制的二氟核苷类抗代谢物抗癌药,是去氧胞苷的水溶性类似物,主要干扰肿瘤细胞DNA的形成,RRM1是其作用靶点。RRM1是RNA合成的前体,参与核糖核苷酸还原成脱氧核糖核酸的过程,是DNA损伤修复过程中的限速酶和同工酶。RRM1基因启动子区具有一定的多态性,可能影响RRM1基因对DNA的损伤修复功能[9];RRM1C37A、RRM1C524T是RRM1常见的基因位点。Bepler等[10]研究发现,RRM1C37A位点C/C基因型的非小细胞肺癌患者总生存率和无进展生存期明显高于A/C基因型和A/A基因型患者;Zheng等[11]报道,RRM1C37A位点A/C基因型的肺癌患者疾病进展时间和总生存时间均优于C/C和A/A基因型患者;Kim等[12]对接受吉西他滨治疗的晚期非小细胞肺癌患者进行基因多态性检测,结果发现RRM1C37A位点A/C和RRM1C524T位点C/T基因型患者的化疗有效率高于其他基因型患者,但各基因型之间无进展时间和总生存时间比较差异无统计学意义。
本研究结果显示,与其他基因型患者RRM1C524T位点T/T基因型患者化疗效果稍差,但各基因型患者的RR比较差异均无统计学意义;RRM1C37A位点C/C基因型患者3~4级恶心呕吐及3~4级白细胞减少发生率均高于其他基因型患者;我们还发现,RRM1C37A位点C/C基因型患者随访期间病死率、转移率及复发率均高于其他基因型患者。上述结果提示,肺鳞癌患者RRM1基因多态性可能影响化疗毒副反应及预后,RRM1C37A位点C/C基因型患者体内吉西他滨代谢异常,吉西他滨在体内蓄积,可能是此类患者毒副反应增加、预后差的原因之一[13,14]。
综上所述,晚期肺鳞癌患者RRM1C37A位点C/C基因型患者吉西他滨化疗毒副反应重、预后差。
[1] 王晖,武晓楠,丁丽,等.吉西他滨相关不良反应与RRM1基因多态性的关系[J].现代肿瘤医学,2013,21(1):161-163.
[2] 陈妍,张威威,吉兆宁,等.UGT1A1基因多态性与吉西他滨治疗晚期非肺鳞癌毒性和疗效的关系[J].齐齐哈尔医学院学报,2015(22):3277-3280.
[3] 储大同.肺癌[M].北京:北京大学医学出版社,2007:9-14.
[4] 何伟娜,盛立军,孙亚红,等.UGT1A1*28基因多态性与伊立替康二线治疗小细胞肺癌患者临床观察[J].中国实用医药,2016(2):179-180.
[5] 赵晓光,宋明霞,徐洁,等.UGT1A1基因多态性与小细胞肺癌伊立替康化疗毒性和疗效的研究[J].河北医科大学学报,2014(9):1000-1002.
[6] 林莉,刘晓晴,宋三泰,等.肺癌患者RRM1(-37)位点基因多态性及其与临床相关性的研究[J].中国肺癌杂志,2008,11(6):784-788.
[7] 吴泽刚,李艳,郑红云,等.恶性肿瘤患者RRM1基因启动子多态性检测结果分析[J].现代检验医学杂志,2015(3):35-37,42.
[8] 潘战宇,姜战胜,巴一,等.RRM1*28基因多态性与中药预防吉西他滨恶性呕吐效果的关系[J].中国肿瘤临床,2013,(23):1441-1444.
[9] 何奕,赵瑾,龚倩,等.RRM1*6基因多态性与IP方案治疗广泛期肺鳞癌患者临床疗效和毒副反应的相关性分析[J].肿瘤药学,2014(3):182-186.
[10]BeplerG,ZhongZH,GautamA,etal.RibonucleotidereductaseM1genepromoteractivitypolymorphisms,populationfrequenciesandclinicalrelevance[J].Lungcancer, 2005,47(2):183-192.
[11]ZhengZ,ChenT,LiX,etal.DNAsynthesisandrepairgenesRRM1andERCC1inlungcancer[J].NEnglJMed, 2007,356(8):800-808.
[12]KimSO,JeongJY,KimMR,etal.Efficacyofgemcitabineinpatientswithnon-smallcelllungcanceraccordingtopromoterpolymorphismsoftheribonucleotidereductaseM1gene[J].ClinCancerRes, 2008,14(10):3083-3088.
[13] 马丽霞,陈艳,杨长良,等.尿苷二磷酸葡醛酰转移酶1A1基因多态性与吉西他滨治疗广泛期肺鳞癌不良反应的相关性[J].中华肿瘤杂志,2015,37(1):29-32.
[14] 蒋庆庆,胡成平.RRM1*28基因多态性与肺鳞癌[J].国际呼吸杂志,2013,33(4):273-278.
10.3969/j.issn.1002-266X.2016.44.034
R726.5
B
1002-266X(2016)44-0094-03
2016-04-18)
