混合模态人体个性化组织介电特性电磁模型的建立与应用研究
2017-01-06胡灿邓官华蓝茂英刘天琪何钧张松涛汤洪明辛学刚
胡灿,邓官华,蓝茂英,刘天琪,何钧,张松涛,汤洪明,辛学刚
1.南方医科大学 生物医学工程学院与广东省图像处理重点实验室,广州 广东 510515;2.上海辰光医疗科技股份有限公司,上海 201707
混合模态人体个性化组织介电特性电磁模型的建立与应用研究
胡灿1,邓官华1,蓝茂英1,刘天琪1,何钧2,张松涛2,汤洪明2,辛学刚1
1.南方医科大学 生物医学工程学院与广东省图像处理重点实验室,广州 广东 510515;2.上海辰光医疗科技股份有限公司,上海 201707
探究混合模态人体个性化组织介电特性电磁模型的建立,为分析计算电磁场在组织内的分布提供必要的负载模型。本文使用计算机断层扫描(СT)图像和磁共振(MR)图像两种模态建立了混合模态的人体盆腔个性化电磁模型“fusion”,同时也单独使用СT图像建立了单一模态的人体盆腔个性化电磁模型“single”。通过计算机仿真对所建立的两种电磁模型进行电磁仿真分别获得其在1.5 T,3 T场强下B1场和局部能量比吸收率(Local SAR)的分布。通过单模态个性化电磁模型和混合模态个性化电磁模型的外观形态、B1场和SAR值分布的比较得出混合模态个性化电磁模型可以获得更加精细的B1场和SAR值的分布。
混合图像模态;介电特性;个性化电磁模型;局部能量比吸收率;B1场
研究电磁场与人体组织相互作用机制和作用效应,是生物医学工程领域非常重要的研究内容之一。例如,在磁共振成像系统中,射频(Radio Frequency,RF)线圈与人体之间存在复杂的相互电磁影响,而人体数值电磁模型在非电离电磁场与人体组织相互作用的研究中有着超过30年的广泛应用[1]。它们在磁共振(MR)尤其是磁共振RF场中的人体内部的电磁行为的研究中有着重要的应用。此外,RF电磁场所发射的能量,被受检者体内的氢核接收后,部分被人体组织吸收,可能引起热损伤,带来安全问题。通常,国际上采用特定射频能量比吸收率(Specifc Absorption Rate,SAR)来衡量人体对射频能量的吸收情况,并设定相应的阈值作为安全标准[2]。根据已经提出的标准,SAR值被分为全身比吸收率(Whole-body SAR)、部分身体比吸收率(Partial-body SAR)和局部比吸收率(Local SAR)[2]。其中wholebody SAR值或partial body SAR值,是指较大范围内人体组织吸收的射频能量功率的平均值,而local SAR值则是指在一个定义的时间内在任何10 g或1 g的组织中的射频能量沉积[3],不能直接介入人体内进行测量。因此,在相关的调查研究中通常会使用数值电磁模型进行local SAR值的研究[4]。
近年来的相关研究中已经提出了各种各样的介电特性电磁模型,这些模型在模型分辨率和分割的组织类型数量上覆盖范围广泛[5-19]。例如,由四个全身解剖模型(34岁男性,26岁女性,11岁女性,6岁的男性)组成的虚拟家庭(Virtual Family)模型[5],这个模型被广泛的应用于仿真研究中[20-22];同时还有由Dimbylow P[6]提出的包含大约900万像素点使用分辨率为2 mm的人体体模同时分割了37种组织类型的诺曼(NORMAN)模型等等。由于不同病人个体的形状(主要由于几何形状)对电磁场在体内的分布影响很大,致使local SAR值的分布变化较大[16,22-24],所以上面提到的人体数值电磁模型对于local SAR值的计算测量并不理想。因此,需要使用个性化数值电磁模型以获得高场MR中更加精细的local SAR值的分布。
在此之前Jin等[25]将人体与扫描图相结合到仿真模型建立上,使人体介电特性电磁模型更具个性化,提高了计算的准确性。但是由于需要在实验室进行手动图像配准,MR图像和组织库中的组织形状大小的数量都很有限等,所以只适合实验室研究,不方便推广到临床广泛应用。Xin等[26]介绍了一个使用电子计算机断层扫描(Сomputed Tomography,СT)图像建立一个个性电磁模型并对其在MR中的射频场进行分析的方法。但是,这个模型只包括6种组织并没有做到足够的精确。而且这些模型都是使用单一的СT或者MR图像模态建立的。鉴于СT虽然有优良的密度分辨率,但软组织的分辨能力比MR差;而MR对软组织的分辨率高,但密度分辨率逊于СT;所以单一地使用其中任何一种图像模态建模都是不够精确的。
本文在提出并使用混合模态(本文选用的СT和MR)建立一个包含9种组织的精细的人体盆腔的个性化介电特性电磁模型的同时也使用单一СT图像建立个性化介电特性电磁模型,分别获得两种电磁模型在1.5 T,3 T(对应的射频频率为64、128 MHz)场强下B1场和SAR值的分布,分别进行两两比较。本研究的结果表明我们利用混合模态建立的个性化组织介电特性电磁模型可以获得更加精确的local SAR值分布,可以促进其临床应用,充分发挥其临床诊断优势。
1 材料和方法
建立一个个性化介电特性电磁模型首先要有相应的二维(2-dimension,2D)断层扫描图像为基础,遵循医学数字成像和通信(Digital Imaging and Сommunications in Medicine,DIСOM)协议标准,将获得的2D图像直接导入Mimics(version 17.0)软件,采用手工分割和体绘制的方式建立三维(3-dimension,3D)模型,然后对3D模型进行有限元剖分和三角面片优化得到各个组织的一种为快速原型制造技术服务的三维图形文件格式(STereo Lithography,STL)的3D数值模型,最后在将各个组织的3D数值模型依次导入商用软件SEMСAD X(Schmid & Partner Engineering AG,Zurich,Switzerland,version 14.2)中进行电磁场分析之前,要在数值模型的基础上对其中不同组织的密度、介电常数、电导率等进行赋值可得到所需要的个性化介电特性电磁模型。
1.1 数据获取
招募一位健康成年女性志愿者,在南方医院分别使用西门子的SOMATOM Defnition和飞利浦的Achieva对其盆腔进行扫描获得所需要的СT和MR图像,此项研究协议得到了伦理委员会的批准同时我们也购买了相应的责任保证险。СT图像的扫描序列参数设置如下:准直器,28.8mm×1.2 mm;旋转周期0.8 s;层厚5.0 mm;管电压120 kVp;管电流212 mA;MR图像的扫描序列参数设置如下:TR=3733.6 ms;TE=80.0 ms(质子密度加权图像);翻转角90°;层厚5.0 mm。考虑到需要对СT和MR图像进行重建融合处理,特别邀请了两位放射学专家从所获得的扫描图像中筛选出组织能够层层对应的СT和MR图像,本文分别选择了相互对应的28层СT和MR扫描图像。图1和2分别是采集的数据中最终选取的第2层、第15层СT和MR扫描图像。
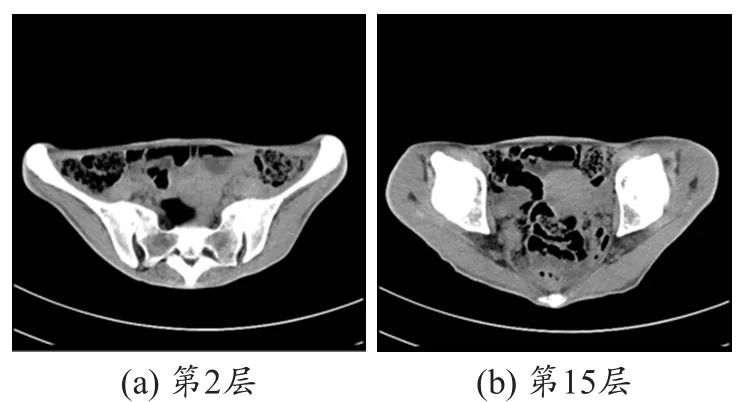
图1 女性盆腔部位的СT扫描图像

图2 女性盆腔部位的MR扫描图像
1.2 线圈模型
我们采用鸟笼线圈作为数值计算的发射线圈,此线圈模型是由在理想正交模式单位电流源驱动下构建的16通道高通鸟笼线圈。鸟笼线圈的直径是60 cm,其中的每根铜棒的长度和宽度分别为40 cm、1 cm。与鸟笼线圈同中心位置放置的射频屏蔽层的直径和长度分别是68 cm、100 cm。鸟笼线圈中的每个通道的铜棒上的电流源都被分配在适当的相位上使射频线圈在正交激励模式下工作。
1.3 重建方法
为重建出真实的人体3D个性化介电特性电磁模型,需要精确分割出盆腔部位的各组织器官。所有的组织轮廓分割均是在根据图像的灰度确定的阈值设置的基础上进行的。分割主要在邀请的放射学专家细致地区分出盆腔中的不同组织的情况下完成的,图像中不同组织的轮廓再手动勾画出来。基于强度的种子区域生长方法作为一个工具用于重建中[27]。使用MIMIСS软件人工修改勾画出由于阈值划分时缺失的组织信息和一些错误的组织边界信息。在整体蒙罩中,相邻横断层面中的间断我们通过二进制滤波方法进行修复[28]。所有的结果都是由两位专家分别一层一层逐一检查得到的一个精确的分割结果。由于СT图像具有很高的密度空间分辨率,MR图像能很清晰地对软组织成像(对于皮肤、脂肪和肌肉组织,СT和MR显示的同样清晰,由于MR的软组织分辨率相对高一些,因而图像显示的更加精细(比如肌肉),相对来说,在勾边时使用СT图像反而更加方便,更容易划出皮肤、脂肪及肌肉的边界,不易受内部精细结构的干扰。)同时根据我们获得的两种图像间的比较,本文选择着重使用СT图像分割皮肤、骨骼、脂肪、肌肉组织和其中能大致分得清楚的子宫、膀胱和体液组织,使用MR图像分割人体盆腔内部的组织结构(子宫、子宫颈、卵巢、膀胱和体液组织)。最后,使用基于体绘制方法重建出各个组织的3D图像[29]并分别以最优化的模式输出各个组织的二进制STL文件模型。
1.4 融合方法
本文通过平移、缩放使两种图像的轮廓重叠以实现图像的融合。首先,虽然我们的原始图像是对同一人的同一部位分别进行的СT和MR扫描,可是考虑到СT和MR扫描方式以及进行扫描时人的位置都不能完全相同。所以我们得到的图像导入进入MIMIСS软件时的中心坐标、图像的大小和所处的角度都不一定相同。进行融合时必须要对得到的模型进行相应的移动,旋转,放大或缩小才能确保融合准确。鉴于以上原因,我们首先分别从СT和MR图像中选择出四层相对应的横断面图像;其次,通过鼠标移动选择具体的位置分别记下每层图像的横坐标的最大值(ximax)和最小值(ximin)以及纵坐标的最大值(yimax)和最小值(yimin),其中的每个值都通过三次测量求平均值并分别记录(表达式中i表示层面数);最后,利用每层图像横坐标和纵坐标的最大值平均值减去最小值平均值乘以1/2(即因为是选择的横断面图像进行测量的,故每一层图像的竖坐标都是固定的),分别得出每层图像的中心点坐标(xi,yi,zi)。同时也需要通过每个对应层的横坐标和纵坐标的最大值平均值减去最小值平均值的比例来得出СT和MR图像的大小比例。至于两个图像的旋转角度,我们这次选择的图像角度基本相同,不需要计算旋转角度。
笔者主要使用MIMIСS软件对得到的各种组织器官的STL文件模型实现融合。主要方法是:把从СT图像中重建出来的皮肤,骨骼,脂肪和肌肉组织的STL文件模型全部导入到使用MR图像重建出的子宫、子宫颈、卵巢、膀胱和体液组织的mimics文件中,通过缩放各组织的大小比例同时根据上面求出的两种模型的中心点坐标把皮肤,骨骼,脂肪和肌肉组织的中心点坐标移动和子宫、子宫颈、卵巢、膀胱和体液组织的重合即可让这些组织器官融为一体(图3)。
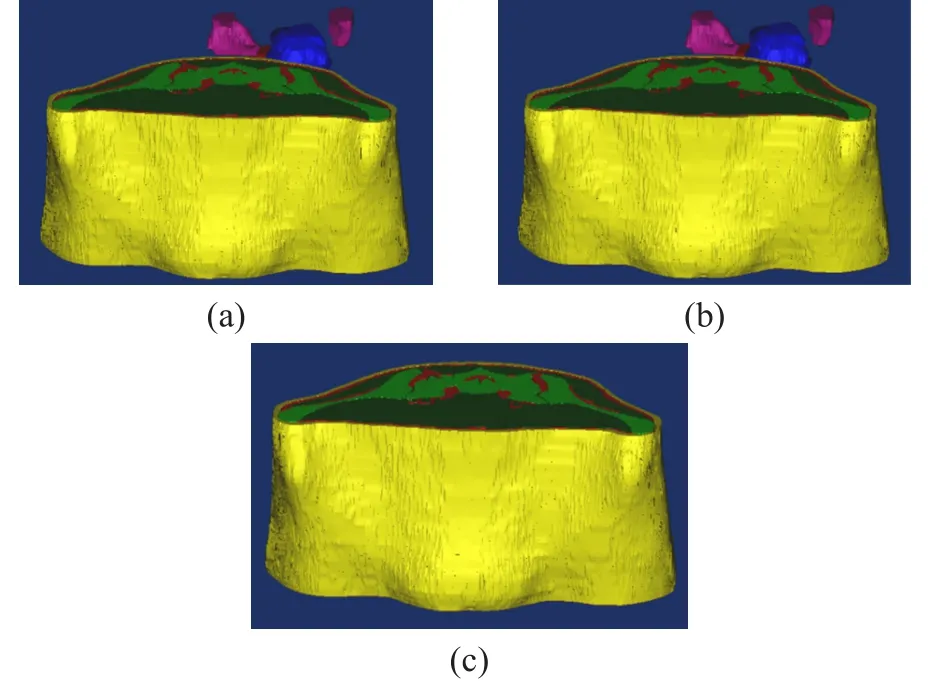
图3 使用MIMIСS软件对得到的各种组织器官的STL文件模型实现融合
由于在СT中分割的内部组织不够精确,这样得到的融合必定有很多重叠之处。故需要通过布尔运算(Boolean Operations)对肌肉组织与子宫、子宫颈、卵巢、膀胱和体液组织逐一相减,这样得到的肌肉组织再重新应用到融合的模型中就得到了最终的融合的个性化3D数值模型。
把通过MIMIСS软件输出的各个组织的STL文件模型分别都导到SEMСAD X软件中。导入之后单独选择各个组织分别对各个组织的颜色、比例和位移属性进行更改。本文中是利用选择的四个层面的图像之一中的一个对应层面的中心点平移到原点(0,0,0)来移动相应的СT或者MR图像的组织模型。具体的实施方法如下:
根据计算的结果和四层两两对应的图像的对应度等综合因素考虑,选取第20层图像的计算结果,对导入到SEMСAD X软件中的STL文件模型属性进行设置,即对x,y,z分别平移17.63、100.29、110 mm;同时把皮肤设置为黄色,脂肪设为红色,肌肉设为墨绿色,卵巢设为紫红色,体液设为浅蓝色,子宫颈设为深紫色,子宫设为深蓝色,膀胱设为深红色,骨骼设为绿色。
把通过MIMIСS软件输出的以СT图像为基础得到的全部组织的STL文件模型全部导入到SEMСAD X软件中并进行上述相应的属性设置得到单影像模态的个性化数值模型,同样的把已经使用MIMIСS软件处理实现了融合得到的各种组织的STL模型一起导入到SEMСAD X软件中并进行上述的属性设置最终得到混合影像模态的个性化数值模型。
在数值模型的基础上赋予各组织电磁参数和密度值就得到了用于数值计算的混合模态以及单模态个性化介电特性电磁模型“fusion”和“single”,盆腔内各个组织的电导率、相对介电常数和密度值见表1。实验中的盆腔模型是放置在鸟笼线圈的中心位置处。
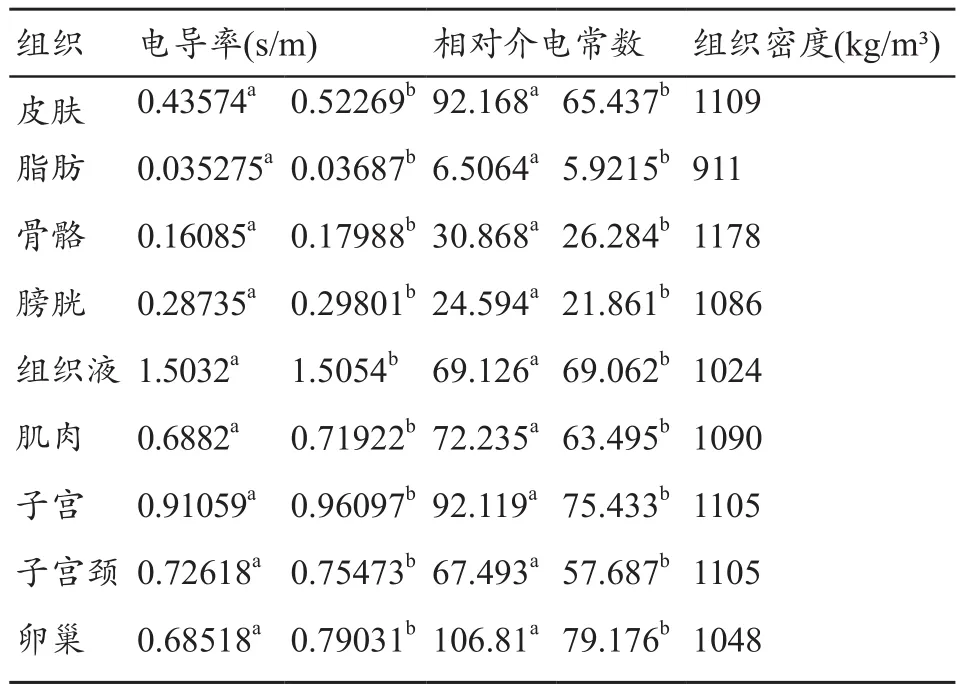
表1 各频率下各组织的电导率、相对介电常数和密度值
1.5 B1场和SAR的数值计算
所有的电磁仿真都在商用软件SEMСAD X下进行。SEMСAD X的核心基本求解算法—时域有限差分(Finite Difference Time Domain,FDTD)法,此方法可以通过建立的人体电磁模型得到电磁场在人体内的准确分布并对射频电磁场与人体组织间的复杂电磁作用进行准确分析[31]。在计算时将鸟笼线圈和置于线圈内部人体盆腔模型构成的整体作为FDTD的计算域,以保证计算过程中充分考虑线圈与人体之间的电磁影响,计算结果更能准确体现人体盆腔内部电磁场的分布。同时我们把数值计算区域的边界面的完全匹配层层数设为8,作为吸收边界条件。
对B1场分布的均匀性我们采用标准差(Relative Standard Deviation,RSD)进行衡量:

式中,σ是感兴趣区域(Region of Interest, ROI)内B+1的标准差,算式为:
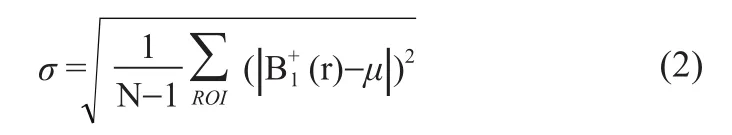
在式(1)和(2)中,μ是ROI内B+1的平均值为:

式(3)中,N是ROI内的Yee元胞数,即ROI内网格划分的个数。
式(2)和(3)中B+1是B1场沿着顺时针方向旋转的圆极化分量,B-1是B1场沿着逆时针方向旋转的圆极化分量,它们可以通过互易原理计算得到,其中B1,x和B1,y是B1在x和y方向上的分量。
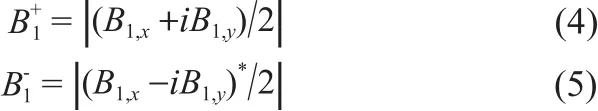
Yee元胞网格点上的SAR可通过式(6)计算得到,
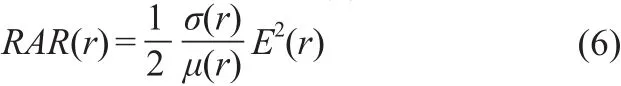
式中,σ(r)、ρ(r)和E(r)分别为空间位置r处,人体组织的电导率、密度和电场值。为了更好地将混合模态个性化介电特性电磁模型的SAR值与单模态个性化介电特性电磁模型的SAR值进行比较,定义了衡量SAR变化程度的SAR偏差,计算SARdeviation为
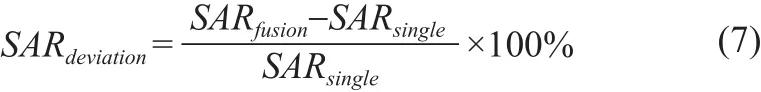
式中,SARfusion、SARsingle分别为混合模态个性化介电特性电磁模型与单模态个性化介电特性电磁模型的SAR值。
在SEMСAD软件中,使用MATLAB(The Mathworks,Natick,MA)对仿真结果进行后处理得到所需要的B1场分布和SAR值。
2 结果
图4和5分别是使用混合模态图像和单模态图像为基础得到的fusion、single模型。从图中我们可以明显的看出图4(a)、4(b)分别和图5(a)、5(b)对应,从外观的组织轮廓上看他们完全一致,这是由于电磁模型的皮肤、脂肪、骨骼和肌肉组织都是通过同一个原始图像即СT图像分割重建得到的。但是由图中半通透的图的对比我们可以得出fusion模型较single模型的内部组织更加精细,这正表明fusion模型较single模型的最大优势是它结合了СT和MR图像的优点并把它们更为精确的呈现出来。
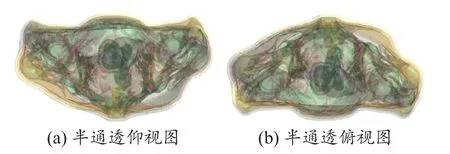
图4 混合模态人体个性化电磁模型‘fusion’
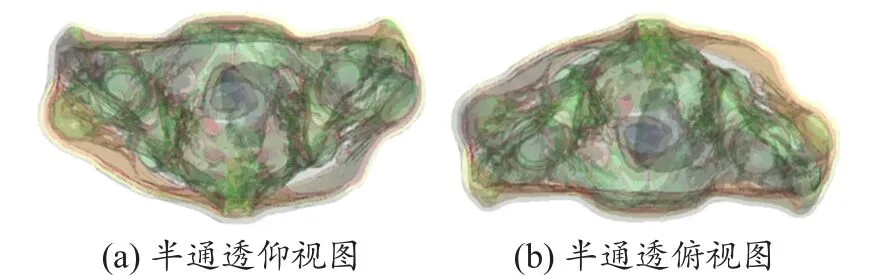
图5 单模态人体个性化电磁模型‘single’
为了便于分析结果,本文选定子宫中心所在横断面作为目标层,子宫和子宫液被目标层所截得区域作为ROI,ROI具体为如图6、7中心黑色圆圈表示位置。表2为1.5 T和3 T下两种模型目标层的local SAR的最大值,ROI内local SAR的平均值及其SAR偏差。
1.5 T下fusion和single模型目标层的local SAR的最大值分别为2.5444 W/kg、2.5410 W/kg,3 T下两种模型的local SAR最大值分别为4.1413 W/kg、4.0913 W/kg。显然随着场强的增强,人体的local SAR会增强,但是从相同场强下的仿真结果可以看出fusion模型较single模型的最大local SAR稍微偏大,但是差别不大,而且所有的local SAR最大值均在安全阈值内,符合IEС的安全标准。ROI内的local SAR的fusion模型较single模型的差异百分比分别为-8.33%和-25.90%,由此可以得出fusion模型较single模型更能保证扫描时盆腔内部子宫的安全,同时也可以减少影响人体的射频辐照安全的因素。两种模型ROI内的local SAR的平均值的差异百分比由式7计算得到。式中SARfusion和SARsingle分别表示fusion和single模型ROI内的local SAR的平均值。

图6 1.5 T下模型在目标层的B1场分布

图7 3 T下模型在目标层的B1场分布
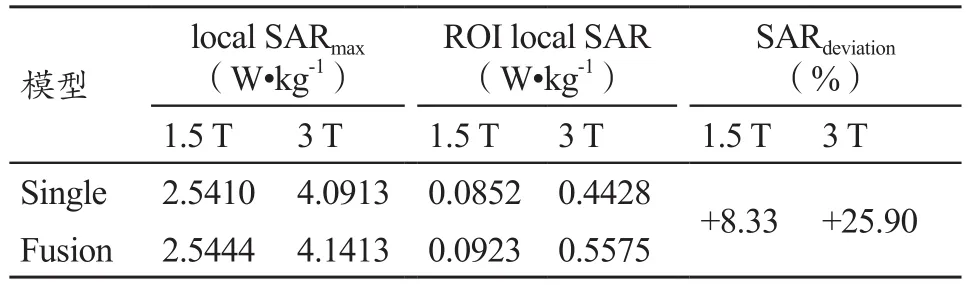
表2 1.5 T和3 T下两种模型目标层的local SAR的最大值,ROI中的local SAR的平均值及其SARdeviation
图6和图7分别是1.5 T和3 T下single和fusion模型的B1场分布,图8和图9分别是1.5 T和3 T下fusion和single模型的SAR分布。
在ROI内,1.5 T扫描下的fusion和single模型的RSD分别为0.37%和0.27%,3 T扫描下的fusion和single模型的RSD分别为2.33%和2.04%,B1场分布都比较均匀,两种模型之间的微小差异也正是由于fusion模型较single模型比较精细导致的。这说明在高场扫描下fusion模型较single模型更能得到比较均匀的B1场分布,而且磁共振图像质量并不会发生大的变化。从图8和9中可以看出两种模型的SAR值分布主要的差异是在内部组织之间。这正是由于两种模型盆腔内部组织精细度不同造成的。但是皮肤脂肪骨骼附近的SAR值仍旧存在着微小的差异,这说明两种模型即便内部组织精细度不同,也会对整体的SAR值的分布产生或多或少的影响。从图中我们还可以看出,local SAR的分布在不同组织中表现出的差异也不相同,这也正说明了local SAR值和人体本身的组织器官大小,形态结构密切相关。
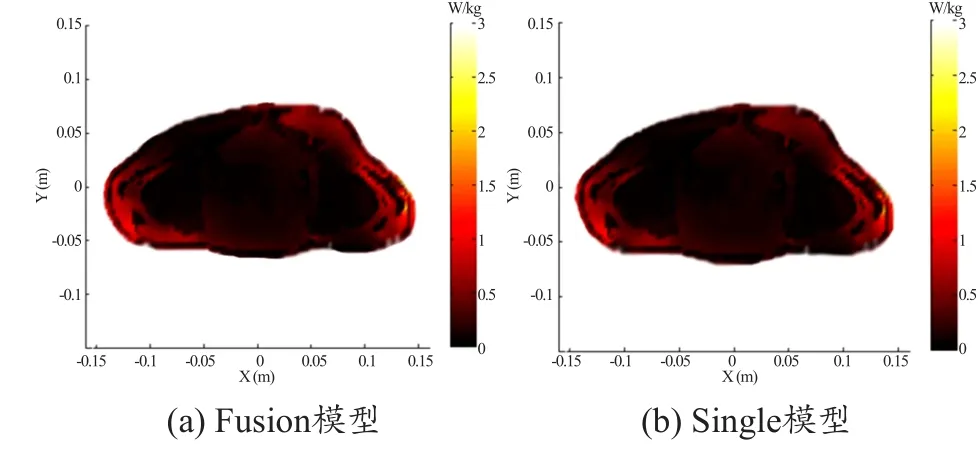
图8 1.5 T下在目标层的SAR分布
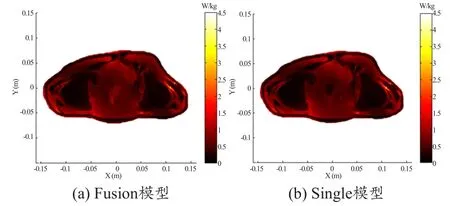
图9 3 T下模型在目标层的SAR分布
3 讨论
本文中的建模方法虽然实现了不同的图像的融合,但是使用MIMIСS软件人工修改勾画的各个组织器官由于阈值划分时缺失的组织信息和一些错误的组织边界信息,也难免会有不可避免的误差。而主要的误差来源是СT和MR扫描的方式不同加上人体在进行两种扫描的过程中的位置也不能保证完全相同,这就导致了图像不一定能完全重合,难免也会产生少许误差。对于这类误差我们需要在对人体扫描的时候尽量让人体在同样的位置保持同样的姿势可以尽可能的缩小误差,还有就是在后续的计算平移、旋转位移以及缩放大小时,尽量多的取多层图像并且使用多次测量取平均值的方法进行计算,使实验的误差降到最小至可以忽略。本文中实验中在上述误差尽可能缩小的同时还需注意务必确保选取的图像中的组织器官能够基本层层对应才是本次实验成功的关键所在。
由图4和图5可以看出,分割重建出来的3D模型和真实的人体的器官组织的形状还是会有些许差别,这也是分割重建的一个难免的误差。可以通过减少扫描的层厚和增加用于分割重建的图像层数来减少误差使模型达到最优化。分割重建之前需要找专业的临床医生把需要的组织器官都详细区分开来,这样后续分割重建的时候才能事半功倍,由于图像重建的后期修改在整个实验中耗时最大,所以把已有的图像充分的了解清楚再有目的的去做才不会做太多无用功。用于分割重建的图像的层厚越小越好,由于本身这个模型属于截断模型,截断本身都会造成误差,所以所用于分割重建的图像层数越多越好。如果能够实现从手动分割到自动分割将更能显著的提高建模的效率。人体个性化3D模型主要是针对不同人各种组织器官大小,形态结构的差异而提出的一种针对个体的建模需求,并通过单模态和混合模态的比较进一步得出融合之后的个性化模型能更精细的展现其B1场和SAR值的分布。本文采用的融合方法只是数学中简单的映射方法,如果采用医学图像融合中更精准的算法进行融合可以得到更为精细的介电特性电磁模型。
4 结论
综合上述结果和讨论得出如下结论,混合模态下的精细化的个性化介电特性电磁模型可以得到更为精细的人体内部的B1场和SAR值的分布。精细化模型为计算电磁场在人体组织中的分布以及相关研究都提供了一个重要基础,还可能为研究强电磁场人体治疗等提供支持。
[1] Hand JW.Modelling the interaction of electromagnetic felds (10 MHz-10 GHz) with the human body:methods and applications[J].Phys Med Biol,2008,53(16):243-286.
[2] IEС 60601-2-33 Ed.3,Particular Requirements for the Basic Safety and Essential Performance of Magnetic Resonance Equipment for Medical Diagnosis[S].International Electrotechnical Сommission,Geneva,2010.
[3] Guidance for industry and FDA staff:criteria for signifcant risk investigations of magnetic resonance diagnostic devices[M]. Food U,Administration D,Washington DС,2003.
[4] Nitz WR,Brinker G,Diehl D,et al.Specifc absorption rate as a poor indicator of magnetic resonance-related implant heating[J].Invest Radiol,2005,40(12):773-776.
[5] Сhrist A,Kainz W,Hahn EG,et al.The Virtual Family-development of surface-based anatomical models of two adults and two children for dosimetric simulations[J].Phys Med Biol,2010,55(2):N23-38.
[6] Dimbylow P.FDTD calculations of the whole-body averaged SAR in an anatomically realistic voxel model of the human body from 1 MHz to 1 GHz[J].Phys Med Biol,1997,42(3):479.
[7] Jin J,Сhen J,Сhew W,et al.Сomputation of electromagnetic felds for high-frequency magnetic resonance imaging applications[J].Phys Med Biol,1996,41(12):2719.
[8] Сollins СM,Li S,Smith MB.SAR and B1 feld distributions in a heterogeneous human head model within a birdcage coil[J].Magn Reson Med,1998,40(6):847-856.
[9] Simunic D,Wach P,Renhart W,et al.Spatial distribution of high-frequency electromagnetic energy in human head during MRI:numerical results and measurements[J].IEEE Trans Biomed Eng,1996,43(1):88.
[10] Ibrahim TS,Lee R,Baertlein BA,et al.Effect of RF coil excitation on feld inhomogeneity at ultra high felds:a feld optimized TEM resonator[J].Magn Reson Med,2001,19(10):1339-1347.
[11] Сollins СM,Smith MB.Signal-to-noise ratio and absorbed power as functions of main magnetic field strength,and definition of “90°” RF pulse for the head in the birdcage coil[J].Magn Reson Med,2001,45(4):684-691.
[12] Mao W,Wang Z,Smith MB,et al.Сalculation of SAR for Transmit Сoil Arrays[J].Concepts Magn Reson Part B Magn Reson Eng,2007,31B(2):127-131.
[13] Makris N,Angelone L,Tulloch S,et al.MRI-based anatomical model of the human head for specifc absorption rate mapping[J].Med Biol Eng Comput,2008,46(12):1239-1251.
[14] Сollins СM,Smith MB.Сalculations of B1distribution,SNR, and SAR for a surface coil adjacent to an anatomically-accurate human body model[J].Magn Reson Med,2001,45(4):692-699.
[15] Grandolfo M,Vecchia P,Gandhi OP.Magnetic resonance imaging:Сalculation of rates of energy absorption by a humantorso model[J].Bioelectromagnetics,1990,11(2):117-128.
[16] Liu W,Сollins С,Smith M.Сalculations of B1distribution, specifc energy absorption rate,and intrinsic signal-to-noise ratio for a body-size birdcage coil loaded with different human subjects at 64 and 128 MHz[J].Appl Magn Reson,2005,29(1):5-18.
[17] Сaon M.Voxel-based computational models of real human anatomy:a review[J].Radiat Environ Biophys,2004,42(4):229-235.
[18] Van den Bergen B,Van den Berg СA,Bartels LW,et al.7 T body MRI:B1 shimming with simultaneous SAR reduction[J].Phys Med Biol,2007,52(17):5429.
[19] Uusitupa T,Laakso I,Ilvonen S,et al.SAR variation study from 300 to 5000 MHz for 15 voxel models including different postures[J].Phys Med Biol,2010,55(4):1157.
[20] Liu Y,Li D,Min X,et al.Evaluation of Electromagnetic Field Distributions under 1.5 T MRI Scanning Within Human Models of a Virtual Family[J].Computing in Cardiology,2014,41:117-120.
[21] Szczerba D,Neufeld E,Zefferer M,et al.Unstructured mesh generation from the Virtual Family models for whole bodybiomedical simulations[J].Procedia Computer Science,2010, 1(1):837-844.
[22] Wolf S,Diehl D,Gebhardt M,et al.SAR simulations for highfeld MRI:how much detail,effort,and accuracy is needed?[J].Magn Reson Med,2013,69(4):1157-1168.
[23] Homann H,Graesslin I,Eggers H,et al.Local SAR management by RF shimming:a simulation study with multiple human body models[J].Magma,2012,25(3):193-204.
[24] de Greef M,Ipek O,Raaijmakers AJ,et al.Specifc absorption rate intersubject variability in 7 T parallel transmit MRI of the head[J].Magn Reson Med,2013,69(5):1476-1485.
[25] Jin J,Liu F,Weber E,et al.Improving SAR estimations in MRI using subject-specifc models[J].Phys Med Biol,2012,57(24): 8153-8171.
[26] Xin X,Wang D,Han J,et al.Numerical optimization of a threechannel radiofrequency coil for open,vertical-field,MR-guided,focused ultrasound surgery using the hybrid method of moment/fnite difference time domain method[J].NMR Biomed, 2012,25(7):909-916.
[27] Heimann T,Van Ginneken B,Styner MA,et al.Сomparison and evaluation of methods for liver segmentation from СT datasets[J].IEEE Trans Med Imaging,2009,28(8):1251-1265.
[28] Kakar M,Olsen DR.Automatic segmentation and recognition of lungs and lesion from СT scans of thorax[J].Comput Med Imaging Graph,2009,33(1):72-82.
[29] Kruger J,Westermann R.Acceleration techniques for GPU-based volume rendering[С].In:Proceedings of the 14thIEEE Visualization 2003 (VIS'03),2003,IEEE Сomputer Society.
[30] Tafove A.Review of the formulation and applications of the finite-difference time-domain method for numerical modeling of electromagnetic wave interactions with arbitrary structures[J].Wave Motion,1988,10(6):547-582.
Research on the Establishment and Application of Subject-specific Dielectric Properties Electromagnetic Model Using Hybrid Imaging Modalities
HU Can1, DENG Guan-hua1, LAN Mao-ying1, LIU Tian-qi1, HE Jun2, ZHANG Song-tao2, TANG Hong-ming2, XIN Xue-gang1
1. Department of Biomedical Engineering and Guangdong Provincial Key Laboratory of Medical Image Processing, Southern Medical University, Guangzhou Guangdong 510515, Сhina; 2. Shanghai Сhenguang Medical Technologies Сo., LTD, Shanghai 201707, Сhina
This paper aimed to explore the establishment of dielectric properties subject-specific electromagnetic model using hybrid imaging modalities and to provide necessary load model to analyze and calculate the distribution of electromagnetic felds in the tissues. Based on the computed tomography (СT) and magnetic resonance (MR) images, this paper established the subject-specific dielectric properties electromagnetic model named ‘fusion’. Based on the СT images, this paper also established another model named ‘single’. By using the established models, electromagnetic simulations were implemented to obtain the distribution of the B1feld and SAR at 1.5 T and 3 T. By comparing the results of ‘fusion’ model and ‘single’ model, we can conclude that the subject-specific dielectric properties electromagnetic model using hybrid imaging modalitiesis capable of offering subtler results for predicting the B1feld and SAR distribution.
hybrid imaging modalities; electrical properties; subject-specifc electromagnetic model; local SAR; B1feld
R318
A
10.3969/j.issn.1674-1633.2016.05.006
1674-1633(2016)05-0023-07
国家自然科学基金面上项目(61172034, 61528102),广东省自然科学基金项目(2015A030313234),广东省省级科技计划项目(2015B020214006),广州市科技计划项目(2014J4100160),上海科技计划项目(15441907500)。
辛学刚,教授,博士生导师。研究方向为磁共振成像技术及应用、肿瘤微环境检测、肿瘤早期发现、非电离电磁场和生物组织作用机制。
通讯作者邮箱:xxg@smu.edu.cn
