卤化氢的酸性及其度量方法
2017-01-05孙逸明占小红
孙逸明+占小红
摘要:卤化氢的酸性是高中化学的重要内容。由于知识水平的限制,学生只能定性地认识到在水中完全电离的HCl、HBr、HI是强酸,不完全电离的HF是弱酸,而对其酸性强弱的原因及度量方法认识不足,甚至有些教师也可能存在认知上的错误。实际上,卤化氢在气态、纯液态、浓稀水溶液等不同环境中呈现酸性的具体形式不同,需要用质子亲和能、酸度函数、电离常数、表观电离度等不同物理量来度量。拉平效应使得HCl、HBr、HI在稀水溶液中的酸性差别很小,表现为“完全电离”;在甲醇等部分非水溶剂中,区分效应使得三者酸性差别很大。
关键词:卤化氢;酸性;度量方法;拉平效应;区分效应
文章编号:1005–6629(2016)11–0093–04 中图分类号:G633.8 文献标识码:B
卤化氢(HX,X=F,Cl,Br,I)是高中化学中常见的酸。教科书常以它们为例说明元素性质的规律和有关化学概念、原理。例如,苏教版必修《化学1》指出HCl在水中完全电离,从物质分类的角度来说属于强电解质;选修《化学反应原理》给出HF在水溶液中的电离常数,大约在10-4的数量级,属于弱酸。
化学高考题对卤化氢也颇为青睐,常考查与其相关的离子方程式的书写,例如,2012年新课标理科综合试题化学部分第26题要求学生写出FeCl3溶液和HI溶液反应的离子方程式;也有考查学生对强弱电解质电离的理解,例如,2010年浙江省理科综合试题化学部分第26题给出了T=25℃时2.0×10-3 mol·L-1 HF水溶液中H+和F-的浓度随pH变化的曲线图,要求学生计算该温度下HF的电离平衡常数。
如此看来,卤化氢的酸性是学生需要掌握的重要化学性质。通过高中化学的学习,学生认识到HCl、HBr、HI在水中完全电离,都是强酸;HF在水中不完全电离,是弱酸。由于高中阶段学生的知识有限,教科书对卤化氢酸性的介绍仅限于稀水溶液的定性比较,不涉及卤化氢呈现酸性的机制以及稀水溶液以外状态下的酸性比较。在实际的教学过程中,教师通常会采取模糊处理的方法避开学生难以理解之处,因此学生可能会因对相关知识的认识不足而产生科学性错误。那么,HCl、HBr、HI三者的酸性是否完全等同呢?四种卤化氢的酸性强弱如何排序呢?针对这些疑问,本文就不同状态下卤化氢的酸性及其度量方法进行梳理、讨论,为中学教师提供参考,在教学过程中尽可能避免错误的解释。
1 卤化氢呈现酸性的机制
根据酸碱质子理论,卤化氢是典型的质子酸。其表现酸性的过程就是将质子转移给其他物质的过程,酸性的强弱即为转移质子能力的大小。在这个过程中,卤化氢是质子给予体(酸),其他物质是质子接受体(碱)。给予质子的卤化氢种类不同、接受质子的物质种类不同,都会导致卤化氢表现出来的酸性不同。
2 不同条件下卤化氢的酸性及其度量方法
在高中阶段,由于所学知识有限,学生只能根据卤化氢在水中是否完全电离来定性地判断其酸性强弱。而实际上,卤化氢处于气态、纯液态及浓或稀水溶液中时,由于所处的环境不同,导致其呈现酸性的具体方式不同,度量方法也不同,不能简单地一概而论。
2.1 气态
当卤化氢处于气态时,不存在水溶液中的溶剂化作用,而且卤化氢之间相互的质子转移反应发生的程度极小[2HX(g)→H2X+(g)+X-(g)],几乎不存在[1],因此产生质子的机制可以视为HX(g)解离成简单的H+(g)和X-(g):
HX(g)→H+(g)+X-(g)
此时可以用卤离子的质子亲和能A来度量其酸性[2]。质子亲和能A即1mol X-(g)结合1mol H+(g)生成1mol HX(g) [H+(g)+X-(g)→HX(g)]时的能量变化。
也即焓变ΔH,正值代表吸收能量,负值代表放出能量。该反应的ΔH常有上百、上千kJ·mol-1,远大于TΔS项,故ΔG≈ΔH,用质子亲和能作为反应趋势大小的判据没有问题[3]。四种卤离子的质子亲和能如表1所示。
由表1数据可知,从左至右卤离子与质子结合时放出的能量越来越少,反应趋势减小,卤离子结合质子的能力减弱、碱性减弱,对应的共轭酸——卤化氢的酸性增强。因此,在气态时,卤化氢的酸性由强到弱的顺序依次为HI、HBr、HCl、HF。
2.2 纯液态及浓水溶液
由于缺少反映HCl、HBr、HI在纯液态及浓水溶液时行为的数据,故此处只讨论HF的性质。
在纯液态和浓水溶液中,常用Hammett酸度函数[4]来度量物质的酸性。Hammett酸度函数的表达式为: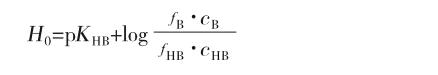
其中KHB是共轭酸HB的解离常数,f是活度系数,c为浓度,f与c的乘积即活度a,H0越小HB的酸性越强。
在纯液态时,整个体系为非水体系,HF既是质子给予体,也是质子接受体,发生自偶电离,产生溶剂化质子和二氟氢根离子: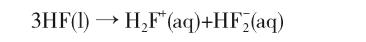
其酸性需用H0度量。已知无水H2SO4的H0=-11.93,通常将H0与无水H2SO4相当或比其更小的酸称为超强酸。液态HF的H0≈-11,因此它是一种超强酸,具有极强的转移质子的能力,例如,常见的强酸HNO3能够被液态HF质子化而显碱性:

2.3 稀水溶液
2.3.1 利用Ka或pKa度量
在稀的水溶液中,卤化氢将质子转移给水分子形成水合质子与卤离子:
HX(aq)+H2O(l)→H3O+(aq)+X-(aq)
高中阶段通常将反应中的水省略不写,故该过程又被称为卤化氢的电离。该过程是一个化学平衡,可以用电离常数Ka或其负对数pKa来度量其进行程度的大小。Ka越大,或pKa越小,该反应进行的程度就越大,对应的卤化氢的酸性就越强。四种卤化氢在水中的电离常数Ka及其负对数pKa如表2[8]所示。
由表2数据可知,电离常数Ka由大到小的顺序依次为HI、HBr、HCl、HF,pKa由大到小顺序依次为HF、HCl、HBr、HI,故四种卤化氢的酸性由强到弱的顺序依次为HI、HBr、HCl、HF。通常认为,平衡常数大于105或106的反应几乎能进行到底,故而尽管HCl、HBr、HI三者的电离常数存在数量级的差异,但反应都进行得较为完全,表观上差异很小、难以区分。事实上,也较少用在水中的电离常数Ka来度量三者的酸性大小,因为水是一种接受质子能力较强的溶剂,几乎能够接受HCl、HBr、HI给出的所有质子,使三者表现出的酸性几乎相同、难以分别,这便是分析化学中的“拉平效应”,水是HCl、HBr、HI酸性的“拉平溶剂”。若使用接受质子能力弱于水的甲醇、乙酸等作为溶剂,则能使三者表现出不同的酸性,这便是“区分效应”,甲醇、乙酸等溶剂是HCl、HBr、HI酸性的“区分溶剂”。
若没有直接的Ka或pKa数据,也可以将卤化氢与水分子间的质子传递过程设计为如下BornHaber循环[9],总共6个步骤:
a~f步骤各自的能量变化为:HX(aq)的脱水能、HX(g)的键能、X(g)的电子亲和能、H(g)的电离能、X-(g)的水合能、H+(g)的水合能。在T=298K时,查表可知各步的ΔH,运用Hess定律,将上述各步叠加即可得到总反应——HX(aq)电离成H+(aq)与X-(aq)的ΔH;再查得总反应的ΔS,根据Gibbs-Helmholtz公式即可算出总反应的ΔG=ΔH-TΔS;最后利用下列公式求出反应平衡常数Ka,再求得pKa。
ΔG=-RTlnKa
例如,对于HI而言,a~f各步的ΔH数据(单位:kJ·mol-1)依次为23、298、-302、1318、-308、-1091,加和可得总反应的ΔH=-62 kJ·mol-1;查得总反应的ΔS=11 J·mol-1·K-1,根据上述公式求得,在T=298K时,反应的ΔG=-65.3 kJ·mol-1,Ka=2.77×1011,pKa=-11.4。
2.3.2 利用表观电离度度量
除了Ka和pKa,也可以用表观电离度来度量电离过程的进程度。在已知卤化氢初始浓度的条件下,测量H3O+的浓度,即可得到卤化氢在水溶液中的表观电离度。在T=291K时,0.1 mol·L-1的水溶液中卤化氢的表观电离度如表3[10]所示。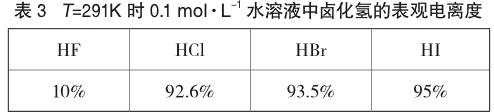
由表3数据可知,所谓“完全电离”的HCl、HBr、HI,其表观电离度也没有达到100%。这主要是因为,溶液中的阴、阳离子并非完全独立自由地运动,它们会吸引异号离子在自身周围对称分布形成“离子氛”,离子氛的束缚使它们不能完全发挥离子应有的功能,“外观上”表现出的浓度小于理论浓度。通常用a表示活度(即有效浓度)、c表示理论浓度、f表示活度系数(f<1),三者之间的关系是a=fc,故活度小于理论浓度。当初始浓度均为0.1 mol·L-1时,从左至右表观电离度依次上升,说明H3O+的浓度依次上升,即越来越多的卤化氢将质子转移给水分子,转移质子的程度、能力增强,因此该条件下卤化氢的酸性由强到弱的顺序依次为HI、HBr、HCl、HF。
上述四者中,HF的表观电离度特别小。然而普遍的观点[11]认为,HF在稀溶液中的电离是相当完全的,即绝大多数HF将质子转移给水分子形成H3O+。但是,H3O+和F-能够通过氢键形成结合强度很大的离子对[H3O+…F-],该离子对很难解离,导致绝大多数H3O+受到束缚无法自由移动,因此HF表现出的酸性很弱。而其他卤化氢较少形成这种离子对,表现出的酸性远强于HF。
需要指出的是,有些教师认为,可以将键能作为稀水溶液中卤化氢酸性强弱的判据[12]。即氢卤键的键能越大,卤化氢越难解离,酸性越弱,并以四种卤化氢的键能数据为依据,如表4所示。
但是,这个方法是错误的。因为键能表示的是气态卤化氢解离成气态氢原子和气态卤原子所需的能量:
HX(g)→H(g)+X(g)
该过程与卤化氢在水中的质子转移并不相同,不可直接套用。
3 小结
卤化氢的酸性是高中化学的重要内容。由于高中阶段知识水平的限制,学生只能定性地比较卤化氢在稀水溶液中的酸性强弱,对其酸性强弱及其原因的认识存在明显不足。
实际上,在不同环境中,卤化氢酸性呈现的具体形式及度量方法不同。
在气态时,卤化氢发生自偶电离的程度极小,可以认为其小部分单纯地解离为简单的气态质子和卤离子,可用卤离子的质子亲和能度量其酸性,酸性按照HF、HCl、HBr、HI的顺序依次增强。
在纯液态时,HF可发生自偶电离,质子在HF分子之间转移,其Hammett酸度函数的值约为-11,是一种超强酸,具有极强的转移质子的能力。
在浓水溶液中,HF与F-通过很强的氢键缔合形成稳定且碱性很弱的缔合离子,释放大量的水合质子,酸性很强。
在稀水溶液中,卤化氢将提供质子给水分子,酸性按照HF、HCl、HBr、HI的顺序依次增强。其中HF之所以酸性特别弱,并非其提供质子的能力弱,而是由于形成了难解离的离子对[H3O+…F-],绝大多数H3O+受到束缚无法自由移动。而HCl、HBr、HI三者尽管电离常数Ka、表观电离度确实存在大小差异,但“外观上”难以区分,它们的酸性需要借助接受质子能力弱于水的溶剂才能较好地分别。
上述内容并非高中学生需要掌握的知识,但教师若要向学生解释它们酸性的强弱,要注意区分不同环境下的卤化氢酸性的特殊性和度量方法,尤其需要关注常见的情况——稀水溶液状态下卤化氢的酸性定量衡量问题,尽量避免出现张冠李戴的不科学解释。
参考文献:
[1][3]铁丽云,王成刚.用气态质子亲和能表示物质的固有酸碱性[J].高等函授学报,1997,(4):47~51.
[2]周毅.氢卤酸的强度规律及其理论解释[J].阴山学刊,1995,12(3):97~101.
[4]胡缙昌.谈Hammett酸度函数[J].建材高教理论与实践,1996,(3):50~51.
[5][7]黄元乔.几种状态下HF的酸性强度性质及结构特性[J].湖北教育学院学报,2002,19(5):10~11.
[6]夏懋,林德昌. F-H…F是最强的氢键吗[J].科教文汇,2010,(8):73~74.
[8]林紫荣,刘榕芳,刘德发,范兴.计算氢卤酸强度的三个经验公式[J].扬州师院学报,1995,15(1):42~45.
[9]余文.氢卤酸强度与卤素离子的大小[J].玉林师专学报,1994,15(3):79~81.
[10]汪战彪.浅谈氢卤酸酸性递变规律[J].重庆工业高等专科学校学报,2003,18(2):24~25,29.
[11][12]姜斌,傅春华,刘俊宁.氢卤酸酸性递变规律探究[J].教育教学论坛,2011,(34):172~174.
